
ГОУ ВПО «Уральская государственная медицинская академия
Федерального агентства по здравоохранению и социальному развитию»
кафедра биохимии
Утверждаю
Зав. каф. проф., д.м.н.
Мещанинов В.Н.
_____‘’_____________2007 г
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
К ПРАКТИЧЕСКОМУ ЗАНЯТИЮ № 21
(для преподавателей)
Факультет: лечебно-профилактический, медико-профилактический, педиатрический.
Курс: 2
Семестр: 4
1. ТЕМА ЗАНЯТИЯ: Особенности обмена отдельных аминокислот.
2. УЧЕБНАЯ ЦЕЛЬ ЗАНЯТИЯ: Рассмотреть специфические пути обмена отдельных аминокислот и патологии, связанные с их нарушением.
3. ЗАДАЧИ ЗАНЯТИЯ:
3.1. Провести тест-контроль исходного уровня знаний студентов.
3.2. Рассмотреть пути обмена глицина и серина, отметить их взаимосвязь с углеводным и липидным обменами, с биосинтезом гема и пуриновых нуклеотидов.
3.3. Рассмотреть пути обмена метионина и цистеина, отметить их взаимосвязь. Подчеркнуть роль этих аминокислот в биосинтезе всех других серосодержащих метаболитов.
3.4. Обсудить биохимическую схему образования глутаминовой и аспарагиновой кислот, пути их использования в организме. Подчеркнуть их роль в обезвреживании и использовании аммиака, особо отметить их участие в энергетическом обмене и их клиническое применение как антиоксидантов, антигипоксантов и адаптогенов.
3.5. Расобрать схему обмена фенилаланина. Выделить три основных направления обмена: катехоламиновый, мелатониновый и гомогентизиновый. Рассмотреть энзимопатии, связанные с нарушением обмена (фенилкетонурия, альбинизм, алкаптонурия).
3.6. Расмотреть основные пути тканевого обмена триптофана, отметить роль триптофана в образовании триптамина и серотонина, в снижении потребности организма в витамине РР.
3.8. В лабораторной работе научить студентов методу первичного скрининг-теста на фенилкетонурию.
Дополнительный вопрос для педфака:
3.7. Врожденные нарушения обмена цистеина, фенилаланина, тирозина и триптофана.
4. ПРОДОЛЖИТЕЛЬНОСТЬ ЗАНЯТИЯ: 3 акад. часа.
5. МЕСТО ПРОВЕДЕНИЯ ЗАНЯТИЯ: учебная комната
6. ОСНАЩЕНИЕ ЗАНЯТИЯ
6.1. Набор для тест-контроля знаний студентов по теме: Особенности обмена отдельных аминокислот.
6.2. Иллюстративный материал: 1) обмен глицина и серина; 2) обмен метионина и цистеина; 3) обмен глутаминовой и аспарагиновой кислот; 4) обмен фенилаланина; 5) обмен триптофана.
6.3. Химпосуда, штативы для пробирок.
6.4. Биообразцы мочи для скрининг-теста на фенилкетонурию.
6.5. Раствор хлорного железа (III) для определения фенилмолочной в образцах.
7. ПЛАН ПРОВЕДЕНИЯ ЗАНЯТИЯ И БЮДЖЕТ УЧЕБНОГО ВРЕМЕНИ
7.1. Организационные вопросы – 3 мин.
7.2. Введение. Формулировка актуальности, цели и задач практического занятия – 5 мин.
7.3. Тест-контроль уровня знаний студентов – 17 мин.
7.4. Рассмотрение теоретических вопросов темы – 50 мин.
7.5. Перерыв – 10 мин.
7.6. Продолжение разбора теоретических вопросов – 40 мин.
7.7. Самостоятельное выполнение студентами лабораторной работы, составление отчета – 20 мин.
7.8. Обсуждение результатов лабораторной работы, подведение итогов занятия - 5 мин.
8. МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ПРОВЕДЕНИЮ ЗАНЯТИЯ.
Контрольные вопросы по теме занятия
8.1. Отметить значение аминокислот в биосинтезе различных метаболитов, необходимых для функционирования и регуляции всех видов обмена.
8.2. Каковы пути образования серина и глицина в организме? Показать путь биосинтеза серина из 3-ФГК и превращения серина в глицин. Отметить роль гликолиза как источника 3–ФГК.
8.3. Каковы пути использования глицина в организме? Дать общую схему.
8.4.Отметить роль серина как исходного метаболита в биосинтезе коламина, холина и соответствующих фосфолипидов.
8.5. Что такое одноуглеродные фрагменты? Рассмотреть реакции образования и взаимопревращений одноуглеродных фрагментов, отметить их роль в различных видах обмена.
8.6. Показать участие витамина В12 и ТГФК в переносе одноуглеродных фрагментов. Рассмотреть реакцию образования ТГФК как активацию фолиевой кислоты, роль в ней фолатредуктазы
8.7. Показать значение метионина как источника метильных групп в реакциях биологического метилирования: образование метилирующего агента - S-аденозилметионина, роль в этом цикле ТГФК и витамина В12.
8.8. Отметить роль метионина как липотропного вещества, указать на его лекарственное применение при нарушениях обмена фосфолипидов.
8.9. Показать путь биосинтеза цистеина из метионина.
8.10. Рассмотреть реакции катаболизма цистеина. Отметить роль цистеина как исходного субстрата в образовании всех других серосодержащих метаболитов (цистеамин, таурин, ФАФС и др.).
8.11. Показать реакции образования глутаминовой и аспарагиновой кислот, дать общую схему их использования в организме.
8.12. Рассмотреть реакции образования глутамина и аспарагина. Подчеркнуть их роль в детоксикации и дальнейшем использовании аммиака. Привести схему обмена глутамина.
8.13. Привести реакции превращения глутаминовой кислоты в ГАМК, ГОМК и янтарную кислоту. Показать значение этого пути в энергетическом обмене, связать его с антигипоксическим и адаптогенным действием глутаминовой кислоты. Отметить биохимические причины антиоксидантной активности глутаминовой кислоты.
8.14. Рассмотреть нейромедиаторные свойства ГАМК и ГОМК, связать это с их лекарственным применением
8.15. Рассмотреть общую схему обмена фенилаланина и указать на биологическое значение каждого из путей: катехоламиновый – источник гормонов и нейромедиаторов; мелатониновый – источник пигментов; гомогентизиновый – катаболический с использованием конечных продуктов в энергетическом обмене.
8.16. Рассмотреть энзимопатии, связанные с нарушением обмена фенилаланина: фенилкетонурию, альбинизм, алкаптонурию. Указать их биохимические причины (точки ферментативной недостаточности), метаболические сдвиги и клинические проявления.
8.17. Показать реакции превращения триптофана в триптамин и серотонин, отметить роль этих биогенных аминов.
8.18. Рассмотреть схему кинуренинового пути обмена триптофана, его роль в снижении потребности организма в витамине РР.
8.19. Дать представление о причинах врожденных нарушений обмена триптофана и об их проявлениях.
8.20. При подведении итогов лабораторной работы подробно остановиться на биохимических методах диагностики фенилкетонурии.
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ПО ТЕМЕ ЗАНЯТИЯ
ФОЛИЕВАЯ КИСЛОТА
Значительную роль в обмене ряда АК, синтезе некоторых сложных липидов, нейромедиаторов, гормонов и ряда других веществ играют производные фолиевой кислоты.
Фолиевая кислота широко распространёна в продуктах животного и растительного происхождения, синтезируется микрофлорой кишечника.

Активная форма фолиевой кислоты – ТГФК. Она образуется в печени при восстановлении фолиевой кислоты с участием фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит НАДФН2.

Образование одноуглеродных фрагментов, их взаимопревращения
ТГФК принимает от АК одноуглеродные фрагменты: серин и глицин дают метиленовый фрагмент (-СН2-), гистидин – формимино- и формильный фрагменты.
В составе ТГФК одноуглеродные фрагменты могут подвергаться взаимопревращениям: метиленовая группа превращаться в метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH).

Затем ТГФК отдает одноуглеродные фрагменты на:
-
синтез пуриновых оснований
-
синтез тимидиловой кислоты
-
регенерацию метионина
-
превращение дУМФ в дТМФ;
-
превращение глицина в серина и т.д.
Недостаточность фолиевой кислоты
Гиповитаминоз фолиевой кислоты возникает редко, его вызывает использование сульфаниламидных препаратов. Сульфаниламиды — структурные аналоги парааминобензойной кислоты, они ингибируют синтез фолиевой кислоты у микроорганизмов, вызывая их гибель. Некоторые производные птеридина (аминоптерин и метотрексат) тормозят рост почти всех организмов, нуждающихся в фолиевой кислоте, их используют для подавления опухолевого роста у онкологических больных.
Гиповитаминоз фолиевой кислоты приводит к:
-
мегалобластической (макроцитарной) анемии. Она характеризуется уменьшением количества эритроцитов, снижением содержания в них гемоглобина, что вызывает увеличение размера эритроцитов. Причина — нарушение синтеза ДНК и РНК из-за недостатка тимидиловой кислоты и пуриновых нуклеотидов.
-
лейкопении;
-
задержке роста.
-
нарушению регенерации эпителия, особенно в ЖКТ (связано с недостатком нуклеотидов для синтеза ДНК в постоянно делящихся клетках слизистой оболочки).
КОБАЛАМИН (В12)
В12 синтезируется только микроорганизмами, им богаты печень, почки. Активные формы кобаламина – метилкобаламин (цитоплазма) и дезоксиаденозилкобаламин (митохондрии).
Кобаламин участвует:
-
в передачи метила с метил-ТГФК на гомоцистеин при регенерации метионина.
-
в превращениях одноуглеродных фрагментов в составе ТГФК.
-
в метаболизме жирных кислот с нечетным числом атомов С и аминокислот с разветвленной цепью. Перенос протонов в реакциях изомеризации.
Недостаточность В12
Гиповитаминоз возникает при нарушении всасывании В12 (дефицит фактора Касла при пониженной кислотности желудочного сока).
Гиповитаминоз В12 сопровождается:
-
макроцитарной (мегалобластической) анемией: снижение числа эритроцитов, гемоглобина, увеличение размера эритроцитов. Причина — нарушение синтеза ДНК.
-
расстройствами деятельности нервной системы. При распаде жирных кислот с нечетным количеством атомов С и разветвленных АК из-за дефицита В12 накапливается нейротоксичная метилмалоновая кислота.
ОБМЕН СЕРИНА И ГЛИЦИНА
Серин и глицин - заменимые аминокислоты.
Синтез серина:

Обмен глицина:
Основной путь синтеза

Основной путь катаболизма (в митохондриях печени)

Схема путей обмена серина и глицина
Серии и глицин выполняют в организме человека разнообразные и очень важные функции.

Глицин — важнейший (после ГАМК) тормозной нейромедиатор в спинном мозге, промежуточном мозге и некоторых отделах головного мозга.
Наследственные нарушения обмена глицина
Известно несколько заболеваний, связанных с нарушениями обмена глицина. В их основе лежит недостаточность ферментов или дефект системы транспорта этой АК.
Гиперглицинемия возникает при дефекте глицинрасщепляющей системы. Проявляется повреждением мозга, судорогами, гипотонией, нарушением дыхания.
Глицинурия характеризуется повышенным выделением глицина с мочой (до 1 г/сут) при нормальном содержании его в крови. Причиной является нарушение реабсорбции глицина в почках.
Первичная гипероксалатурия характеризуется постоянно высоким выделением оксалата с мочой, независимо от поступления его с пищей. Дефект глицинаминотрансферазы блокирует превращение глиоксилата снова в глицин. Глицин → глиоксилат → оксалат
Прогрессирует двустороннее образование оксалатных камней в мочевыводящих путях, развиваются нефрокальциноз и инфекция мочевыводящих путей. Больные погибают в детском возрасте от почечной недостаточности или гипертонии.
В состав белков человека входят 2 АК, содержащие серу, — метионин и цистеин. Эти аминокислоты метаболически тесно связаны между собой.
МЕТИОНИН
Метионин — незаменимая аминокислота, может регенерировать из гомоцистеина с участием серина и глицина. Метионин:
-
участвует в синтезе белков организма;
-
является источником метильной группы, используемой в реакциях трансметилирования;
-
является источником атома серы, необходимого для синтеза цистеина;
-
участвует в реакциях дезаминирования;
-
Метионил-тРНК участвует в инициации процесса трансляции.
Образование S-аденозилметионина
Метильная группа в метионине прочно связана с серой, поэтому донором этого одноуглеродного фрагмента служит активная форма метионина - S-аденозилметионин (SAM). (SAM — нестабилен т.к. сера при валентности 2 имеет 3 связи). SAM образуется при присоединении метионина к аденозину с участием метионинаденозилтрансферазы (есть во всех типах клеток). Аденозин образуется при гидролизе АТФ.
Ресинтез метионина, роль ТГФК и витамина В12.
Связь обменов метионина и цистеина
 Реакции
трансметилирования с участием
S-аденозилметионина
Реакции
трансметилирования с участием
S-аденозилметионина
Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT).
Синтез холина

Синтез лецитина

Аналогично синтезируются:
-
из ГАМК → карнитин;
-
из гуанидинацетата → креатин;
-
из норадреналина → адреналин;
-
из карнозина → анзерин;
-
Реакции трансметилирования используются также в синтезе азотистых оснований, инактивации гормонов, нейромедиаторов и обезвреживании ксенобиотиков.
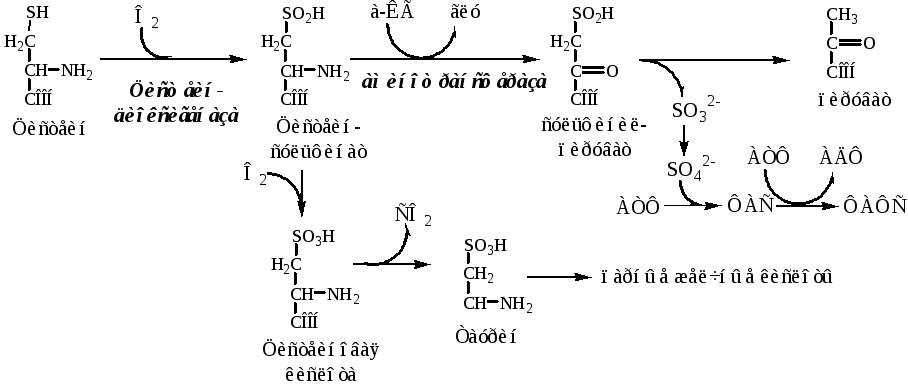
ЦИСТЕИН
Цистеин – серосодержащая условнозаменимая АК. Синтезируется из незаменимого метионина и заменимого серина.
Нарушение синтеза цистеина возникает при гиповитаминозе фолиевой кислоты, В6, В12 или наследственных дефектах цистатионинсинтазы и цистатионинлиазы. Гомоцистеин превращается в гомоцистин, который накапливается в крови, тканях и выделяется с мочой.
Обмен цистеина: схема путей, их значение.
Цистеин:
-
используется в белках для формирования третичной структуры (дисульфидные мостики);
-
SH группы цистеина формируют активный центр многих ферментов;
-
идет на синтез глутатиона, таурина (парные желчные кислоты), НS-КоА, ПВК (глюкоза);
-
Является источником сульфатов, которые идут на синтез ФАФС или выделяются с мочой.
Образование сульфат-иона, его утилизация (образование ФАФС).
 ФАФС
используется:
ФАФС
используется:
1. В обезвреживании ксенобиотиков:
2. В синтезе гликозаминогликанов (сульфирование ОН групп производных глюкозы, галактозы сульфотрансферазой).
ФЕНИЛАЛАНИН
Фенилаланин — незаменимая АК, которая содержится в достаточных количествах в пищевых продуктах. Фенилаланин идет в основном на синтез белков и тирозина.
|
|
Превращение фенилаланина в тирозин необратимо катализирует фенилаланингидроксилаза (монооксигеназа), коферментом которой служит тетрагидробиоптерин (Н4БП), кофактором - Fe2+. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием НАДФH2. Реакция необходима для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает. |
Фенилкетонурия
В печени здоровых людей небольшая часть фенилаланина (10%) превращается в фениллактат и фенилацетилглутамин. При дефекте фенилаланингидроксилазы этот путь катаболизма фенилаланина становится главным, что способствует развитию фенилкетонурии (ФКУ).
Классическая ФКУ — наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы (частота 1:10000 новорождённых), которые приводят к снижению активности фермента или полной его инактивации.
При ФКУ концентрация фен повышается в крови в 20—30 раз, в моче — в 100—300 раз по сравнению с нормой. В крови и моче повышается содержание метаболитов альтернативного пути: фенилпирувата, фенилацетата, фениллактата и фенилацетилглутамина.
Проявления ФКУ:
-
нарушение умственного и физического развития;
-
судорожный синдром;
-
нарушение пигментации.
Проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации фенилаланина ограничивают транспорт тирозина и триптофана через гематоэнцефалический барьер и тормозят синтез нейромедиаторов (дофамина, норадреналина, серотонина).
Прогрессирующее нарушение умственного и физического развития у детей, больных ФКУ, можно предотвратить диетой с очень низким содержанием или полным исключением фенилаланина. Если такое лечение начато сразу после рождения ребёнка, то повреждение мозга предотвращается. Считается, что ограничения в питании могут быть ослаблены после 10-летнего возраста (окончание процессов миелинизации мозга), однако в настоящее время многие педиатры склоняются в сторону «пожизненной диеты». При отсутствии лечения больные не доживают до 30 лет.
Для диагностики ФКУ используют качественные и количественные методы обнаружения патологических метаболитов в моче, определение концентрации фенилаланина в крови и моче.
Дефектный ген, ответственный за фенилкетонурию, можно обнаружить у фенотипически нормальных гетерозиготных носителей с помощью теста толерантности к фенилаланину.

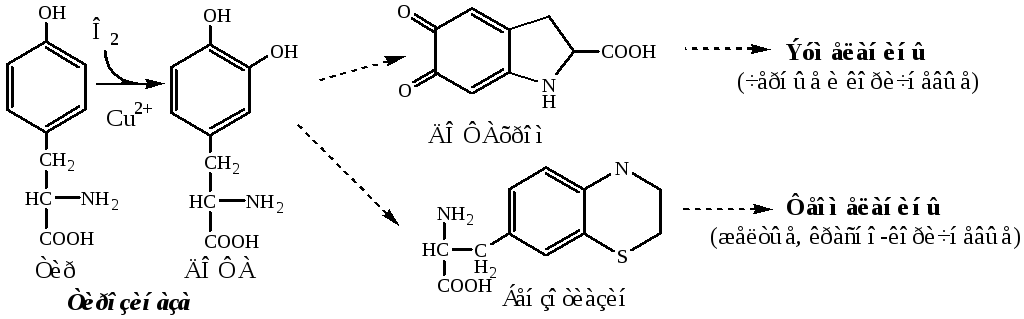
ТИРОЗИН
Тирозин — условно заменимая АК, образуется из незаменимого фенилаланина. Содержание тир в пищевых белках достаточно велико.
Тирозин используется в синтезе белков, катехоламинов, тиреоидных гормонов и меланинов. Обмен тирозина зависит от типа тканей.
1. Обмен тирозина в надпочечниках и нервной ткани
В мозговом веществе надпочечников и нервной ткани тирозин метаболизирует по катехоламиновому пути с образованием дофамина, норадреналина и адреналина (только в надпочечниках).

Тирозингидроксилаза (тирозинмонооксигеназа) Fe2+ -зависимый фермент, в качестве кофермента использующий Н4БП. Ее ингибирует норадреналин.
Дофамин и норадреналин служат медиаторами в синаптической передаче нервных импульсов, а адреналин — гормон широкого спектра действия, регулирующий энергетический обмен. Одна из функций катехоламинов — регуляция деятельности ССС.
Нарушение синтеза катехоламинов может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества. Снижение в нервных клетках содержания дофамина и норадреналина часто приводит к депрессивным состояниям. При шизофрении в височной доле мозга наблюдается гиперсекреция дофамина.
Болезнь Паркинсона
Болезнь Паркинсона развивается при снижении активности тирозинмонооксигеназы и ДОФА-декарбоксилазы, что приводит к недостаточности дофамина в чёрной субстанции мозга. Это одно из самых распространённых неврологических заболеваний (частота 1:200 среди людей старше 60 лет). Заболевание сопровождается акинезией (скованность движений), ригидностью (напряжение мышц) и тремором (непроизвольное дрожание).
Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма используют заместительную терапию препаратами-предшественниками дофамина (производными ДОФА) — леводопа, мадопар, наком и др. Также подавляют инактивацию дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.).
2. Обмен тирозина в меланоцитах
В пигментных клетках (меланоцитах) обмен тирозин идет по меланиновому пути. Из тирозина синтезируются пигменты — меланины 2 типов: эумеланины и феомеланины. Эумеланины (чёрного и коричневого цвета) — нерастворимые высокомолекулярные полимеры 5,6-дигидроксииндола. Феомеланины — жёлтые или красновато-коричневые полимеры, растворимые в разбавленных щелочах.
Меланины присутствуют в сетчатке глаз, в составе волос, в коже. Цвет кожи зависит от распределения меланоцитов и количества в них разных типов меланинов.
Альбинизм
При наследственном дефекте тирозиназы (1:20000) в меланоцитах нарушается синтез меланинов и развивается альбинизм.
Клиническое проявление альбинизма (от лат. albus — белый) — отсутствие пигментации кожи, сетчатки глаз и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи.
3. Превращение тирозина в щитовидной железе
В щитовидной железе из тирозина синтезируются и выделяются гормоны йодтиронины: тироксин (тетрайодтиронин) и трийодтиронин.
5. Катаболизм тирозина в печени
Катаболизм тирозина происходит в печени по гомогентизиновому пути (схема).

Фумарат может окисляться до СО2 и Н2О или использоваться для глюконеогенеза. Ацетоацетат — кетоновое тело, окисляемое до СО2 и Н2О с выделением энергии.
Алкаптонурия («чёрная моча»)
При наследственном дефекте диоксигеназы гомогентизиновой кислоты (2—5 случаев на 1 млн новорождённых) развивается алкаптонурия. При алкаптонурии происходит накопление в организме гомогентизиновой кислоты, избытки которой выделяются с мочой. На воздухе гомогентизиновая кислота окисляется с образованием тёмных пигментов - алкаптонов.
Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит.
Тирозинемии
Некоторые нарушения катаболизма тирозина в печени приводят к тирозинемии и тирозинурии. Различают 3 типа тирозинемии.
1. Тирозинемия типа 1 (тирозиноз). Причиной заболевания является дефект фумарилацетоацетатгидролазы. Накапливающиеся метаболиты снижают активность некоторых ферментов и транспортных систем аминокислот. Патофизиология этого нарушения достаточно сложна. Острая форма тирозиноза характерна для новорождённых. Клинические проявления — диарея, рвота, задержка в развитии. Без лечения дети погибают в возрасте 6—8 мес из-за развивающейся недостаточности печени. Хроническая форма характеризуется сходными, но менее выраженными симптомами. Гибель наступает в возрасте 10 лет. Содержание тирозина в крови у больных в несколько раз превышает норму. Для лечения используют диету с пониженным содержанием тирозина и фенилаланина.
2. Тирозинемия типа II (синдром Рихнера—Ханхорта). Причина — дефект тирозинаминотрансферазы. Концентрация тирозина в крови больных повышена. Для заболевания характерны поражения глаз и кожи, умеренная умственная отсталость, нарушение координации движений.
3. Тирозинемия новорождённых (кратковременная). Заболевание возникает в результате снижения активности фермента п-гидроксифенилпируватдиоксигеназы. В результате в крови больных повышается концентрация п-гидроксифенилацетата, тирозина и фенилаланина. При лечении назначают бедную белком диету и витамин С.
ТРИПТОФАН
Триптофан – незаменимая АК. В физиологических условиях >95% триптофана метаболизирует по кинурениновому пути и 1% по серотониновому пути.
Схема кинуренинового пути
 Синтез НАД+
уменьшает потребность организма в
витамине РР.
Синтез НАД+
уменьшает потребность организма в
витамине РР.
Серотониновый путь
 Серотонин
образуется в надпочечниках, ЦНС и тучных
клетках.
Серотонин
образуется в надпочечниках, ЦНС и тучных
клетках.
Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.
Образование и использование в организме ГАМК и ГОМК. Антиоксидантные, антигипоксические и адаптогенные свойства Глу, Асп, их клиническое применение.
ГЛУТАМАТ
Синтез глутамата
Глутамат образуется:
1). при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой:

2). В реакция переаминирования с участием аминотрансфераз:

Использование глутамата
-
Используется в синтезе белков, липидов, углеводов;
-
Ведущая роль в интеграции азотистого обмена. Обеспечивает реакции переаминирования АК: глутамат универсальный донор аминогруппы для синтеза заменимых АК (Ала, Асп, Асн, Сер, Гли, Глн, Про). Обеспечивает непрямое дезаминирование большинства АК. Участвует в обезвреживании аммиака с образованием глутамина;
-
Является источником α-КГ, необходимого для ЦТК и синтеза АТФ;
-
Входит в состав глутатиона;
Глутамат содержится в больших количествах в головном мозге, где выполняет разнообразные функции:
-
один из основных возбуждающих нейромедиаторов в коре, гиппокампе, полосатом теле и гипоталамусе;
-
используется для синтеза тормозного нейромедиатора ГАМК;
-
В виде пироглутамата (циклическая форма) входит в состав нейропептидов — люлиберина, тиролиберина, нейротензина, бомбезина и др.;
-
участвует в регуляции процессов памяти;
-
глутамат служит источником янтарной кислоты (сукцинат), которая может окисляться при гипоксии, давая АТФ (антигипоксант);
-
участвует в обезвреживании аммиака с образованием глутамина

Нарушение обмена глутамата приводит к целому ряду патологических нарушений ЦНС: эпилепсии, расстройствах вестибулярной системы, ишемии и др. Глутамат и его аналоги используют как лекарственные средства при хронической недостаточности аминокислотного обмена, вегетососудистой дистонии, эпилепсии (в качестве предшественника ГАМК — тормозного медиатора).
ГЛУТАМИН
Синтез глутамина

Использование глутамина
-
Используется в синтезе белков, углеводов;
-
Источник азота в синтезе пуриновых и пиримидиновых оснований, аспарагина, аминосахаров;
-
Обеспечивает транспорт азота из тканей;
АСПАРТАТ
Синтез аспартата

Использование аспартата
-
Используется в синтезе белков, липидов, углеводов;
-
Участвует в орнитиновом цикле при синтезе мочевины;
-
Участвует в синтезе карнозина, анзерина, пуриновых и пиримидиновых нуклеотидов, N-ацетиласпарагиновой кислоты.
АСПАРАГИН
Синтез аспарагина

Использование аспарагина
-
Используется в синтезе белков, липидов, углеводов;

