
01 - Теплотехника, курс лекций, часть 1, ТД
.pdfАбдрахманов А.Р.
Теплотехника
Курс лекций
Казань 2008
Содержание
Введение.............................................................................................................................................. |
|
3 |
|
1. Техническая термодинамика..................................................................................................... |
5 |
||
1.1. Основные понятия и определения.................................................................................... |
5 |
||
1.2. Параметры состояния и состояние системы.................................................................... |
7 |
||
1.3. Термическое уравнение состояния газа........................................................................... |
9 |
||
1.4. |
Газовые смеси................................................................................................................... |
10 |
|
1.5. |
Теплоемкость.................................................................................................................... |
13 |
|
1.6. |
Первый закон термодинамики........................................................................................ |
14 |
|
1.7. |
Энтальпия.......................................................................................................................... |
15 |
|
1.8. |
Основные термодинамические процессы...................................................................... |
17 |
|
1.8.1. |
Изобарный процесс (p = const) ............................................................................... |
20 |
|
1.8.2. |
Изотермический процесс (T = const)...................................................................... |
20 |
|
1.8.3. |
Изохорный процесс (v = const) ............................................................................... |
20 |
|
1.8.4. |
Адиабатный процесс (q = 0) .................................................................................... |
21 |
|
1.9. |
Второй закон термодинамики......................................................................................... |
21 |
|
1.10. |
|
Цикл Карно................................................................................................................... |
26 |
1.11. |
|
Обратимые и необратимые процессы........................................................................ |
28 |
1.12. |
|
Энтропия....................................................................................................................... |
29 |
1.13. |
|
Изменение энтропии в процессах............................................................................... |
31 |
1.14. |
|
T–s диаграмма............................................................................................................... |
33 |
1.15.Изображение на T–s диаграмме основных процессов. Цикл Карно на T–s
диаграмме...................................................................................................................................... |
35 |
Введение
Теплотехника – отрасль науки и техники, охватывающая методы и принципы получения, преобразования, распределения, транспортирования, использования тепла с помощью тепловых машин, аппаратов и устройств (паровых, водогрейных котлов, теплообменников, паровых машин, паровых и газовых турбин, двигателей внутреннего сгорания, реактивных двигателей и т.п.).
Курс «Теплотехника» состоит из двух частей:
1.Техническая термодинамика
2.Теория теплообмена.
Термодинамика – наука, изучающая законы превращения энергии и особенности процессов этих превращений. В данном курсе наибольший интерес представляет раздел термодинамики, в котором изучаются теоретические основы взаимных превращений теплоты и работы в тепловых машинах. Эта часть называется технической термодинамикой.
Исторически термодинамика возникла как потребность практики тепловых машин. Она позволяла рассчитать лишь идеальные, без учета тепловых потерь, параметры тепловых машин. Совершенство реальной тепловой машины зависит от ряда физических и химических процессов, среди которых главным является теплообмен.
Теория теплообмена – наука, изучающая процессы переноса теплоты в пространстве. Процессы теплообмена очень широко распространены в природе
ив технике. В любой системе, где имеет место неравномерность температур, возникает перенос теплоты от более нагретых объектов к менее нагретым. Например, вследствие разницы температур между камерой сгорания двигателя
иокружающей средой теплота передается из камеры сгорания в окружающее пространство; вследствие разности температур теплота передается от горячего пара или горячей воды, циркулирующих в системе отопления, к более холодному воздуху в отапливаемом помещении; в парогенераторах из воды получают водяной пар за счет передачи теплоты от горячих продуктов сгорания топлива к воде и т.д.
Таким образом, развитие тепловых машин определило появление науки, которая изучала бы процессы теплообмена. Теория теплообмена позволяет рассчитать параметры тепловых машин с учетом теплового взаимодействия отдельных элементов этих машин, оценить потери тепла, рассчитать температурное состояние деталей. Кроме того, теория теплообмена занимается разработкой методов интенсификации теплообмена и оценкой их эффективности, тепловой защитой отдельных элементов от воздействия
высокотемпературных сред, проблемой уменьшения тепловых потерь в различных энергетических устройствах.
Любое физическое явление изучается теоретически и экспериментально. Поэтому в данном курсе рассматриваются закономерности, полученные как теоретическим, так и опытным путем.
Изучение курса «Теплотехника» имеет важнейшее значение для инженерной подготовки инженеров-технологов. Данный курс является базовой общетехнической дисциплиной.
Для изучения дисциплины помимо настоящего пособия необходимо самостоятельно проработать следующую литературу:
1.Мухачев Г.А., Щукин В.К. Термодинамика и теплопередача. М.: Высш.
шк., 1990;
2.Теплопередача: Учебник для вузов / В.П.Исаченко, В.А.Осипова, А.С.Сукомел. 4-е изд., перераб. и доп. М.: Энергоиздат, 1981;
3.Михеев М.А., Михеева И.М. Основы теплопередачи. М.: Энергия, 1977.

1. Техническая термодинамика
1.1.Основные понятия и определения
Тепловая машина – устройство, в котором происходит преобразование теплоты в работу или работы в теплоту.
Тепловой двигатель – тепловая машина, в которой теплота преобразуется в работу. Тепловой двигатель служит для того, чтобы приводить в движение какой-либо объект за счет тепловой энергии.
Вхолодильных машинах и в тепловых насосах затрачивается работа для передачи теплоты от более холодных тел к более нагретым.
Неотъемлемым свойством материи является движение. Движение неуничтожимо, как и сама материя. Мерой движения материи является энергия.
Втехнической термодинамике рассматриваются два способа передачи
энергии:
1.Посредством работы
2.Посредством теплоты.
Эти два способа не являются равноценными. Если работа может пойти на увеличение любого вида энергии, то теплота непосредственно (без дополнительного преобразования) может пойти только на увеличение внутренней энергии.
Внутренняя энергия U – это энергия, заключенная в системе. Внутренняя энергия системы есть сумма всех видов взаимодействия частиц, составляющих систему. Она состоит их кинетической энергии поступательного, вращательного и колебательного движений молекул, потенциальной энергии взаимодействия молекул, энергии внутриатомных и внутриядерных движений частиц, из которых состоят атомы и др.
Работа L и теплота Q имеют размерность энергии, в системе СИ – это Джоуль:
1Дж = Н м = кгс2м2 .
При этом они не являются видами энергии. Это два различных способа передачи энергии. Определенному состоянию системы не соответствует какоелибо значение работы или теплоты.
В технической термодинамике принято следующее правило знаков (см.
рис. 1.1):
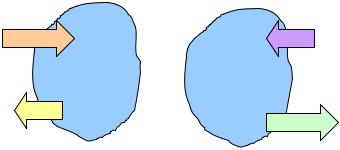
−теплота Q положительна (имеет знак «+»), если она подводится к системе, и отрицательна (имеет знак «–»), если она отводится от системы;
−работа L наоборот положительна (имеет знак «+»), если она отводится от системы (совершается системой), и отрицательна (имеет знак «–»), если она подводится к системе (затрачивается на изменение состояния системы).
Q+ |
L– |
Q– |
L+ |
рис. 1.1
Правило знаков для теплоты и работы
В технической термодинамике изучаемыми системами являются тела, посредством которых производится взаимное превращение теплоты и механической работы (например, газообразные продукты сгорания в тепловых двигателях). Такие тела называют рабочими телами.
Равновесное состояние системы – состояние системы, при котором имеет место постоянство параметров во времени, не зависящее от внешних воздействий.
Стационарное состояние – состояние системы, при котором имеет место постоянство параметров во времени, обусловленное внешними воздействиями.
Термодинамический процесс – изменение состояния системы, возникающее под влиянием внешних сил.
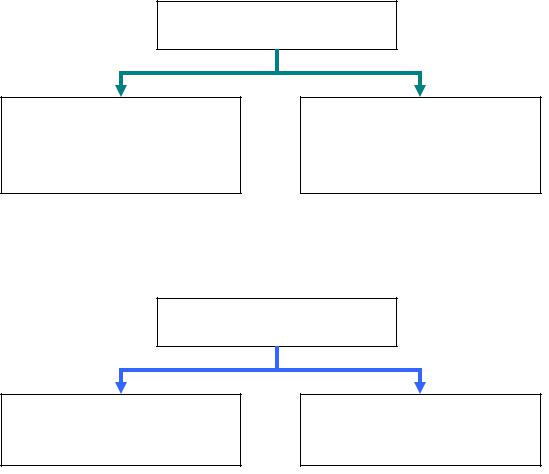
Термодинамические процессы могут быть равновесные и неравновесные (рис. 1.2). Термодинамические процессы могут также быть обратимыми и необратимыми (рис. 1.3).
Термодинамические
процессы
Равновесные – процессы, в которых система проходит ряд последовательных равновесных состояний
Неравновесные – при протекании которых система не находится в равновесии
рис. 1.2
Равновесные и неравновесные термодинамические процессы
Термодинамические
процессы
Обратимые – направление течения процесса может быть изменено на обратное
Необратимые – направление течения процесса не может быть изменено на обратное
рис. 1.3
Обратимые и необратимые термодинамические процессы
1.2.Параметры состояния и состояние системы
Вкаждый момент времени система характеризуется рядом величин, которые в общем случае могут меняться с изменением самой системы в результате взаимодействия ее с окружающей средой. Эти величины называются термодинамическими параметрами.
Основные термодинамические параметры: − давление p;
− температура T или t;
− удельный объем v или плотность ρ. Удельный объем связан с массой:
v = V |
= |
1 |
; |
(1.1) |
m |
|
ρ |
|
|

|
|
|
ρ = m |
= 1 , |
(1.2) |
гдеV – объем, м3; m – масса, кг. |
V |
v |
|
||
|
|
табл. 1.1 |
|||
|
|
|
|
|
|
|
Единицы измерения основных параметров |
||||
|
|
|
|
|
|
|
Па = Н / м2 |
1 |
кПа = 103Па |
1МПа = 106Па |
|
p |
1 бар = 105Па |
1 |
ата = 1 кгс/см2 = 98067 Па |
|
|
|
1 мм рт.ст. = 133,32 Па |
1 |
мм вод.ст. = 9,8067 Па |
|
|
T |
К – градус Кельвина |
T = t + 273,15 |
|
||
t |
°С – градус Цельсия |
|
|||
|
|
|
|
||
v |
м3/кг |
|
|
|
|
ρ |
кг/м3 |
|
|
|
|
Давление – сила, действующая на единицу поверхности, направленная нормально (перпендикулярно) к ней.
p = FS ;
для газов p = 23 n mw2 2 ,
где n – концентрация (число молекул в 1 м3 газа); mw2 2
движения молекул идеального газа.
pб
pа
pи = g h
(1.3)
(1.4)
– кинетическая энергия
h
рис. 1.4
Абсолютное, барометрическое и избыточное давление
Идеальный газ – это газ, у которого нет притяжения между молекулами, и молекулы не имеют объема.
pа = pб + pи ; |
(1.5) |
где pа – абсолютное давление; pб – барометрическое (атмосферное) |
давление; |
pи – избыточное давление (см. рис. 1.4). |
|
Если pа < pб |
|
pа = pб − pв , |
(1.6) |
где pв – вакуумметрическое давление
Температура – мера нагретости тела. Другое определение: температура – мера внутренней энергии (характеризует внутреннюю энергию). Чем выше температура, тем больше внутренняя энергия.
T = |
2 |
k |
mw2 |
, |
(1.7) |
|
3 |
2 |
|||||
|
|
|
|
где k – постоянная Больцмана.
Температуры тел определяют направление возможного самопроизвольного перехода тепла.
Формулы (1.4) и (1.7) основаны на молекулярно-кинетической теории (МКТ), подробно в данном курсе не рассматривается.
Представленные параметры: давление p, температура T и удельный объем v (плотность ρ) – представляют собой термические параметры. Существуют также калорические параметры: c – теплоемкость, r – удельная теплота парообразования, Eу (рассматриваются далее).
1.3.Термическое уравнение состояния газа
Известное из МКТ уравнение состояния идеального газа в технической термодинамике имеет вид
p v = R T , |
(1.8) |
или |
|
p = ρ R T , |
(1.9) |
p = m R T . |
(1.10) |
V |
|
Здесь R – газовая постоянная, Дж/(кг К). R – характеристика конкретного газа в предположении, что свойства газа соответствуют требованиям идеального газа.
R = |
µR |
, |
(1.11) |
|
µ |
|
|
где µR = 8314 Дж/(кмоль К) – универсальная газовая постоянная; µ – молярная масса конкретного газа, кг/кмоль.

|
|
|
|
|
|
|
|
табл. 1.2 |
|
Газовые постоянные для различных газов |
|
|
|||||
|
|
|
|
|||||
Газ |
|
Молярная масса |
Газовая постоянная |
|||||
Кислород O2 |
|
µO2 = 2 16 = 32 кг/кмоль |
RO2 = |
8314 |
= 259,8 Дж/(кг К) |
|||
|
|
|
|
|
|
32 |
|
|
Водород H2 |
|
µH2 = 2 1 = 2 кг/кмоль |
RH2 = |
8314 |
= 4157 Дж/(кг К) |
|||
|
|
|
|
|
|
2 |
|
|
Водяной пар H2O |
µH2O = 2+16 = 18 кг/кмоль |
RH2O |
= |
8314 = 461,9 Дж/(кг К) |
||||
|
|
|
|
|
|
18 |
|
|
Углекислый газ |
|
µСO2 = 14+2 16 = 46 кг/кмоль |
RCO2 |
= |
8314 |
=180,7 Дж/(кг К) |
||
CO2 |
|
46 |
|
|||||
Воздух (смесь |
|
|
Rв = |
8314 |
|
|
||
газов) |
|
µв = 28,97 кг/кмоль |
28,97 = 287 Дж/(кг К) |
|||||
Уравнения состояния реальных газов отличаются от уравнений (1.8)и |
||||||||
(1.9), но в любом случае для газов |
|
|
|
|
|
|
||
|
|
ρ = f ( p,T ) , |
|
|
|
|
|
(1.12) |
|
|
v = f ( p,T ) . |
|
|
|
|
|
(1.13) |
1.4.Газовые смеси
Если смесь находится в равновесии, то температуры всех составляющих газов одинакова и равна температуре смеси Tсм. В таком состоянии молекулы каждого газа рассеяны равномерно по всему объему смеси, т.е. имеют свою концентрацию ni и, следовательно, свое давление pi, называемое парциальным
(см. рис. 1.5).
По закону Дальтона
(1.14)
(1.15)
Качественно состав смеси можно определить разными способами. Наиболее простой из них – определение массового состава. Для каждого компонента смеси находится массовая доля:
gi = mi . (1.16)
mсм
|
mi |
|
|
|
|
|
|
=1. |
(1.17) |
||
|
|||||
∑gi = ∑ m |
|
||||
|
см |
|
|
||
