
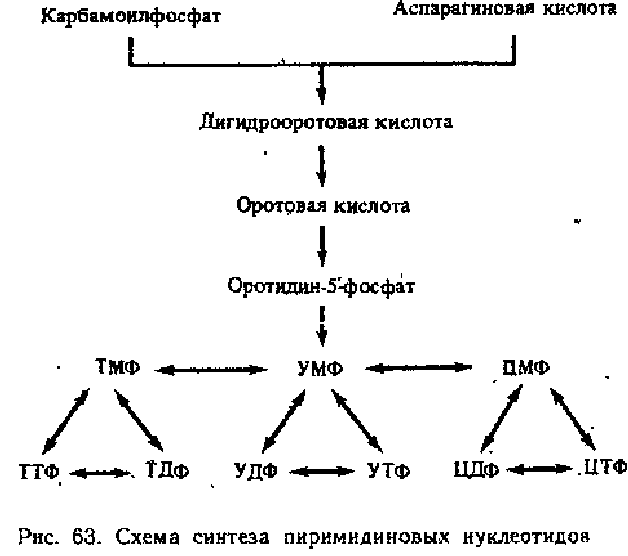
- •1. Законы термодинамики
- •2. Свободная энергия
- •3.Эндергонические и экзергонические реакции
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •I. Моносахариды
- •2. Олигосахарнды
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1. Окислительное дезаминирование
- •2. Непрямое дезаминирование (трансдезаминирование)
- •2. Нарушения липидного обмена
1. Окислительное дезаминирование
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат (см. схему ниже).
Окислительное дезаминирование глутамата -
обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное шинирование α-кетоглутарата.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).

Схема

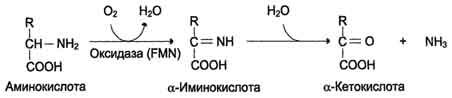
В организме человека и животных в основном происходит окислительное дезаминирование аминокислот. Этот процесс катализируется оксидазами L - и D-аминокислот с простетиче-скими группами соответственно ФМН и ФАД.
Оксидаза L-аминокислот
В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты (см. схему в конце стр.).
Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры (рис. 9-8).
2. Непрямое дезаминирование (трансдезаминирование)
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
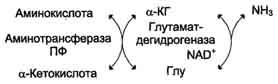
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы (рис. 9-9), что обеспечивает как катаболизм аминокислот (рис. 9-9, А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (рис. 9-9, Б).
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:

Можно выделить 4 стадии процесса:
трансаминирование с α-кетоглутаратом, образование глутамата;
трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом (см. схему А на с. 476).
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы (см. схему Б на с. 476).
474

Рис. 9-8. Биологическая роль оксидазы D-аминокислот.

Рис. 9-9. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
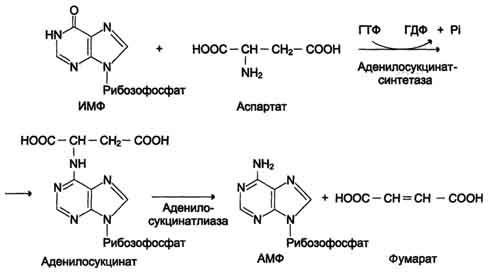
Схема А

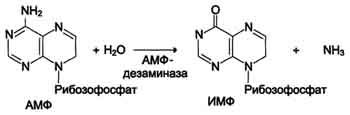
Схема Б.

Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
Билет 52-другой вариант
У человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования: прямое и непрямое.
Прямое окислительное дезаминирование
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное).
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически неактивны.
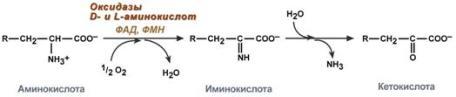
Реакция, катализируемая оксидазами D- и L-аминокислот
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется толькоглутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования (см ниже).
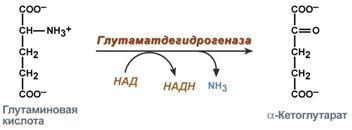
Реакция прямого окислительного дезаминирования глутаминовой кислоты
|
|
|
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называется трансаминирование и его механизм довольно сложен.
В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2").
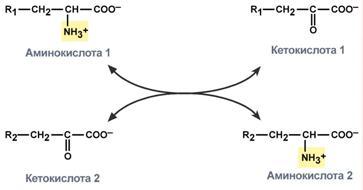
Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы в глюконеогенезе.
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх).
В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование.
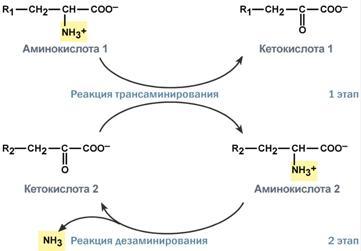
Схема обоих этапов трансдезаминирования
Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Процесс трансдезаминирования идет в организме непрерывно, потому что:
сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
Билет 53
Для удаления аммиака есть два способа
Практически весь аммиак удаляется из организма через почки в виде мочевины, которая синтезируется в печени, и в виде образующися в эпителии канальцев почек солей иона аммония.
В клетки печени и почек аммиак попадает в составе глутамина и аспарагина, глутаминовой кислоты, аланина и в свободном виде. Кроме этого, при метаболизме он образуется в большом количестве и в самих гепатоцитах.
В клетке глутамин и аспарагин дезаминируются соответственно глутаминазой и аспарагиназой с образованием аммиака (точнее, иона аммония).
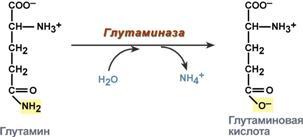
Реакция дезаминирования глутамина
Аланин вступает в реакцию трансаминирования. Образованный в результате реакции пируват идет в глюконеогенез или энергетический обмен. Параллельно образуется глутаминовая кислота.
В целом глутаминовая кислота в гепатоците может появляться тремя путями: 1) из крови, 2) при дезаминировании глутамина, 3) при трансаминировании α-кетоглутарата с аспартатом или аланином. Происхождение и дальнейшая ее судьба зависит от конкретных концентраций всех задействованных веществ. Обычно далее глутамат дезаминируется глутаматдегидрогеназой с образованиемаммиака.
Синтез мочевины
В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма.
Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.
Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.
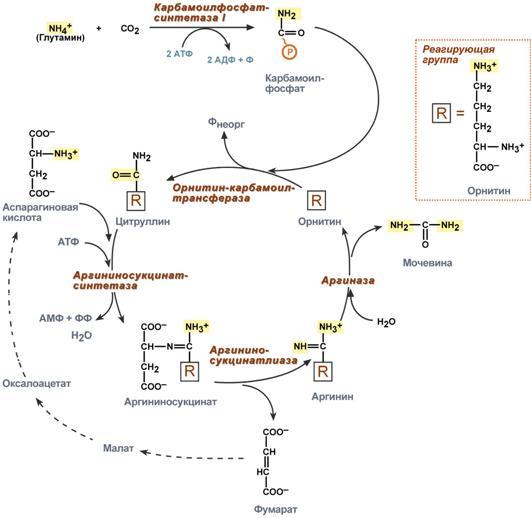
Реакция синтеза карбамоилфосфата и орнитиновый цикл
Синтез аммонийных солей
Непосредственный синтез аммонийных солей или аммониегенез происходит в просвете канальцев почек из секретируемых сюда аммиака и ионов водорода и фильтрующихся органических и неорганических анионов первичной мочи. Около 10% всего аммиака выводится почками в виде аммонийных солей.
Часть глутамина крови, не задержавшаяся в печени, достигает почек. В эпителиальных клетках почечных канальцев, в основном в дистальных канальцах, имеется фермент глутаминаза, гидролизующая амидную группу с образованием глутамата. Глутамат, в свою очередь, дезаминируется глутаматдегидрогеназой.
Параллельно в эпителии происходят процессы клеточного дыхания, сопросождающиеся образованием угольной кислоты, которая диссоциирует на ион Н+ и карбонат-ион НСО3−. Ионы водорода секретируются в первичную мочу, карбонат-ионы – в кровь.
Выделяемый аммиак диффундирует в просвет канальца, где соединяется с ионом Н+, образуя ионы аммония NH4+. Они связываются с неорганическими (фосфаты, хлориды, сульфаты) или с органическими анионами (уксусной, щавелевой, молочной кислот).
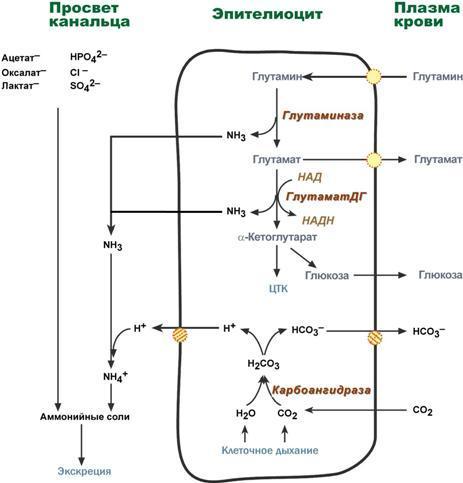
Реакции синтеза аммонийных солей
Билет 53-другой вариант
Аммиак образуется в ходе следующих процессов:
1) дезаминирования аминокислот;
2) дезаминирования биогенных аминов (гистамина, серотонина, цисте-амина и т. д.);
3) дезаминирования пуриновых оснований (гуанина и аденина);
4) дезаминирования амидов аминокислот (аспарагина к глутамина);
5) распада пиримидиновых оснований (урацила, тимина, Цнтозина). Аммиак — очень токсичное соединение, особенно для нервных клеток.
При накоплении его возникает возбуждение нервной системы. Поэтому в тканях Существуют механизмы его обезвреживания. К ним относятся: 1) образование мочевины; 2) восстановительное аминирование, или трансреамини-робание; 3) образование амидов аминокислот — аспарагина и глутамина; 4) образование аммонийных солей.
Основной путь обезвреживания аммиака — синтез мочевины. Еще в прошлом веке русские ученые М. В. Ненцкий и С. С. Салаз-кин показали, что в печени происходит образование мочевины из аммиака и углекислоты. Кребс и Гензенлейт установили, что синтез мочевины представляет собой циклический процесс, в котором каталитическую роль играет орнитин. Коген и Ратнер выяснили, что начальной реакцией этого цикла является синтез карбамоил фосфата. На рис. 58 приведен цикл образования мочевины. На образование одной молекулы мочевины расходуется три молекулы АТФ. Мочевина — безвредное для организма соединение. Главным местом ее образования в организме является печень, где есть все ферменты мочевниообразовання. В головном мозгу имеются все ферменты синтеза мочевины, кроме карбамоилфосфатсинтетазы, поэтому в нем мочевина не -образуется. Нарушение функции печени ведет к снижению мочевинообразования, и содержание мочевины в крови и выделение ее с мочой падает.
Восстановительное аминнрование — малоэффективный процесс связывания аммиака, так как необходимы значительные количества 2-оксоглута-рата.
Образование аспарагина н гяутамниа является важным вспомогательным путем связывания аммиака. Оно протекает с участием аспарагинсин-тетазы и глутаминсинтетазы по уравнениям:

Этот процесс активен в нервной и мышечной тканях, в почках.
Образование аммонийных солей. Глутамин и в меньшей степени аспа-рагии считают своеобразной транспортной формой аммиака, так как, образуясь в тканях, они с кровью попадают в почки, где подвергаются гидролизу под действием специфических ферментов — глутаминазы и аспарагиназы:

Освободившийся в канальцах почек аммиак нейтрализуется с образованием солей аммония
NH3 + H+ + CI-—+NH4C1 которые выделяются с мочой.
Билет 54

Образование н распад медиаторов. Медиаторы образуются в нервной ткани и ряде других клеток. Нейромедиаторы* образующиеся в нервных окончаниях, участвуют в передаче нервного импульса на другие нервные клетки или периферические органы и ткани Тканевые медиаторы участвуют в межтканевой регуляции обмена веществ.
В образовании ряда медиаторов существенное значение имеет реакция декарбоксилирования аминокислот, которая катализируется специфическими ферментами декарбокснлазачи, содержащими в качестве кофермента пиридоксальфосфат:
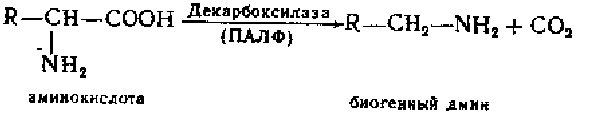
Продуктом декарбоксилироиания являются амины, обладающие высокой биологической активностью, поэтому их называют биогенными аминами. Большинство медиаторов принадлежат к этой группе соединений.

Почти все ткани и органы содержат гистамин. Особенно много его в тканях легких и в коже, имеется он в спинном мозге и подкорковых образованиях головного мозга. Большое количество гистамина образуется и депонируется в тучных клетках соединительной ткани, в которых он связан в виде белково-гепаринового комплекса. Освобождается он нз тучных клеток под действием веществ, .которые называются либераторами гистамина. Большое количество гистамина образуется в слизистой желудка, где он действует на секрецию пепсина и соляной кислоты. В крови гистамин связан с гранулами базофилов и эозинофнлов. Небольшие количества его всегда имеются в плазме крови и других биологических жидкостях.
В больших количествах гистамин освобождается при патологических Процессах, являясь медиатором аллергических реакций
Образование
серотонина. Серотонин образуется из
триптофана:
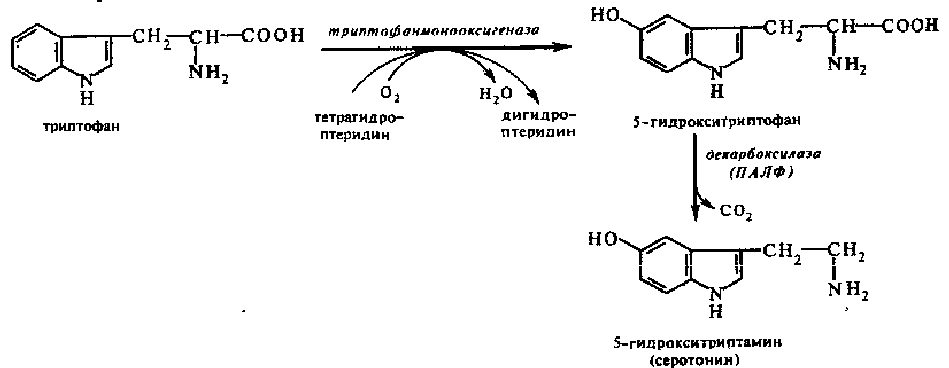
Примерно 90% серотонина взрослого человека содержится в «энтерохромаффинных клетках кишечника. Остальная часть его находится в тучных клетках кожи, селезенке, печени, почках, легких. Много серотонина в тромбоцитах крови и в центральной нервной системе. В частности, он образуется в сером веществе коры головного мозга, в гипоталамусе. Серотонин играет роль медиатора в нервной системе и местного регулятора функций периферических органов и тканей.
Образование у-аминомасляной кислоты (ГАМК). ГАМК образуется из глутаминовой кислоты под действием глутаматдекарбоксилазы:
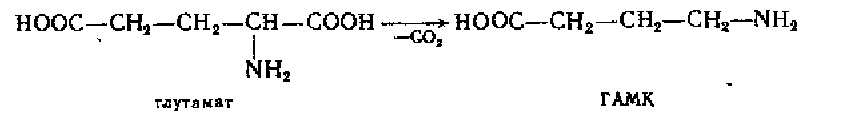
Синтез протекает в тормозных синапсах нервной системы, являясь их медиатором. Наибольшие количества ГАМК содержатся в подкорковых образованиях головного мозга (в черной субстанции, бледном шаре, гипоталамусе). В периферических органах она встречается в виде следов.играет роль нейрогуморального ингибитора.
Тирамин, b-(n-оксифенил)-этиламин, HO-C6H4-CH2-CH2-NH2, органическое вещество из группы биогенных аминов. Тирамин найден в спорынье, гниющих тканях, сыре. Отсюда и его название (от греч. tyros – сыр). Физиологически активен (в связи с сосудосуживающим действием повышает кровяное давление, влияет на процессы возбуждения и торможения в нервной системе) и токсичен. Образуется из аминокислоты тирозина под действием бактериальных декарбоксилаз, в частности при гнилостных процессах в кишечнике млекопитающих животных и человека. Обезвреживание избыточного тирамина в живом организме осуществляется в результате его окисленияферментом моноаминоксидазой (МАО).[1]
Билет 54 –другой вариант
Декарбоксилирование аминокислот
Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования. Несмотря на ограниченный круг аминокислот и их производных, подвергающихся декарбоксилиро-ванию в животных тканях, образующиеся продукты реакции – биогенные амины – оказывают сильное фармакологическое действие на множество физиологических функций человека и животных.
В живых организмах открыты 4 типа декарбоксилирования аминокислот:
1. α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:
![]()
2. ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:
![]()
3. Декарбоксилирование, связанное с реакцией трансаминирования:

В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.
4. Декарбоксилирование, связанное с реакцией конденсации двух молекул:

Эта реакция в тканях животных осуществляется при синтезе δ-амино-левулиновой кислоты из глицина и сукцинил-КоА (см. главу 13) и при синтезе сфинголипидов, а также у растений при синтезе биотина.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот (см. главу 10) как белковым компонентом, так и природой кофермента. Декарбоксилазы аминокислот состоят из белковой части,обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (ПФ), как и у трансаминаз.
Таким образом, в двух совершенно различных процессах обмена аминокислот участвует один и тот же кофермент. Исключение составляют две декарбоксилазы: гистидиндекарбоксилаза Micrococcus и Lactobacilus и аденозилметионин-декарбоксилаза Е. coli, содержащие вместо ПФ остаток пировиноградной кислоты.
Механизм реакции декарбоксилирования аминокислот в соответствии с общей теорией пиридоксалевого катализа (см. рис. 12.3) сводится к образованию ПФ-субстратного комплекса, представленного, как и в реакциях трансаминирования, шиффовым основаниемПФ и аминокислоты:
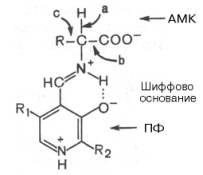
Образование подобного комплекса в сочетании с некоторым оттягиванием электронов белковой частью молекулы ферментасопровождается лабилизацией одной из трех связей при α-углеродном атоме, благодаря чему аминокислота способна вступать вреакции трансаминирования (а), декарбоксилирования (b) и альдольного расщепления (с).
Билет 55
Эритроциты примерно
через 120 дней разрушаются (лизируются)
в кровеносном русле или в селезенке.
Гемоглобин, освобождающийся из эритроцитов
в крови, связывается гаптоглобином
(специальный а2-глобулин
плазмы) и в виде комплекса гемоглобин
— гаптоглобнн попадает в клетки
ретикулоэндотелиальной системы (РЭС),
главным образом селезенки. Гемоглобин
окисляется в метгемоглобин (Fe**"),
а затем подвергается распаду. При этом
гаптоглобнн отщепляется .и переходит
в кровь. В клетках РЭС происходит первая
фаза распада гемоглобина, сопровождающаяся
образованием из него билирубина:

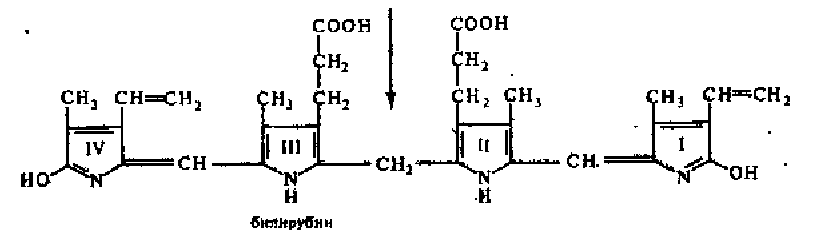
Сначала под действием гемоксигеназы происходит окислительное расщепление а-метинового мостика гема, соединяющего два соседних пиррольных кольца. Кольцевая структура гема разрывается и образуется вердоело-бин. Последний теряет железо, которое связывается белком-переносчиком трансферином и доставляется с кровью в костный мозг и глобин. Глобин гидролнзуется катепсинами селезенки до аминокислот. Разомкнутая тетра- лиррольная цепь вердоглобнна называется билидердином (желчный пигмент зеленого цвета). При восстановлении биливердиыа образуется билирубин — пигмент красно-желтого цвета.
Билирубин — плохо растворимое в воде соединение, поэтому, поступая в Кровь, он связывается белком плазмы альбумином. Комплекс альбумин — билирубин — важнейшая нормальная транспортная форма желчных пигментов. С током крови билирубин поступает в клетки печени. Как липофильное вещество он легко проникает'через мембрану клеток печени, освобождаясь от альбумина.
Внутри клеток печени происходит вторая фаза превращения гемпротеидов (рис. 61). В печейн образуются конъюгированные формы билирубина — билирубинглюкурониды. Донором глюкуроновой кислоты выступает УДФ-глю-куроновая кислота. Реакция катализируется УДФ^люкуронозилтрпнсферй-зой. Образуются билирубннмоноглюкуронид (20%) и билирубинднглюкуро-нид (80%). Билирубинглюкурониды — хорошо растворимые в воде соединения.
Билирубинглюкурониды лишь в незначительных количествах могут диффундировать в кровеносный капилляр. Поэтому в плазме крови присутствуют две формы билирубина: некокъюгированный (он же непрямой, или свободный) и конъюгированный (он же прямой, или связанный). На долю первого приходится около 75% общего билирубина плазмы крови, на долю второго — около 25%.
Билирубинглюкурониды выделяются с желчью в кишечник, где происходит заключительная, третья фаза распада гемпротеидов. В желчных путях отщепляется гликуроновая кислота от билирубинглюкуроннлов и вновь образуется неконъюгнрованныЙ билирубин. В тонком кишечнике небольшая часть билирубина может всасываться и через портальную вену вновь поступать в печень, а оттуда опять с желчью выделяться нз кишечника. Эта. печеночно-кишечная циркуляция, сходная с циркуляцией желчных кислот, возможно, имеет биологическое значение. Большая же масса билирубина подвергается многократному восстановлению бактериями кишечника или редуктазамн слизистой кишечника. В тонком кишечнике билирубин превращается в мезобилирубин, затем мезобилирубиноген (или уробилиноген). Последний всасывается в тонком кишечнике и через воротную вену поступает в печень, где уробилиноген необратимо разрушается до моно- и дипирролов. Неразрушенный уробилиноген вновь поступает с желчью в кишечник. В толстом кишечнике мезобилирубиноген (уробилиноген) восстанавливается анаэробными бактериями до стеркобилииогена, который, как и уробилиноген, бесцветен. Большая часть стеркобилииогена выделяется с фекалиями и быстро окисляется кислородом воздуха до стеркобилина — оранжево-желтого пигмента, в основном определяющего цвет фекалий.
Небольшие количества стеркобилииогена всасываются в прямой кишке и через- систему геморроидальных вен, минуя печень, достигают с током крови почек, которые выводят его с мочой, Стеркобилиноген мочи, как и в фекалиях, окисляется в стеркобилнн, частично определяя нормальный соломенно-желтый Цвет мОчи, Ранее считалось, _что с мочой выделяетсЯ-уробнлн-ноген (это нашло отражение в его названии), который окисляется в уробилин, имеющий ту же окраску, что и стеркобилин. В норме уробилиноген не выделяется ни с мочой, ни с фекалиями.
Итак, в норме промежуточный продукт распада гема — билирубин — не накапливается в крови, а быстро захватывается клетками печени. По содержанию билирубина и соотношению его форм в крови можно судить, с одной стороны, о скорости распада гемпротеидов в клетках РЭС, а с другой — о превращении билирубина в печени. В норме содержание общего билирубина в сыворотке крови составляет 8—20 мкмоль/л (из них 75% неконъюгированного).
Конечный продукт
превращения билирубина — стеркобилиноген
— выделяется
у человека в
основном с калом (примерно 300 мг в сутки)
и в незначительных количествах с
мочой (около 1—4 мг в сутки). В норме
билирубин в моче практически отсутствует
(нижний предел чувствительности
используемых методов позволяет определить
конъюгированный билирубин в моче при
его концентрации свыше 0,3 мг/л). Непрямой
(неконъюгированный) билирубин может
попасть в мочу только, если его повышение
в сыворотке крови сочетается с нарушением
проницаемости гломерулярной мембраны.
Прямой конъюгированный билирубин в
плазме крови в норме отсутствует. При
патологии элиминация прямого
(конъюгированного) билирубина с мочой
значительно варьирует. При остром
вирусном гепатите увеличение концентрации
прямого билирубина в моче может быть в
дожелтушный период, что существенно
при массовом обследовании (диспансеризации)
на гепатит. При выздоровлении билирубин
исчезает из мочи. Патологическая
билирубинурия может иметь место при
следующих заболеваниях: инфекционный
гепатит, цирроз печени, заболевания
желчного пузыря и желчных протоков,
метастатическая карцинома печени или
гематома, токсическое повреждение
печени.
Под влиянием
различных факторов в организме может
нарушаться образование, превращение
и выведение билирубина. Повышение
содержания билирубина в крови ведет
к отложению его в тканях, в том числе в
коже и слизистых, и вызывает окрашивание
их в
коричневато-желтый
цвет (цвет билиру бина). Эти состояния
называют желтухами,
которых бывает
несколько видов: гемолитическая
(или
надпеченочная), паренхиматозная
(или
гепатоцеллю-лярная) и обтурационная
(или
подпеченочная).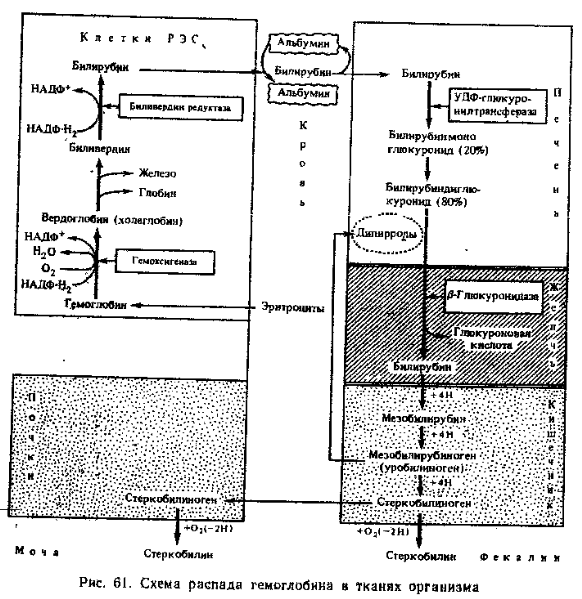
Билет 56
Переваривание нуклеопротеинов и всасывание продуктов их распада осуществляются в пищеварительном тракте. Под влиянием ферментов желудка, частично соляной кислоты, нуклеопротеины пищи распадаются на полипептиды и нуклеиновые кислоты; первые в кишечнике подвергаются гидролитическому расщеплению до свободных аминокислот. Распад нуклеиновых кислот происходит в тонкой кишке в основном гидролитическим путем под действием ДНК- и РНКазы панкреатического сока. Продуктами реакции при действии РНКазы являются пуриновые и пи-римидиновые мононуклеотиды, смесь ди- и тринуклеотидов и резистентные к действию РНКазы олигонуклеотиды. В результате действия ДНКазы образуются в основном динуклеотиды, олигонуклеотиды и небольшое количество мононуклеотидов. Полный гидролиз нуклеиновых кислот до стадии мононуклеотидов осуществляется, очевидно, другими, менее изученными ферментами (фосфодиэстеразами) слизистой оболочки кишечника. В отношении дальнейшей судьбы мононуклеотидов существует два предположения. Считают, что мононуклеотиды в кишечнике под действием неспецифических фосфатаз (кислой и щелочной), которые гидролизируют фосфоэфирную связь мононуклеотида («нуклеотидазное» действие), расщепляются с образованием нуклеозидов и фосфорной кислоты и в таком виде всасываются. Согласно второму предположению, мононуклеотиды всасываются, а распад их происходит в клетках слизистой оболочки кишечника. Имеются также доказательства существования в стенке кишечника нуклеотидаз, катализирующих гидролитический распад моно-нуклеотидов. Дальнейший распад образовавшихся нуклеозидов осуществляется внутри клеток слизистой оболочки преимущественно фосфороли-тическим, а не гидролитическим путем. Всасываются преимущественно нуклеозиды, и в таком виде часть азотистых оснований может быть использована для синтеза нуклеиновых кислот организма. Если происходит дальнейший распад нуклеозидов до свободных пуриновых и пиримидиновых оснований, то гуанин не используется для синтетических целей. Другие основания, как показывают опыты с меченными по азоту аденином и урацилом, в тканях могут включаться в состав нуклеиновых кислот. Однако экспериментальные данные свидетельствуют, что биосинтез азотистых оснований, входящих в состав нуклеиновых кислот органов и тканей, протекает преимущественно, если не целиком, de novo из низкомолекулярных азотистых и безазотистых предшественников.
Нуклеиновые кислоты гидролнзуются в тканях организма с помощью нуклеаз — деэокснрибоиуклеаз (ДНКазы) и рибонуклеаз (РНКаэы). Эти ферменты катализируют расщепление внутренних илн концевых межнуклеотидных связей (3', У-фосфодиэфирных) в ДНК и РНК. Иуклеазы, расщепляющие связи внутри полннуклеотидной цепи, называются эндонуклеазами, а отщепляющие концевые нуклеотиды — экзонуклеазами. Некоторые экзокуклеезы способны парализовать как ДНК, так и РНК. Под действием нуклеаз поли-нухлеотидная цепь распадается до олигонуклеотидов и мононуклеотидов (нуклеознд-5'- или З'-монофосфатов).
Мононуклеотиды распадаются до конечных продуктов обмена -гидролити-ческнм или фосфоролнтическим путями (в первом случае для разрыва связей используется вода, а во втором — фосфорная кислота),
Моновукдеотиды расщепляются с помощью нуклвотидаз {5'-нуклеотн-дазы и. З'-нуклеотндазы) и нуклеозидгидролвз до свободных оснований, пентозы и фосфата.
Пуриновые основания
окисляются до мочевой кислоты:
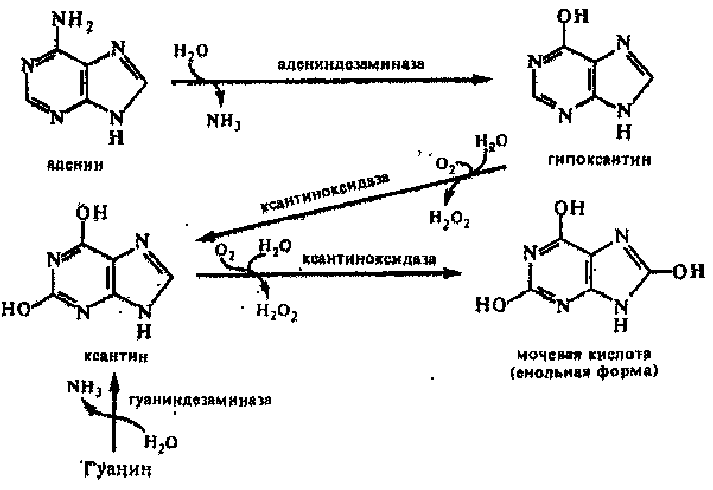
Она является конечным продуктом обмена пуриновых нуклеотидов в организме человека и выделяется с мочой. Превращение пирнмидиновых оснований идет до р-аланина, СОя и аммиака. Р-Аланин используется для синтеза дипептидов мышц — карноз'ина и ансерина — или выделяется с мочой.
Таким образом, содержание мочевой кислоты в крови и моче отражает интенсивность расщепления нуклеиновых кислот в организме.
Нарушения обмена пуринов
Подагра
Когда гиперурикемия принимает хронический характер, говорят о развитии подагры (греч. poclos – нога, agra – захват, дословно – "нога в капкане").
В крови мочевая кислота находится в форме ее солей – уратов натрия. Растворимость уратов в плазме крови невелика и при превышении порога растворимости в плазме (около 0,7 ммоль/л) они кристаллизуются в периферических зонах с пониженной температурой, образуя тофусы (греч. tophus – пористый камень, туф). Накапливающиеся в межклеточном веществе ураты некоторое время фагоцитируются, но фагоциты не способны разрушить пуриновое кольцо. В результате это приводит к гибели самих фагоцитов, к выходу лизосомальных ферментов, активации свободнорадикального окисления и развитию острой воспалительной реакции – развивается подагрический артрит. В 50-75% случаев первым признаком заболевания является мучительная ночная боль в больших пальцах ног.
Мочекаменная болезнь
Мочекаменная болезнь заключается в образовании солевых кристаллов (камней) разной природы в мочевыводящих путях. Непосредственно образованиемочекислых камней составляет около 15% от всех случаев этой болезни. Мочекислые камни в мочевыводящих путях откладываются примерно у половины больных подагрой.
|
Две переходные формы мочевой кислоты при pH 5,75 |
Наиболее часто такие камни представлены в дистальных канальцах и собирательных трубочках. Причиной отложения кристаллов мочевой кислоты является гиперурикемия и повышенное выведение уратов натрия с мочой. Главным провоцирующим фактором кристаллизации являетсяувеличение кислотности мочи. При понижении рН мочи ниже 5,75 ураты переходят в менее растворимую форму (кетоформу) и кристаллизуются в почечных канальцах. Возрастает образование уратных камней при закислении мочи, которое возникает по различным причинам, в том числе и из-за избыточного питания мясопродуктами, которые содержат большое количество нуклеиновых кислот, аминокислот и неорганических кислот, что делает такую пищу "кислой" и усугубляет процесс.
Синдром Леша-Нихана
Болезнь Леша-Нихана – это полное врожденное отсутствие активности гипоксантин-гуанин-фосфорибозил-трансферазы, фермента, отвечающего за реутилизацию пуриновых оснований. Признак рецессивный и сцеплен с Х-хромосомой. Впервые его описали в 1964 г в США студент-медик Майкл Леш и педиатр Уильям Нихан.
Дети рождаются клинически нормальными, только к 4-6 месяцу обнаруживаются отклонения в развитии, а именно – отставание физического развития (с трудом держит голову), повышенная возбудимость, рвота, периодическое повышение температуры. Выделение мочевой кислоты можно обнаружить еще раньше по оранжевой окраске пеленок. К концу первого года жизни симптомы нарастают, развивается нарушение координации движений, хореоатетоз, корковый паралич, спазм мышц ног. Наиболее характерный признак заболевания проявляется на 2-3-м году жизни – аутоагрессия или самокалечение – неодолимое стремление детей кусать себе губы, язык, суставы пальцев на руках и ногах.
Билет 57
В хранении, передаче и преобразовании генетической информации центральное место занимают нуклеиновые кислоты. Решающим фактором при этом является способность нуклеиновых, оснований к специфическому (комплементарному)спариванию (см. с. 90). (Эти процессы более детально рассматриваются в следующих разделах.)
А. Реализация и передача генетической информации
Хранение информации. Генетическая информация закодирована в последовательности нуклеотидов ДНК (DNA), организованных в функциональные участки, называемые генами. [РНК (RNA) как носитель генетической информации используется только некоторыми вирусами.] Участки ДНК кодируют белки, т. е. они содержат информацию об аминокислотной последовательности белков. Каждый остаток представлен в ДНК своим кодовым словом (кодоном), состоящим из трех следующих друг за другом оснований. Так, ДНК-кодон для фенилаланина представлен тринуклеотидом ТТС (2) На уровне ДНК кодоны образуют ее некодирующую цепь[последовательность нуклеотидов которой соответствует последовательности мРНК (mRNA)] (см. с. 90).
Репликация. Во время деления клеток генетическая информация должна перейти в дочерние клетки. Для достижения этого вся ДНК клетки копируется в процессерепликации во время S-фазы клеточного цикла (см. с. 380), при этом каждая ее цепь служит матрицей для синтеза комплементарной последовательности (1, см. с. 238).
Транскрипция. Для экспрессии гена, т.е. синтеза закодированных в нем белков, последовательность нуклеотидов кодирующей цепи ДНК должна быть трансформирована в аминокислотную последовательность. Поскольку ДНК не принимает непосредственного участия в синтезе белка, информация, хранящаяся в ядре, должна быть перенесена на рибосомы, где собственно и осуществляется биосинтез белков. Для этого соответствующий участок кодирующей цепи ДНК считывается (транскрибируется) с образованием гетерогенной ядерной РНК [гяРНК (hnRNA)], т. е. последовательность этой РНК комплементарна кодирующей цепи ДНК(3; см. с. 90). Поскольку в РНК вместо тимина содержится урацил (см с. 86), AAGтриплет ДНК трансформируется в UUC-кодон гяРНК.
Созревание РНК. У эукариот гяРНК, прежде, чем покинуть ядро в виде матричной РНК (мРНК, 4), претерпевает существенные изменения: из молекулы вырезаются избыточные (некодирующие) участки (интроны), а оба конца транскриптов модифицируются путем присоединения дополнительных нуклеотидов (см. с. 242).
Трансляция. Зрелая мРНК попадает в цитоплазму и связывается с рибосомами, преобразующими полученную информацию в аминокислотную последовательность. Рибосомы (см. с. 246) — это рибонуклеопротеидные комплексы, включающие несколько десятков белков и несколько молекул рибосомной РНК (рРНК (rRNA), см. с.88). Рибосомные РНК выполняют функцию структурного элемента рибосом, а также принимают участие в связывании мРНК и образовании пептидных связей.
Механизм преобразования генетической информации основан на взаимодействии кодонов мРНК с транспортной РНК [тРНК (tRNA), см. с. 88], которая переносит на рибосому аминокислоты, связанные с 3'-концом тРНК, в соответствии с информацией, закодированной в мРНК. Примерно в середине цепи тРНК расположен триплет (например,GAA), называемый антикодоном и комплементарный соответствующему кодону а мРНК. Если транслируется кодон UUC, то с ним взаимодействует антикодон в составе Phe-тРНК (5), несущей на 3'-конце остаток фенилаланина. Таким образом, остаток аминокислоты занимает положение, в котором на него может быть перенесена растущая полипептидная цепь, связанная с соседней тРНК (6).
Активация аминокислот. Прежде чем связаться с рибосомой, транспортные РНК присоединяют соответствующую аминокислоту с помощью специфического «узнающего» фермента (7, схема на с. 244), обеспечивающего точный перенос (трансляцию) генетической информации с уровня нуклеиновых кислот на уровень белка.

Можно отметить три варианта переноса генетической информации, обнаруженные в различных организмах.
.1. Перенос генетической информации в пределах одного класса нуклеиновых кислот, т. е. от ДНК к ДНК или у некоторых вирусов от РНК к РНК. называется репликацией или самоудшеннеи. Иногда такой вид переноса наследственной информации образно называют .«переносом из хранилища в хранилище», подразумевая под этим, что ДНК (или РНК у некоторых вирусов) выполняет функцию хранилища генетической информации. Репликация происходит во время деления клеток (в 5:фазу митотического цикла) и размножения вирусов, когда необходимо целиком передать информацию от одного организма к другому. Возможна репликация отдельных участков ДНК, называемая амплификацией.
2. Перенос информации между разными классами нуклеиновых кислот: ДНК—РНК, называется транскрипцией или переписыванием. В отличие от репликации при транскрипции происходит копирование не целиком всей информации, заложенной в молекуле ДНК. а только ее отдельных участков, ходе транскрипции образуются все типы РНК: главные (мРНК, тРНК, рРНК) и минорные.
Из' этого следует, что циСтроны ДНк содержат информацию не только о структуре полнпептндной цепи, но и о структуре тРНК, рРНК и минорных типов РНК.
. Транскрипция бывает прямая (от ДНК к РНК) и обратная (от РНК к ДНК)- Впервые обратная транскрипция была выявлена у РНКовых опухолеродных вирусов (называемых онкорнавнрусами), которые встраиваются в ДНК клетки-хозяина путем обратной транскрипции. Чужеродный' участок ДНК — копия вирусной РНк— вызывает опухолевую' трансформацию клетки, Возможно, обратная транскрипция имеет значение не только при опухолевой трансформации клеток, но и при их нормальной жизнедеятельности -или в ходе их дифференцировки. В- принципе обратная транскрипция возможна при использовании любого типа РНК, а не только мРНК.
3. Перенос генетической информации от мРНК к белку, т. е. в пределах разных классов макромолекул, называется трансляцией или переводом. При трансляции происходит как бы перевод информации с «языка» нуклеиновых кислот,, имеющего нуклео'тидныЙ алфавит, на «язык» полипептидной цепи, в котором использован аминокислотный алфавит. Транслируется только мРНК. Остальные типы РНК являются готовыми продуктами генов, образующимися прн транскрипции. рРНК и тРНК играют вспомогательную роль при трансляции. Трансляция, по термодинамическим и биологическим соображениям, может быть только прямой — от мРНК к белку. Обратная трансляция запрещена.
Подобное направление переноса генетической информации от ДНК через РНК к белку называется цвмтралопоил гшстулшим молекулярной генетики, который был сформулирован Криком. Согласно ему не может быть переноса информации от белка к РНК,' но допускается перенос от РНК к ДНК. Если вдруг обнаружится перенос информации от белка к РНК, то придется пересмотреть весь фундамент молекулярной генетики.
Итак, первичными продуктами действия генов являются два типа макромолекул. Это прежде всего белок и некоторые тнпы РНК: рРНК, тРНК и минорные РНК-
Все виды передачи генетической информации основаны на матричном механизме. Это означает, что для каждого ил них необходима матрица. При репликации матрицей служит одна из цепей ДНК (или РНК у вирусов), при транскрипции — участок ДНК (прямая транскрипция) или РНК (обратная транскрипция), а при трансляции — мРНК, т. е. матрицей может быть только нуклеиновая кислота. Матрица позволяет с большой точностью (что очень важно, поскольку речь идет о наследственных свойствах) и экономичностью (что не менее важно) воспроизводить имеющуюся в клетке генетическую информацию. Точность копирования соответствующей нуклеиновой матрицы обеспечивает правило комплементарности азотистых оснований нуклеотидов, согласно которому происходит спаривание А с Т (или с У в РНК) -и Г с Ц. Благодаря этому порядок чередования нуклеотидов в каждой новой полинуклеотидной цепи комплементарен матрице.
Билет 58
Теоретически возможны несколько вариантов репликации ДНК: консервативная, когда дочерняя двойная спираль ДНК образуемся без разделения цепей родительской ДНК; полуконсервативная) при которой цепи родительской ДНК расходятся, и на каждой из родительских цепей образуются комплементарные цепи дочерней ДНК, и дисперсивная, которая предусматривает расщепление в нескольких местах цепей родительской ДНК и образование на ней новых цепей ДНК-
В 1957 г. Меселсон и Сталь установили, что в живых организмах репликация ДНК происходит по полуконсервативному механизму. Сначала он представлялся просто:на расплетающихся цепях ДНК, которые являются матрицами, образуются комплементарные новые цепи ДНК. Нуклеотиды при этом выстраиваются по матрице соответственно правилу комплементарности, а «сшиваются» друг с другом фосфодиэфирнымй связями с помощью специального фермента ДНК-полимеразы. Впоследствии оказалось, что ДНК-полимераза не способна начать синтез новой ДНК из свободных нуклеотидов; она лишь способна удлинять полинуклеотидную цепь, т. е. для нее нужна затравка. В настоящее время репликация ДНК представляется сложным, многоступенчатым процессом,
Для репликации ДНК необходим ряд условий;
1) наличие дезоксирибонуклеозидтрифосфатов (дАТФ, дТТФ, дГТФ i! дЦТФ) как структурного материала для сборки новых цепей ДНК;
2) расплетение двойной спирали ДНК;
3) образование затравки;
4) наличие ферментов, участвующих в образовании затравки и синтезе новых полинуклеотидных цепей ДНК.
Механизм репликации ДНК у прокариотов. Каждая стадия процесса репликации протекает с участием соответствующих ферментов.
/. Расплетающие белки разрывают водородные связи между комплементарными основаниями двойной спирали ДНК- В результате двойная спираль расплетается и расходится на отдельные цепи. (Внешне это напоминает расстегивание застежки «молния».) Расплетенный участок ДНК называется репликативной вилкой. В его образовании участвует сразу до 200 молекул расплетающего белка, поэтому каждая ветвь репликативной вилки, *на которой происходит начало синтеза новой ДНК, имеет протяженность до 2000 неспаренных оснований. Механизм действия расплетающих белков детально не изучен. Возможно, для расплетения ДНК используется энергия АТФ.
2. «Затравочная» ДНК-зависимая РНК-полимераз'а'— особый вариант РНК-полимеразы (обычно эти ферменты участвуют в транскрипции), которая образует небольшую РНК-затравку («шраймер»), комплементарную участку ДНК в репликативной внлке. Синтез РНК-затравки идет от конца 5' к концу 3'. Порядок чередования нуклеотидов в РНК задается ДНК-матрицей, а сшивка их 5'->-3'-фосфодиэфирнымй связями осуществляется РНК-полиме-рвзой.
3. ДНК-Полимеразы. Известны три формы ДНК-полимераз у прокариотов: I, II и III. Все они обладают двумя видами активности: полимеразной и нуклеазной. Полимеразная состоит в образовании фосфодиэфирных связей 5'-»-3' между дезоксирибонуклеотидами, нуклеазная — в гидролизе фосфодиэфирных связей.
ДНК-полимераза I расщепляет РНК-затравку при репликации (действует как РНКаза) и на ее месте синтезирует комплементарный фрагмент ДНК . ДНК-полимераза - II имеет очень низкую полимеразную активность. Функция ее в репликации неизвестна.
: ДНК-Полимераза III является основным ферментом репликации, синтезируя на разошедшихся цепях ДНК комплементарные участки новой ДНК в направлении 5'-*-3'.
4. Рибонуклеаза Н. Участвует в гидролизе РНК-затравки в ходе репликации наряду с ДНК-полимеразой I.
5. ДНК-Лигазы (соединяющие ферменты). Обнаружено несколько ферментов, функция которых состоит в соединении друг с другом новосинте-зироэанных 'фрагментов ДНК- ДИК-Лигазы образуют фосфодиэфирные связи 3'-*-5', используя НАД* в качестве источника аденнлила.
Общая схема репликации представляется следующим образом (рис, 65). Под действием расплетающих белков образуются сразу в нескольких местах молекулы ДНК (как правило, на внутренних участках) репликативные вилки. Начинается репликация (инициация) с образования РНК-затравки с помощью РНК-полнмеразы в направлении 5'-*-3'. После завершения синтеза короткой цепи РНК на матрице ДНК фермент отделяется от ДНК, Далее происходит присоединение к РНК-затравке дезоксирибонуклеотидов с помощью ДНК-полимеразы III в направлении 5'-*3', Образуется гибридная цепь: РНК— ДНК, Причем ДНК-полимераза III синтезирует короткие фрагменты ДНК (фрагменты Оказаки) на другой родительской цепи репликатив-ной вилки. Интересно, что по ходу синтеза ДНК-полимераза III может исправлять ошибки при неправильном спаривании нуклеотидов. Если произошла ошибка, то этот нуклеотид тут же отщепляется ферментом благодаря нуклеазной активности, а прн правильном спаривании" нового нуклеотида присоединяет его к уже имеющемуся фрагменту ДНК.
РНК-Затравка после действия ДНК-полимеразы III полностью удаляется или специфической рибонуклеазой Н, или ДНК-полимеразой I. На месте бывшей РНК-затравки наращивается цепь ДНК с помощью ДНК-полимеразы I. Соединение синтезированных фрагментов ДНК (фрагментов Оказаки) в направлении 3'-*5' происходит с помощью ДНК-лигазы,
Биологический смысл репликации – сохранение и точная (неискажённая) передача генетической информации в ряду поколений клеток и организмов, а также при воспроизведении ДНК-содержащих структур (митохондрий, пластид, некоторых вирусов).
Билет 59
В процессе жизнедеятельности зрелой клетки только часть генетической информации, записанной в ДНК хроматина, реализуется при транскрипции в виде копий РНК- Участки неактивной, или репрессированной, ДНК входят в состав глобулярных нуклеосом хроматина, а активной — в состав межнуклеосомных фрагментов или «развернутых» линейных нуклеосом.
Элементарную единицу транскрипции у прокариотов и зукариотов, т. е. отрезок ДНК, подвергающийся транскрипции, принято называть транскриптоном. Иногда транскрнптоны прокариотов называют также оперонами
Отдельные участки транскриптонов несут разную функцию, Одна группа участков относится к информативным, а другая — к неинформативным. К информативным относятся структурные цнстроны или гены, несущие информацию о структуре полипептндной цепи или нематричных РНК (рРНК, тРНК, других низкомолекулярных стабильных РНК); неинформативные выполняют другие функции и не содержат генетической информации.. Совершенно неожиданно оказалось, что структурные гены в транскриптоне могут быть двух типов; непрерывными и «разорванными», или прерывистыми, Непре рывность генов считалась абсолютным признаком.. Тем не менее во многих структурных генах, особенно зукариотов, генетическая информация записана С перерывами. Участки в структурных генах, несущие информацию, называются экзанами.
а неинформативные — интронами Возможно, нитроны играют дополнительную регуляторную функцию для экзонов.
В ДНК хромосом обнаружены подвижные фрагменты, которые названы мобильными генами или транспозонами. Миграцию транспозонов объясняют механизмом обратной транскрипции, т. е. сначала образуется транскрипт мобильного гена, а затем он используется как матрица для встраивания ДНК-копин а другом участке хромосом. Функция «прыгающих» генов еще не ясна Известно, однако, что они могут вызывать перестройки в геноме, изменять функцию тех участков ДНК. рядом с которыми они встраиваются. Вместо с тем мобильные гены, участвуя в перестройке отдельных фрагментов хромосом, влияют на изменчивость организмов и их эволюцию.
Начальный участок транскриптона, с которого начинается транскрипция, называется промотор. К нему присоединяются белки, облегчающие начало транскрипции, и фермент транскрипции РНК-полнмераза. Оператор — участок ДНК, связывающий белки-регуляторы транскрипции. Таким бел ком-регулятором транскрипции у прокариотов является репрессор.
У эукариотов после промотора находится участок транскрнптона, который называют акцепторной или управляющей зоной. С ней взаимодействуют различные регуляторы, влияющие на транскрипцию. В акцепторной зонеимеется фрагмент ДНК (его называют усилитель или «эихансер»), который облегчает транскрипцию с участием РНК-полимеразы.
К оператору, или акцепторной зоне, примыхают структурные цистроны, или гены, содержащие перемежающиеся участки интронов и экзонов. В одном транскриптоне может быть один структурный цистрон (моноцистронный транскриптон) или несколько (полицистронный транскриптон). В конце транскриптона имеется последовательность нуклеотидов, которая является своего рода сигналом об окончании транскрипции, — терминатор. РНК, образующаяся при транскрипции, называется транскриптом. Транскрипт — комплементарная копия транскриптона от промотора до терминатора.
Для транскрипции необходимы определенные условия:
1) участок ДНК. подлежащий TpdKCKpнянин, долж'Л-; быть расгиетуя для образования одноцепочсчной матрицы (только одну щ?пь ДНК служит матрицей при синтезе РНК; ten и бы обе цепи ДНК одновременно использовались в качестве матрицы, то на одном траискрпитоне синтезировались бы две комплементарные РНК, несущие информацию для двух разных белков);
2) наличие рнбонуклеонидтрифосфатив (АТФ, ГТФ. УТФ ЦТФ) для синтеза РНК;
3) наличие специальных ферментов транскрипции ДНК-завнсимыч РНК-полймераз, синтезирующих РНК по матрице ДНК.
Механизм .транскрипции ДНК Транскрипция имеет три фазы: инициацию, элонгацию и терминацию, т. е. начало, продолжение и окончание синтеза РНК (рис. 67).
Инициация транскрипции происходит вследствие присоединения ДНК-зависимой РНК-полимеразы к промотору, обладающему высоким сродством к этому ферменту. Промотор — стартовая точка транскрипции РНК-полимераза прокариотов состоит из пяти разных субъединиц. Четыре из них образуют агрегат, называемый корферментом (от лат. сог — сердце, сердцевина), катализирующий образование фосфоднэфирных связей между нуклеотидами в РНК- Пятая субъединица, называемая о-фактором или о-субъединицей, легко отделяется от кор-фермента. Эта а-субъединица как бы выбирает стартовую точку транскрипции, связываясь с промотором. Затем .к а-фактору, выбравшему место транскрипции, присоединяется кор-фермент. и начинает транскрипцию. Неясно, что вызывает разъединение двойной спирали ДНК в месте транскрипции. Возможно, эту функцию тоже выполняет РНК-полимераза, а может быть, есть специальный белок (типа расплетающего, как прн репликации),
У зукариотов имеется три РНК-полимеразы: I, II н III. Это белки, состоящие из нескольких субъединиц и отличающиеся друг от друга по специфичности транскрипции. РНК-Пол имераза I ответственна за транскрипцию генов рРНК, РНК-полимераза II — за тРНК и 5S рРНК, а РНК-полимераза III участвует в синтезе предшественника мРНК. Очевидно, структура трех разных типов РНК'-полимераз зукариотов предусматривает специфический выбор транскриптонов, содержащих информацию о структуре рРНК, тРНК и полипептидной цепи.
РНК-Полимеразы наращивают цепь всегда только в направлении 5'-»-3'. поэтому 5'-конец содержит всегда трифосфат (Ф~Ф~Ф—), а 3'—свободный ОН. Начинается синтез всех цепей РНК либо о фффА, либо с фффГ, которые специфически спариваются со стартовыми основаниями разных транскриптонов.
Элонгация транскрипции происходит при скольжении РНК-полимеразы вдоль матрицы ДНК, Каждый следующий нуклеотид спаривается с комплементарным основанием в ДНК-матрице, а РНК-полнмераза «скрепляет* его с растущей цепью РНК фосфодиэфирными связями. Скорость элонгации составляет примерно 40—50 нуклеотидов в секунду,
Терминация транскрипции происходит после достижения РНК-полнмеразой нуклеотидных последовательностей ДНК, являющихся стоп-сигналами. Считают, что такими стоп-сигналами в транскриптоне могут быть поли(А) последовательности, поскольку в транскриптах на З'-конце обнаруживаются комплементарные им поли (У) последовательности. Выделен н специальный фактор .терминации — р-фактор, который является белком. Он обрывает транскрипцию, каким-то образом взаимодействуя с терминирующими последовательностями транскриптона. Благодаря терминаторам цепи РНК образуются только определенной длины.
По мере того как транскрипция подходит к концу, синтезированная РНК отделяется от ДНК. Первичные продукты транскрипции, т. е. РНК, являются полными копиями (в комплементарном изображении) транскриптонов ДНК. А значит, в новосинтезированиой РНК имеются информативные и неинформативные участки, Причем неинформатнвиые участки, несущие определенные функции в транскриптоне ДНК. очевидно, не нужны а РНК и являются своеобразными издержками транскрипции. Да и перенесены они в РНК потому, что процесс транскрипции непрерывен, а «выборочное» ко-пирование только информативных (структурных) участков транскриптонов вряд ли возможно. Первичные транскрнпты нужно освободить от неинформативного груза и оставить только информативную часть молекул РНК. Поэтому первичный транскрнпт называют РНК-предщестненннком. Прн транскрипции образуется в основном три типа предшественников РНК:
1) предшественник мРНК, или гетерогенная ядерная РНК (сокращенно Пре-мРНК или ГнРНК), содержащая мРНК, использующуюся в цитоплазме как матрица при синтезе белка;
2) предшественники рРНК (пре-рРНК). содержащие 18S рРНК и 28S рРНК у эукариотов и, соответственно, 16S и 23S рРНК у прокариотов;
3) предшественник тРНК (пре-тРНК).
В ядре эукариотов асе предшественники связываются с белками, образуя рибонуклеопротеиды.
Билет 60
Обратная транскрипция характерна для так называемых ретровирусов — обширной группы вирусов, различающихся как по биологическим свойствам (в частности, по способности вызывать злокачественные опухоли), так и по морфологии. К данной группе относятся хорошо известные вирус иммунодефицита человека, вирус саркомы Рауса. Их вирионы содержат фермент обратную транскриптазу (РНК-за-висимую ДНК-полимеразу). Когда вирус попадает в клетку-хозяина, с помощью обратной транскриптазы осуществляется синтез ДНК с использованием в качестве матрицы вирусной РНК. Новосинтезированная (одноцепочечная) ДНК при участии ферментов клетки-хозяина превращается в двунитевую структуру в результате достраивания комплементарной ДНК (кДНК). Эта двунитевая ДНК встраивается в геном клетки-хозяина с помощью специфических рекомбинационных механизмов, где она может в течение длительного времени (в ряду поколений) оставаться в скрытом неэкспрессируемом состоянии. Однако под действием определенных факторов (ионизирующие излучения, канцерогенные агенты и т.д.) эти бездействующие гены могут активироваться и способствовать превращению клетки в раковую
8. Генная инженерия
Генная инженерия — это направление в молекулярной генетике по разработке методов конструирования нужных генов и внедрению нх в клетку хозяина с целью изменения ее генетических свойств,
В настоящее время методы генной инженерии используются для генетического конструирования видов, т. е. соединения генов разных организмов (вируса и бактерии, вируса и зукариотов), направленного улучшения наследственных качеств организма (селекция), промышленного получения белков, являющихся продуктом действия пересаженных в клетку генов и т. д.
Методы генной инженерии включают следующие основные стадии:
1) получение интересующего гена, т. е. фрагмента ДНК;
2) соединение этого гена с так называемой векторной молекулой, способной доставить ген в клетку хозяина и тем обеспечить репликацию чужеродного гена;
3) введение полученной гибридной ДНК в клетку реципиента;
4) отбор клеток, где размножается (клонируется) введенный чужеродный ген.
Получение интересующего гена. Получают требуемые гены или химическим, или ферментативным способом. Прямой химический синтез гена можно провести, если известна последовательность в нем нуклеотидов. Успехи химии позволяют получить подобным способом ген практически любой длины. Во втором случае предварительно или выделяют в очищенном виде мРНК на тканей (так получены мРНК глобина, овальбумина, иммуноглобулинов и т. д.)^ или синтезируют химическим путем нужную мРНК. Далее мРНК используют как матрицу для ферментативного, синтеза комплементарной ДНК (кДНК) с помощью обратной транскрипции. Для этой цели используется РНК-завнсимая ДНК-полимераза, или обратная транскрнптаза. Сначала с помощью обратной траскрнптавы на мРНК образуется однонитевая кДНК, а затем с помощью ДНК-полныеразы достраивается вторая нить кДНК-
Получение гибридной ДНК. Вектором называется часть гибридной ДНК. обеспечивающая проникновение и репликацию ее в клетке-хозяине. В качестве вектора применяются плазмиды, умеренные фагн, вирусы. Гибридную ДНК получают путем разрезания молекулы вектора специальными ферментами (рестрнктазамн) и соединения его с чужеродным геном с помощью ДНК-лнгазы, '
Перенос гибридной ДНК и клонирование генов. После получения гиб ридной ДНК ее вносят в среду, где находятся клетки-реципиенты. Наиболее частым объектом является кишечная палочка. Для улучшения проникновения гибридной ДНК в клетки их обрабатывают различными способами (например, растворами СаС1а). Клетки, в которых начинается размножение генов, транскрибирование и транслирование, отбираются. Индикатором функционирования пересаженного гена является соответствующий белок. Значительная часть этих белков выделяется во внеклеточную среду, их легко можно получить, например, осадив клетки центрифугированием. Подобными методами была осуществлена пересадка многих генов, в том числе гена инсулина, соматотропина, овальбумина и др. Это открывает возможность промышленного получения белковых лекарственных препаратов геннойнженерным методом.
Технология рекомбинантных ДНК использует следующие методы:
· специфическое расщепление ДНК рестрицирующими нуклеазами, ускоряющее выделение и манипуляции с отдельными генами;
· быстрое секвенирование всех нуклеотидов очищенном фрагменте ДНК, что позволяет определить границы гена и аминокислотную последовательность, кодируемую им;
· конструирование рекомбинантной ДНК;
· гибридизация нуклеиновых кислот, позволяющая выявлять специфические последовательности РНК или ДНК с большей точностью и чувствительностью;
· клонирование ДНК: амплификация in vitro с помощью цепной полимеразной реакции или введение фрагмента ДНК в бактериальную клетку, которая после такой трансформации воспроизводит этот фрагмент в миллионах копий;
· введение рекомбинантной ДНК в клетки или организмы.
Ген соматостатина был получен на основе сведений о первичном строении этого пептидного гормона, состоящего всего из 14 аминокислот. Использованный в этой работе подход оказался весьма перспективным для получения и многих других пептидных гормонов.
В различных лабораториях в СССР и за рубежом были созданы штаммы Е. coli, синтезирующие в составе гибридных белков гормон роста человека (соматотропин), пептидные гормоны -- брадикинин и ангиотензин, нейропептид лей-энкефалин и др.
Ген гормона роста человека длиной 584 п.н.-- наиболее длинный из искусственно синтезированных в настоящее время. Он был встроен в плазмиду, реплицирующуюся в Е. coli под контролем промотора триптофанового оперона.
Трансформированные полученной химерной плазмидой клетки Е. coli продуцировали при индукции промотора около 3 млн. молекул гормона роста человека в расчете на клетку. Этот полипептид, как было установлено в экспериментах на крысах с удаленным гипофизом, по функциям оказался полностью идентичен гормону роста человека.
В 1976г. Гилберт и Максам в Гарвардском университете, а также Сэнгер разработали быстрый метод химического анализа ДНК. Появилась реальная возможность опреде-лять последовательность до 1000 нуклеотидов в неделю силами одного исследователя.
В 1982-1985гг. стало возможно создать прибор для автоматического анализа нуклеиновых кислот (а значит и генов).
Еще один важнейший этап - это синтез биополимеров по установленной структуре. Первые коммерческие приборы, производящие автоматизированный синтез полипептидов, были разработаны на основе исследований Меррифилда в 1963г. Они используются в исследовательских лабораториях и в фармацевтической промышленности.
Метод химического синтеза генов обеспечил также возможность получения штаммов бактерий продуцентов инсулина человека, важного лечебного препарата для больных диабетом.
Таким способом получены и клонированы гены, кодирующие глобины человека, животных и птиц, белок хрусталика глаза быка, яичный белок, фиброин шелка, продуцируемый тутовым шелкопрядом, и др.
Этот же принцип был применен для получения, клонирования и экспрессии генов интерферона человека в бактериях. Интерферон - ценный лекарственный препарат, широко используемый для борьбы с вирусными инфекциями и лечения ряда других заболеваний, включая злокачественные опухоли. Интерферон вырабатывается в клетках животных и человека, но обладает выраженной видовой специфичностью.
За счет введения в векторную плазмиду сигнальных последовательностей, инициирующих синтез и РНК и белка, удалось получить бактерии, способные синтезировать до 5 мг интерферона в расчете на 1л суспензии бактерий. Это в 5000 раз больше, чем содержится в 1л крови доноров. Замена Е. coli на микробы некоторых других видов позволяет еще больше увеличить производительность такой «фабрики интерферона».
Генно-инженерная биотехнология лекарственных средств. Этот способ производства лекарственных препаратов в настоящее время освоен в лабораторных условиях и внедряется в фармацевтическую промышленность. Методы генной инженерии могут быть использованы только для получения белковых и пептидных препаратов. Пересадкой генов, кодирующих образование инсулина, соматостатина, соматотропина и других белково-пептидных гормонов, в кишечную палочку были получены в культуральиой жидкости продукты деятельности пересаженных генов, т. ё. соответствующие белковые препараты. Особую ценность представляет разработка промышленной биотехнологий производства инсулина, требующегося во все возрастающих количествах. Возможность его получения традиционным способом — из поджелудочных желез крупного рогатого скота — ограничена, а химический синтез, осуществленный в лабораторных условиях, трудоемок и пока несовершенен.
Большой интерес для фармацевтической промышленности представляет новый способ биотехнологии нммунопрепаратов — антител, интерферона. Он основан на получении клеточных гибридов, которые могут производить антитела в пробирках. Для этой цели были-взяты клетки селезенки, продуцирующие антитела, но неспособные Долго жить в пробирке, и клетки опухолей, которые хорошо живут и размножаются в искусственной среде. Из них получены клеточные гибриды, т. е. клетки, получившиеся не вследствие деления, а в результате слияния. Эти клеточные гибриды, названные гибридояами, унаследовали от клеток' селезенки способность синтезировать антитела, а от опухолевых клеток — быстро размножаться в искусственных условиях Весь процесс получения препаратов чистых антител и интерферона упрощается. Животным вводят соответствующие белковые вещества (иммунизируют) или заражают вирусом (для производства интерферона), берут от них клетки селезенки, получают гибридомы и соответствующие иммунопрепараты. В настоящее время многие фармацевтические фирмы производят иммунопрепараты подобным способом.
Билет 61
5. Молекулярные основы трансляции
При трансляции генетический текст мРНК переводится в линейную последовательность аминокислот полипептидной цепи белка. Поскольку продуктом трансляции является специфический белок, то процесс трансляции в равной степени можно назвать биосинтезом белка.
Процесс трансляции можно разделить на два этапа, которые имеют разную локализацию в клетке: рекогниция, или узнавание аминокислот, и собственно биосинтез белка. Рекогниция протекает в гиалоплазме, а биосинтез белка происходит на рибосомах.
Рекогниция, или узнавание аминокислот
Сущность процесса узнавания аминокислот состоит в том, чтобы соединить аминокислоту со своей тРНК. Структура тРНК обладает качествами потенциального «переводчика», так как в одной молекуле совмещены способности «читать» нуклеотидный текст (антикодон тРНК специфически спаривается с кодоном мРНК) и нести (на акцепторном конце) свою аминокислоту. Однако соединяться со своей аминокислотой тРНК не может. Для этой цели в клеточном соке имеются специальные ферменты, которые по существу выполняют роль «переводчиков», т. е. обеспечивают узнавание тРНК своей аминокислоты.Эти ферменты называются аминоацил-гРНК-синтетазами (сокращенно АРСазы). Они специфически узнают тРНК и аминокислоту, катализируя их соединение по реакции
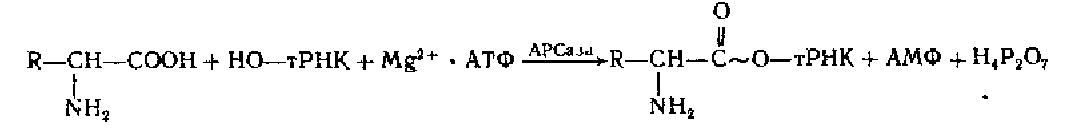
Для этого процесса требуется АТФ (Mgz+ играет роль кофактора), энергия которой используется на образование макроэргической связи в аминоацнл-тРНК, т. е. в реакции происходит одновременно активирование аминокислоты С карбоксильного конца и присоединение её к гидроксилу (З'-ОН) аденозина акцепторного конца (ЦЦА) тРНК. АРСазы обладают способностью выборочно использовать при узнавании ассортимент тРНК для данной аминокислоты, т. е. ведущим звеном узнавания является аминокислота, а к пей подгоняется своя тРНК (иди свои тРНК)
Далее тРНК путем простой диффузии переносят присоединенную к ней аминокислоту к рибосомам, где происходит сборка белка из аминокислот, поступающих в виде разных аминоацил-тРНК.
Биосинтез белка на рибосомах
Для биосинтеза белка (второго этапа трансляции) требуются; мРНК как генетическая матрица, программа которой определяет порядок чередования аминокислот в белке; аминоацил-тРНК (для чтения «текста» мРНК и Как источник аминокислот при сборке белка); рибосомы как молекулярные машины для последовательного соединения аминокислот в полипептидную цепь в соответствии с программой мРНК; ГТФ как источник энергии при синтезе белка в рибосомах; белковые «факторы*, помогающие на разных фазах сборки белка в рибосомах, и, наконец, некоторые ионы как кофакторы (Mg1*, К+ и др.).
Механизм синтеза белка на рибосомах
Синтез белка, или собственно трансляцию, принято разделять на три фазы: инициация (начало), элонгация (удлинение полипепТндной цепи) и терминация (окончание).
Инициация. Начало трансляции — наиболее медленный процесс. В нерабочем состоянии субчастицы рибосом разомкнуты. мРНК, поступившая из ядра в цитоплазму, связывается с малой субчастицей на поверхности, обращенной к большой субчастнце. Причем точка присоединения к субчастнце расположена рядом с 5'-концом РНК, так как «чтение» программы РНК всегда идет в направлении 5'-*-3'. В пределах субчастицы умещаются только два кодона мРНК. Первым кодовом мРНК у 5'-конца является АУГ или ГУГ, Эти кодойы называются инициирующими, так как именно с них всегда начинается трансляция в рибосомах. Этим кодонам соответствует антикодон метионил-тРНК. У эукарнотов имеются две разные метионил-тРНК. Одна из них всегда участвует в инициации, а другая используется в процессе элонгации. У прокариотов синтез белка начинается с формилметиоиил-тРНК, где NH2-rpynna заблокирована формильной группой,
Кроме того, в инициации участвует как минимум три белковых фактора инициации (F|, Fa, F3), которые не являются составными компонентами рибосом, и ГТФ. Белковые факторы инициации облегчают связывание мРНК с малой субчастицей и ГТФ. К этому первичному комплексу (факторы инициации — малая субчастица — мРНК — ГТФ) присоединяется большая субчастица, т. е. происходит смыкание субчастиц рибосом, после чего факторы инициации удаляются из рибосом. Необходимая для смыкания субчастиц энергия получается за счет гидролиза ГТФ. Образовавшийся инициаторный комплекс (мРНК, рибосома и метионил-тРНК) готов к элонгации. Причем метионил-тРНК своим антнкодоном специфически спаривается с кодоном АУГ мРНК, т. е. как бы «подвешивается» на водородных связях к мРНК. а акцепторный конец, где находится аминокислота, прикрепляется к большой субчастице рибосом.
Элонгация. Рассмотрим, как происходит удлинение полипептида на одну аминокислоту (рис, 68), Синтез полипептида всегда начинается от N-конца и заканчивается С-концом. Наращивание полипептида на одну аминокислоту осуществляется в три шага:
1) связывание аминоацил-тРНК;
2) транспептидация (или перенос пептида);
3) транслокацня (или перемещение мРНК на один триплет).
Первый шаг. В рибосомах слева находится тРНК. которая антикодоном связана с кодоном мРНК, а акцепторный конец «связан» с растущим пептидом
Этот пептид, входящий в пептндил-тРНК. связан с П-участком, который в виде белковой ниши находится на большой субчастице. В момент первого шага второй кодон мРНК свободен. С ним спаривается своим антикодоном поступающая в рибосомы аминоацил-тРНК- Амино-ацнльный конец этой тРНК связывается с А-участ'ком большой субчастицы рибосомы. На этом первый шаг, т. е. связывание, заканчивается. На Связывание тратится энергия фосфатной связи ГТФ.
Второй шаг — транспептидация — совершается таким образом, что происходит переброс пептидила с левой тРНК на аминогруппу аминоацил-тРНК- ПрН этом образуется пептидная связь. Катализируют образование пептидной связи белки рибосом, обладающие пептидилтрансферазной активностью.
Третий шаг состоит в размыкании субчастиц рибосом, на что расходуется энергия одной молекулы ГТФ. Пептидил-тРНК, уже несущая трипепт'ид, перемешается из А-участка вместе с мРНК. с которой
она спарена, в П-участок на один триплет и выталкивает свободную тРНК нз рибосом. Для синтеза одной пептидной связи (или удлинения полипептида на одну аминокислоту) затрачивается энергия двух молекул ГТФ.
Помогают элонгации так называемые белковые факторы элонгации. Элонгация продолжается до тех пор, пока' весь текст мРНК не будет прочитан.
Термннация — окончание трансляции — зависит от присутствия в мРНК терминирующих кодонов, или «стоп-сигналов» (УАА, УГА, УАГ) и белковых факторов терминации. С терминирующими кодонами не может связаться ни одна тРНК, так как нет тРНК с соответствующими антикодокамн. Возможно, что белковые факторы терминацнк освобождают синтезированную полипептидную цепь (рис. 69).
В клетке мРНК в синтезе белка использует не одну, а несколько рибосом. Такой работающий комплекс мРНК с несколькими (от 4 до 20) рибосомами называется полирибосомой. Благодаря образованию полирибосом нет нужды в большом числе копий мРНК. В то же время синтез белка протекает быстрее, чем при использовании только одной рибосомы. За секунду полипептидная цепь удлиняется на одну аминокислоту, а в интенсивную фазу роста клеток скорость синтеза нарастает до 20 аминокислот в секунду. Послеотделения мРНК от рибосомы она тут же гидролизуется цитоплазматическими рнбонуклеазами. Поэтому для биосинтеза тех же белков необходимо вновь создавать мРНК-
Под генетическим, или аминокислотным, кодом понимают соответствие кодо-нон (кодовых слов) определенным аминокислотам. Генетический код— своеобразный словарь, переводящий текст, записанный с помощью четырех нуклеотидов, в белковый текст, записанный с помощью 20 аминокислот. Генетический код имеет следующие свойства.
1. Триплетность — каждой аминокислоте соответствует тройка нуклеотидов. Легко подсчитать, что существуют 4а=б4 кодона. Из них 61 является смысловым н 3 — бессмысленными (терминирующими).
2. Неперекрываемость — каждый из триплетов генетического текста независим друг от друга.
- 3. Вырожденность,—отдельные аминокислоты имеют несколько кодонов. Об этом говорит простое сравнение: на 20 аминокислот приходится 61 смысловой кодон, т, е. в Среднем каждой аминокислоте соответствует около 3 кодонов. Причина вырожденности кода состоит в том, что главную смысловую нагрузку несут два первых нуклеотида в триплете, а третий не так важен. Отсюда правило вырожденности кода: если два кодона имеют два одинаковых первых нуклеотида, а их третьи нуклеотиды принадлежат к одному классу (пуриновому или пиримидиновому), то они кодируют одну и ту же аминокислоту.
Однако из этого идеального правила есть два исключения. Это кодон АУА, который должен соответствовать не изолейцину, а метионину и кодон УГА, который является терминирующим, тогда как должен соответствовать Триптофану, Вырожденность кода имеет, очевидно, приспособительное значение.
4. Специфичность — каждой аминокислоте соответствуют только определенные кодоны, которые не могут использоваться для другой аминокислоты.
5. Колинеарность — соответствие линейной последовательности кодонов мРНК и аминокислот в белке.
6. Универсальность — все перечисленные выше свойства генетического кода характерны для всех жнвых организмов. В последнее время принцип универсальности кода поколеблен в связи с тем, что в митохондриях собственный генетический код отличается от известного ранее. В нем кодов УГА соответствует триптофану, а АУА — метионииу, как того требует правило вырожденности кода. Возможно, в начале эволюции у всех простейших организмов был такой же код, как и у митохондрий, а затем он претерпел небольшие отклонения.
Генетический код
способ сохранения наследственной информации в виде последовательности нуклеотидов вмолекулах нуклеиновых кислот.
Билет 62
Белки определяют жизнедеятельность клетки. Поэтому клетка должна тонко регулировать не синтез белков вообще, а необходимого в данный момент ассортимента белков.
Белки, которые синтезируются с постоянной скоростью, называются конститутивными, а синтезирующиеся с резко изменяющейся в зависимости от разных условий скоростью — адаптивными или индуцибельными. Конститутивные белки (в том числе и ферменты) содержатся в клетках примерно в постоянных количествах независимо от того, есть ли в них потребность. Количество молекул индуцибельных (адаптивных) белков варьирует в больших пределах. Очевидно, что- синтез конститутивных белков не регулируется, а индуцибельных, напротив, подвержен тонкой регулировке.
Если регуляция на уровне фермента может изменять только функциональные возможности самого фермента (интенсивна по своей природе), то регуляция синтеза белков (переноса генетической информации) изменяет количество молекул данных белков (или ферментов) и является экстенсивной.
Стимуляция биосинтеза белков, сопровождающаяся увеличением их количества, называется индукцией, а подавление синтеза белков — репрессией. Очевидно, в клетках имеются вещества, сигнализирующие о состоянии метаболизма внутри клетки или в организме. Это позволяет включать или выключать синтез белков. Такими веществами у прокариотов могут быть поступающие в клетку питательные вещества, метаболиты и некоторые внутриклеточные регуляторы (тупа циклических нуклеотидов). У многоклеточных, особенно сложноорганизованных, помимо автономных внутриклеточных регуляторов значительное место занимают внеклеточные регуляторы синтеза белков, которые подчиняют деятельность генетического аппарата биосинтеза белков конкретной клетки ткани или органа задачам целого организма.
4. Препараты, влияющие на синтез белка
Препараты, влияющие на синтез белка, широко используются в практике. Индукторы применяются с целью стимуляции синтеза белка в поврежденных или ослабленных длительным бездействием (атрофичных) органах. Этот эффект индукторов облегчает восстановление функций клеток пораженного органа.
Ингибиторы синтеза белка применяются в противоположных целях: для подавления деления и роста клеток.
Препараты, усиливающие синтез белка. Препараты этой группы являются индукторами синтеза белка и относятся к так называемым анаболическим средствам. Анаболические средства бывают гормональные и негормональные. Наиболее обширна группа препаратов гормональной природы. Среди них наиболее выраженной способностью к индукции синтеза белка (действуя на уровне транскрипции) обладают анаболические стероиды (метандростено-лон, феноболин и самый активный ретаболил), являющиеся производными мужских половых гормонов (андрогенов) и применяющиеся только с целью стимуляции синтеза белка в организме. Выраженной анаболической активностью обладает инсулин, причем этот белковый гормон, очевидно, активирует синтез белка на уровне трансляции.
Ингибиторы синтеза белка — более обширная группа препаратов, используемая при биохимических исследованиях и в практической медицине. Все ингибиторы синтеза белка можно разделить на ингибиторы: а) транскрипции,' б) процессинга и транспорта РНК, в) трансляции. Хотя некоторые препараты действуют на несколько этапов переноса генетической информации
Ингибиторы транскрипции по1 механизму делятся на три группы: ингибиторы ДНК-зависимых РНК-полимераз, блокирующие ДНК-матрицу и искажающие информацию синтезируемой РНК.
В качестве примера препаратов первой группы можно назвать: а-амани-тин (яд бледной поганки), избирательно ингибирующий РНК-полнмеразу Ш (ответственную за транскрипцию мРНК); антибиотики рифамицины, блокирующие ядрышковую РНК-полнмеразу I (отвечает за транскрипцию рРНК) и обратную транскриптазу. а-Аманитин используется при биохимических исследованиях, а рифамицины—как антибактериальные препараты " в медицинской практике.
Ко второй группе относятся вещества, связывающиеся нековалентно с матрицей ДНК и мешающие работе РНК-полимеразы. Например, актиноми-цин D (используется в биохимических исследованиях), а также антибиотики оливомицин, дактиномицин и растительные алкалоиды винбластин и вин-кристин, которые применяются в медицине как противоопухолевые препараты.
К третьей группе можно отнести, например, 5-фтороурацил, включающийся в мРНК вместо природного нуклеотида и приводящий в негодность синтезируемую матрицу РНК-Ингибиторы процессинга и транспорта мРНК- Потенциальными ингибиторами синтеза белка на этом этапе могут быть ингибиторы внутриядерных РНКаз, РНК-лигаз, осуществляющих различные фазы созревания мРНК- Препятствует присоединению полиаденилового фрагмента к мРНК кордицепин (3-дезоксиаденозин), который можно назвать ингибитором транспорта мРНК, поскольку полнадениловый фрагмент облегчает транспорт ее из ядра в цитоплазму.
Ингибиторы трансляции (т. е. синтеза белка в рибосомах). В качестве примера можно назвать антибиотики, применяемые как антибактериальные препараты.
Хлоромфеникол действует на бактериальные 70S рибосомы и рибосомы митохондрий и хлоропластов эукариотов (на 80S рибосомы он не влияет). Хлорамфеникол связывается с 50S субчастицей рибосом и блокирует пепти-дилтрансферазную реакцию, вызывая преждевременный обрыв синтезируемой полипептидной цепи.
Линкомицин близок к действию хлорамфеникол а на 80S рибосомы.
Эритромицин (и другие антибиотики макролиды) ингибирует транслокацию пептидил-тРНК из участка А в П-участок 50S субъединнцы бактериальных рибосом (т. е. блокирует третий шаг элонгации трансляции).
Тетрациклины более избирательно влияют на 70S, чем на 80S рибосомы. Блокируют связывание мРНК и аминоацил-тРНК с малой субчастицей рибосом, т. е. фазу инициации и элонгации' синтеза белка в рибосомах.
Стрептомицин влияет на 70S рибосомы бактерий и не оказывает действия на 80S рибосомы. Специфически связывается с белком малой субчастицы и нарушает правильное считывание мРНК. Синтез белка при этом прекращается или образуется дефектный белок, не способный функционировать.
В лабораторных исследованиях применяется циклогексимнд (актидион)^ действующий исключительно на 80S рибосомы эукариотов. Он связывается с большей субчастицей рибосом и тормозит транслокацию. В высоких концентрациях блокирует 'РНК-полимеразу I, т. е. действует на транскрипцию.
Билет 63
Липидами называются органические вещества биологической природы, нерастворимые в воде и растворимые в неполярных растворителях, в таких, как хлороформ, эфир или бензол.
Триацилглицериды
Триацилглицериды – это сложные эфиры глицерина и высших жирных кислот.
Общая формула:

Простые триацилглицериды содержат остатки одинаковых, смешанные – разных жирных кислот. Названия триацилглицеридов строятся на основе названий ацильных остатков, входящих в их состав жирных кислот. Смешанные триацилглицериды могут содержать хиральный атом углерода в положении 2 и иметь энантиомеры
Триацилглицериды – малополярные, не растворимые в воде вещества, так как их молекулы не содержат сильнополярных или заряженных групп. Триацилглицериды, содержащие преимущественно остатки ненасыщенных кислот, при обычных условиях являются жидкостями, насыщенных кислот – твердыми веществами. Основная биологическая функция триацилглицеридов – запасные вещества животных и растений.
Фосфолипиды
Фосфолипиды – общее название липидов, содержащих остаток фосфорной кислоты. Фосфолипиды – основные липидные компоненты клеточных мембран.
Фосфоглицериды
Основные структурные компоненты, составляющие молекулы фосфоглицеридов, – это глицерин, жирные кислоты, фосфорная кислота, аминоспирты (этаноламин или холин) или аминокислота серин. Их рассматривают как производные L-глицеро-3-фосфата, в котором спиртовые группы этерифицированы жирными кислотами, а остаток фосфорной кислоты образует сложноэфирную связь с аминоспиртом.
Главный липидный компонент клеточных мембран. Они сопутствуют жирам в пище и служат источником фосфорной кислоты, необходимый для жизни человека.
Фосфолипиды участвуют в транспорте жиров, жирных кислот и холестерина. Фосфолипиды замедляют синтез коллагена и повышают активность коллагеназы (фермента, разрушающего коллаген).
Билет 64
Переваривание жиров включает 5 этапов
1. Эмульгирование жиров пищи – необходимо для того, чтобы ферменты ЖКТ смогли начать работу.
2. Гидролиз триацилглицеролов, фосфолипидов и эфиров ХС под влиянием ферментов ЖКТ.
3. Образование мицелл из продуктов переваривания (жирных кислот, МАГ, холестерола).
4. Всасывание образованных мицелл в эпителий кишечника.
5. Ресинтез триацилглицеролов, фосфолипидов и эфиров ХС в энтероцитах.
Под влиянием перистальтики ЖКТ и составных компонентов желчи пищевой жир эмульгируется. Образующиеся лизофосфолипиды также являются хорошим поверхностно-активным веществом, поэтому они способствуют эмульгированию пищевых жиров и образованию мицелл. Гидролиз эфиров ХС осуществляет холестерол-эстераза панкреатического сока.
В панкреатическом соке также имеется активируемая трипсином фосфолипаза А2, отщепляющая жирную кислоту от С2. Обнаружена активность фосфолипазы С и лизофосфолипазы.
В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицеролы, жирные кислоты и свободный холестерол, формирующие структуры мицеллярного типа (размер около 5 нм). Свободный глицерол всасывается прямо в кровь.
Синтез желчных кислот идет в эндоплазматическом ретикулуме при участии цитохрома Р450, кислорода, НАДФН и аскорбиновой кислоты. 75% холестерина, образуемого в печени, участвует в синтезе желчных кислот.
В печени синтезируются первичные желчные кислоты – холевая (гидроксилирована по С3, С7, С12) и хенодезоксихолевая(гидроксилирована по С3, С7), затем они образуют конъюгаты с глицином – гликопроизводные и с таурином – тауропроизводные, в соотношении 3:1 соответственно.

После расщепления полимерных липидных молекул полученные мономеры всасываются в верхнем отделе тонкого кишечника
Желчные кислоты частично также могут попадать в клетки и далее в кровь воротной вены, однако большая их часть остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта.
Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, иногда могут использоваться и эндогенные жирные кислоты. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это ликвидирует их детергентное действие на мембраны и позволит переносить по крови в ткани.
В кишечнике и желчи желчные кислоты находятся в виде анионов (желчные соли). По структуре желчные кислоты — амфипэтические молекулы, так как имеют гидрофобное кольцо и гидрофильные группы — гидроксильиую и карбоксильную. Поэтому они обладают выраженными поверхностно-активными свойствами, способствуя эмульгированию липидов .в кишечнике. Желчные кислоты необходимы для нормального переваривания и всасывания липидов в кишечнике. Они помогают также всасыванию в пищеварительном тракте жирорастворимых внтаминов
Билет 65
Гидролиз триацилглицеринов в тканях осуществляется тканевой триацимлицеринлипазой, которая гидролизует их на глицерин и свободные жирные кислоты. Кислая липаза содержится в лизосомах, щелочная — в микросомах, нейтральная—в цитоплазме. Характерным свойством тканевой липазы является чувствительность к гормонам, которые, активируя аденилатциклазу, вызывают переход неактивной липазы тканей в активную путем фосфорилирования с помощью протеинкиназы, Механизм этот сходен с активированием фосфорилазы В. Под действием липазы происходит мобилизация триацилглицеринов. Этот процесс называется также тканевым липолизом.
Фосфоглицериды клеточных мембран гидролизуютсн с помощью фосфолипаз А|, А2, С и D, локализованных преимущественно в лизосомах. Продуктами гидролиза фосфоглицеридов являются глицерин,'жирные кислоты, азотистые спирты, неорганический фосфат.
Окисление глицерина
Обмен глицерина тесно связан с гликолизом, в который вовлекаются метаболиты глицерина по следующей схеме:

Сначала глицерин при участии глицеролфосфокиназы превращается в альфа-глицеролфосфат. Последний под действием НАД-зависимой а-глииеролфосфат-дегидрогеназы превращается в дигидроксиацетонфосфат, который, являясь обычным метаболитом гликолиза, включается в гликолиз и превращается его ферментами до лактата в анаэробных условиях илн до СОа и НаО в аэробных. Превращение одной молекулы глицерина дает одну молекулу АТФ в анаэробных условиях и 19 молекул АТФ в аэробных. Глицерин — хороший энергетический субстрат и используется в этих целях практически всеми органами и тканями.
Эти процессы используются в качестве использования энергии.
Билет 66
Окисление жирных кислот (β-окисление)
β-окисление, т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С1 и С2 исходной жирной кислоты.
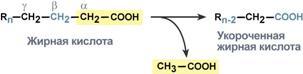
Элементарная схема β-окисления
Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ. Суммарное уравнение окисления пальмитиновой кислоты выглядит следующим образом:
Пальмитоил-SКоА + 7ФАД + 7НАД+ + 7Н2O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН2 + 7НАДН
Этапы окисления жирных кислот
1. Активация жирной кислоты
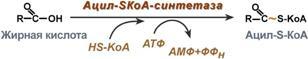
2. Ацил-S-КоА не способен проходить через митохондриальную мембрану, поэтому существует способ его переноса в комплексе с витаминоподобным веществом карнитином. На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
3. После связывания с карнитином жирная кислота переносится через мембрану транслоказой. Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь образует ацил-S-КоА который вступает на путь β-окисления.
4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. В них последовательно происходитокисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА-дегидрогеназа). В последней, трансферазной, реакции от жирной кислоты отщепляется ацетил-SКоА. К оставшейся (укороченной на два углерода) жирной кислоте присоединяется HS-КоА, и она возвращается к первой реакции. Все повторяется до тех пор, пока в последнем цикле не образуются два ацетил-SКоА.
Значение жирных кислот как энергетических субстратов для разных органов и тканей. Не все ткани с одинаковой интенсивностью используют жирные кислоты и промежуточные продукты их окисления — кетоновые тела — как энергетические субстраты. Активно используют жирные кислоты сердце, а также почки, скелетные мышцы (при длительной работе). В этих же органах сгорают кетоновые тела, которые служат источником энергии. В нервной ткани доля использования жирных кислот и кетоновых тел для обеспечения энергетических нужд незначительна.
Билет 67
Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя илипосле еды.
Условно можно выделить 4 этапа биосинтеза:
1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот.
2. Перенос ацетил-SКоА из митохондрий в цитозоль:
может быть в комплексе с карнитином, подобно тому как переносятся внутрь митохондрии высшие жирные кислоты, но здесь транспорт идет в другом направлении,
обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК.
3. Образование малонил-SКоА из ацетил-SКоА.
Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов.

Образование малонил-SКоА из ацетил-SКоА
4. Синтез пальмитиновой кислоты.
Осуществляется мультиферментным комплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ).

Билет 68
Синтез триацилглнцеринов происходит при депонировании липидов в жировой ткани или в других тканях организма. Этот процесс локализуется в гиалоплазме клеток.
Непосредственно для синтеза триацилглнцеринов используется 3-глицерофосфат. а не свободный глицерин, и ацил-КоА, а не свободная жирная кислота, 3-глицерофосфат образуется путем фосфорилирования поступающего в ткани глицерина или при восстановлении промежуточного продукта гликолиза дигидроксиацетонфосфата.
Первой стадией синтеза триацилглицеринов служит образование фосфатндной кислоты с участием глицерофосфат-ацилтрансферазы:

Далее фосфатидная Кислота подвергается действию фосфатидат-фосфатазы с образованием днацилглицернна:

На диацилглицернн с помощью диацилглицерол-ацилтрансферазы переносится третий ацнльный остаток:
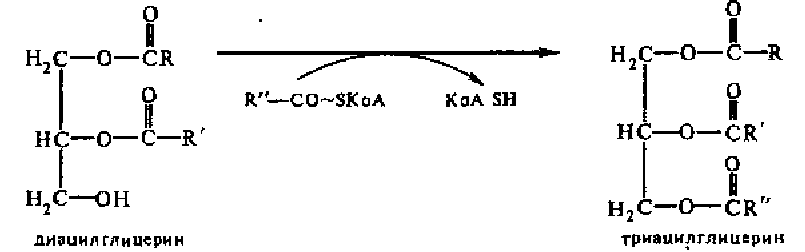
Синтезируемый триацилглицерин накапливается в виде жировых включений в цитоплазме клеток.
Биосинтез кетоновых тел
Кетоновыми, или ацетоновыми, телами называются три вещества: ацетоацетат, п-гидроксибутират и ацетон. Они являются недоокисленнымн, промежуточными продуктами распада, главным образом жирных кислот и углеродных склетов так называемых кетогенных аминокислот (лейцин, изолейции, лизин, фенилаланин, тирозин и триптофан). Образование кетоновых тел, или кето-генез, происходит в митохондриях печени.
Гидроксиметилглутаратный цикл. На первой стадии происходит конденсация двух молекул ацетил-КоА с участием ацетил-КоА-ацетилтрансферазы:

Далее ацетоацетил-КоА конденсируется еще с одной молекулой ацетил-КоА с участием гидроксиметилглутарил-КоА-синтазы:

В-Гидрокси-В-метилглутарил-КоА расщепляется под действием гидроксиметил-глутарил-КоА-лиазы на ацетил-КоА и ацетоацетат:
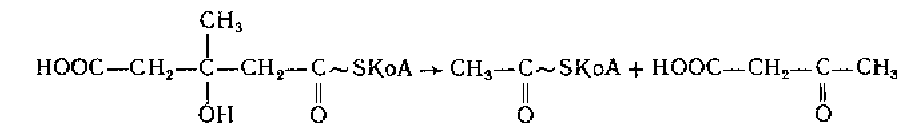
Ацетил-КоА вновь используется на первой стадии и тем самым переходит в цикл
. 1. Регуляция липидного обмена
1. При ограниченном потреблении углеводов или нарушении их использования (дефиците инсулина) усиливаются мобилизация жирных кислот и их транспорт кровью в печень. Происходит снижение скорости потребления ацетил-КоА путем: вовлечения в цикл трикарбоновых кислот и синтеза жирных кислот в печени.
2. При достаточном поступлении углеводов с пищей и нормальном поступлении глюкозы в клетки (что обеспечивается инсулином) увеличивается содержание метаболитов ЦТК.
Контроль скорости мобилизации и липогенеза происходит под влиянием гормонов. Активация липолиза происходит под воздействием адреналина и норадреналина, кортикостероидов, глюкагона и гормонов гипофиза — вазопрессина, АКТГ, липотропинов. Одновременно эти гормоны ограничивают стимуляцию липогенеза инсулином, результатом является повышение содержания жирных кислот в крови.
Обратный процесс — накопление липидов в депо — стимулирует инсулин. Он также активирует липогенез, обеспечивает транспорт глюкозы в клетку и ее окисление по основному пути.
