
- •1. Законы термодинамики
- •2. Свободная энергия
- •3.Эндергонические и экзергонические реакции
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •I. Моносахариды
- •2. Олигосахарнды
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1. Окислительное дезаминирование
- •2. Непрямое дезаминирование (трансдезаминирование)
- •2. Нарушения липидного обмена
1. Этапы аэробного гликолиза
В аэробном гликолизе можно выделить 2 этапа.
Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
2. Реакции аэробного гликолиза
Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата
Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с участием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Эта обратимая реакция изомеризации протекает под действием фермента глюкозофосфатизомеразы.
Затем следует ещё одна реакция фосфорилирования с использованием фосфатного остатка и энергии АТФ. В ходе этой реакции, катализируемой фосфофруктокиназой, фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Данная реакция, так же, как гексокиназная, практически необратима, и, кроме того, она наиболее медленная из всех реакций гликолиза. Реакция, катализируемая фосфофруктокиназой, определяет скорость всего гликолиза, поэтому, регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы.
Фруктозо-1,6-бисфосфат далее расщепляется на 2 триозофосфата: глицеральдегид-3-фосфат и дигидроксиацетонфосфат. Реакцию катализирует фермент фруктозобисфосфатальдолаза, или просто альдолаза. Этот фермент катализирует как реакцию альдольного расщепления, так и альдольной
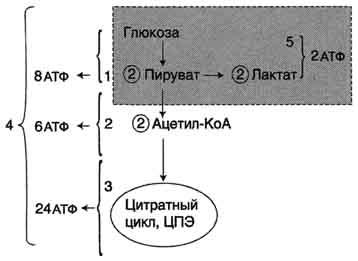
Рис. 7-34. Пути катаболизма глюкозы. 1 - аэробный гликолиз; 2, 3 - общий путь катаболизма; 4 - аэробный распад глюкозы; 5 - анаэробный распад глюкозы (в рамке); 2 (в кружке) - стехиометрический коэффициент.
Рис. 7-35. Превращение глюкозо-6-фосфата в триозофосфаты.
конденсации, т.е. обратимую реакцию. Продукты реакции альдольного расщепления - изомеры. В последующих реакциях гликолиза используется только глицеральдегид-3-фосфат, поэтому дигидроксиацетонфосфат превращается с участием фермента триозофосфатизомеразы в глицероальдегид-3-фосфат (рис. 7-35).
В описанной серии реакций дважды происходит фосфорилирование с использованием АТФ. Однако расходование двух молекул АТФ (на одну молекулу глюкозы) далее будет компенсировано синтезом большего количества АТФ.
Превращение глицеральдегид-3-фосфата в пируват
Эта часть аэробного гликолиза включает реакции, связанные с синтезом АТФ. Наиболее сложной в данной серии реакций является реакция превращения глицеральдегид-3-фосфата в 1,3-бисфосфоглицерат. Это превращение - первая реакция окисления в ходе гликолиза. Реакцию катализирует глицеральдегид-3-фосфатдегидрогеназа, которая является NAD-зависимым ферментом. Значение данной реакции заключается не только в том, что образуется восстановленный кофермент, окисление которого в дыхательной цепи сопряжено с синтезом АТФ, но также и в том, что свободная энергия окисления концентрируется в макроэргической связи продукта реакции. Глицеральдегид- 3 -фосфатдегидрогеназа содержит в активном центре остаток цистеина, сульфгидрильная группа которого принимает непосредственное участие в катализе. Окисление глицеральдегид-3-фосфата приводит к восстановлению NAD и образованию с участием Н3РО4 высокоэнергетической ангидридной связи в 1,3-бисфосфоглицерате в положении 1. В следующей реакции высокоэнергетический фосфат передаётся на АДФ с образованием АТФ. Фермент, катализирующий это превращение, назван по обратной реакции фосфоглицераткиназой (киназы называются по субстрату, находящемуся в уравнении реакции по одну сторону с АТФ). Данная серия реакций показана на рис. 7-36.
Образование АТФ описанным способом не связано с дыхательной цепью, и его называют субстратным фосфорилированием АДФ. Образованный 3-фосфоглицерат уже не содержит макроэргической связи. В следующих реакциях происходят внутримолекулярные перестройки, смысл которых сводится к тому, что низкоэнергетический
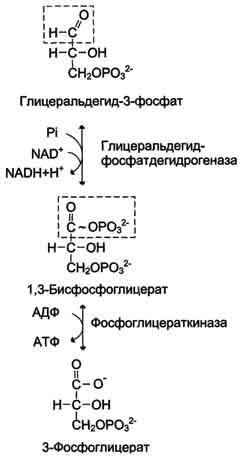
Рис. 7-36. Превращение глицеральдегид-3-фосфата в 3-фосфоглицерат.
фосфоэфир переходит в соединение, содержащее высокоэнергетический фосфат. Внутримолекулярные преобразования заключаются в переносе фосфатного остатка из положения 3 в фосфоглицерате в положение 2. Затем от образовавшегося 2-фосфоглицерата отщепляется молекула воды при участии фермента енолазы. Название дегидратирующего фермента дано по обратной реакции. В результате реакции образуется замещённый енол - фосфоенолпируват. Образованный фосфоенолпируват - макроэргическое соединение, фосфатная группа которого переносится в следующей реакции на АДФ при участии пируваткиназы (фермент также назван по обратной реакции, в которой происходит фосфорилирование пирувата, хотя подобная реакция в таком виде не имеет места).
Превращение фосфоенолпирувата в пируват - необратимая реакция. Это вторая в ходе гликолиза реакция субстратного фосфорилирования. Образующаяся енольная форма пирувата затем неферментативно переходит в более термодинамически стабильную кетофор-му. Описанная серия реакций представлена на рис. 7-37.

Рис. 7-37. Превращение 3-фосфоглицерата в пируват.
Схема 10 реакций, протекающих при аэробном гликолизе, и дальнейшее окисление пирувата представлены на рис. 7-33.
Билет 48
Фотосинтез — это процесс преобразования лучистой энергии в химическую с использованием последней в синтезе углеводов из углекислого газа. Суммарное уравнение фотосинтеза:
![]()
Процесс этот эндергонический и требует значительного количества энергии Поэтому суммарный процесс фотосинтеза складывается из двух стадий, которые принято называть световой (или энергетической) и темповой (или метаболической). В хлоропласте эти стадии пространственно разобщены — световая осуществляется в квантосомах мембран тилактоидов, а темновая—вне тилактоидов, в водной среде стромы. Взаимосвязь между световой и темновой стадиями можно выразить схемой
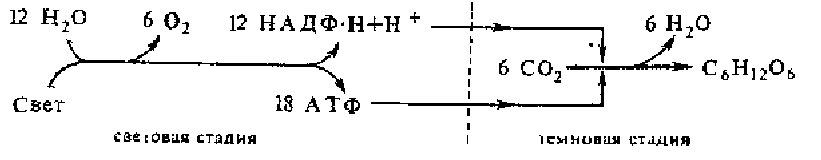
Световая стадия протекает на свету. Энергия света трансформируется на-этой стадии в химическую энергию АТФ, а бедные энергией электроны воды переходят в богатые энергией электроны НАДФ • Нг_ Побочным веществом, образующимся в ходе световой стадии, является кислород. Богатые энергией продукты световой стадии АТФ и НАДФ * Нг используются в следующей стадии, которая может проходить в темноте. В темновой стадии наблюдается восстановительный синтез глюкозы из СОг. Без световой стадии темновая невозможна.
Механизм световой (фотохимической) стадии фотосинтеза
В мембранах тилактоидов имеются два фотохимических центра, или фотосистемы, которые обозначаются как фотосистемы I и II (рис. 46). Каждая из фотосистем не может заменить друг друга, ибо функции их различны В состав фотосистем входят различные пигменты: зеленые — хлорофиллы а и Ь, желтые — каротиноиды и красные или синие — фикобилины. Фотохимически активен среди этого комплекса пигментов только хлорофилл с. Остальные пигменты играют вспомогательную роль, являясь лишь собирателями световых квантов (своеобразные светособирающие линзы) н проводниками их к фотохимическому центру. Функцию фотохимических центров выполняют особые формы хлорофилла а, а именно: в фотосистеме I —пигмент 700 (Р70о), поглощающий свет с длиной волны около 700 нм, в фотосистеме II — пигмент 680 (Р680), поглощающий свет с длнной волны 680 нм. На 300—400 молекул светособирающих пигментов в фотосистемах I и II приходится только одна молекула фотохимически активного пигмента — хлорофилла а. Поглощение световых квантов фотосистемой I переводит нигмент Р700 из основного состояния в возбужденное — Р*оо, в котором он легко теряет электрон. Потеря электрона вызывает образование электронной дырки в виде Р^,
Электроиная дырка способна легко заполняться электроном.
Итак, поглощение световых квантов фотосистемой I приводит к разделению зарядов: положительного в виде электронной дырки (Р^о) и отрицательно заряженного электрона, который сначала акцептируется специальными железосерными белками (FeS-центр), а затем или транспортируется но одной из цепей переносчиков обратно к Р^н,, заполняя электронную дырку, или по другой цепи переносчиков через ферредоксин и флавопротеид к постоянному акцептору — НАДФ • Ня. В первом случае происходит замкнутый циклический транспорт электрона/а во втором —нециклический. Возвращение возбужденных электронов иа Рщщ связано с освобождением энергии (при переходе с высокого на низкий энергетический уровень), которая аккумулируется-в фосфатных связях АТФ. Этот процесс называется фотофосфорилированием; при циклическом переносе происходит циклическое фотофосфорилирование, при нециклическом — соответственно нециклическое. В тнлактоидах идут оба процесса, хотя второй более сложный. Он сопряжен с работой .фотосистемы И.
Поглощение световых квантов фотосистемой II вызывает разложение (фотоокисление) воды в фотохимическом центре Р^по схеме
Фотолиз воды называется реакцией Хилла. Электроны, образующиеся прн разложении воды, первоначально акцептируются веществом, обозначаемым Q (иногда его называют цитохромом СБМ по максимуму поглощения, хотя оно не является цитохромом). Затем от вещества Q через цепь переносчиков, похожую по составу на митохондрнальную, электроны направляются к Pf00, заполняя электронную дырку.
Следовательно, утраченные Р700 электроны восполняются за счет электронов воды, разлагаемой под действием света в фотосистеме II. Нециклический поток электронов от НгО к НАДФ ■ Нг, происходящий при взаимодействии двух фотосистем и связывающих их электронно-транспортных цепей, наблюдается вопреки значениям редокс-потенциалов: Е° для /гОг/НгО= +0,81 В. а Е" для НАДФ/НАДФ • Н= —0,32 В. Энергия света обращает поток электронов «вспять». Существенно то, что при переносе от фитисжмёмы II к фотосистеме I часть энергии электронов аккумулируется в виде протонного потенциала на мембране тилактоидов, а затем в энергию АТФ.
Механизм образования протонного потенциала в цепи переноса электронов и его использование на образование АТФ в хлоропластах сходен с таковым в митохондриях. Однако в механизме фотофосфорилирования имеются некоторые особенности. Тилактоиды представляют собой как бы вывернутые наизнанку митохондрии, поэтому направление переноса электронов и протонов через мембрану противоположно направлению его в митохондриальной мембране (рис. 47). Электроны движутся к внешней стороне, а протоны концентрируются внутри тнлактоидного матрикса. Матрикс заряжается положительно, а внешняя мембрана тилактоида — отрицательно, т. е. направление протонного градиента противоположно направлению его в митохондриях. Другой особенностью является значительно большая доля рН в протонном потенциале по сравнению с митохондриями. Тилактоидный матрикс сильно закисляется, поэтому ДрН может достигать 0,1—0,2 В, в то время как Дф составляет около 0,1 В. Общее значение Дрн+>0,25 В.
Н*-АТФ-синтетаза, обозначаемая в хлоропластах как комплекс «CF, + F0», ориентирована тоже в противоположном направлении. Головка ее (F,) смотрит наружу, в сторону стромы хлоропласта. Протоны выталкиваются через CF0+Ft изматрикса наружу, и в активном центре F, образуется АТФ за счет энергии протонного потенциала.
В отличие от мнтохондриальной цепи в тилактоидной имеется, по-видимому, только пня участка сопряжения, поэтому на синтез одной молекулы АТФ требуется вместо двух три протона, т.е. соотношение 3 Н+/1 моль АТФ.
Механизм темновой стадии фотосинтеза
Продукты световой стадии АТФ и НАДФ - На, находящиеся в строме хлоропласта, используются здесь же для синтеза глюкозы из С02. Ассимиляция диоксида углерода (фотохимическое Карбоксилирование) представляет собой циклический процесс, который называется также лентозофосфатным фотоснн-тетнческим циклом или циклом Кальвина (рис. 48). В нем можно выделить три основные фазы: !
1) фиксация С02 рибулозодифосфатом;
2) образование триозофосфатов при восстановленин 3-фосфогл|ицерата;
3) регенерация рибулозодифосфата.
Фиксация С02 рибулозодифосфатом катализируется ферментом рибуло-зодшросфаткарбоксилазой:
![]()
Далее 3-фосфоглицерат восстанавливается с помощью НАДФ • Н^и АТФ до глицеральдегнд-3-фосфата. Эта реакция катализируется ферментом — глице-ральдегид-3-фосфат-дегидрогеназой. Глицеральдегид-3-фосфат легко изоме-рнзуется в дигндроксн ацетон фосфат. Оба триозофосфата используются в образовании фруктозобнсфосфата (обратная реакция, катализируемая фрукто-зобисфосфат-альдолазой). Часть молекул образовавшегося фруктозобнсфосфата участвует вместе с триозофосфатами в регенерации рибулозодифосфата (замыкают цикл), а другая часть используется для запасания углеводов в фо-тосинтезирующих клетках, как показано на схеме.
Подсчитано, что для синтеза одной молекулы глюкозы из С02 в цикле Кальвина требуется 12 НАДФ • Н + Н+ и 18 АТФ (12 молекул АТФ расходуются на восстановление 3-фосфоглицерата, а 6 молекул — в реакциях регенерации рибулозодифосфата). Минимальное соотношение — 3 АТФ г 2 НАДФ-Н,
Можно заметить общность принципов, лежащих в основе фотосинтетиче' ского и окислительного фосфорилирования, причем фотофосфорнл-ирование представляет собой как бы обращенное окислительное фосфорилирование:
Энергия света является движущей силой фосфорилирования и синтеза органических веществ (S-Hj) при фотосинтезе и, наоборот, энергия окисления органических веществ — при окислительном фосфорилировании. Поэтому именно растения обеспечивают жизнь животным и другим гетеротрофным организмам:
Углеводы, образующиеся при фотосинтезе, служат для построения углеродных скелетов многочисленных органических веществ растений. Азоторгани-ческие вещества усваиваются фотосинтезирующими организмами путем восстановления неорганических нитратов или атмосферного азота, а сера — восстановлением сульфатов до сульфгндрильных групп аминокислот. Фотосинтез в конечном итоге обеспечивает построение не только обязательных для жизни белков, нуклеиновых кислот, углеводов, липидов, кофакторов, но и многочисленных продуктов вторичного синтеза, являющихся ценными лекарственными веществами (алкалоиды, флавоноиды, полифенолы, терпены, стероиды, органические кислоты и т.д.).

Билет 48-другой вариант
Фотосинтез (от греч. φωτο- — свет и σύνθεσις — синтез, совмещение, помещение вместе) — процесс образования органических веществ из углекислого газа и воды на свету при участии фотосинтетических пигментов (хлорофилл урастений, бактериохлорофилл и бактериородопсин у бактерий). В современной физиологии растений под фотосинтезом чаще понимается фотоавтотрофная функция — совокупность процессов поглощения, превращения и использования энергии квантов света в различных эндэргонических реакциях, в том числе превращения углекислого газа ворганические вещества.
Световая (светозависимая) стадия
В ходе световой стадии фотосинтеза образуются высокоэнергетические продукты: АТФ, служащий в клетке источником энергии, и НАДФН, использующийся как восстановитель. В качестве побочного продукта выделяется кислород. В общем роль световых реакций фотосинтеза заключается в том, что в световую фазу синтезируются молекула АТФ и молекулы-переносчики протонов, то есть НАДФ Н2.
Фотохимическая суть процесса
Хлорофилл имеет два уровня возбуждения (с этим связано наличие двух максимумов на спектре его поглощения): первый связан с переходом на более высокийэнергетический уровень электрона системы сопряжённых двойных связей, второй — с возбуждением неспаренных электронов азота и магния порфиринового ядра. При неизменном спине электрона формируются синглетные первое и второе возбуждённое состояние, при изменённом — триплетное первое и второе.
Второе возбуждённое состояние наиболее высокоэнергетично, нестабильно и хлорофилл за 10-12 сек переходит с него на первое, с потерей 100 кДж/моль энергии только в виде теплоты. Из первого синглетного и триплетного состояний молекула может переходить в основное с выделением энергии в виде света (флуоресценция ифосфоресценция соответственно) или тепла, с переносом энергии на другую молекулу, либо, поскольку электрон на высоком энергетическом уровне слабо связан с ядром, с переносом электрона на другое соединение.
Первая возможность реализуется в светособирающих комплексах, вторая — в реакционных центрах, где переходящий в возбужденное состояние под воздействием кванта света хлорофилл становится донором электрона (восстановителем) и передаёт его на первичный акцептор. Чтобы предотвратить возвращение электрона на положительно заряженный хлорофилл, первичный акцептор передаёт его вторичному. Кроме того, время жизни полученных соединений выше чем у возбуждённой молекулы хлорофилла. Происходит стабилизация энергии и разделения зарядов. Для дальнейшей стабилизации вторичный донор электронов восстанавливает положительно заряженный хлорофилл, первичным донором же является в случае оксигенного фотосинтеза вода.
Проблемой, с которой сталкиваются при этом проводящие оксигенный фотосинтез организмы, является различие окислительно-восстановительных потенциалов воды (для полуреакции H2O → O2 (E0=+0,82 В) и НАДФ+ (E0=-0,32 В). Хлорофилл при этом должен иметь в основном состоянии потенциал больший +0,82 В чтобы окислять воду, но при этом иметь в возбуждённом состоянии потенциал меньший чем −0,32 В чтобы восстанавливать НАДФ+. Одна молекула хлорофилла не может отвечать обоим требованиям. Поэтому сформировалось две фотосистемы и для полного проведения процесса необходимо два кванта света и два хлорофилла разных типов.
Светособирающие комплексы
Хлорофилл выполняет две функции: поглощения и передачи энергии. Более 90 % всего хлорофилла хлоропластов входит в состав светособирающих комплексов (ССК), выполняющих роль антенны, передающей энергию к реакционному центру фотосистем I или II. Помимо хлорофилла в ССК имеются каротиноиды, а у некоторых водорослейи цианобактерий — фикобилины, роль которых заключается в поглощении света тех длин волн, которые хлорофилл поглощает сравнительно слабо.
Передача энергии идёт резонансным путём (механизм Фёрстера) и занимает для одной пары молекул 10−10—10−12 с, расстояние на которое осуществляется перенос составляет около 1 нм. Передача сопровождается некоторыми потерями энергии (10 % от хлорофилла a к хлорофиллу b, 60 % от каротиноидов к хлорофиллу), из-за чего возможна только от пигмента с максимумом поглощения при меньшей длине волны к пигменту с большей. Именно в таком порядке взаимно локализуются пигменты ССК, причём наиболее длинноволновые хлорофиллы находятся в реакционных центрах. Обратный переход энергии невозможен.
ССК растений расположен в мембранах тилакоидов, у цианобактерий основная его часть вынесена за пределы мембран в прикреплённые к ним фикобилисомы — палочковидные полипептидно-пигментные комплексы, в которых находятся различные фикобилины: на периферии фикоэритрины (с максимумом поглощения при 495—565 нм), за ними фикоцианины (550—615 нм) и аллофикоцианины (610—670 нм), последовательно передающие энергию на хлорофилл a (680—700 нм) реакционного центра.
Основные компоненты электронтранспортной цепи
Фотосистема II
Фотосистема — совокупность ССК, фотохимического реакционного центра и переносчиков электрона. Светособирающий комплекс II содержит 200 молекул хлорофилла a, 100 молекул хлорофилла b, 50 молекул каротиноидов и 2 молекулы феофитина. Реакционный центр фотосистемы II представляет собой пигмент-белковый комплекс, расположенный в тилакоидных мембранах и окружённый ССК. В нём находится димер хлорофилла a с максимумом поглощения при 680 нм (П680). На него в конечном счёте передаётся энергия кванта света из ССК, в результате чего один из электронов переходит на более высокое энергетическое состояние, связь его с ядром ослабляется и возбуждённая молекула П680 становится сильным восстановителем (E0=-0,7 В).
П680 восстанавливает феофитин, в дальнейшем электрон переносится на хиноны, входящие в состав ФС II и далее на пластохиноны, транспортируемые в восстановленной форме к b6f комплексу. Одна молекула пластохинона переносит 2 электрона и 2 протона, которые берутся из стромы.
Заполнение электронной вакансии в молекуле П680 происходит за счёт воды. В состав ФС II входит водоокисляющий комплекс, содержащий в активном центре ионымарганца в количестве 4 штук. Для образования одной молекулы кислорода требуется две молекулы воды, дающие 4 электрона. Поэтому процесс проводится в 4 такта и для его полного осуществления требуется 4 кванта света. Комплекс находится со стороны внутритилакоидного пространства и полученные 4 протона выбрасываются в него.
Таким образом, суммарный результат работы ФС II — это окисление 2 молекул воды с помощью 4 квантов света с образованием 4 протонов во внутритилакоидном пространстве и 2 восстановленных пластохинонов в мембране.
b6f или b/f-комплекс
b6f комплекс является насосом, перекачивающим протоны из стромы во внутритилакоидное пространство и создающий градиент их концентрации за счёт выделяющейся в окислительно-восстановительных реакциях электронтранспортной цепи энергии. 2 пластохинона дают перекачку 4 протонов. В дальнейшем трансмембранный протонный градиент (pH стромы около 8, внутритилакоидного пространства — 5) используется для синтеза АТФ трансмембранным ферментом АТФ-синтазой.
Фотосистема I
Светособирающий комплекс I содержит примерно 200 молекул хлорофилла.
В реакционном центре первой фотосистемы находится димер хлорофилла a с максимумом поглощения при 700 нм (П700). После возбуждения квантом света он восстанавливает первичный акцептор — хлорофилл a, тот — вторичный (витамин K1 или филлохинон), после чего электрон передаётся на ферредоксин, который и восстанавливает НАДФ с помощью фермента ферредоксин-НАДФ-редуктазы.
Белок пластоцианин, восстановленный в b6f комплексе, транспортируется к реакционному центру первой фотосистемы со стороны внутритилакоидного пространства и передаёт электрон на окисленный П700.
Циклический и псевдоциклический транспорт электрона
Помимо полного нециклического пути электрона, описанного выше, обнаружены циклический и псевдоциклический.
Суть циклического пути заключается в том, что ферредоксин вместо НАДФ восстанавливает пластохинон, который переносит его назад на b6f комплекс. В результате образуется больший протонный градиент и больше АТФ, но не возникает НАДФН.
При псевдоциклическом пути ферредоксин восстанавливает кислород, который в дальнейшем превращается в воду и может быть использован в фотосистеме II. При этом также не образуется НАДФН.
Темновая стадия
В темновой стадии с участием АТФ и НАДФН происходит восстановление CO2 до глюкозы (C6H12O6). Хотя свет не требуется для осуществления данного процесса, он участвует в его регуляции.
С3-фотосинтез, цикл Кальвина
Цикл Кальвина или восстановительный пентозофосфатный цикл состоит из трёх стадий:
карбоксилирования;
восстановления;
регенерация акцептора CO2.
На первой стадии к рибулозо-1,5-бифосфату присоединяется CO2 под действием фермента рибулозобисфосфат-карбоксилаза/оксигеназа. Этот белок составляет основную фракцию белков хлоропласта и предположительно наиболее распространённый фермент в природе. В результате образуется промежуточное неустойчивое соединение, распадающееся на две молекулы 3-фосфоглицериновой кислоты (ФГК).
Во второй стадии ФГК в два этапа восстанавливается. Сначала она фосфорилируется АТФ под действием фосфороглицерокиназы с образованием 1,3-дифосфоглицериновой кислоты (ДФГК), затем при воздействии триозофосфатдегидрогеназы и НАДФН ацил-фосфатная группа ДФГК дефосфорилируется и восстанавливается до альдегидной и образуется глицеральдегид-3-фосфат — фосфорилированный углевод (ФГА).
В третьей стадии участвуют 5 молекул ФГА, которые через образование 4-, 5-, 6- и 7-углеродных соединений объединяются в 3 5-углеродных рибулозо-1,5-бифосфата, для чего необходимы 3АТФ.
Наконец, две ФГА необходимы для синтеза глюкозы. Для образования одной её молекулы требуется 6 оборотов цикла, 6 CO2, 12 НАДФН и 18 АТФ.
Билет 49
Продукты питания, которые использует человек, чрезвычайно разнообразны. Основная часть продуктов питания имеет биологическое происхождение (растительные и животные продукты) и меньшая часть небиологическое (вода и растворенные в ней минеральные соли). Поскольку в биологических объектах основная часть веществ находится в виде биополимеров, то основную массу пищи составляют высокомолекулярные компоненты, а не мономеры, В понятие «питательные вещества» входит группа основных компонентов пищи, которые обеспечивают необходимые энергетические и пластнческие потребности организма. К питательным веществам относятся шесть групп веществ: 1) белки; 2) углеводы; 3) липиды; 4) витамины (включая и вита-миноподобные вещества); 5) минеральные вещества; 6) вода.
Кроме питательных веществ в пище содержится большая группа вспомогательных веществ, которые не имеют ни энергетического, ни пластического значения, но определяют вкусовые и другие качества пищи, помогая распаду и всасыванию питательных веществ. Присутствие этих веществ обычно учитывается при разработке рационального питания.
Белки. Биологическая ценность белков животного и растительного происхождения определяется составом аминокислот, особенно незаменимых. Если в пищевых продуктах белки содержат все незаменимые аминокислоты, то эти белки относятся к полноценным. Остальные пищевые белки неполноценные. Растительные белки в отличие от животных как правило, менее полноценны. Существует международный «условный образец» состава белка, отвечающего потребностям организма. В этом белке 31,4% составляют незаменимые аминокислоты; остальное — заменимые. Чтобы оценить состав любого пищевого белка, важно иметь эталон с необходимым содержанием незаменимых аминокислот и наиболее физиологичным соотношением каждой из незаменимых аминокислот. В качестве эталона был приннт белок куриного яйца, наиболее отвечающий физиологическим потребностям организма. Любые пищевые белки сравниваются по составу аминокислот с эталонным.
Общая суточная потребность в белках взрослого человека составляет 80-—100 г, из них половина должна быть животного происхождения.
Углеводы. Биологическую ценность среди углеводов пиши имеют полиса хариды — крахмал и гликоген; днсахариды—сахароза, лактоза, трегалоза, мальтоза, изомальтоза. Лишь небольшая доля углеводов пищи приходится на моносахариды (глюкоза, фруктоза, пентозы и т. д.). Содержание моносахаридов в пище может возрасти после кулинарной или иной обработки пищевых продуктов. Основная функция углеводов — энергетическая, но они выполняют структурные и ряд других рассмотренных ранее функций, свойственных углеводам (см. «Углеводы»). Углеводы, имеющие р-гликоэидные связи (целлюлоза, гемицеллюлозы и др.), не расщепляются, поэтому они играют вспомогательную роль в пищеварении, активируя механическую деятельность кишечника.
Суточная потребность взрослого человека-в углеводах составляет 400— 500 г, из них около 400 г приходится на крахмал. Остальная часть — на днсахариды, в основном на сахарозу.
Липиды. Биологическую ценность для организма человека представляют в основном следующие компоненты пищи. Триацилглицерины, составляющие главную (по массе) часть липидов пищи. Они определяют энергетическое
значение пищевых липидов, которые составляют от '/з Д° 'А энергетической ценности пищи. Различные виды фосфолипидов, входящих в состав мембран клеток, поступают преимущественно с продуктами животного происхождения (мясные продукты, желток яиц, масло и т. д.), так же как и холестерин и его эфиры. Фосфолипиды и холестерин определяют пластическую функцию липидов пищи. С липидами пищи поступают незаменимые для организма жирорастворимые витамины н витаминоподобные соединения.
Суточная потребность в пищевых липидах составляет 80—100 г, из них не менее 20—25 г должно поступать растительных липидов, содержащих ненасыщенные жирные кислоты.
Витамины и витамнноподобные вещества поступают в организм с растительными и животными продуктами. Кроме того, некоторые витамины синтезируют* в организме кишечными бактериями (энтерогенные витамины). Однако недоля значительно меньше пищевых. Витамины — абсолютно незаменимые компоненты пищн, поскольку они используются для синтеза в клетках организма коферментов, являющихся обязательной частью сложных ферментов.
Суточная потребность в отдельных витаминах колеблется от нескольких микрограммов до десятков н сотен миллиграммов.
Минеральные вещества. Главным их источником служат небиологические компоненты пищи, т.е. растворенные в питьевой воде минеральные вещества. Частично они поступают в организм с пищевыми продуктами животного и растительного происхождения. Минеральные вещества используются как пластический материал (например, кальций, фосфор и др.) и как кофакторы ферментов.
Минеральные вещества относятся к незаменимым факторам пищи. Хотя возможна относительная взаимозаменяемость некоторых минеральных элементов в биологических процессах, но невозможность их взаимопревращения в организме является причиной незаменимости этих веществ. Кофакторная часть пищевых минеральных веществ сродни Витаминам.
Суточная потребность взрослого организма человека в отдельных минеральных веществах сильно колеблется от нескольких граммов (макроэлементы) до нескольких миллиграммов или микрограммов (микроэлементы, ультраэлементы) .
Вода относится к незаменимым компонентам пищи, хотя небольшие количества воды образуются из белков, липидов и углеводов при обмене их в тканях. Вода поступает с продуктами биологического и небиологического происхождения. Суточная потребность для взрослого человека составляет 1750-2200 г.
Термин «энергетическая ценность» отражает количество энергии, которая может высвободиться из пищевых веществ в результате биологического окисления при использовании ее на выполнение физиологических функций организма. Институт питания АМН при расчете энергетической ценности продукта рекомендует руководствоваться следующими уточненными коэффициентами энергетической ценности основных компонентов пищи, кДж/г: белки — 16,7; жиры — 37,7; усвояемые углеводы — 15,7. При определении энергетической ценности продукта необходимо учитывать усвояемость его отдельных пищевых веществ. Для ориентировочных расчетов Минздравом в 1961 г. рекомендованы следующие коэффициенты усвояемости, %: белки — 84,5; жиры — 94; углеводы (сумма усвояемых и неусвояемых) — 95,6. Для более точных расчетов необходимо также учитывать аминокислотный скор белка.
На долю аминокислот (в составе белков и свободных) приходится более 95 % всего азота организма. Поэтому об общем состоянии аминокислотного и белкового обмена можно судить по азотистому балансу, т. е. разнице между количеством азота,поступающего с пищей, и количеством выделяемого азота (главным образом в составе мочевины). У взрослого здорового человека при нормальном питании имеет место азотистое равновесие, т. е. количество выделяемого азота равно количеству поступающего. В период роста организма, а также при выздоровлении после истощающих заболеваний выводится азота меньше, чем поступает, — положительный азотистый баланс. При старении, голодании и в течение истощающих заболеваний азота выводится больше, чем поступает, — отрицательный азотистый баланс. При положительном азотистом балансе часть аминокислот пищи задерживается в организме, включаясь в состав белков и клеточных структур; общая масса белков в организме увеличивается. Наоборот, при отрицательном азотистом балансе общая масса белков уменьшается (катаболическое состояние). Если из диеты исключить все белки, но полностью сохранить другие компоненты в количествах, обеспечивающих энергетические потребности организма, то азотистый баланс становится отрицательным. Примерно через неделю пребывания на такой диете количество выводимого азота стабилизируется, достигая величины около 4 г за сутки. Такое количество азота соответствует 25 г белка (или аминокислот). Следовательно, при белковом голодании организм ежесуточно расходует около 25 г белков собственных тканей. Практически такой же результат получается при исключении из диеты не всех белков, а только незаменимых аминокислот или даже только одной из них. При полном голодании отрицательный азотистый баланс еще больше, чем при исключении из пищи только белков. Это обусловлено тем, что аминокислоты, образующиеся при распаде тканевых белков, при полном голодании используются также и для обеспечения энергетических потребностей организма. В рационе, достаточном по калорийности, минимальное количество белков, необходимое для поддержания азотистого равновесия, составляет 30-50 г. Однако это количество не обеспечивает оптимума для здоровья и работоспособности. Взрослый человек при средней физической нагрузке должен получать около 100 г белков в сутки
ИСТОЧНИКИ И ПУТИ ИСПОЛЬЗОВАНИЯ АМИНОКИСЛОТ В КЛЕТКАХ
Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг.
458
Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений (рис. 9-1).
Какой-либо специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде триацилглицеролов), не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных.
В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
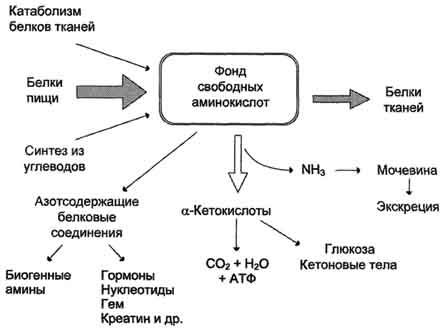
Рис. 9-1. Источники и пути использования аминокислот.
Билет 50
Протеолитическне ферменты, участвующие в переваривании белков и пептидов, синтезируются и выделяются в полость пищеварительного тракта в виде проферментов, или зимогенов. Зимогены неактивны и не могут переваривать собственные белки клеток. Активируются протеолитические ферменты в просвете кишечника, где действуют на пищевые белки.
В желудочном соке человека имеются два протеолитических фермента — пепсин и гастрнксин, которые очень близки по строению, что указывает на образование их нз общего предшественника.
Пепсин образуется в виде профермента — пепсиногена — в главных клетках слизистой желудка. Выделено несколько близких по строению пепсино-генов, из которых образуется несколько разновидностей пепсина: пепсин I, II (Па, Пб), III. Пепсиногены активируются с помощью соляной кислоты, выделяющейся обкладочными клетками желудка, и аутокаталитически, т. е. с помощью образовавшихся молекул пепсина.
Ингибитор пепсина обладает резко основными свойствами, так как состоит из 8 остатков лизина и 4 остатков аргинина. Активация заключается в отщеплении от N-конца пепсиногена 42 аминокислотных остатков; сначала отщепляется остаточный полипептид, а затем ингибитор пепсина.
Пепсин относится к карбоксипротеиназам, содержащим остатки дикарбоновых аминокислот в активном центре с оптимумом рН 1,5—2,5.
Субстратом пепсина являются белки — либо нативные, либо денатурированные. Последние легче поддаются гидролизу. Денатурацию белков пищи обеспечивает кулинарная обработка или действие соляной кислоты. Следует отметить следующие биологические функции соляной кислоты: 1) активация пепсиногена; 2) создание оптимума рН для действия пепсина и гастриксина в желудочном соке; 3) денатурация пищевых "белков; 4) антимикробное действие.
От денатурирующего влияния соляной кислоты и переваривающего действия пепсина собственные белки стенок желудка предохраняет слизистый секрет, содержащий глнкопротеиды.
Пепсин, являясь эндопептидаэой, быстро расщепляет в белках внутренние пептидные связи, образованные карбоксильными группами ароматических аминокислот — фенилаланина, тирозина и триптофана. Медленнее гидроли-зует фермент пептидные связи, образованные алифатическими и дикарбоновыми аминокислотами в полипептидной цепи. Гастрнксин близок к пепсину по молекулярной массе (31 500). Оптимум рН у него около 3,5. Гастриксин гидролизует пептидные связи, образуемые дикарбоновыми аминокислотами. Соотношение пепсин/гастриксин в желудочном соке 4:1. При язвенной болезни соотношение меняется в пользу гастриксина.
Присутствие в желудке двух протеиназ, из которых пепсин действует в сильнокислой среде, а гастриксин в среднекислой, позволяет организму легче приспосабливаться к особенностям питания. Например, растительно-молочное питание частично нейтрализует кислую среду желудочного сока, и рН благоприятствует переваривающему действию не пепсина, а гастриксина. Последний расщепляет связи в пищевом белке.
Пепсин и гастриксин гидролизуют белки до смеси полипептидов (называемых также альбумозами и пептонами). Глубина переваривания белков в желудке зависит от длительности нахождения в нем пищи. Обычно это небольшой период, поэтому основная масса белков расщепляется в кишечнике.
Протеолитическне ферменты кишечника. В кишечник протеолитические ферменты поступают из поджелудочной железы в виде проферментов: трипси-ногена, химотрипсиногена, прокарбоксипептидаз А и В, проэластазы. Активирование этих ферментов происходит путем частичного протеолиза их полипептидной цепи, т. е. того фрагмента, который маскирует активный цектр протеиназ. Ключевым процессом активирования всех проферментов является образование трипсина (рис. 31). Трипсиноген, поступающий из поджелудочной железы, активируется с помощью кишечной энтерокиназы, или энтеропептидазы, Кроме того, образующийся трипсин аутокэталитически способствует превращению трипсиногена я трипсин, Механизм активирования трипсиноге-на заключается в гидролизе одной пептидной связи, в результате чего освобождается N-концевой гексапептид, называемый ингибитором трипсина. Далее трипсин, разрывая пептидные связи в остальных проферментах, вызывает образование активных ферментов. При этом образуются три разновидности химотрипсина, карбоксипептидазы А и В, эластаза.
Кишечные протеиназы гидролизуют пептидные связи пищевых белков и полипептидов, образовавшихся после действия желудочных ферментов,, до свободных аминокислот. Трипсин, химотрипсины, эластаза, будучи эндопепти-дазами, способствуют разрыву внутренних пептидных связей, дробя белки и полипептиды на более мелкие фрагменты. Трипсин гидролизует пептидные связи, образованные главным образом карбоксильными группами лизина и аргинина, менее активен ои в отношении пептидных связей, образованных изолейцином.
Химотрипсины наиболее активны в отношении пептидных связей, в образовании которых принимает участие тирозин, феннлаланин, триптофан. По специфичности действия химотрипсин похож на пепсин. Эластаза гидролизует те пептидные связи в полипептидах, где находится пролин.
Карбоксипептидаза А относится к цинксодержащим .ферментам. Она отщепляет от подипептндов С-концевые ароматические и алифатические аминокислоты, а карбоксипептидаза В — только С-кониевые остатки лизина и аргинина.
N-концевые аминокислоты полипептидов отщепляет аминополипептидаза кишечника, которая активируется цинком или марганцем, а также цнетеином. В слизистой кишечника присутствуют дипептидазы, гидролизующие днпептиды на две аминокислоты. Дипептидазы активируются ионами кобальта, марганца и цистеином.
Разнообразие протеолитических ферментов приводит к полному расщеплению белков до свободных аминокислот даже в том случае, если белки предварительно не подвергались действию пепсина в желудке. Поэтому больныепосле операции частичного или полного удаления желудка сохраняют способность усваивать белки пищи.
Билет 50-другой вариант
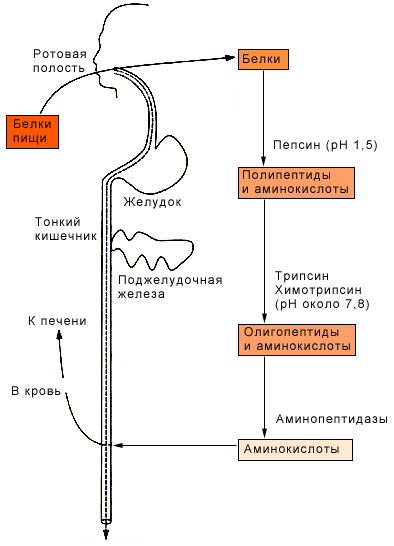
Белки, поступающие с пищей, подвергаются в желудочно-кишечном тракте распаду при участии протеолитических ферментов или пептидгидролаз, которые ускоряют гидролитическое расщепление пептидных связей между аминокислотами. Различные пептидгидролазы обладают относительной специфичностью, они способны катализировать расщепление пептидных связей между определенными аминокислотами. Пептидгидролазы выделяются в неактивной форме ( это предохраняет стенки пищеварительной системы от самопереваривания). Активируются они при поступлении пищи в соответствующий отдел желудочно-кишечного тракта или при виде и запахе пищи по механизму условного рефлекса. Активация пепсина и трипсина происходит по механизму автокатализа, другие пептидгидролазы активируются трипсином.
Во рту белки пищи только механически измельчаются, но не подвергаются химическим изменениям, так как в слюне нет пептидгидролаз. Химическое изменение белков начинается в желудке при участии пепсина и соляной кислоты. Под действием соляной кислоты белки набухают, и фермент получает доступ во внутренние зоны их молекул. Пепсин ускоряет гидролиз внутренних (расположенных далеко от концов молекул) пептидных связей. В результате из белковой молекулы образуются высокомолекулярные пептиды. Если в желудок поступают сложные белки, пепсин и соляная кислота способны катализировать отделение их простетической (небелковой) группы.
Высокомолекулярные пептиды в кишечнике подвергаются дальнейшим превращениям в слабощелочной среде под действием трипсина, химотрипсина и пептидаз. Трипсин ускоряет гидролиз пептидных связей, в образовании которых принимают участие карбоксильные группы аргинина и лизина; химотрипсин расщепляет пептидные связи, образованные с участием карбоксильных групп триптофана, тирозина и фенилаланина. В результате действия этих ферментов высокомолекулярные пептиды превращаются в низкомолекулярные и некоторое количество свободных аминокислот. Низкомолекулярные пептиды в тонком кишечнике подвергаются действию карбоксипептидаз А и В, отщепляющих концевые аминокислоты со стороны свободной аминогруппы, и аминопептидаз, делающих то же самое со стороны свободной аминогруппы. В результате образуются дипептиды, которые гидролизуются до свободных аминокислот под действием дипептидаз. Аминокислоты и некоторое количество низкомолекулярных пептидов всасываются кишечными ворсинками. Этот процесс требует затрат энергии. Часть аминокислот уже в стенках кишечника включаются в синтез специфических белков, большая же часть продуктов пищеварения поступает в кровь (95%) и в лимфу.
Часть аминокислот, образовавшаяся в процессе пищеварения, и непереваренные белки нижних отделов кишечника подвергаются гниению под действием кишечных бактерий. Из некоторых аминокислот образуются ядовитые продукты: фенолы, амины, меркаптаны. Они частично выводятся из организма с калом, частично всасываются в кровь, переносятся ею в печень, где происходит их обезвреживание. Этот процесс требует значительных затрат энергии.
Сложный белок в пищеварительной системе распадается на белок и простетическую группу. Простые белки подвергаются гидролизу до аминокислот. Превращения простетических групп происходят в соответствии с их химической природой. Гем хромопротеидов окисляется в гематин, который почти не всасывается в кровь, а выделяется с калом. Нуклеиновые кислоты в кишечнике гидролизуются при участии эндонуклеаз, экзонуклеаз и нуклеотидаз. Под действием эндонуклеаз из молекул нуклеиновых кислот образуются крупные осколки - олигонуклеотиды. Экзонуклеазы от концов молекул нуклеиновых кислот и олигонуклеотидов отщепляют мономеры - отдельные мононуклеотиды, которые под действием нуклеотидаз могут распадаться на фосфорную кислоту и нуклеозид. Мононуклеотиды и нуклеозиды всасываются в кровь и переносятся к тканям., где мононуклеотиды используются для синтеза специфических нуклеиновых кислот, а нуклеозиды подвергаются дальнейшему распаду.
Билет 51
Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферментыаминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная формавитамина В6).
В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
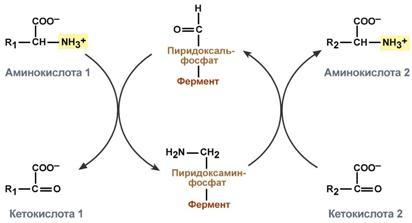
Схема реакции трансаминирования
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованиюкетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
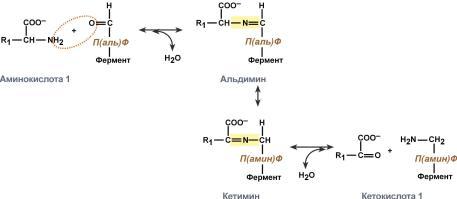
Механизм реакции трансаминирования
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
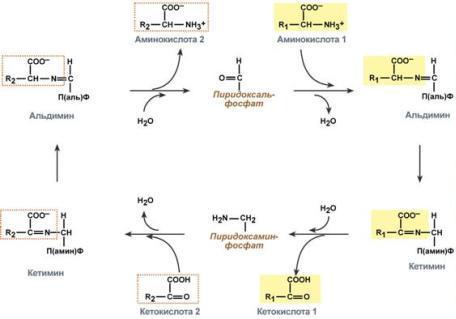
Реакции полного цикла трансаминирования
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:
пировиноградной с образованием аланина,
щавелевоуксусной с образованием аспартата,
α-кетоглутаровой с образованием глутамата.
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты.
Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
Пиридоксальфосфат катализирует реакции трансаминирования и декарбоксилирования аминокислот,
Трансаминирование играет важную роль в процессах мочевинообразования, глюконеогенеза, путях образования новых аминокислот.
Реакции трансаминирования имеют чрезвычайно важное биологическое значение, так как они являются весьма вероятным способом, обеспечивающим связь между углеводами и белками. [3]
В обмене веществ реакция трансаминирования играет важную и разнообразную роль. От нее зависят такие процессы, как 1) биосинтез аминокислот ( трансаминированием завершается синтез не менее чем одиннадцати аминокислот); 2) распад аминокислот ( см. ниже); 3) объединение путей углеводного и аминокислотного обмена и 4) синтез некоторых специфических соединений, в том числе мочевины и у-аминомасляной кислоты. [6]
Билет 51-другой вариант
Трансдезаминироваине — основной путь дезаминирования аминокислот. Оно происходит в два этапа. Первый — трансаминирование, т. е. перенос аминогруппы с любой аминокислоты на а-кетокислоту без промежуточного образования аммиака; второй — собственно окислительное дезаминирование аминокислоты. Поскольку в результате первого этапа аминогруппы «собираются» в составе глутаминовой кислоты, то второй этап связан с ее окислительным дезаминированием. Рассмотрим каждый из этапов процесса трансдезаминирования.
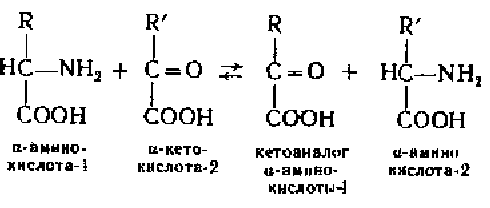
Реакция трансаминирования обратима, она катализируется ферментами — аминотрансферазами, или трансаминазами. Источником аминогрупп в реакции трансаминирования служат не только природные а-аминокислоты, но и многие р-, у-, б- н s-амннокнслоты, а также амиды аминокислот — глутамин и аспарагин.
Большинство известных аминотрансфераз проявляют групповую специфичность,, используя в качестве субстратов несколько аминокислот. Акцептором аминогрупп в реакциях трансаминирования являются три а-кетокислоты: пируват, оксалоацетат и 2-оксоглутарат. Наиболее часто акцептором NH2-rpynn служит 2-оксоглутарат; при этом из него образуется глутаминовая кислота. При переносе аминогрупп на пируват или оксалоацетат образуются соответственно аланин или аспарагиновая кислота по уравнению
![]()
Далее
NН2-группы
с вланина и аспарагнновой кислоты
переносятся на 2-оксоглутарат. Эту
реакцию катализируют высокоактивные
аминотрансферазы: аланикаминотрансфераза
(АЛТ)
и
аспаргатаминотрансфераза
(ACT),
обладающие субстратной специфичностью:

Аминотрансферазы состоят из апофермента и кофермента. Коферментамн аминотрансфераз являются производные пиридоксина (витамина В6) — пи-ридоксаль-5-фосфат (ПАЛФ) и пиридоксамин-5-фосфат (ПАМФ). Оба кофермента (см. строение их в гл. «Ферменты») обратимо переходят друг в друга в ходе реакции трансаминирования. Следует заметить, что аминотрансферазы для катализа требуют оба кофермента в отличие от других ферментов, которые нуждаются в одном из них н бывают либо пиридоксальфосфат-зависимыми, либо пиридоксаминфосфатзависимыми.
Механизм реакций ферментативного трансаминирования аминокислот был предложен советскими биохимиками (А. Е. Браунштейн и М. М. Шемякин) и зарубежными (Метцлер, Икава и Снелл). Согласно этому механизму NH2-rpynna аминокислот на первой стадии взаимодействует с альдегидной группой пирндоксальфосфата О—СН—ПАЛФ с образованием промежуточных шиффовых оснований типа альдимина и затем его таутомерной формы ке-тимана H3N—СНг—ПАМФ (шиффово основание пиридоксаминофосфата):
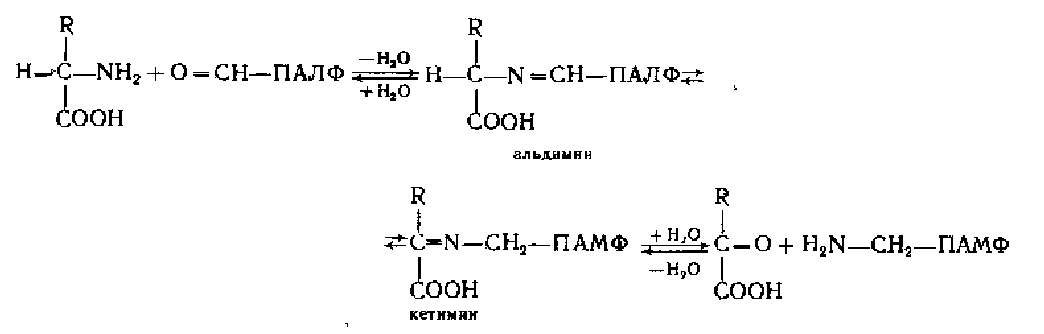
Далее кетнмин гидролизуется с образованием кетоаналога исходной аминокислоты и ПАМФ. На второй стадии ПАМФ взаимодействует с а-кетокисло-той (акцептором аминогрупп) и 'все повторяется в обратном порядке, т. е. образуется сначала кетимин, затем альдимин. Последний гидролизуется. В результате образуются новая аминокислота и ПАЛФ. Таким образом, коферменты аминотрансфераз выполняют функцию переносчика аминогрупп путем" перехода из альдегидной формы в аминированную и обратно.
Биологический смысл реакций трансаминирования состоит в том, чтобы собрать аминогруппы всех распадающихся аминокислот в составе молекул всего одного типа аминокислоты, а именно глутаминовой.
Реакции трансаминирования:
активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
при патологиях (сахарный диабет, гиперкортицизм) обуславливают наличие субстратов для глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
является одной из транспортных форм аминного азота в гепатоциты,
способна реагировать со свободным аммиаком, обезвреживая его.
Билет 52
