
- •1. Законы термодинамики
- •2. Свободная энергия
- •3.Эндергонические и экзергонические реакции
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •I. Моносахариды
- •2. Олигосахарнды
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1. Окислительное дезаминирование
- •2. Непрямое дезаминирование (трансдезаминирование)
- •2. Нарушения липидного обмена
Билет 1
Биологическая химия — наука о структуре химических веществ, входящих в состав живой материи, их превращении и физико-химических процессах, лежащих в основе жизнедеятельности. Биохимия является частью биологии, охватывая те ее области, которые требуют для изучения процессов жизнедеятельности физико-химических и химических подходов, приемов и методов.
Исторически биохимия связана родственными узами с органической химией, изучающей химические свойства веществ, входящих в состав живой материи, и физиологией, изучающей функции живых организмов.
У нее много общего с химическими дисциплинами, такими, как органическая и физическая химия, особенно это относится к методам, применяемым для изучения природных веществ; однако перед биохимией и химическими науками стоят разные задачи. Для органической и физической химии представляют интерес прежде всего строение и свойства химических соединений ,информацию о которых эти науки черпают с помощью специальных методов химии и физической химии (структурный и. стереохимический анализы, методы молекулярных орбиталей, встречного синтеза, химической модификации, получения химических аналогов и т. п.). Тогда как главным для биохимии является выяснение функционального (биологического) назначения всех химических веществ и физико-химических процессов в живом организме, а также механизм нарушения этих функций при разных заболеваниях.
Биохимия обязана своему становлению многим смежным наукам н по-прежнему сохраняет с ними тесную связь в изучении живой природы, но вместе с тем она остается оригинальной и самостоятельной наукой, задачей которой является исследование взаимосвязи строения веществ и их функций, превращения химических соединений в живом организме, способа преобразования энергии в живых системах, механизмов регуляции химических превращений и физико-химических процессов в клетках, тканях и органах, молекулярных механизмов переноса генетической информации в живых организмах и т. д.
Краткая история развития биохимии
Исторически сложилось два этапа исследований в биохимии: статический и динамический. Статическая, или описательная, биохимия изучает состав живой материи, структуру и свойства выделяемых биологических соединений. Динамическая биохимия исследует химические превращения веществ в организме и значение этих превращений для процессов жизнедеятельности. Безусловно, статическая биохимия является более ранним этапом, но впоследствии оба направления развивались параллельно.
Биохимия — сравнительно молодая наука, возникшая на рубеже XIX в. Однако корни ее уходят в глубокую древность. Крупнейший ученый и врач средневековья Абу Али-ибн-Сина (Авиценна) (980—1037) приводит в своем труде «Канон врачебной науки» классификацию химических веществ, применяемых в медицине, называет вещества, содержащиеся в «соках организма» и в моче.
В XVIII в. был сделан ряд важных открытий, М. В. Ломоносов открыл закон сохранения материи и движения (1748) и указал на его применимость как для живой, так и неживой природы. В этом же веке был открыт кислород (Шееле, Пристли) и показана необходимость его для дыхания человека и животных (Пристли, Лавуазье). Было доказано, что растения поглощают углекислый газ и выделяют кислород, т. е. был открыт фотосинтез (Пристли, Инген-Хуз, Сенебье). Из живых объектов было выделено большое число органических соединений —- органические кислоты и спирты (Шееле), мочевина (Руэлль),холестерин (Конради) и др. Заслуживают внимания опыты итальянского аббата Спалланцани, который, исследуя влияние желудочного сока на переваривание мяса у хищных птиц, доказал химическую сущность этого процесса, Начинает развиваться динамическое направление в биохимии.
Развитие методов органической химии в XIX в. существенно ускорило развитие биохимии. В 1828 г. немецкий химик Вёлер синтезировал в лаборатории мочевину из циановой кислоты и аммиака. 1828 г. можно считать годом основания биохимии как науки. В 1863 г. в России было введено преподавание медицинской химии. Первые кафедры были созданы на медицинских факультетах Московского университета (заведующий кафедрой А. Д. Булыгивский), Казанского (А. Я. Данилевский), Харьковского (ф. В. Тихонович) и Киевского (А. А. Шефер) университетов. За рубежом первая подобная кафедра была организована в Германии (1866), ее возглавил крупнейший биохимик того времени Хоппе-Зейлер, Были созданы первые учебники и руководства по биологической (физиологической) химии в Германии Зимоном (1842) и в России профессором Харьковского университета А. И. Ходневым (1847).
В XIX в. были заложены главные направления в биохимии, открыты основные классы соединений, содержащихся в живом организме. Особенно далеко продвинулось изучение химии белков, которыми ученые интересовались не только как обычным продуктом питания, но прежде всего как веществами, широко распространенными в живой природе. Были выделены белки из различных продуктов животного и растительного происхождения. Изучение продуктов гидролиза белка привело к открытию аминокислот. Большую роль в развитии этих исследований сыграли отечественные ученые Н. Э. Лясковскнй, А. Я. Данилевский, С. С. Салаэкин, П. Н. Любавнн, А. П. Сабанеев, М. В. Ненцкий. Незамеченным в свое время осталось открытие швейцарским ученым Мише-ром в 1869 г. ДНК — представителя класса нуклеиновых кислот, являющихся, как оказалось впоследствии, веществами, не менее значимыми для всего живого, чем белки. Были поставлены первые опыты, доказывающие взаимопревращение белков, жиров и углеводов (Либих, Петтенкофер, Фойт, Гофманн).
В XIX в. возникает учение о незаменимых компонентах пищи — витаминах, начало которому положили работы русского ученого Н. И. Лунина(1880), продолженные впоследствии К. А. Сосиным, В. В. Пашутиным и зарубежными — Эйкманом, Функом, Гопкинсом.
Усилиями французских ученых—Бернара, Бертольда, Броун-Секара зарождается новое направление — биохимия гормонов, которое сразу дало практические результаты по применению гормонов в качестве лекарств.
Стремление проникнуть в тайны химических превращений в живом организме привело к расцвету исследований по ферментам.
Берцелиус и Шенбейн доказали сходство действия ферментов и неорганических катализаторов. Дальнейшие работы русских ученых А. Я- Данилевского, М. М. Манасеиной, И. П, Павлова и немецких ученых Э. Бухнера и Г. Бухяера, Яибиха способствовали становлению нового направления в биохимии — ^нзимоли! ин„ которое дало ключ к пониманию механизма химических превращений в живых объектах.
В XX в. биохимия достигла подлинного расцвета. В 1902 г. Э. Фишер с сотр. впервые осуществил искусственный синтез пептидов. Он же разработал пептидную теорию строения белка. Примерно к середине XX в. были изучены основные цепи химического превращения белков, углеводов, липидов, аминокислот и других соединений. Открытие процессов окисления и синтеза жирных кислот и других липидов связывается с именами Кноопа, Линена, Липмана, Кеннеди, Леиинджера. Создаются схемы различных путей превращения углеводов и образования в ходе.их химического носителя энергии — АТФ (Эмбден, Мейергоф, Кребс, Диккенс, Варбург и др.). Важную роль в обосновании механизмов превращения углеводов сыграли '-работы советских биохимиков В. А. Энгельгардта, Я. О. Парнаса, Л. А. Иванова и др.
Было выделено в кристаллическом виде большое число ферментов, установлено их строение, изучены механизмы ферментативных реакций н их регуляция (А. Е. Браунштейн, С. Е. Северин, В. Н. Орехович, С. С. Дебов; Б. ф, Коров-кии, Самнер,Кунитц, Михаэлис, Кошленд, Линей и др.). Благодаря внедрению метода рентгеноструктурного анализа и созданию аминокислотных анализаторов была расшифрована линейная структура инсулина (Сенджер, 1953), пептидов вазопрессина И окситоцниа (Виньо, 1953) и трехмерные структуры белков — миоглобина (Кендрю, 1960), гемоглобина (Перутц), лнзоцима (фил-липс) и др. Исследования отечественных биохимиков занимают ведущее место в изучении структуры и функции белков системы свертывания крови (А. А. Шмядт, А. А. Белицер, Б. А. КудряшОв, Д. М. Зубанров). В 1937 г. выдающийся советский биохимик А. Е. Браунштейн совместно с М. Г. Крицман открыли ферменты трансаминироваыия аминокислот, что положило начало изучению новых .путей превращения азотистых соединений в организме. Эти исследования были развиты впоследствии в трудах С. Р. Мардашева, С. Я- Капланского, Т. Т. Бе-резова, А. Я- Николаева и др.
Необходимо особо отметить работы отечественной школы биохимии, основанной акад. В. С. Гулевичем. Его исследования были посвящены необычным азотсодержащим соединениям мышечной ткани — дипептидам карнозину и ансерину, содержащим р-аланин. Эти работы были продолжены акад. С. Е. Се-' вериным, внесшим существенный вклад не только в изучение механизма действия дипептидрв, но и в разработку различных проблем эизимологни, регуляции ферментов и мультнфермеитных комплексов, биоэнергетики,
В начале XX в. формируется новое направление в биохимии — биоэнергетика. Механизм освобождения энергии из питательных веществ связывался с биологическим окислением. Еще в 1897 г- выдающийся русский ученый, впоследствии основатель советской биохимии А. Н. Бах выдвинул теорию перекис -ного окисления веществ молекулярным кислородом, которая дала толчок к исследованиям в области тканевого дыхания и, по существу, явилась блестящим предвидением нового пути окисления органических веществ в микросомах, Другой выдающийся советский биохимик акад. В. И. Палладии обосновал значение дегидрирования субстратов в тканевом дыхании. В 1931 г. Энгель-гардт открыл явление окислительного фосфорилнрования.
Значительную роль в формировании представлений о механизмах дыхания и образования энергии сыграли исследования советского биохимика В. А. Бе-лицера, Энглера, Варбурга, Кейлина, Кребса, Липмана, Ленинджера, Чанса, Рэкера н др. Впоследствии Н. А. Энгельгардт совместно с М. Н. Любимовой (1939—1942) изучили АТФазную активность основного белка мышц актомио-эина, т. е. обнаружили возможность механохимического сопряжения.
В 1961 г. английский биохимик Митчелл выдвинул гипотезу химико-осмотического сопряжения в биоэнергетике, в обосновании которой сыграли большую роль работы советского биохимика В. П. Скулачева.
В первой четверти XX в. акад. А. И. Опарин заложил основы эволюционной биохимии, выдвинув теорию происхождения жизни на Земле.
Важное место в раскрытии тайн живой материи заняли исследования по выделению, изучению структуры и механизма действия гормонов — специфических регуляторов обмена веществ. Этим исследованиям посвящены работы Н. А. Юдаеаа, В. С. Ильина, Я. X. Туракулова, Ю. А. Панкова и др.
В 40-х годах нашего столетия вновь возрождается интерес к открытым в XIX в. нуклеиновым кислотам в связи с поиском химических веществ — носителей наследственности. В 1953 г. Крик и Уотсон открыли вторичную структуру ДНК, что позволило понять принципы передачи наследственной информации.
Это открытие фактически знаменовало рождение нового направления в биохимии — молекулярной биологии, изучающей молекулярную основу фундаментальных свойств живой материи и, в частности, молекулярные основы наследственности. В развитии и становлении этой науки исключительное значение имели работы школы акад. А. Н. Белозерского, который создал советскую школу молекулярных биологов. Его ученик А. С. Спирин внес существенный вклад в развитие биохимии н в раскрытие механизма синтеза белка на рибосомах. Советский биохимик А. А. Баев установил структуру одной из г-РНК, участвующей в синтезе белка.
В 1961 г. Ниренберг и Маттеи открыли генетический код, а Жакоб и Мо-но — механизм регуляции синтеза белка у бактерий. В 1967 г. Кррнберг впервые осуществил синтез ДНК вируса в пробирке, а в 1970 г. X. Корана синтезировал искусственный ген. Так в 70-х годах молекулярная биология дала начало генной инженерии; занимающейся химическим конструированием генов, пересадкой их в клетки и исправлением генетических дефектов.
Благодатным объектом для биохимика являются микроорганизмы, биохимические процессы которых можно изменить или'пересадкой нужных генов, или модификацией их собственных. В фармацевтической практике биохимия завоевывает все новые позиции. Биологические катализаторы — ферменты применяются в промышленности при синтезе лекарственных средств (например, стероидных гормонов). С помощью метода генной инженерии разрабатывают перспективные способы производства природных лекарственных препаратов. Знание биохимии микроорганизмов позволило создать удобные, экономичные способы промышленного синтеза лекарственных препаратов (аминокислот, нуклеотидов, нуклеозидов, витаминов, антибиотиков и т. д.). Разработаны быстрые и специфичные методы анализа лекарств с использованием ферментов в качестве аналитических реагентов.
Немаловажное значение для практики имеет знание механизма действия лекарств. Изучение превращения лекарств ферментными системами клеток позволяет разработать правильный режим дозировки применяемых средств, регулировать превращение их в организме и понять природу действующего начала, т. е. чем обусловлен эффект — исходным веществом или продуктом его обмена.
Билет 2
Белки, или протеины(от греч. protos — первый, важнейший), являются важнейшей составной частью клеток любого живого организма. Они не встречаются в неживой природе. Белкам принадлежит решающая роль во всех процессах жизнедеятельности.
Белками называются высокомолекулярные азотсодержащие органические вещества, состоящие из аминокислот, соединенных в цепи с помощью пептидных связей, и имеющие сложную структурную организацию.
Это определение объединяет характерные признаки белков, среди которых можно выделить следующие:
1) довольно постоянная доля азота (в среднем 16% от сухой массы);
2) наличие постоянных структурных звеньев — аминокислот;
3) пептидные связи между аминокислотами, с помощью которых они соединяются в полипептидные цепи;
4) большая молекулярная масса (от 4—5 тысяч до нескольких миллионов дальтонов);
5) сложная структурная организация полипептидной цепи, определяющая физико-химические и биологические свойства белков.
Элементный состав белков. Первый признак вытекает из элементного состава белков (в % от сухой матгсы белка):
Углерод........51—55 Водород ....... 6—7
Кислород .......21—23 Сера.........0,3—2,5
Азот.........15—18 Зола......... 0—0,5
В среднем для большинства белков растительного, животного и микробного происхождения доля азота в отличие от других элементов довольно постоянна— примерно 16%; на основании этого признака рассчитывают количество белка: массу азота, найденную при анализе, умножают на коэффициент.6,25 (100: 16 = 6,25). Структурные звенья, или мономеры, белков можно обнаружить после кислотного гидролиза. Этот прием наиболее часто используют для изучения состава белков. Мономерами белков являются а-аминокнслоты L-ряда. Соединяются аминокислоты в цепь ковалентными пептидными связями.
Молекулярная масса белков. Важнейшим признаком белков является большая молекулярная масса. В зависимости от длины цепи все полипептиды условно можно разделить на пептиды (содержат от 2 до 10 аминокислот) ноли пептиды (от 10 до 40 аминокислот) и белки (свыше 40 аминокислот). Если принять среднюю молекулярную массу одной аминокислоты около 100, то молекулярная масса пептидов приближается к 1000, полипептидов — до4000, а белков — от 4—5 тыс. до нескольких миллионов. Ниже приводится молекулярная масса некоторых белков.
Глюкагон 4000 Инсулин 6000
Билет 3
Аминокислотами называются -органические карбоновые кислоты, у которых как минимум один из атомов водорода углеводородной цепи замещен на аминогруппу. В зависимости от положения группы —NHa различают а, р, у и т. д. L-аминокислоты.
Аминокислоты делятся на две группы: протеиногенные (входящие в состав белков) и непротеиногенные (не участвующие в образовании белков).
Среди протеиногенных аминокислот выделяют главные (их всего 20) и редкие. Редкие белковые аминокислоты (например, гидрокснпролин, гидрокснлизин, амииолимонная кислота и- др.) на самом деле являются производными тех же 20 аминокислот.
Протеиногенные аминокислоты участвуют в построении множества разных белков независимо от вида организма, а непротеиногенные аминокислоты могут быть даже токсичны для организма другого вида, т. е, ведут себя как обычные чужеродные вещества
Помимо стандартных аминокислот в белках встречаются и модифицированные аминокислоты. Они являются производными обычных стандартных аминокислот. Как правило, химическая модификация происходит после включения аминокислоты в состав белка.
Биологическое значение модифицированных нестандартных аминокислот может быть продемонстрировано на примере у-карбоксиглутаминовой кислоты:
Наличие у-карбоксиглутаминовой кислоты, содержащей дополнительную группу -СООН, обеспечивает оптимальное связывание ионов Са2+ белком плазмы крови протромбином, что необходимо для его активации и превращения в тромбин. Этот процесс сопряжен с превращением другого белка плазмы — фибриногена в фибрин, необходимый для образования кровяного сгустка и остановки кровотечения. При недостатке витамина К происходит нарушение процесса карбоксилирования глутаминовой кислоты в составе протромбина и, как следствие, замедление свертывания крови.
Другие примеры соединений, содержащих модифицированные аминокислоты, — трийодтиронин (ТЗ) и тетрайодтиронин (тироксин, или Т4). Йодсодержащие аминокислоты синтезируются в щитовидной железе из тирозина. ТЗ и Т4 — важнейшие гормоны, участвующие в регуляции многих процессов жизнедеятельности:Примером модификации является окисление двух -SH-групп цис-теиновых остатков, что приводит к образованию аминокислоты цистина, содержащей дисульфидный мостик. Дисульфидные мостики играют важную роль в формировании структуры некоторых белков, например иммуноглобулинов, инсулина. В таких белках цистеиновые остатки молекулы цистина входят в состав двух разных полипептидных цепей, которые благодаря дисульфидной связи оказываются поперечно сшитыми между собой.
Гидроксипролин и гидроксилиэин — также примеры модифицированных аминокислот. Они входят в состав коллагена — основного белка соединительной ткани:
глутатион (у-глутамилцистеинилглицин, у-глу-цис-гли)—один из наиболее широко распространенных внутриклеточных пептидов, принимающий участие в окислительно-восстановительных процессах в клетках и переносе аминокислот через биологические мембраны:
офтальмовая кислота (у-глутамил-а-аминобутирилглицин)—антагонист глутатиона, столь же широко распространена в природе, как и сам глутатион:
Карнозин (р-аланилгистидин; §-ала-гис)—пептид, содержащийся в мышцах животных:
Он препятствует накоплению и устраняет продукты перекисного окисления липидов, участвует в поддержании буферной емкости мышечного сока, ускоряет процесс распада углеводов в мышцах и в виде фосфата вовлекается в энергетический обмен в мышце.
Роль пептидов в процессах жизнедеятельности крайне многообразна. Многие из них служат гормонами некоторые представлены сильнейшими ядами (яды змей, жаб, улиток, пауков, насекомых, высших грибов, микробов), мощными антибиотиками, рилизинг-факторами (способствуют синтезу и высвобождению гормонов), регуляторами клеточного деления, переносчиками молекул и ионов через биологические мембраны,регуляторами психической деятельности.
Билет 4
При изучении состава белков было установлено, что все они построены по единому принципу и имеют четыре уровня организации: первичную, вторичную, третичную, а отдельные из них и четвертичную структуры.
Первичная структура. Представляет собой линейную цепь аминокислот, расположенных в определенной последовательности и соединенных между собой пептидными связями. Пептиднаясвязь образуется за счет α-карбоксильной группы одной аминокисло ты и α-аминной группы другой.
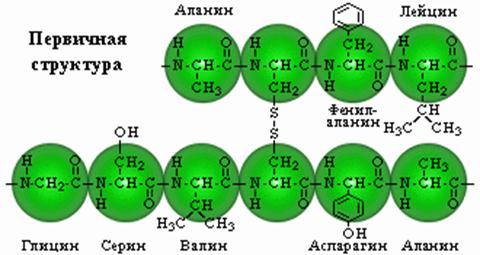
Аминокислоты могут объединяться в длинные цепи, образуя между собой пептидные связи. Две аминокислоты при этом образуютдипептид; если к нему добавить еще одну, то возник нет трипептид ит.д. Пептиды, содержащие до 10 аминокислот, называютолигопептидами, а до 50 — полипептидами. Полипептиды, содержащие более 50 аминокислот, уже называют белками, хотя это название чаще используют для соединений, содержащих более 100 аминокислот.
Аминокислотные звенья, входящие в состав пептида, обычно называют аминокислотными остатками. Они уже не являются аминокислотами, так как в результате образования пептидных связей у каждой из них не хватает одного атома водорода в аминной группе и одного гидроксильного аниона в карбоксильной. Аминокислотный остаток, находящийся на том конце пептида, где имеется свободная α-аминная группа, называется аминоконцевым или N-концевым остатком; остаток же на противоположном кон це молекулы, имеющем свободную карбоксильную группу,— карбоксиконцевым или С-концевым. Наз вание пептидов образуется из названия входящих в них аминокислотных остатков в соответствии с их последовательностью,начиная с N-конца.
Вторичная структура. Представляет собой упоря доченную и компактную упаковку полипептидной цепи. По конфигурации она бывает в виде спирали и склад чатой структуры.
Основу α-спирали составляет пеп тидная цепь, а радикалы аминокислотнаправлены кнаружи, располагаясь по спирали. Внешне α-спираль похожа на слегка растянутую спираль электроплитки. Такая форма характерна для белков, имеющих одну полипептидную цепь (альбуминов, глобулинов и др.).
Складчатая β-структура представляет собой плос кую форму и похожа намеха гармошки. Она характерна для белков, имеющих несколько полипептид ных цепей, расположенных параллельно, β-структура встречается в таких белках, как трипсин, рибонуклеаза, кератин волос, коллаген сухожилий.
Образование вторичной структуры обеспечиваетсяводородной связью. Она образуется при участии атома водорода, находящегося между двумя сильноотрицательными атомами, к одному из которых он (во дород) имеет большее сродство.
Водородная связь является слабой, она легко обра зуется и так же легко разрывается. В молекуле белка этот вид связи образуется между водородом α-аминной группы одной пептидной связи и кислородом β-карбоксильной группы другой.
В α-спирали водородная связь образуется таким образом, что каждаяNH-группа пептидной связи соединяется с четвертой по счету вдоль цепи СО-группой другой связи. Именно благодаря такому соедине нию обеспечивается спирализация цепи. В β-структуре водородная связь образуется между теми же груп пировками, но принадлежа щими разным полипептид ным цепям. Таким образом, все СО- и NH-группы полипептидных цепей оказыва ются связанными между со бой водородными связями.
Третичная структура. Имеющая третичную струк туру белковая молекула представляет собой более компактное пространствен ное расположение полипеп тидной цепи, точнее ее вто ричной структуры. Форма третичной структуры может быть самая различная и определяется тем, что различные функциональные группы полипептидной цепи могут образовывать различные типы связей (электростатические, ионные, силы Ван-дер-Ваальса и др.).
Этот тип структуры является довольно жестким, что обус ловлено наличием дисульфидных (—S...S—) связей (дисульфидных мостиков), которые образуются между атомами серы двух молекул цистеина, расположенных в разных участках полипептидной цепи.
Именно третичная структура обеспечивает выполнение белком его основных функций и в зависимости от этого третичная структура может быть представлена или в виде шарика (глобулы) у глобулярных белков, или и виде нитей (фибрилл) у фибриллярных белков. Глобулярные белкиобнаружены в крови и многих органах. Их представителями являются альбумины и глобулины. Фибриллярные белки составляют основу мышечной ткани.
Четвертичная структура. В организме имеются более сложные по структуре белки, состоящие из нескольких так называемых субъединиц,каждая из которых представляет собой молекулу белка со своей специфической структурой, вплоть до третичной. Такое объединение субъединиц называют четвертичной структурой. Особен ностью белков с четвертичной структурой является их способность проявлять свои функции и свойства только при наличии всех субъединиц. Удаление хотя бы одной из них приводит к потере функций. К та ким белкам относятся гемоглобин,ряд ферментов и др.
Т.о., под четвертичной структурой понимают структуру белков, состоящих из нескольких полипептидных цепей. Каждая из этих цепей имеет свою завершенную пространственную структуру и называетсясубъединицей белка с четвертичной структурой.
Билет 5
Аминокислотный состав и пространственная организация каждого белка определяют его физико-химические свойства. Белки обладают кислотно-основными, буферными, коллоидными и осмотическими свойствами.
Белки являются амфотерными полиэлектролитами, т. е. сочетают в себе, подобно аминокислотам, кислотные и основные свойства. Кислотно-основные свойства аминокислот обусловлены прежде всего наличием а-амино- и а-карбоксильной групп {кислотно-основная пара). В молекулах белков эти группы участвуют в образовании пептидных связей, а амфотерность белкам придают кислотно-основные группы боковых радикалов аминокислот входящих в белок. Разумеется, в каждой молекуле нативного белка (полипептидной цепи) имеется как минимум по одной концевой а-амино- и а-карбоксильной группе (если у белка только третичная структура). У белка с четвертичной структурой число концевых групп —NK2 и —СООН равно числу субъединиц, или протомеров. Поскольку больщая часть полярных групп находится на поверхности глобулярных белков, то именно они определяют кислотно-основные свойства и заряд белковой молекулы. Кислотные свойства белку придают кислые аминокислоты (аспарагиновая, глутамииовая и амннолимониая), а щелочные свойства — основные аминокислоты (лизин, аргинин, гистидин),
Коллоидные и осмотические свойства белков
Водные растворы белков являются устойчивыми и равновесными, они со временем не выпадают в осадок (не коагулируют) и не требуют присутствия стабилизаторов. Белковые растворы гомогенны и, в сущности, их можно отнести к истинным растворам. Однако высокая молекулярная масса белков придает их растворам многие свойства коллоидных систем:
1) характерные оптические свойства (опалесценция растворов и способность их рассеивать лучи видимого света);
2) малая скорость диффузии;
3) неспособность проникать через полупроницаемые мембраны;
4) высокая вязкость растворов;
5) способность к образованию гелей.
Оптические свойства белков. Растворы белков, особенно концентрированные, обладают характерной опалесцениией. При боковом освещении раствора белка лучи света в нем становятся видимыми и образуют светящийся конус иди полосу'— эффект Тиндаля (в сильно разбавленных растворах белка не видна опалесценция и почти отсутствует светящийся конус Тиндаля). Объясняется этот светорассеивающий эффект дифракцией лучей света частицами белка в растворе.
Малая скорость диффузии. Диффузией называется самопроизвольное перемещение молекул растворенных веществ вследствие градиента концентра-ций (от зон с высокой концентрацией к зонам с низкой концентрацией). Белки имеют ограниченную скорость диффузии в сравнении с обычными молекулами и ионами, которые перемещаются в сотни и тысячи раз быстрее, чем белкн. Скорость диффузии белков больше зависит от формы их молекул, чем от молекулярной массы. Глобулярные белки в водных растворах подвижнее фибриллярных белков..Диффузия белков имеет важное значение для нормального функционирования клетки.
Осмотические свойства белков'. Белки из-за высокой молекулярной массы не могут диффундировать через полупроницаемую мембрану, тогда как ннзкомолекулярные вещества легко проходят через такие мембраны. Это свойство белков используют в практике для очистки их растворов от низкомолекулярных примесей. Такой процесс называется диализом.
Неспособность белков диффундировать через полупроницаемые мембраны вызывает явление осмоса, т. е. перемещение молекул воды через полупроницаемую мембрану в раствор белка.
Биологические мембраны также непроницаемы для белка, поэтому осмотическое давление, создаваемое.белком, зависит от концентрации его внутри и вне клетки. Осмотическое давление, обусловленное белком^, называют также онкотическим давлением.
Высокая вязкость растворов белка. Высокая вязкость характерна не только для растворов белка, но вообще для растворов высокомолекулярных соединений. С увеличением концентрации белка вязкость раствора повышается, поскольку повышаются силы сцепления между молекулами белка. Вязкость зависит от формы молекул. Растворы фибриллярных белков всегда более вязки, чем растворы глобулярных белков. С повышением температуры вязкость растворов белка снижается. Добавки некоторых солей, например кальция, повышают вязкость, способствуя сцеплению молекул с помощью кальциевых мостиков.
Способность белков к образованию гелей. Взаимодействие между макромолекулами белка в растворе может привести к образованию структурных сеток, внутри которых находятся захваченные молекулы воды. Такие структурированные системы называются гелями или студнями.
Высаливание
Процесс осаждения белков нейтральными солевыми растворами называется высаливанием. Характерной особенностью белков, полученных высаливанием, является сохранение ими нативных биологических свойств после удаления соли.
Механизм высаливания состоит в том, что добавляемые анионы н катионы солевого раствора снимают гидратную оболочку белков, являющуюся одним из факторов его устойчивости. Возможно, одновременно происходит и нейтрализация зарядов белка ионами соли, что также способствует осаждению белков.Способность к высаливанию наиболее выражена у анионов солей.
Сильным высаливающим эффектом в этом ряду обладают сульфаты. На практике для высаливания белков чаще всего применяют сульфат натрия и аммония. Кроме солей белки осаждают органическими водоотнимающимн средствами (этанол, ацетон, метанол и др.). Фактически это то же высаливание.
Высаливание широко используют для разделении и очистки белков, поскольку многие белки различаются по размеру гндратной оболочки и величине зарядов. Для каждого из них имеется своя зона высаливания, т. е. концентрация соли, позволяющая дегидратировать и осадить белок. После удаления высаливающего агента белок сохраняет все свои природные свойства и функции.
Денатурация (денативация) При действия различных веществ, нарушающих высшие уровни организации белковой молекулы (вторичную, третичную, четвертичную) с сохранением первичной структуры, белок теряет свои натнвные физико-химические и, главное, биологические свойства. Эта явление называется денатурацией (денати-вацией). Оно характерно только для молекул, имеющих сложную пространственную организацию. Синтетические и природные пептиды не способны к -Денатурации.
При денатурации разрываются связи, стабилизирующие четвертичную, третичную и даже вторичную структуры. Полипептидная цепь разворачивается и находится в растворе или в развернутом виде, или в виде беспорядочного клубка. При зтом теряется гидратная оболочка и белок выпадает в осадок. Однако осажденный денатурированный белок отличается от того же белка, осажденного путем высаливания, так ках в первом случае он утрачивает натнвные свойства, а во втором сохраняет. Это указывает на то, что механизм действия веществ, вызывающих денатурацию и высаливание, разный. При высаливании сохраняется нативная структура белка, а при денатурации разрушается.
Денатурирующие факторы делятся на физические и химические. К физическим факторам относятся: температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучение.
Тепловая денатурация белков является наиболее изученным процессом. Она считалась одним нз характерных признаков белков. Давно известно, что при нагревании белок, свертывается (коагулирует) и выпадает в осадок. Большинство белков термолабильны, однако известны белки, очень устойчивые к нагреванию
К химическим факторам, вызывающим денатурацию, относятся: кислоты и щелочи, органические растворители (спирт, ацетон), детергенты (моющие средства), некоторые амиды (мочевина, соли гуаннднна И т. д.), алкалоиды, тяжелые металлы (соли ртутн, иедн, бария, цинка, кадмия и т. д.). Механизм денатурирующего действия химических веществ зависит от их физико-химических свойств. Кислоты и щелочи широко используются в качестве осаднтелей белков. Многие белки денатурируются при крайних значениях рН — ниже 2 или выше 10—11.
Тяжелые металлы, алкалоиды издавна применяются как осадители; они образуют прочные связи с полярными группами белков и тем самым разрывают систему водородных и ионных .связей.
.
Свойства денатурированных белков. Наиболее типичными для денатурированных белков являются следующие признаки.
1. Увеличение числа реактивных или функциональных групп по сравнению с нативной молекулой белка (функциональными группами называются группы боковых радикалов аминокислот: СООН, NHS, SH, ОН). Часть этих групп обычно находится внутри молекулы белка и не выявляетсн специальными реагентами. Развертывание полипептидной цепи при денатурации позволяет обнаружить эти дополнительные, или скрытые, группы.
гидратной оболочки, развертыванием молекулы белка с «обнажением» гидрофобных радикалов и нейтрализацией1 зарядов полярных групп).
3. Изменение конфигурации молекулы белка.
4. Потеря биологической активности, вызванная нарушением нативной структурной организации молекулы.
5. Более легкое расщепление протеолитнческими ферментами по сравнению с нагивным белком — переход компактной нативной структуры в развернутую рыхлую форму облегчает доступ ферментов к пептидным связям белка, которые они разрушают.
Заметим также, что денатурирующие вещества, осаждающие белки, используются в биохимической практике с иными целями, чем высаливающие. Высаливание как прием применяется для выделения какого-то белка или группы белков, а денатурация для освобождения от белка смеси каких-либо -веществ. Удаляя белок, можно получить безбелковый раствор или устранить действие этого белка.
Методы выделения и очистки белков.
гомогенизация - клетки растираются до однородной массы;
экстракция белков водными или водно-солевыми растворами;
диализ;
высаливание;
электрофорез;
хроматография: адсорбция, расщепление;
ультрацентрифугирование.
Билет 6
К простым белкам относят гистоны, протамины, альбумины, глобулины, проламины, глютелины и протеиноиды (или склеропротеины).
Гистоны (от греч. histos — ткань) '— тканевые белки многоклеточных организмов, связанных с ДНК хроматина. Это белки небольшой молекулярной массы (11 000—24 000); по электрохимическим свойствам относятся к белкам с резко выраженными основными признаками (изоэлектрическая точка у разных Гистонов колеблется в пределах 9,5—12,0). Гистоны имеют только третичную структуру. Выделяют 5 главных типов или фракций гистонов: Н(, Нгл Нгь, Нз, Н4. Деление основано на ряде признаков, главным из которых является соотношение лизина и аргинина во фракциях (табл. 11).
Выделен дополнительный тип гистонов — гистон Н5, содержащийся в ядерных эритроцитах птиц, амфибий и рыб
В естественных условиях гистоны прочно связаны с ДНК и выделяются в составе нуклеопротеида. Связь гистон — ДНК электростатическая, так как гистоны имеют большой положительный заряд, а цепь ДНК — отрицательный. Гистоноподобные белки встречаются в составе рибосом цитоплазмы клеток. У одноклеточных организмов некоторые из фракций гистонов отсутствуют.
Основные функции гистонов -— структурная и регуляторная. Структурная функция состоит в том, что гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно, хроматина и хромосом. Четыре фракции гистонов, за исключением Н,, составляют основу нуклеосом, являющихся структурными единицами хроматина; фракция Н, заполняет фрагменты ДНК между нуклеосомами. Регуляторная функция заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Протамины — своеобразные биологические заменители гистонов, но качественно отличающиеся от них аминокислотным составом и структурой. Это самые низкомолекулярные белки (М 4000—12 000), они обладают резко выраженными основными свойствами нз-за большого содержания аргинина (до 80%). Как и гистоны, протамины — поликатионные белки; они связываются с ДНК в хроматине спермиев. Замена гистонов на протамины в хроматине спермнев наблюдается не у всех животных.
Альбумины и глобулины — групповое название белков, высаливающихся при разном насыщении нейтральными солями (сульфатом аммония или натрия). При 50%-ном насыщении раствора соли выпадают в осадок глобулины, а при полном (100%-ном) насыщении — альбумины. Альбумины н глобулины содержатся в плазме кровн, в клетках и биологических жидкостях организма. Каждая из этих двух групп белков настолько разнородна, что среди них имеются белки с самыми разнообразными функциями.
Альбумины. — белки относительно небольшой молекулярной массы (15— 70 тыс.); они имеют избыточный отрицательный заряд и кислые свойства (изоэлектрическая точка 4,7) из-за большого содержания глутаминовой кислоты. Это сильно гидратнрованные белки, поэтому они осаждаются только при большой концентрации водоотнимающнх веществ. Характерным свойством альбуминов является высокая адсорбционная способность. Они адсорбируют полярные и неполярные молекулы. Благодаря высокой неспецнфнческой адсорбции различных веществ альбумины плазмы крови играют физиологически важную транспортную роль.
Глобулины — белки с большей, чем альбумины, молекулярной массой (свыше 100 000). В отличие от альбуминов они нерастворимы в чистой воде; растворимы в слабых солевых растворах. Глобулины — слабокислые или ней* тральные белки (изоэлектрическая точка лежит в интервале рН в — 7,3); содержат меньше, чем альбумины, кислых аминокислот. Это слабогидрати-роваивые белки, поэтому и осаждаются они в менее концентрированных растворах сульфата аммония. Некоторые из глобулинов обладают способностью к специфическому связыванию веществ (специфические переносчики), другие, как и альбумины, к неспецифическому связыванию липидорастворимых веществ. Некоторые глобулины выполняют важные функции в качестве антител); другие отвечают за перенос липидов, железа и меди в кровеносном русле.
При электрофорезе внутриклеточных белков или других жидкостей организма разделение белков происходит по тем же зонам подвижности, что и белков сыворотки крови. Но это не значит, что здесь присутствуют белкн с той же функцией, что и в сыворотке крови, хотя электрофоретическая картина их сходна. Поэтому белки сыворотки крови часто используют в качестве стандарта для сравнения с белками, выделенными из разных тканей и жидкостей (при этом говорят, что такой-то неизвестный белок обладает, например, подвижностью {^-глобулина или альбумина и т. д.).
Билет 7
НУКЛЕОПРОТЕИНЫ
Нуклеопротеины состоят из белков и нуклеиновых кислот. Последние рассматриваются как простетические группы. В природе обнаружено 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическим свойствам,– дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Названия нуклеопротеинов отражают только природу углеводного компонента (пентозы), входящего в состав нуклеиновых кислот. У РНП углевод представлен рибозой, у ДНП – дезоксирибозой. Доказано, что ДНП преимущественно локализованы в ядре, а РНП – в цитоплазме. В то же время ДНП открыты в митохондриях, а в ядрах и ядрышках обнаружены также высокомолекулярные РНП.Биохимики имеют достаточно оснований для утверждения, что природа синтезированных в клетках белков зависит в первую очередь от природы ДНП, точнее ДНК, а свойства живых организмов, как и структурная организация субклеточных органелл, клеток и целостного организма, определяются свойствами синтезированных белков. ДНК хранит наследственную информацию .С нуклеопротеинами и соответственно нуклеиновыми кислотами непосредственно связаны, кроме того, такие биологические процессы, как митоз, мейоз, эмбриональный и злокачественный рост и др. Относительно белкового состава ДНП известно, что все 5 классов гистонов различаются по размерам, аминокислотному составу и величине заряда (всегда положительный). Так, выделяют гистоны, богатые лизином (H1), молекулярная масса которых составляет в среднем 20000, и богатые аргинином с мол. массой до 15000. Они обозначаются следующими символами:
H1 – богатые лизином,
Н2А – богатые аргинином и лизином,
Н2В – умеренно богатые аргинином и лизином,
Н3 – богатые аргинином,
Н4 – богатые глицином и аргинином.
Природа негистоновых белков пока не достаточно выяснена. В их состав входят сложные белки, ферменты, а также регуляторные белки. По своим свойствам последние отличаются от гистонов и представлены кислыми белками. В различных нуклеопротеинах количество нуклеиновой кислоты колеблется от 40 до 65% (например, в рибосомах про- и эукариот .Ионная связь между РНК и белковыми молекулами ВТМ весьма непрочная и легко разрывается даже в ≪мягких≫ условиях, что позволяет отделить РНК от белка. Интересно, что после удаления разрывающего ионную связь агента при смешивании этих продуктов происходят полная регенерация исходного ВТМ, восстановление всех его физических параметров и биологических свойств, включая способность поражать зеленый лист. Акад. А.С. Спирин и одновременно М. Номура разделили 70S рибосомы (рибонуклеопротеины) на их составляющие и разработали условия для самосборки полноценных функционирующих рибосом. В основе этого удивительного явления самосборки лежит, по-видимому, программа, содержащаяся в первичной структуре как белка, так и нуклеиновой кислоты и определяющая, какое количество белковых молекул и в какой последовательности должно присоединиться к единственной молекуле РНК (в случае ВТМ) или к 3 молекулам РНК (в рибосомах), чтобы обеспечить высокую точность реконструкции надмолекулярных структур.
В настоящее время и ядерный хроматин (ДНП), и рибосомы, и вирусные нуклеопротеиды обычно рассматривают именно как надмолекулярные комплексы или структуры, а отнесение этих образований в раздел ≪Сложные белки≫ –в значительной степени дань традиции.
Нуклеоиротеиды. Имеют важное значение, так как их небелковая часть представлена нуклеиновыми кислотами: дезоксирибонуклеиновой (ДНК) и рибонук леиновой (РНК). Нуклеиновые кислоты участвуют вхранении и передаче наследственной информации о синтезе белков, специфичных для данного организма. Белковая часть нуклеопротеидов представлена в ос новном протаминами и гистонами. Комплексы ДНК с протаминами обнаружены в сперматозоидах, а с гистонами — в соматических клетках, где молекула ДНК «намотана» вокруг молекул гистонов. Гистоны обеспечивают компактную упаковку ДНК и ее хра нение, так как ДНК в составе нуклеопротеида не может проявлять своей биологической функции — передавать закодированную в ней наследственную информацию.
Билет 8
Нуклеозиды – это N-гликозиды, образованные нуклеиновыми основаниями и рибозой или дезоксирибозой.
Между аномерным атомом углерода моносахарида и атомом азота в положении 1 пиримидинового цикла или атомом азота в положении 9 пуринового цикла образуется b -гликозидная связь.
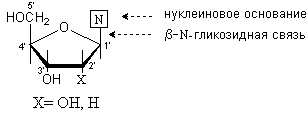
В зависимости от природы моносахаридного остатка нуклеозиды делят на рибонуклеозиды (содержат остаток рибозы) идезоксирибонуклеозиды (содержат остаток дезоксирибозы). Названия нуклеозидов строят на основе тривиальных названий нуклеиновых оснований, добавляя окончание –идин для производных пиримидина и -озин для производных пурина. К названиям дезоксирибонуклеозидов добавляют приставку дезокси-. Исключение составляет нуклеозид, образованный тимином и дезоксирибозой, к которому приставка дезокси- не добавляется, так как тимин образует нуклеозиды с рибозой лишь в очень редких случаях.

Для обозначения нуклеозидов используются однобуквенные обозначения, входящих в их состав нуклеиновых оснований. К обозначениям дезоксирибонуклеозидов ( за исключением тимидина) добавляется буква ”д”.
Наряду с представленными на схеме основными нуклеозидами в составе нуклеиновых кислот встречаются минорные нуклеозиды, содержащие модифицированные нуклеиновые основания (см. выше).
В природе нуклеозиды встречаются также в свободном состоянии, преимущественно в виде нуклеозидных антибиотиков, которые проявляют противоопухолевую активность. Нуклеозиды-антибиотики имеют некоторые отличия от обычных нуклеозидов в строении либо углеводной части, либо гетероциклического основания, что позволяет им выступать в качестве антиметаболитов, чем и объясняется их антибиотическая активность.
Как N-гликозиды, нуклеозиды устойчивы к действию щелочей, но расщепляются под действием кислот с образованием свободного моносахарида и нуклеинового основания. Пуриновые нуклеозиды гидролизуются значительно легче пиримидиновых.
Нуклеотиды
Нуклеотиды представляют собой соединения соответствующего типа нуклеозида с фосфорной кислотой. Они также делятся на рибонуклеотиды, содержащие рибозу, и дезоксирибонуклеотиды, содержащие 2'-дезоксирибозу. Ниже приведено строение адениловых нуклеотидов.
Фосфат может присоединяться в разные положения кольца пентоза (в рибонуклеотидах — в положениях 2', 3', 5', в дезоксирнбонуклеотидах —- в положения 3', 5'). Имеющиеся в клетке свободные нуклеотиды содержат фосфатную группу в' положении 5'. Нуклеознд-5'-фосфаты участвуют в биологическом синтезе; нуклеиновых кислот и образуются при их распаде. Поскольку нуклеозид-5'-фосфаты, или мононуклеотиды, являются производными соответствующих куклеозидов, то различают те же главные и редкие рибомононуклеотиды и дезоксирибомононуклеотнды. Удлинение фосфатного конца мононуклеотида за счет присоединения дополнительных фосфатов приводит к образованию нуклеозидполифосфатов:
Чаще всего в клетках встречаются нуклеозиддифосфаты и нуклеозидтрифосфаты.
Все нуклеозидфосфаты находятся в клетке в виде анионов, поэтому аденозинфосфаты правильнее обозначать АМФ2-, АДФ3-, АТФ*~. АДФ и АТФ являются макроэргическими, т. е. богатыми энергией, соединениями, химическая энергия которых используется организмом для различных функций. Остальные нуклеозидди- и трифосфаты также участвуют в реакциях синтеза биологических веществ.
Уникальны биохимические функции нуклеотидов. В качестве основных можно отметить следующие:
1) являются строительными блоками нуклеиновых кислот (ДНК и РНК); участвуют в молекулярных механизмах, с помощью которых генетическая информация хранится, реплицируется и транскрибируется;
2) выполняют важную роль в энергетическом (фосфорном) обмене, в аккумулировании и переносе энергии;
3) служат агонами (коферментами и активными простетическими группами) в окислительно-восстановительных ферментах;
4) играют важную роль в синтезе олиго- и полисахаридов, жиров. Таким образом, нуклеотиды — универсальные биомолекулы, играющие фундаментальную роль в обмене веществ и энергии живой клетки.
Применение АТФ в медпрактике:
Для медицинского применения выпускается раствор натрия аденозинтрифосфата 1 % для инъекций (Solutio Natrii adenosintriphosphatis 1 % рro injectionibus). Ранее относительно широко применяли АТФ при хронической коронарной недостаточности. Установлено, однако, что для ее проникновения через клеточные мембраны требуется большое количество энергии, что ставит под сомнение роль АТФ как источника энергии для обеспечения сократительной способности миокарда и улучшения в нем метаболических процессов. Основное применение натрия аденозинтрифосфат имеет в настоящее время в комплексной терапии мышечной дистрофии и атрофии, спазмах периферических сосудов (перемежающейся хромоте, болезни Рейно, облитерирующем тромбангиите). Иногда применяют для стимулирования родовой деятельности. В последние годы установлено, что АТФ может быть с успехом использован для купирования пароксизмов наджелудочковых тахикардий. Полагают, что действие обусловлено образующимся при распаде АТФ аденозином, подавляющим автоматизм синусно-предсердного узла и сердечных проводящих миоцитов (волокон Пуркинье). Частично эффект связан с блокадой мембранных кальциевых каналов, увеличением проницаемости мембран миокарда для ионов калия.
Билет 9
С химической точки зрения ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков — нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы и фосфатной группы. В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула спирализована. В целом структура молекулы ДНК получила название «двойной спирали».
В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин). Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином, гуанин — только с цитозином. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции, и принимают участие в биосинтезе белков (процессе трансляции). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции.
Дезоксирибонуклеиновая кислота (ДНК) представляет собойбиополимер (полианион), мономером которого являетсянуклеотид[5][6].
Каждый нуклеотид состоит из остатка фосфорной кислоты, присоединённого по 5'-положению к сахару дезоксирибозе, к которому также через гликозидную связь (C—N) по 1'-положению присоединено одно из четырёх азотистых оснований. Именно наличие характерного сахара и составляет одно из главных различий между ДНК и РНК, зафиксированное в названиях этих нуклеиновых кислот (в состав РНК входит сахар рибоза).
Исходя из структуры молекул, основания, входящие в состав нуклеотидов, разделяют на две группы: пурины (аденин [A] и гуанин [G]) образованы соединёнными пяти- и шестичленным гетероциклами; пиримидины (цитозин [C] и тимин [T]) — шестичленным гетероциклом[8].
Двойная спираль
В зависимости от концентрации ионов и нуклеотидного состава молекулы, двойная спираль ДНК в живых организмах существует в разных формах. Полимер ДНК обладает довольно сложной структурой. Нуклеотиды соединены между собой ковалентно в длинные полинуклеотидные цепи. Эти цепи в подавляющем большинстве случаев (кроме некоторых вирусов, обладающих одноцепочечными ДНК-геномами) попарно объединяются при помощи водородных связей во вторичную структуру, получившую название двойной спирали[3][7]. Остов каждой из цепей состоит из чередующихся фосфатов и сахаров[11]. Внутри одной цепи ДНК соседние нуклеотиды соединены фосфодиэфирными связями, которые формируются в результате взаимодействия между 3'-гидроксильной (3'—ОН) группой молекулы дезоксирибозы одного нукдеотида и 5'-фосфатной группой (5'—РО3) другого. Асимметричные концы цепи ДНК называются 3' (три прим) и 5' (пять прим). Полярность цепи играет важную роль при синтезе ДНК (удлинение цепи возможно только путём присоединения новых нуклеотидов к свободному 3'-концу).
Эти две длинные цепи закручены одна вокруг другой в виде двойной спирали, стабилизированной водородными связями, образующимися между обращёнными друг к другу азотистыми основаниями входящих в неё цепей. В природе эта спираль, чаще всего, правозакрученная. Направления от 3'-конца к 5'-концу в двух цепях, из которых состоит молекула ДНК, противоположны (цепи «антипараллельны» друг другу).
Образование связей между основаниями
Каждое основание на одной из цепей связывается с одним определённым основанием на второй цепи. Такое специфическое связывание называется комплементарным.Пурины комплементарны пиримидинам (то есть, способны к образованию водородных связей с ними): аденин образует связи только с тимином, а цитозин — с гуанином. В двойной спирали цепочки также связаны с помощью гидрофобных взаимодействий и стэкинга, которые не зависят от последовательности оснований ДНК[15].
Комплементарность двойной спирали означает, что информация, содержащаяся в одной цепи, содержится и в другой цепи. Обратимость и специфичность взаимодействий между комплементарными парами оснований важна для репликации ДНК и всех остальных функций ДНК в живых организмах.
Так как водородные связи нековалентны, они легко разрываются и восстанавливаются. Цепочки двойной спирали могут расходиться как замок-молния под действием ферментов (хеликазы) или при высокой температуре[16]. Разные пары оснований образуют разное количество водородных связей. АТ связаны двумя, ГЦ — тремя водородными связями, поэтому на разрыв ГЦ требуется больше энергии. Процент ГЦ пар и длина молекулы ДНК определяют количество энергии, необходимой для диссоциации цепей: длинные молекулы ДНК с большим содержанием ГЦ более тугоплавки[17].
правила Чаргаффа. Независимо от происхождения ДНК эти закономерности представляются следующим образом:
1) количество молекул аденина равно количеству молекул тимина (А = Т);
2) количество молекул гуанина равно количеству молекул цитози-на (G = С);
3) количество молекул пуриновых оснований равно количеству молекул пиримидиновых оснований (А + G = Т + С);
4) количество оснований с 6-аминогруппами в цепях ДНК равно количеству оснований с 6-гидроксигруппами (А + С = G + Т);
5) отношение (G+C)/(A+T) резко отличается для разных видов ДНК, но постоянно для клетки одного вида; это отношение называется фактором специфичности.
Фактор специфичности одинаков для ДНК различных органов и тканей одного организма и практически не отличается у разных видов животных и растений в пределах одного класса. У высших растений и животных его величина находится в пределах 0,55—0,93; у бактерий — 0,35—2,73. Правила Чаргаффа легли в основу открытия строения ДНК, ее вторичной структуры.
Физико-химические свойства ДНК
ДНК — довольно сильная многоосновная кислота, полностью ионизированная при рН 4,0. Фосфатные группы расположены по периферии. Они прочно связывают ионы Са2+ и Mg2+, амины, гистоны — положительно заряженные белки. Устойчивость комплементарных пар оснований зависит от величины рН. Пары оснований наиболее устойчивы в интервале рН 4,0—11,0. За его пределами двухцепочечная спираль ДНК теряет устойчивость и раскручивается.
Молекулярная масса ДНК неодинакова и зависит от источника ее получения,. Однако истинная молекулярная масса ДНК животных и растений, определенная по вязкости и по длине молекул, значительно выше и достигает десятков миллиардов.
У большинства вирусов ДНК представляет собой двойную спираль, линейную или замкнутую в кольцо. У некоторых вирусов она представляет собой одну полинуклеотидную цепь, замкнутую в кольцо и имеющую сравнительно небольшую молекулярную массу — 2*106. ДНК сравнительно легко деполимеризуется под действием некоторых химических соединений, ультразвука, ионизирующей и ультрафиолетовой радиации. Нагревание растворов ДНК до температур 70—80 °С, а также их подщелачивание вызывают денатурацию ДНК, заключающуюся в плавлении двойной спирали (разрушение водородных связей и гидрофобных взаимодействий), и расхождение полинуклеотидных цепей. Денатурация сопровождается понижением вязкости раствора, повышением поглощения в ультрафиолетовой области, увеличением отрицательного удельного вращения плоскости поляризации света, увеличением плавучей плотности образцов ДНК. Возрастание светопоглощения света при 260 нм называется гипохромным эффектом; это важнейший критерий денатурации ДНК, по которому можно контролировать этот процесс.
нативные ДНК денатурируют в узком интервале температур (-10 °С), поэто-му тепловую денатурацию часто называют плавлением. Температура плавления тем выше, чем больше в молекуле ДНК GC-nap; этот показатель может использоваться для определения нуклеотидного состава ДНК. Установлено, что температура плавления линейно связана с составом ДНК: ее повышение на 1° соответствует 2,5 молярных % GC-nap. При быстром охлаждении после тепловой денатурации ДНК не восстанавливает своих нативных свойств; однако при медленном охлаждении происходит ренатурация молекул ДНК.
Биологические функции ДНК
Важнейшая биологическая функция ДНК — генетическая, т.е. хранение и передача наследуемых признаков. Сейчас многочисленными экспериментами установлено, что ДНК — основной компонент клеточных органелл-хромосом. Трансформирующаяся ДНК включается ковалентно в ДНК невирулентной клетки (клетки-реципиента) и, таким образом, реплицируется вместе с хромосомой реципиента; свойство вирулентности наследуется. В то же время возможность передачи генетической информации бактериальным клеткам в результате введения РНК или белка не получила экспериментального подтверждения.
Билет 10
Рибонуклеи́новые кисло́ты (РНК) — одна из трех основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов.
РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.
Клеточные РНК образуются в ходе процесса, называемого транскрипцией, то есть синтеза РНК на матрице ДНК, осуществляемого специальными ферментами — РНК-полимеразами. Затем матричные РНК (мРНК) принимают участие в процессе, называемомтрансляцией. Трансляция — это синтез белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК.
Нуклеотиды РНК состоят из сахара — рибозы, к которой в положении 1' присоединено одно из оснований: аденин, гуанин,цитозин или урацил. Фосфатная группа соединяет рибозы в цепочку, образуя связи с 3' атомом углерода одной рибозы и в 5' положении другой. Фосфатные группы при физиологическом рН отрицательно заряжены, поэтому РНК — полианион. РНК транскрибируется как полимер четырёх оснований (аденина (A), гуанина (G), урацила (U) и цитозина (C), но в «зрелой» РНК есть много модифицированных оснований и сахаров[11]. Всего в РНК насчитывается около 100 разных видов модифицированных нуклеотидов, из которых 2'-О-метилрибоза наиболее частая модификация сахара, а псевдоуридин — наиболее часто встречающееся модифицированное основание[12]. У псевдоуридина (Ψ) связь между урацилом и рибозой не C — N, а C — C, этот нуклеотид встречается в разных положениях в молекулах РНК. В частности, псевдоуридин важен для функционированиятРНК[13]. Другое заслуживающее внимания модифицированное основание — гипоксантин, деаминированный гуанин, нуклеозидкоторого носит название инозина. Инозин играет важную роль в обеспечении вырожденности генетического кода. Роль многих других модификаций не до конца изучена, но в рибосомальной РНК многие пост-транскрипционные модификации находятся в важных для функционирования рибосомы участках. Например, на одном из рибонуклеотидов, участвующем в образовании пептидной связи[14].
Структура
Азотистые основания в составе РНК могут образовывать водородные связи между цитозином и гуанином, аденином и урацилом, а также между гуанином и урацилом[15]. Однако возможны и другие взаимодействия, например, несколько аденинов могут образовывать петлю, или петля, состоящая из четырёх нуклеотидов, в которой есть пара оснований аденин — гуанин[16].
Важная структурная особенность РНК, отличающая её от ДНК — наличие гидроксильной группы в 2' положении рибозы, которая позволяет молекуле РНК существовать в А, а не В-конформации, наиболее часто наблюдаемой у ДНК[17]. У А-формы глубокая и узкая большая бороздка и неглубокая и широкая малая бороздка[18]. Второе последствие наличия 2' гидроксильной группы состоит в том, что конформационно пластичные, то есть не принимающие участие в образовании двойной спирали, участки молекулы РНК могут химически атаковать другие фосфатные связи и их расщеплять[19].
Вторичная структура РНК-компонентателомеразы простейших
«Рабочая» форма одноцепочечной молекулы РНК, как и у белков, часто обладает третичной структурой. Третичная структура образуется на основе элементов вторичной структуры, образуемой с помощью водородных связей внутри одной молекулы. Различают несколько типов элементов вторичной структуры — стебель-петли, петли и псевдоузлы
Многие типы РНК, например, рРНК и мяРНК в клетке функционируют в виде комплексов с белками, которые ассоциируют с молекулами РНК после их синтеза или (у эукариот) экспорта из ядра в цитоплазму. Такие РНК-белковые комплексы называются рибонуклеопротеиновыми комплексами или рибонуклеопротеидами.
Рибосомная РНК. Она входит в состав клеточных органелл — рибосом. Биохимическая функция рРНК пока до конца не изучена. Предполагается, что она выполняет роль молекулярного каркаса, на котором крепятся участники процесса трансляции; рРНК имеет большую молекулярную массу (до 2406), характеризуется метаболической стабильностью.
Предполагается, что в белоксинтезирующей системе клетки функция рРНК не исчерпывается ролью структурного компонента. У прокариотов обнаружено, что в рРНК имеются небольшие участки, комплементарные участкам мРНК. Спаривание этих участков, видимо, способствует первоначальному связыванию мРНК с рибосомой. Не исключено, что некоторые участки рРНК играют определенную роль в формировании пептидтрансферазного центра рибосомы, ответственного за образование пептидных связей при синтезе белка.
Транспортные РНК. Это низкомолекулярные нуклеиновые кислоты; молекулярная масса колеблется в пределах 23 000—30 000, каждой из 20 белковых аминокислот соответствует, по крайней мере, одна тРНК.
отличаются сравнительно невысокими значениями молекулярных масс (17000—35000), локализованы в гиалоплазме клетки, ядерном соке, бесструктурной части хлоропластов и митохондрий. они осуществляют кодирование аминокислот и перенос их в рибосомальный аппарат клетки в процессе биосинтеза белков.
Матричная РНК составляет незначительную часть (3—10 %) всех клеточных РНК; молекулярная масса колеблется в широких пределах и доходит до 14-Ю6. Она программирует синтез всех клеточных белков цитоплазмы. В рибосомах играет матричную функцию: участие в процессе сборки полипептидных цепей.
Билет 11
ФОСФОПРОТЕИНЫ
К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1%; вителлин, вителлинин и фосвитин,выделенные из желтка куриного яйца; овальбумин, открытый в белке куриного яйца; ихтулин, содержащийся в икре рыб, и др. Большое количество фосфопротеинов содержится в клетках ЦНС. Фосфопротеины занимают особое положение в биохимии фосфорсодержащих соединений не только в результате своеобразия структурной организации, но и вследствие широкого диапазона функций в метаболизме. Характерной особенностью структуры фосфопротеинов является то, что фосфорная кислота оказывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата.Новые данные свидетельствуют о том, что в клетках фосфопротеины синтезируются в результате посттрансляционной модификации, подвергаясь фосфорилированию при участии протеинкиназ. Здесь лишь укажем на существенную роль специфической протеинкиназы, катализирующей фосфорилирование ОН-группы тирозина, в биосинтезе онкобелков. Таким образом, уровень фосфопротеинов в клетке зависит в значительной степени от регулирующего действия ферментов, катализирующих фосфорилирование (протеинкиназы) и дефосфорилирование (протеинфосфатазы). Следует отметить, что фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала в процессе эмбриогенеза и дальнейшего постнатального роста и развития организма.Особо следует отметить, что некоторые ключевые ферменты, регулирующие процессы внутриклеточного обмена веществ, также существуют как в фосфорилированной, так и в дефосфорилированной форме. Этим подчеркивается значение фосфорилирования–дефосфорилирования в процессах химической модификации макромолекул, участвующих в интегральных процессах метаболизма. Фосфопротеины – эти белки содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала в процессе роста и развития зародышей и молодого растущего организма. Наиболее изучены фосфопротеины – казеин молока, вителлин яичного желтка, ихтулин икры рыб. Металлопротеины наряду с белком содержат ионы какого-либо металла или нескольких металлов. Металлопротеины выполняют различные функции. Например, белок трансферрин (содержит железо) служит физиологическим переносчиком железа в организме. Другие металлопротеины являются биологическими катализаторами-ферментами – амилазы (содержат Са2+) гидролизуют крахмал, карбоангидроза (Zn2+) расщепляет угольную кислоту, аскорбинотоксидаза (Cu2+) разрушает витамин С и т.д.
Билет 12
По биохимическим функциям гемпротеиды делятся на неферментные (гемоглобин, миоглобин и др.) и ферментные (цитохромы, каталаза, пероксидаза и др.). Небелковая часть гемпротендов — гем является металлопорфириновым комплексом. Порфирин имеет много изомеров в зависимости от положения заместителей в макроцикле. Один нз его изомеров - протопорфирин IX— имеет в положениях 1, 3, 5, 8 метильные группы, в положениях 2 и 4 — ви-нильные и в положениях 6 и 7 — пропионнльные:
Комплекс протопорфирнна IX с Fe2+" называется протогем или просто гем, а с Fe3"1" — гемин. Координационное число для железа равно шести. В теме железо связано двумя ковалентными связями с атомами азота двух пнррольных колец и двумя координационными связями с атомами азота остальных пиррольных колец. Из двух неиспользованных координационных связей одна идет на соединение с белком, а вторая — на соединение с различными лигандамн (физиологическими — кислород, вода и чужеродными — диоксид углерода, цианид и т. д.)..
Кроме наиболее распространенного гема IX имеются и другие разновидности гемов: гем а, имеющий формильную группу в положении 8, гидрокси-алкильную в положении 2 и алкилвинильную в положении 4; гем с, в котором-с винильными группами в положениях 2 и 4 связаны остатки цистеина. Гем d представляет собой железодигндропорфирин. Один из вариантов гема входит в разные гемпротеиды, которым он придает красную окраску,
Гемоглобин. Гемоглобин имеет четвертичную структуру. Молекулярная масса его 66 ООО—68 ООО. Как следует из названия, гемоглобин представляет собой соединение гема с белком глобином. Глобин имеет четыре субъединицы, или полипептидные цепи. Каждая из полипептидных цепей, или субъединиц, обозначается буквами. У гемоглобина взрослого человека (НЬА) эти цепи называются альфа (а) и бета (р). Каждая молекула НЬА содержит по две а- и (1-це-пн. Они различаются первичной структурой-и длиной' полипептидной цепи: а-цепи содержат по 141 аминокислотному остатку, {J-цепи — по (46. Вторичные; структуры их представлены в виде спиральных сегментов различной длины, соединенных неспиральными участками. В а-цепях семь спиральных сегментов; в р-цепях восемь. Спиральные сегменты обозначаются латинскими буквами (А, В, С, D, E,,F, G, Н). Третичные структуры а- и Ргцепей очень сходны. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Гем прочно удерживается в этом «кармане» благодаря ван-дер-ваальсовым связям между неполярными участками гема и гидрофобными радикалами аминокислот (этих связей около 60). Остатки пропионовой кислоты гема образуют одну-дзе дополнительные ионные связи с белком. Однако глобин связан не только с порфнриновым кольцом гема, но и с атомом железа. Железо связывается с имидазольным радикалом гистидина. Это пятая координационная связь Fe с азотом бокового радикала гистидина (четыре связи Fe затрачиваются на соединение с пнррольными кольцами протопорфирина IX). Шестая координационная связь Fe свободна и используется для связывания кислорода или других лнгандов (рис. 14).
Белковая часть молекулы гемоглобина влияет на свойства гема и наоборот. Четвертичная структура гемоглобина похожа на тетраэдр.
Функция гемоглобина. Основная функция гемоглобина состоит в связывании кислорода и переносе его от легких к тканям. В каждом эритроците около 400 млн. молекул гемоглобина, каждая из которых способна связать четыре молекулы Оа, т. е. по одной на субъединнцу. Гемоглобин, связанный с кислородом, называется оксигемоглобин.
Миоглобин имеет третичную структуру и представляет собой одну цепь гемоглобина. В отличие от гемоглобина он в пять раз быстрее связывает кислород. Кривая насыщения его кислородом имеет вид гиперболы. В этом кроется большой биологический смысл, поскольку миоглобин находится в глубине мышечной ткани (где низкое парциальное давление кислорода). Жадно связывая кислород, миоглобин создает кислородный резерв, который расходуется по мере необходимости, восполняя временную нехватку кислорода. Миоглобин — хромопротеид, содержащийся в мышцах. Миоглобин создает запасы кис лорода в мышцах, где его количество может достичь 14% всего кислорода организма. Это имеет важное значение, особенно для работы мышцы сердца
Билет 13
Ферменты —- биологические катализаторы белковой природы.
Ферментам присущи все особенности структурной организации белков. Они имеют четыре уровня организации: первичный, вторичный, третичный и четвертичный. Ферменты с четвертичной структурой, а их большинство, состоят из протомеров (субъединиц). Как и другие функциональные белки, они делятся на простые (ферменты-протеины) и сложные (ферменты-протеиды). Сложные ферменты состоят из белковой масти — апоферхента, и небелковой — кофактора. Кофакторы ферментов — ионы металлов и кофермепты Последние являются небольшими органическими молекулами, строение которых рассмотрено ниже. Алофермент и кофакторы порознь малоактивны или вообще неактивны как катализаторы; объединение их вместе дает активную молекулу фермента, которая называется полным ферментом или холофер-ментом.
Функциональная организация фермента. В трехмерной структуре простого и сложного фермента различают ряд участков, несущих определенную функцию В молекуле фермента различают активный центр А, т. е. место в пространственной структуре фермента, с которым связывается субстрат S (вещество, которое превращается под действием фермента). В состав активного центра сложного фермента входят кофакторы. Число активных центров в олнгомериых ферментах (имеющих четвертичную етрук-туру) может быть равно числу субъединиц — по одному центру на субъединицу. Иногда две субъединнцы фермента участвуют в образовании функционально-способного активного центра.
Кроме активного центра у ферментов имеется регуляторный, или аллостерический, центр , который в молекуле фермента пространственно разделен с активным центром. Аллостерическнм (от греч. alios — иной, чужой) он называется потому, что молекулы, связывающиеся с этим центром, по строению (стермчески) не похожи на субстрат, но оказывают влияние на связывание и превращение субстрата в активном центре, изменяя его конфигурацию. Молекула фермента может иметь несколько аллостерических центров. Вещества, связывающиеся с аллостерическим центром, называют алло-стеринескими эффекторами. Они влияют через аллостерический центр на функцию активного центра: или облегчают ее, или затрудняют. Соответственно аллостерические эффекторы называются положительными (активаторы) или отрицательными (ингибиторы).
Ферменты:
1. Они катализируют только энергетически возможные реакции 2 Они никогда не изменяют направления реакции.
3. Они ие изменяют равновесия обратимой реакции, а лишь ускоряют кто наступление
4. Они нь расходуются в псоцессе реакции. Поатом> фермент в клетке работает до тех нор, покэ но каким-либо причинам не разрушится
Однако ферменты обладают и особыми качествами, отличающими их от небиологических катализаторов. Эти отличия связаны с особенностями строения ферментов, являющихся сложными белковыми молекулами.
1. Скорость ферментативного катализа намного выше, чем небиологического. Из этого следует, что ферменты сильнее снижают энергию активации реакции, чем небиологические катализаторы.
2. Ферменты обладают высокой специфичностью. Есть ферменты, действующие только на один из стереоизомеров вещества, тогда как платина, например, используется в качестве катализатора при самых разнообразных реакциях. Высокая специфичность позволяет ферментам направлять обмен веществ в строгое русло.
3. Ферменты катализируют химические реакции в «мягких» условиях, т. е. прн обычном давлении, невысокой температуре (около 37°С) и рН среды, близком к нейтральной. Это отличает их от других катализаторов, действующих при больших давлениях, крайних значениях рН и высокой температуре.
Ферменты из-за белкового строения весьма чувствительны к изменениям температуры, т. е. термолабильны, и к сдвигам рН среды.
4. Ферменты являются катализаторами с регулируемой активностью, чего нельзя сказать о не биологических катализаторах. Это уникальное свойство ферментов позволяет изменять скорость превращения веществ в организме в зависимости от условий среды, т. е. приспосабливаться к действию различных факторов.
5. Скорость ферментативной'реакции прямо пропорциональна количеству фермента, тогда как для небиологического катализа не существует строгой зависимости скорости реакции от количества катализатора. Поэтому недостаток фермента в живом организме означает низкую скорость превращения вещества и, наоборот, одним из путей приспособления клеток организма является образование дополнительных количеств фермента.
Классификация ферментов. Все ферменты разделены на шесть классов, каждый из которых имеет строго определенный номер: 1) оксидоредуктазы, 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (син-■тетазы).
Зависимость скорости реакции от рН среды. для каждого фермента существует свой оптимум рН, прн котором скорость катализируемой им реакции максимальна. Отклонение рН в ту или другую сторону ведет к снижению скорости ферментативной реакции. Оптимум рН у разных ферментов неодинаков. Однако большая часть ферментов клеток имеет оптимум рН, близкий к нейтральному, т. е. совпадающий с физиологическими значениями рН.
Зависимость скорости ферментативной реакции от рН главным образом свидетельствует о состоянии функциональных групп активного центра фермента. Изменение рН среды влияет на ионизацию кислых и основных групп аминокислотных остатков активного центра, которые участвуют или в связывании субстрата (в контактном участке), или в его превращении (в каталитическом участке). Поэтому специфическое влияние рН может быть вызвано или изменением сродства субстрата к ферменту, или изменением каталитической активности фермента, или обеими причинами вместе.
Большинство субстратов имеют кислотные или основные группы, поэтому рН влияет на степень ионизации субстрата. Фермент предпочтительно связывается или с ионизированной, или с неконизированной формой субстрата. Очевидно, при оптимальном пН и функциональные группы активного центра находятся в наиболее реакцнонноспособном состоянии, и субстрат находится в форме, предпочтительной для связывания этими группами фермента.
Зависимость скорости ферментативной реакции от температуры. С повышением температуры среды скорость ферментативной реакции увеличивается, достигая максимума при какой-то оптимальной температуре, а затем падает до нуля (рис. 25). Для химических реакций существует правило, что при повышении температуры на 10°С скорость реакции увеличивается в два-три раза. Термолабильность ферментов связана с их белковым строением. Некоторые ферменты денатурируют уже при температуре около 40°С, но основная часть их инактивируется при температурах выше 40—50°С. Отдельные ферменты инактивирует холод, т. е. при температурах, близких к 0°С, наступает денатурация.
Билет 14
Структура активного центра. В активном центре различают контактный, или якорный, участок, связывающий субстрат, и каталитический участок, где происходит превращение субстрата после его связывания. Однако 'это деление весьма условно, поскольку связывание субстрата в контактном участке влияет на специфичность и скорость превращения его в каталитическом участке.
Обычно активный центр фермента образ уют 12—16 аминокислотных остатков полипептидной цепи. Иногда их число больше. Аминокислоты, формирующие активный центр, находятся в разных местах полипептидной цепи, нередко на противоположных концах. При пространственной укладке они сближаются и образуют активный центр. Остальные аминокислотные остатки полипептидной цепи фермента обеспечивают правильную пространственную конфигурацию активного центра и влияют на реакционную способность его групп.
Аминокислотные остатки, находящиеся рядом с активным центром и влияющие на реакционную способность его групп, принято называть вспомогательными группами. Более отдаленные аминокислотные остатки, влияющие на конформацию всей молекулы фермента, называются способствующими группами. Примерно —2/з аминокислот ферментного белка участвуют прямо или косвенно в работе активного центра.
Функциональные группы активного центра ферментов. У простых ферментов роль функциональных групп контактного и каталитического участков активного центра выполняют только боковые радикалы аминокислот. У сложных ферментов главную роль в этих процессах выполняют кофакторы.
Механизм действия ферментов
Сложная структурная и функциональная организация ферментов отчасти является ключом к пониманию характерных свойств ферментов — высокой специфичности и скорости катализа, не достижимой для неферментных катализаторов.
Большую роль в развитии представлений о механизме действия ферментов сыграли классические работы Михаэлиса и Ментен, развивших положение о фермент-субстратных комплексах. Согласно представлениям Михаэлиса — Ментен весь процесс ферментативного катализа можно условно разделить на три стадии, каждая из которых имеет свои особенности.
ч1. Диффузия субстрата к ферменту и стерическое связывание его с активным центром фермента (образование фермент-субстратного комплекса
2. Преобразование первичного фермент-субстратного комплекса в один илн несколько активированных фермент-субстратных комплексов (обозначенных в уравнении ES* и ES**).
3. Отделение продуктов реакции от активного центра фермента и диффузия их в окружающую среду (комплекс ЕР диссоциирует на Е н Р).
Первая стадия, обычно непродолжительная по времени, зависит от концентрации субстрата в среде и скорости его диффузии к активному центру фермента. Образование комплекса ES происходит практически мгновенно. На этой стадии изменение энергии активации незначительно. Ориентация субстратов в активном центре фермента благоприятствует их сближению и прохождению реакции.
Вторая стадия наиболее медленная, и длительное |ь ее зависит от энергии активации данной химической реакции. На этой стадии происходит расшатывание связей субстрата, их разрыв или образование новых связей в результате взаимодействия каталитических групп фермента. Именно "благодаря образованию активированных переходных комплексов снижается энергия активации субстрата. Вторая стадия лимитирует скорость всего катализа.
Третья стадия непродолжительна, как и первая. Она определяется скоростью диффузии продуктов реакции в окружающую среду.
Молекулярные механизмы действия ферментов еще во многом неясны. Среди изученных механизмов действия ферментов можно отметить следующие:
1) эффект ориентации реагентов (сближения);
2) эффект деформации субстрата (напряжения, изгиба, натяжения);
3) кислотно-основной катализ;
4) ковалентный катализ.
Эффект ориентации реагентов — очень характерное свойство ферментов, позволяющее ускорить превращение (повысить реакционную способность субстратов) в тысячи или десятки тысяч раз. Контактные участки активного центра фермента специфически связывают субстраты и обеспечивают их взаимную ориентацию и сближение так, чтобы это было выгодно для действия каталитических групп. Такая взаимная ориентация двух и более молекул, невозможная при беспорядочных соударениях в водной среде и на поверхности неорганического катализатора, способствует увеличению скорости реакции. Упорядоченное расположение субстратов приводит к снижению энтропии, а значит, способствует снижению энергии активации.
Эффект деформации субстрата (или так называемая теория «дыбы») хорошо объясняет действие гндролаз, лиаз и некоторых трансфераз. До присоединения к ферменту субстрат имеет «расслабленную» конфигурацию. После связывания с активным центром молекула субстрата как бы растягивается («напряженная», или «деформированная», конфигурация). Чем больше длина межатомной связи в субстрате, тем меньше энергия ее разрыва (т. е. снижается энергия активации). Места деформации (растяжения) легче атакуются, например молекулами воды.
Кислотно-основной катализ. Особенность активного центра фермента в отличие от других катализаторов состоит в том, что в нем имеются функциональные группы аминокислотных остатков, которые проявляют свойства как кислоты, так и основания. Поэтому фермент проявляет в ходе каталитического акта кислотно-основные свойства, т. е. играет роль и акцептора, и донора протонов, что невозможно для обычных катализаторов. При закреплении субстрата в активном центре на его молекулу влияют электрофильные и нуклеофильные группы каталитического участка, что вызывает перераспределение электронной плотности на участках субстрата, атакуемого кислотно-основными группами. Это облегчает перестройку и разрыв связей в молекуле субстрата. Ярко выраженной способностью к кислотно-основному катализу обладают ферменты, в каталитическом центре которых имеется гистидин. Гистидин обладает отчетливыми кислотно-основнымн свойствами. При блокировании гистидина фермент инактивируется. Кислотно-основной катализ характерен для гидролаз, лиаз, изомераз. Он часто сочетается с ковалентным катализом.
Ковалентный катализ наблюдается у ферментов, которые образуют ковалентные связи между каталитическими группами активного центра н субстратом. Ковалентные фермент-субстратные промежуточные продукты очень неустойчивы и легко распадаются, освобождая продукты реакции. Для большинства ферментов характерно сочетание описанных механизмов, что обеспечивает их высокую каталитическую активность.
Билет 15
Регуляция активности ферментов
Ферменты, как уже говорилось, относятся к катализаторам с регулируемой активностью. Поэтому через ферменты можно контролировать скорость протекающих химических реакций в организме. Регуляция активности ферментов может осуществляться путем взаимодействия с ними различных биологических компонентов или чужеродных соединений (например, лекарств н ядов), которые принято называть модификаторами или регуляторами ферментов. Под действием модификаторов на фермент реакция может ускоряться (в этом случае их называют активаторами) или замедляться (в этом случае их называют ингибиторами).
Активация ферментов
Активация ферментов определяется но ускорению биохимических реакций, наступающему после действия модификатора. Одну группу активаторов составляют вещества, влияющие на область активного центра фермента. К ним относятся кофакторы ферментов и субстраты. Кофакторы (ионы металлов и коферменты) являются не только обязательными структурными элементами сложных ферментов, но и по существу их активаторами.
Ионы металлов бывают довольно специфичными активаторами. Часто для некоторых ферментов требуются ионы не одного, а нескольких металлов .Активация с помощью ионов металлов осуществляется по разным механизмам, В некоторых ферментах они входят в состав каталитического участка. Б ряде случаев ноны металлов облегчают связывание субстрата с активным центром фермента, образуя как бы своеобразный мостик. Нередко металл соединяется не с ферментом, а с субстратом, образуя металлосубстратный комплекс, который предпочтителен для действия фермента.
Субстрат тоже в известных пределах концентраций является активатором. После достижения насыщающих концентраций субстрата активность фермента не возрастает. Субстрат повышает стабильность фермента и облегчает формирование нужной конформации активного центра фермента. ,
Ионы металлов, коферменты и нх предшественники и активные аналоги, субстраты можно использовать на практике как препараты, активирующие ферменты.
Активация некоторых ферментов может осуществляться путем модификации, не затрагивающей активный центр их молекул. Возможно несколько вариантов такой модификации: 1) активация неактивного предшественника — профермента, или зимогена; 2) активация путем присоединения какой-либо специфической модифицирующей группы к молекуле фермента; 3) активация путем диссоциации неактивного комплекса белок — активный фермент.
Ингибирование ферментов
Ингибиторы представляют большой интерес для понимания механизма ферментативного катализа. Применение различных веществ, связывающих функциональные группы контактного и каталитического участков активного центра фермента, может прояснить значение тех или иных групп, участвующих в катализе. Ингибиторы позволяют понять не только суть ферментативного катализа, но и являются своеобразным инструментом для исследования роли отдельных химических реакций, которые с помощью ингибитора данного фермента можно специфически выключать. Ингибиторы характеризуются прежде всего таким общим признаком, как прочность связывания с ферментом. По этому признаку ингибиторы делятся на две группы: обратимые и необратимые. Отнести ингибитор к одной из двух групп позволяет критерий восстановления активности фермента после диализа или сильного разведения раствора фермента с ингибитором. Необратимые ингибиторы прочно связываются с ферментом, и после этих процедур активность фермента не восстанавливается. Наоборот, комплекс фермент — обратимый ингибитор непрочен и быстро диссоциирует. Активность фермента при этом восстанавливается.
По механизму действия ингибиторы ферментов делятся на следующие основные типы:1)конкурентные,2)неконкурентные, 4)субстратные,5)аллостерические.
Конкурентным ингибированием называется торможение ферментативной реакции,вызванное связыванием с активным центром фермента ингибитора,сходного по структуре с субстратом и препятствующего образованию фермент- субстратного комплекса.При конкурентном торможении ингибитор и субстрат конкурируют за активный центр фермента.С активным центром связывается то соединение,молекул которого больше.Ингибирование наступает вследствие того,субстратоподобный ингибитор связывает часть молекул фермента,которые уже не способны связать ферментно-субстратный комплекс.снять торможение можно избытком субстрата,вытесняющего ингибитор из активных центров ферментных молекул,тем самым возвращая их способность к катализу.
Неконкурентным иигибированнем ферментов называется торможение, связанное с влиянием ингибитора на каталитическое превращение, но не на связывание субстрата с ферментом. Неконкурентный ингибитор или связывается непосредственно с каталитическими группами активного центра фермента,'или, связываясь с ферментом вне активного центра, изменяет конфор- мацию активного центра таким образом, что затрагивает структуру каталитического участка, мешая взаимодействию с ннм субстрата.
Неконкурентными ингибиторами являются, например, цианиды,. Снять действие неконкурентного ингибитора избытком субстрата (как действие конкурентного) нельзя, а можно лишь веществами, связывающими ингибитор Эти вещества называют реактиваторами.
Субстратным ингибированием называется торможение ферментативной реакции, вызванное избытком субстрата. Такое ингибирование происходит вследствие образования фермент-субстратного комплекса, не способного подвергаться каталитическим превращениям. Схематически пример субстратного торможения показан на рис. 28. Комплекс ES2 непродуктивный и делает молекулу фермента неактивной. Субстратное торможение вызвано избытком субстрата, поэтому снимается при снижении его концентрации.
Аллостерическая регуляция характерна только для особой группы ферментов с четвертичной структурой, имеющих регуляторные центры для связывания аллостерических эффекторов. Отрицательные эффекторы, которые тормозят превращение субстрата в активном центре фермента, выступают в роли аллостерических ингибиторов. Положительные аллостерические эффекторы, напротив, ускоряют ферментативную реакцию, и поэтому их относят к аллостерическим активаторам. Аллостерическими эффекторами ферментов наиболее часто выступают различные метаболиты, а также гормоны, ионы металлов, коферменты. В редких случаях роль аллостерического эффектора ферментов выполняют молекулы субстрата.
Механизм действия аллостерических ингибиторов на фермент заключается в изменении конформации активного центра.
Билет 16
В медицине ферменты имеют диагностическое значение — определение отдельных ферментов в клинике помогает распознаванию природы заболевания. Их используют для замещения недостающего фермента в организме или для разложения какого-либо субстрата, с избыточным содержанием которого связывают признаки заболевания. Наиболее часто в клинике применяют пищеварительные ферменты (пепсин, трипсин и т. д.).
С помощью иммобилизованных ферментов осуществляется промышленный синтез ряда гормональных препаратов на фармацевтических предприятиях, разработаны высокочувствительные методы анализа лекарств, экспресс-анализ биологических компонентов и многое другое. Протеолитические ферменты (трипсин, химотряпсин), иммобилизованные на марлевых салфетках, тампонах, применяют в хирургической практике для очищения гнойных ран, омертвевших тканей, основанного на ферментативном разложении белков погибших клеток в гнойных ранах. Иммобилизованные и растворимые ферменты становится одним из самых распространенных лекарств биологическогоо происхождения.

Во-первых, ингибиторы могут дать ценную информацию о химической природе активного центра фермента, а также о составе его функциональных групп и природе химических связей, обеспечивающих образование фермент-субстратного комплекса. Известны вещества, включая лекарственные препараты, специфически связывающие ту или иную функциональную группу в молекуле фермента, выключая ее из химической реакции.
Во-вторых, ингибиторы нашли широкое применение в энзимологии при исследовании природы множественных форм ферментов и изоферментов, различающихся не столько электрофоретической подвижностью, сколько различной чувствительностью к одному и тому же ингибитору. При помощи ингибиторов, выключающих отдельные стадии многоступенчатого метаболического процесса, могут быть точно установлены не только последовательность химических реакций, но и природа участвующих в этих превращениях ферментов.Современная, так называемая рациональная, химиотерапия (направленное применение лекарственных препаратов в медицине) должна основываться на точном знании механизма действия лекарственных средств на биосинтез ферментов, на активность уже синтезированных ферментов или на регуляцию их активности в организме. Иногда для лечения некоторых болезней используют избирательно действующие ингибиторы. Так, ингибитор ряда протеиназ (трипсина, химотрипсина и калликреина) трасилол широко применяется для лечения острого панкреатита – болезни, при которой уровень трипсина и химотрипсина в крови резко возрастает. Знание избирательного ингибиторного действия некоторых природных и синте-тических соединений (так называемых антиметаболитов) на ферменты может служить методологической основой для разработки эффективных методов синтеза химиотерапевтических препаратов. Этот путь открывает широкие возможности для направленного воздействия на синтез ферментов в организме и регуляции интенсивности метаболизма при патологии.
Коферментыами являются витамины,следовательно рассказать о применении витаминов в медицине.
Билет 17
Анаэробные дегидрогеназы представляют собой специфические ферменты, катализирующие отщепление водорода от определенных химических веществ и передающие его другим ферментам — переносчикам водорода. Так, лактатдегидрогеназа катализирует реакцию окисления молочной кислоты до пировиноградной, изоцитратдегид-рогеназа — окисление изолимонной кислоты до щавелево-янтарной
Анаэробные дегидрогеназы – ферменты, катализирующие удаление водорода из субстрата, но не способные использовать кислород в качестве акцептора водорода Эти ферменты выполняют две главные функции: а) Перенос водорода с одного субстрата на другой в сопряженной окислительно-восстановительной реакции. Эти дегидрогеназы специфичны к субстратам, но часто используют один и тот же кофермент или переносчик водорода. б) Функцию компонентов дыхательной цепи, обеспечивающих транспорт электоронов от субстрата на кислород. Среди анаэробных дегидрогеназ различают дегидрогеназы, зависимые от никотинамидных коферментов, рибофлавиновые дегидрогеназы, цитохромы. NAD-зависимые дегидрогеназы катализируют окислительно-восстановительные реакции окислительных путей метаболизма – гликолиза, цикла лимонной кислоты, дыхательной цепи митохондрий. NADP-зависимые дегидрогеназы участвуют в процессах восстановительного синтеза, в частности, во внемитохондриальном синтезе жирных кислот и стероидов; они также являются коферментами дегидрогеназ пентозофосфатного пути. Большинство раибофлавин-зависимых аэробных дегидрогеназ либо участвуют в транспорте электронов по дыхательной цепи, либо поставляют электроны для этой цепи. NADН-дегидрогеназа – компонент дыхательной цепи, переносящий электроны от NADH к более электроположительным компонентам. Другие дегидрогеназы, например, сукцинатдегидрогеназа, ацил-СоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа, переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь. Цитохромы служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b5 ), в растительных клетках, бактериях и дрожжах.
1. оксндоредуктазы. к классу оксидоредуктаз относят ферменты, катализирующие реакции окисления—восстановления
окисление протекает как процесс отнятия атомов н (электронов) от субстрата, а восстановление—как присоединение атомов н (электронов) к акцептору.
характерной особенностью деятельности оксидоредуктаз в живой клетке является их способность образовывать системы (так называемые цепи окислительно-восстановительных ферментов), в которых осуществляется многоступенчатый перенос атомов водорода или электронов от первичного субстрата к конечному акцептору, которым является, как правило, кислород, так что в результате образуется вода.
оксндоредуктазы, переносящие атомы н и электроны от одного компонента окислительной цепи ферментов к другому без передачи их на кислородные атомы называют анаэробными дегидрогеназами или редуктазамн.
другая особенность оксидоредуктаз состоит в том, что, будучи двухкомпонентными ферментами с весьма ограниченным набором активных групп (коферментов), они способны ускорять большое число самых разнообразных окислительно-восстановительных реакций. это достигается за счет того, что один и тот же кофермент способен соединяться со многими апоферментами, образуя каждый раз оксидоредуктазу, специфичную по отношению к тому или иному субстрату или акцептору.
еще одна, пожалуй, главная особенность оксидоредуктаз заключается в том, что они ускоряют протекание химических процессов, связанных с высвобождением энергии. Последняя используется как для обеспечения синтетических процессов в организме, так и для других нужд.
В природных объектах обнаружено около пятисот индивидуальных оксидоредуктаз. Наиболее распространены оксидоредуктазы, содержащие в качестве активной группы никотинамидадениндинуклеотид, или НАД+ Более половины известных в настоящее время оксидоредуктаз содержат НАД* в качестве кофермента. Соединяясь с тем или иным специфическим белком и образуя таким образом двухкомпонентный фермент, который сокращенно называют пиридинпротеином, НАД+ резко усиливает свою способность восстанавливаться по ядру никотинамида. В результате пиридин-протеины способны отнимать от субстратов (спирты, альдегиды, дикарбо-новые и кетокислоты, амины и др.) атомы Н в виде гидрид-ионов (Н~) И протонов (Н+), окисляя, таким образом, указанные соединения. Все пири-динпротеины являются анаэробными дегидрогеназами, т.е. не передают снятые с субстрата атомы водорода на кислород, а посылают их на ближайший в окислительной цепи другой фермент.
Рассмотрим строение и механизм действия одного из пиридинпротеинов— алкогольдегидрогеназы из печени животных. Это белок с М = 73000, состоящий из двух субъединиц, каждая из которых несет молекулу НАД"1" и атом Zn. В процессе отнятия атомов Н от спирта образуется тройной апофермент-кофермент-субстратный комплекс, удерживаемый Zn2 Непосредственно к никотинамидадениндинуклеотиду от молекулы спирта переходит один атом водорода в виде гидридного иона (Н~), т.е. атома водорода, несущего дополнительный электрон. Второй атом водорода, отнимаемый от молекулы спирта, наоборот, теряет электрон, превращаясь в протон (Н+), и поступает в реакционную среду. Поэтому уравнение реакции окисления спирта при участии НАД+ записывают так:
в любом случае над+ получает два электрона за счет присоединения гид-ридного иона (н~).
кроме над+ пиридинферменты содержат в качестве кофермента иикоти-намидадешндтгуклеотвдфосфат (надф+). этот кофермент является производным над"1", у которого водород он-группы 2-го углеродного атома рибозы аденозина замещен на остаток фосфорной кислоты.
надф+, соединяясь со специфическими белками, образует большую группу пиридинпротеинов, характеризующуюся своим набором субстратов. механизм окисления при участии надф+ в качестве кофермента аналогичен таковому при посредстве над"1". более того, надн и надф+, равно как надфн и над+, при каталитическом участии специального фермента—трансгидрогеназы—способны обмениваться атомами водорода и электронами:
Билет 18
оксндоредуктазы, которые переносят атомы н или электроны непосредственно на кислородные атомы, носят название аэробных дегидрогеназ или оксидаз. Оксидазы катализируют реакции, окислителем которых является молекулярный кислород воздуха. Наиболее изученными из них являются глюкозооксидаза* пируватоксидаза, полифенолоксидаза, аскор-бинатоксидаза, оксидаза D* и L-аминокислот.
партнером восстановленных форм пиридинпротеинов в оксидоредуктазной цепи, как правило, служат флавопротеины (фп). таким флавопротеином, например, является фермент, несущий в качестве активной группы фосфорилированный витамин в2. окисленная форма этого флавопротеина (м = 52000) окрашена. каждая молекула фермента несет молекулу рибофлавинфосфата (или флавинмононуклеотида, фмн), способного принимать и отдавать два атома н по атомам n изоаллоксазинового кольца:
Другим коферментом в флавопротеинах является флавинадениидинуклео-тид(ФАД): '
ФМН и ФАД, соединяясь с различными апоферментами, дают начало приблизительно тридцати флавопротеинам, отличающимся различной специфичностью по отношению к субстратам.
Основная функция флавопротеинов—перенос электронов (атомов Н) от восстановленных пиридинпротеинов к другим компонентам окислительно-восстановительной цепи, т.е. ФП в большинстве случаев являются вторичными дегидрогеназами. Однако некоторые флавопротеины, особенно с ФАД в качестве кофермента, могут непосредственно снимать атом Н с субстрата.
Аэробные дегидрогеназы – ферменты, катализирующие удаление водорода из субстрата; в отличие от оксидаз они могут использовать в качестве акцептора водорода не только кислород, но и искусственные акцепторы, такие как метиленовый синий . Эти дегидрогеназы относятся к флавопротеинам, и продуктом катализируемой ими реакции является перекись водорода, а не вода. Аэробные дегидрогеназы содержат в качестве простетической группы флавинмононкулеотид (ФМН) или флавнадениндинуклеотид (ФАД). (ФМН) и (ФАД) образуются в организме из рибофлавина (витамин В2). Многие флавопротеиновые ферменты содержат один или несколько ионов металлов, выполняющих роль кофакторов; такие флавопротеиновые ферменты называют флавопротеинами. К ферментам группы аэробных дегидрогеназ относятся также дегидрогеназа L-аминокислот(ФМН-содержащий фермент), катализирующая окислительное дезаминирование природных L-аминокислот. Широко распространена ксантиндегидрогеназа (ксантиноксидаза), она обнаружена в молоке, тонком кишечнике, почках и печени. Ксантиндегидрогеназа содержит молибден; играет важную роль в превращении пуриновых оснований в мочевую кислоту и особое значение имеет в печени и в почках птиц, которые экскретируют мочевую кислоту как главный конечный азотофиксирующий продукт метаболизма пуринов, а также катаболизма белков и аминокислот. Альдегиддегидрогеназа – FAD-содержащий фермент, находящийся в печени млекопитающих. Это – металлофлавопротеин, содержащий молибден и негемовое железо, окисляющий альдегиды и N-гетероциклические субстраты. Глюкозооксидаза – FAD-специфичный фермент, получаемый из грибов; используется при определении глюкозы.
Флавиновые коферменты содержат витамин В2 - рибофлавин, который имеет желтый цвет, поэтому они были названы желтыми коферментами. Главными коферментами являются ФМН (флавинмононуклеотид) и ФАД(флавинадениндинуклеотид). Особенностью их структуры является то, что они содержат производное рибозы – спирт рибитол .Действующая часть кофермента – флавин (в его основе лежит кольцо изоаллоксазина). Механизм действия ФАД и ФМН состоит в переносе атомов водорода (протонов и электронов).
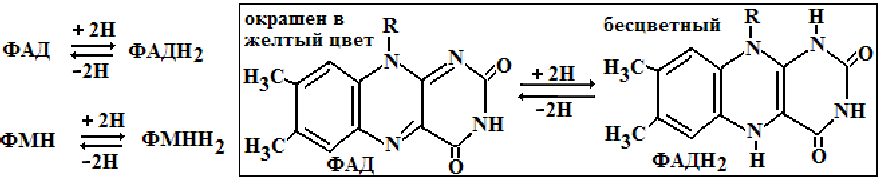
ФАД входит в состав ферментов - флавопротеинов, которые катализируют большое количество разных типов реакций. Выделяют три главных типа реакций:
1) Флавиновые ферменты осуществляют обратимую реакцию дегидрирования (отщепления-
присоединения атомов водорода) от субстрата.
2) Флавиновые коферменты катализируют перенос атомов водорода (электронов и протонов)
в дыхательной цепи митохондрий, забирая их от восстановленных никотинамидных кофер-
ментов (в процессе биологического окисления).
3) Флавиновые коферменты участвуют в свободно-радикальных реакциях. Именно флавино-
вые коферменты в дыхательной цепи митохондрий, являются основным источник суперок-
сидного радикала и пероксида водорода.
ФАД + ФАДН2 → ФАДН. (семихинонный флавиновый радикал)
ФАДН. + О2 + Н+→ ФАД + Н2О2
ФМН и ФАД входят в состав многих ферментов - сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза, оксидаза D-аминокислот, моноаминоксидаза. Флавиновые ферменты принимают участие в β-окислении жирных кислот, в окислении спиртов, альдегидов, глюкозы, аминов, глицерина, пуринов (ксантина, гипоксантина, 6-метилпурина), производных никотина, хинолина, НАДН и НАДФН, амида липоевой кислоты. ФАД участвует в работе пируватдегидрогеназного и альфа-кетоглутаратдегидрогеназного комплексов, в окислении ксенобиотиков. Например, моноаминоксидаза окисляет биогенные амины – гормоны и нейромедиаторы до соответствующих альдегидов:
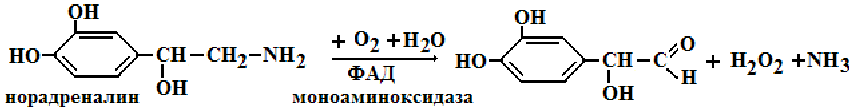
В реакциях, которые протекают с участием кислорода, флавопротеины переносят атомы во-
дорода непосредственно на кислород, что ведет к образованию пероксида водорода. Такие
флавопротеины относят к оксидазам (аэробным дегидрогеназам) – моноаминоксидаза, ксан-__
Билет 19
Цитохромы (от греч, kytos — клетка; chroma — окраска). Это группа железосодержащих белков, участвующих в переносе электронов в аэробных клетках от флавиновых ферментов к кислороду воздуха. Цитохромы — двухкомпонентные ферменты, содержащие железопорфириновые простетические группы — гемы* Группировка тема представляет собой сложную компланарную циклическую систему, состоящую из центрального атома железа, образующего координационные связи с четырьмя остатками пиррола А, В, С, D, соединенными мостиками =СН-. Присоединение и передача электронов осуществляются за счет обратимого изменения валентности атома железа в теме (Fe3+ f*Fe2+), Группа цитохромов образует цитохромную систему, функционирующую путем последовательного окисления и восстановления компонентов системы. Движущей силой передачи электронов от флавопротеина к кислороду через цитохромы является увеличение окислительно-восстановительного потенциала, Цитохромы открыл в 1886 г. Мак-Мунн, а в 1925 г, Д. Кейлин установил их биологическую роль и показал, что цитохромная система играет важную роль в процессе биологического окисления, Цитохромы содержатся во всех организмах, использующих для своей жизнедеятельности энергию, освобождающуюся за счет окисления субстратов кислородом воздуха. Большинство цитохромов (за исключением цитохрома с) прочно связаны с мембранами. Только цитохром с можно выделить путем экстракции из митохондрий растворами солей; для него установлена аминокислотная последовательность.
Классификация цитохромов основана на различиях в природе их гема, В соответствии с четырьмя типами тема выделяют четыре группы цитохромов: а, Ъ9 с, d, которые различаются спектрами поглощения восстановленной формы в видимой области спектра, боковыми
цепями при порфириновых кольцах. У цитохрома а гем содержит формильную боковую группу; у цитохрома с гем связан с белком двумя остатками цистеи-на (рис, 8.15), Связь образуется присоединением SH-группы цистеина к ви-нильной группе порфина. Пятая и шестая координационные связи железа соединены с остатками аминокислот: ги-стидина и метионина.
Комплекс цитохромов аа3 (цито-хромоксидаза) передает электроны молекулярному кислороду и является конечным компонентом цитохромной системы. Цитохромоксидаза прочно связана с мембраной, обладает гидрофоб-Рис 8Л5. Химическая струк- ными свойствами; молекулярная мас-тура гема цитохрома с са комплекса — 240000, одна из гемо- или кофакторов, образующих ковалентные промежуточные соединения с субстратом, В этих случаях донором является кофактор, присоединя ю-щий группу, подлежащую переносу, Трансферазы весьма разнообразны по механизму катализа, специфичности к субстратам, рН-зависимости. Молекулы многих трансфераз имеют четвертичную структуру; некоторые из них выполняют регуляторную функцию в клеточном метаболизме.
ПЕРОКСИДАЗЫ (донор: пероксид водорода оксидоредук-тазы), ферменты класса оксидоредуктаз, катализирующие окисление с помощью H2O2 разл. неорг. и орг. в-в
Наиб. изучена пероксидаза из корней хрена (мол. м. 40 тыс.), молекула к-рой состоит из одной полипептидной цепи (308 аминокислотных остатков), связанной ковалентно с 8 олиго-сахаридными цепями. Молекула содержит также нековалентно связанный гем с атомом Fe(III) у E и Fe(IV) у E1 и E2 (у нек-рых пероксидаз гем отсутствует). При рН ниже 3 и выше 12 гем-белковый комплекс разрушается.
Пероксидазы существует в виде неск. форм (изоферментов), состав и соотношение между которыми зависит от состояния растения. Для наиб. распространенного изофермента из хрена (пероксидаза С) определена аминокислотная последовательность, на основании к-рой синтезирован ген пероксидаз.
Пероксидазы широко распространены в животных и растит. клетках (могут находиться как в связанном с клеточной стенкой состоянии, так и в цитоплазме); они участвуют в фотосинтезе, энергетич. обмене, в трансформации пероксидов и в-в, чужеродных организму.Активность пероксидаз и изоферментный состав значительно изменяются при стрессовых состояниях, ранении, вирусном или микробном инфицировании организма.
Используют пероксидазы в аналит. целях (напр., для определения микроколичеств H2O2, ароматич. аминов, загрязнений вокружающей среде), а также в иммуноферментном анализе.
Катала́за (Н2О2:Н2О2 — оксидоредуктаза)
фермент, катализирующий реакцию разложения перекиси водорода на воду и молекулярный кислород: Н2О2 + Н2О2 = О2 + 2Н2О. Биологическая роль К. заключается в деградации перекиси водорода, образующейся в клетках в результате действия ряда флавопротеиновых оксидаз (ксантиноксидазы, глюкозооксидазы, моноаминоксидазы и др.), и обеспечении эффективной защиты клеточных структур от разрушения под действием перекиси водорода. Генетически обусловленная недостаточность К. является одной из причин так называемой акаталазии — наследственного заболевания, клинически проявляющегося изъязвлением слизистой оболочки носа и ротовой полости, иногда резко выраженными атрофическими изменениями альвеолярных перегородок и выпадением зубов.
К. широко распространена в тканях животных, в т.ч. человека, растений и в микроорганизмах (однако фермент полностью отсутствует у некоторых анаэробных микроорганизмов). В клетках К. локализуется в специальных органеллах — пероксисомах.
К. представляет собой гемопротеин, простетической группой которого является гем, содержащий ион трехвалентного железа. Молекула К. состоит из четырех, по-видимому, идентичных субъединиц с молекулярной массой 60 000 и имеет соответственно четыре простетические группы. Феррипротопорфириновые группы гема прочно связаны с белковой частью фермента — апофермектом и не отделяются от него при диализе. Оптимальная величина рН для К. находится в интервале значений 6,0—8,0.
Участвует в тканевом дыхании.
Функция каталазы сводится к разрушению токсической перекиси водорода, образующейся в ходе различных окислительных процессов в организме.
Билет 20
Трансферазы. В этот класс входят ферменты, ускоряющие реакции переноса функциональных групп и молекулярных остатков от одного соединения к другому. Это один из наиболее обширных классов: он насчитывает около 500 индивидуальных ферментов. В зависимости от характера переносимых группировок различают фосфотрансферазы, аминотрансферазы, гликозилтрансфе-разы, ацилтрансферазы, трансферазы, переносящие одноуглеродные остатки (метилтрансферазы, формилтрансферазы), и др.
Систематическое название складывается по типу: акцептор — группа — трансфераза или донор —группа—трансфераза. Чаще всего донором в реакциях, катализируемых трансферазами, является кофактор, содержащий группу, подлежащую переносу, например:

Фосфотрансферазы. Сюда относятся ферменты, ускоряющие реакцию переноса остатка фосфорной кислоты. Эта реакция имеет исключительно важное значение для жизнедеятельности организма, обеспечивая превращение ряда органических соединений в фосфорные эфиры, обладающие повышенной химической активностью и более легко вступающие в последующие реакции. Перенос фосфатных групп идет на спиртовые, карбоксильные, азотсодержащие, фосфорсодержащие и другие группы тех или иных органических соединений. В соответствии с этим среди фосфортрансфераз различают несколько подподклассов.
донором фосфатных остатков является в большинстве случаев аденозинтрифосфорная кислота (атф), но возможны и другие их источники. к фосфотрансферазам относится, например, гексокиназа—фермент, ускоряющий перенос остатка фосфорной кислоты от молекулы атф к глюкозе (с этой реакции обычно начинается преобразование глюкозы)
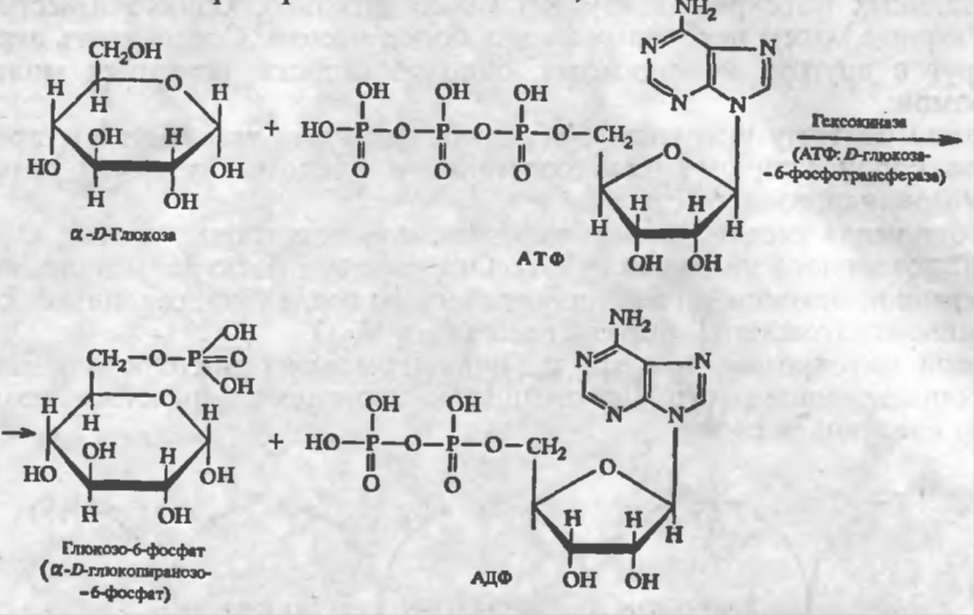
аминотрансферазы. эти ферменты ускоряют реакцию переаминирования аминокислот с кетокислотами и очень важны для обеспечения биосинтеза аминокислот. аминотрансферазы двухкомпонентны: простетической группой их во всех случаях является пиридоксальфосфат, ковалентно присоединенный к апоферменту через свою альдегидную группу) и ионной связью—через остаток фосфорной кислоты:
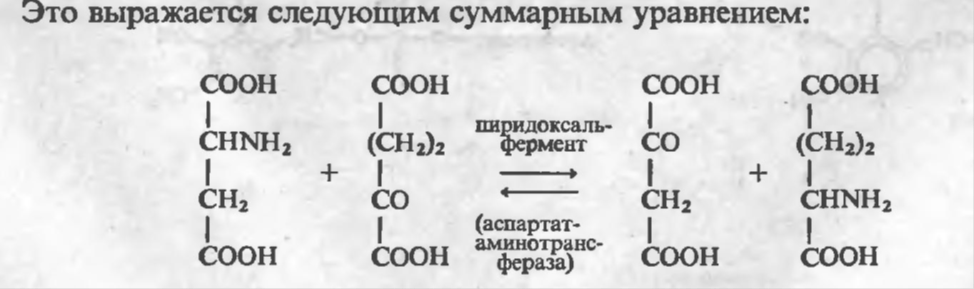
Гликозилтрансферазы. Эти ферменты ускоряют реакции переноса гликозидных остатков из молекул фосфорных эфиров или других соединений к молекулам моносахаридов, полисахаридов или иных веществ, обеспечивая главным образом реакции синтеза и распада олиго- и полисахаридов в животном и растительном мире. Ниже приведено уравнение реакции распада сахарозы при участии сахароза: ортофосфат-а-глюкозилтрансферазы, или сахарозофосфорилазы:
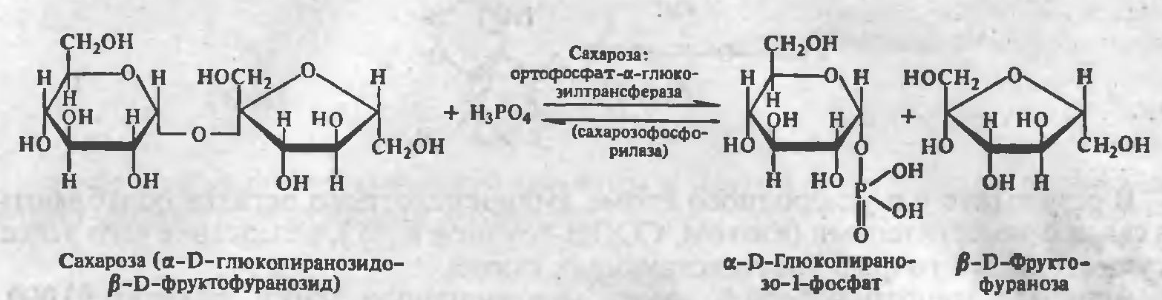
Аналогично этому действуют крахмалфосфорилаза, гликогенфосфорилаза и другие гликозилтрансферазы.
Ацилтрансферазы. Эти ферменты ускоряют перенос ацилов (остатков карбо-новых кислот) на аминокислоты, амины, спирты и другие соединения. Универсальным источником ацильных групп во всех этих реакциях является ацил-коэнзим А, который с полным основанием можно рассматривать как активную группу ацилтрансфераз.
Чаще всего переносу в биологических объектах подвергается ацил уксусной
кислоты—ацетил
Коэнзим А, соединяясь с ацетильным остатком, который занимает место водорода в его HS-группе, образует ацетил-коэнзим А. Последний служит кофактором в соответствующей реакции переноса. Одним из примеров реакции трансацилирования является синтез ацетилхолина:
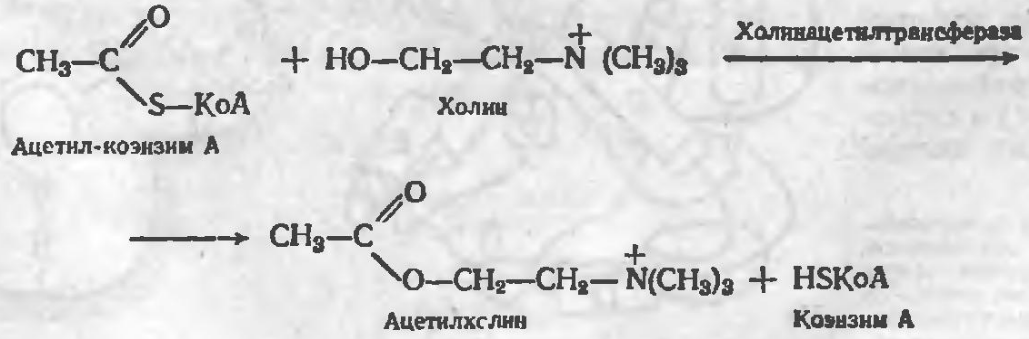
Билет 20-другой вариант
Трансферазы. Это один из самых многочисленных классов ферментов. В зависимости от характера переносимых групп выделяют фосфотрансферазы, аминотрансферазы, гликозилтрансферазы, ацилтрансферазы и др.
Фосфотрансферазы - это ферменты, катализирующие перенос остатка фосфорной кислоты. В результате действия фосфотрансфераз образуются фосфорные эфиры различных органических соединений, многие из которых обладают повышенной реакционной способностью и более легко вступают в последующие реакции. Следовательно, фосфорилирование органических соединений можно считать процессом их активации. Чаще всего донором фосфатных групп является молекула аденозинтрифосфорной кислоты (АТФ). Фосфотрансферазы, использующие в качестве донора фосфатной группы молекулу АТФ, называются киназами. К киназам относится, например, глицеролкиназа, ускоряющая перенос остатка фосфорной кислоты от молекулы АТФ к молекуле глицерина:
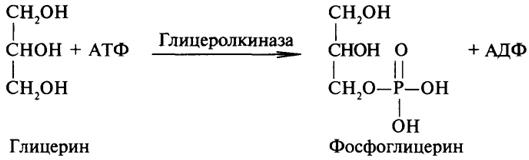
Аминотрансферазы ускоряют перенос аминогруппы. Аминотрансферазы - двухкомпонентные ферменты, коферментом которых служит пиридоксальфосфат (фосфорилированный витамин В6).
Гликозилтрансферазы ускоряют реакции переноса гликозильных остатков, обеспечивая, главным образом, реакции синтеза и распада олиго- и полисахаридов. Если гликозильный остаток переносится на молекулу фосфорной кислоты, то процесс называетсяфосфоролизом, а ферменты, обеспечивающие этот процесс, называются фосфорилазами. В качестве примера приведем схему фосфоролиза мальтозы:

Донором гликозильных остатков в процессах синтеза олиго- и полисахаридов служат нуклеозиддифосфатсахара (НДФ-сахара), одним из представителей которых является уридиндифосфатглюкоза (УДФ-глюкоза):
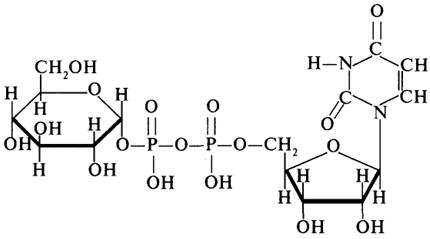 УДФ-глюкоза
УДФ-глюкоза
Ацилтрансферазы катализируют процессы переноса ацилов (радикалов карбоновых кислот) на спирты, амины, аминокислоты и другие соединения. Источником ацилов является ацил-КоА, который можно рассматривать в качестве кофактора в реакциях переноса ацильных групп. Примером реакции трансацилирования может служить реакция синтеза фосфатидной кислоты, в которой участвует фосфоглицерин и две молекулы ацил-КоА:
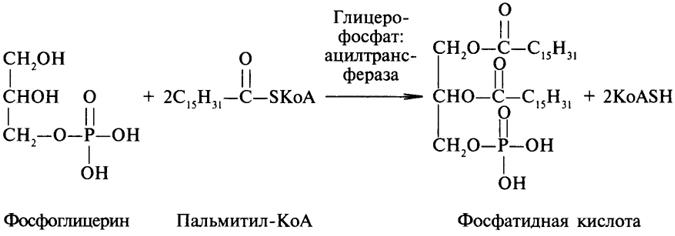
Билет 21
Однако роль воды как акцептора считается главной в действии этих ферментов, поэтому данные ферменты выделены в отдельный класс гидролаз. Например:
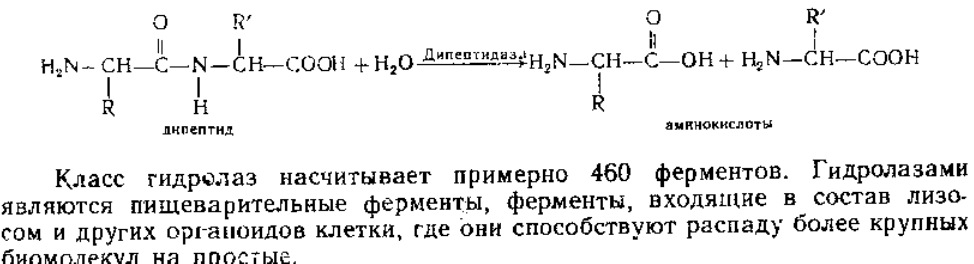
гидролазы. к классу гидролаз относят ферменты, ускоряющие реакции расщепления (а иногда и синтеза) органических соединений при участии воды.в зависимости от характера субстрата, подвергающегося гидролизу, гидролазы делят на ряд подклассов, среди которых наиболее важны следующие: 1) эстеразы, ускоряющие реакции гидролиза сложных эфиров;
2) гликозидазы, ускоряющие реакции гидролиза гликозидов, в том числе углеводов;
3) пептид-гидролазы, ускоряющие реакции гидролиза (а в особых случаях и синтеза) белков, пептидов и других соединений, содержащих пептидные связи;
4) гидролазы, действующие на с—n-связи, отличающиеся от пептидных (например, амидазы и т. п.). всего в составе гидролаз насчитывают почти 500 ферментов.
эстеразы. эти ферменты катализируют реакции гидролиза сложных эфиров спиртов с органическими и неорганическими кислотами. важнейшими подподклассами эстераз являются гидролазы эфиров карбоновьгх кислот и фосфатазы. в качестве представителя первого подподкласса рассмотрим липазу.
липаза ускоряет гидролиз внешних, т. е. а-сложноэфирных, связей в молекулах триацилглицеринов (жиров):
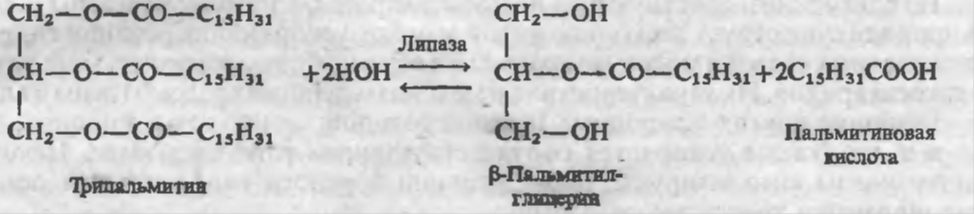
особенно широко распространены фосфатазы, действующие на сложные эфиры фосфорной кислоты и углеводов, например глюкозо-1-фосфатаза:

гликозидазы. эти ферменты ускоряют реакцию гидролиза гликозидов. в зависимости от того, на какой пространственный изомер (а или р) действует фермент,его относят к альфа- или к бетта гликозидам.
Примером являются мальтаза и сахараза:
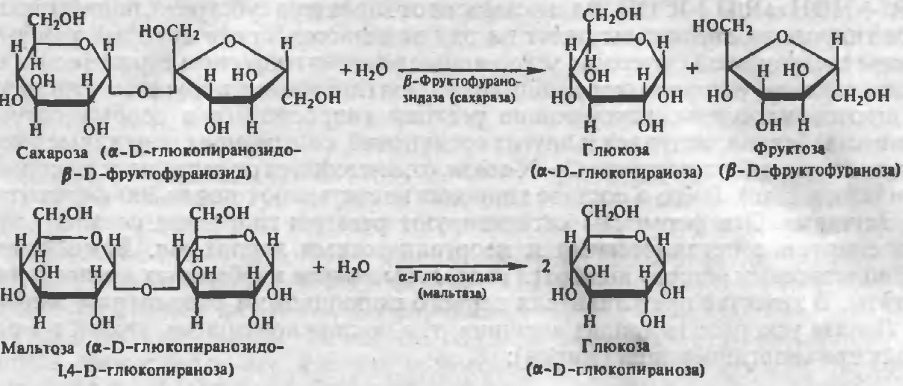

Амидазы. Эти ферменты ускоряют гидролиз амидов кислот. Из них важную роль в биохимических процессах в организме играют уреаза, аспарагиназа и глутаминаза.
Аспарагиназа и глутаминаза ускоряют гидролиз амидов дикарбоновых аминокислот—аспарагиновой и глутаминовой, например:

Билет 21-другой вариант
Гидролазы. Эти ферменты ускоряют реакции гидролиза органических соединений; обязательным участником этих процессов является вода. В зависимости от характера гидролизуемой связи гидролазы подразделяют на ряд подклассов: эстеразы, гликозидазы, пептидгидролазы и др. Отличительной чертой всех гидролаз является то, что они являются однокомпонентными ферментами.
59
Эстеразы катализируют реакции гидролиза сложноэфирных связей. Приведем примеры:
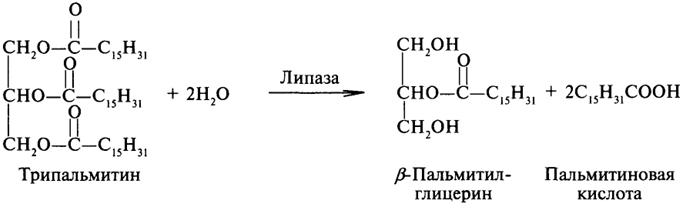
Липаза ускоряет гидролиз внешних сложноэфирных связей в молекуле триглицерида. Особенно широко распространены эстеразы, катализирующие гидролиз сложных эфиров фосфорной кислоты и углеводов. Эти ферменты называются фосфатазами:
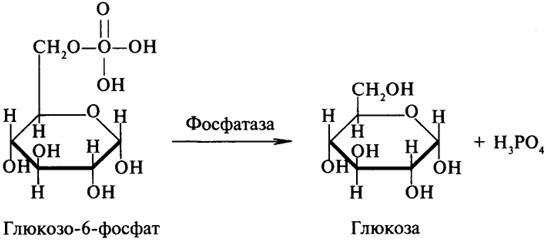
Гликозидазы ускоряют реакции гидролиза гликозидных связей. Примером гликозидазы может служить мальтаза (α-глюкозидаза).

Из гликозидаз, действующих на полисахариды, наиболее распространены амилазы.
Пептид-гидролазы. Ферменты
этого подкласса катализируют гидролиз
пептидных связей в молекулах пептидов
и белков, что можно выразить следующей
схемо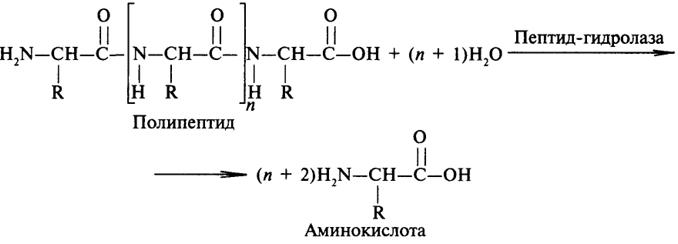
Пептид-гидролазы гидролизуют не все пептидные связи в молекулах белков и пептидов, а только определенные. О специфичности действия пептид-гидролаз речь пойдет в главе "Обмен белков".
Амидазы ускоряют гидролиз амидов дикарбоновых аминокислот - аспарагина и глутамина.
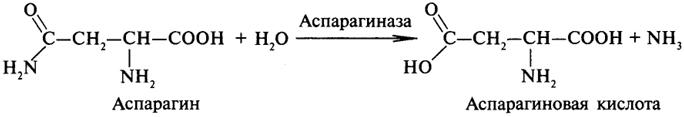
Билет 22
Лиазы — ферменты, катализирующие реакции разрыва связей в субстрате без присоединения воды или окисления. Лиазы подразделяются на четыре подкласса.
Систематическое название составляется по принципу субстрат — группа— лиаза. В тривиальных названиях лиаз указывается особенность учас- -тия групп в реакциях — карбоксилаза (присоединение карбоксильной группы), дегидратаза (отнятие молекулы воды от субстрата) и т. д. Если необходимо подчеркнуть образование субстрата нз двух субстратов более простого строения, то в названии лиаз употребляется термин синтаза (но не синтетаза), например цитратсинтаза.
Пример реакции, катализируемой лиазой:
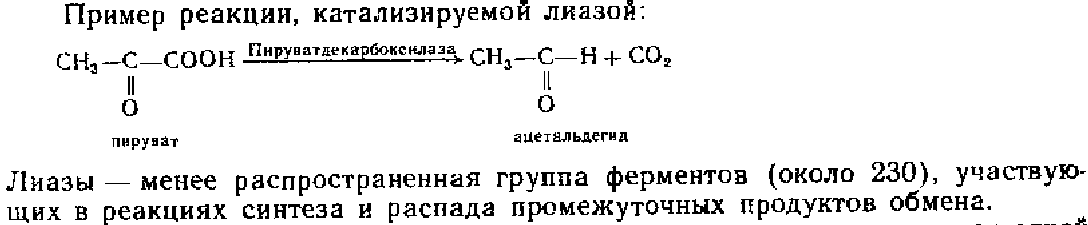
К классу лиаз относятся ферменты, ускоряющие негидролитические реакции распада органических соединений по связям С—С; С—N; С—О и т. д. При этом замыкаются двойные связи и выделяются такие простейшие продукты, как С02, Н20, NH3 и т. п. Некоторые из этих реакций обратимы, и соответствующие ферменты в подходящих условиях катализируют реакции не только распада, но и синтеза. Таким образом, название этого класса ферментов не всегда соответствует содержанию тех процессов, которые ими ускоряются.
Одной из важнейших групп ферментов этого класса являются углерод-углерод-лиазы (С—С-лиазы). Среди них особое значение имеют карбоксили-азы (декарбоксилазы) и альдегид-лиазы.
В природе широко распространены декарбоксилазы кетокислот и аминокислот, катализирующие реакции по следующим схемам:

Характерным представителем альдегид-лиаз является альдолаза, катализирующая обратимую реакцию расщепления фруктозо-1,6-дифосфата до фосфотриоз:
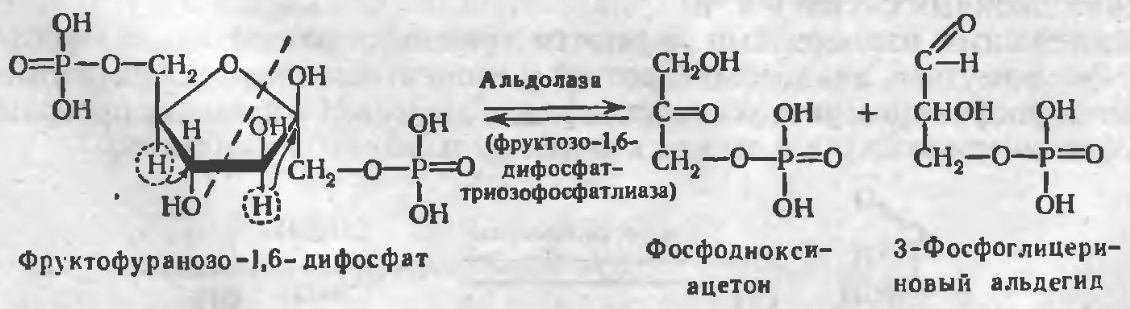
Билет 22-другой вариант
Углерод-углерод лиазы. В природе широко представлены ферменты, ускоряющие декарбоксилирование кето- и аминокислот. Декарбоксилазы или карбокси-лиазы - двухкомпонентные ферменты, коферментом которых является фосфорный эфир витамина B1 - в случае декарбоксилирования кетокислот и витамина В6 - в случае декарбоксилирования аминокислот. Схемы процессов представлены ниже:

Углерод-кислород лиазы (гидролиазы). Ферменты этого подкласса ускоряют реакции гидратации и дегидратации органических соединений.
Эти реакции постоянно идут при распаде и синтезе углеводов и жирных кислот, поэтому гидратазы играют большую роль в жизнедеятельности организмов. Примером может служить фумаратгидратаза, присоединяющая молекулу воды к кратной связи фумаровой кислоты:

Углерод-азот лиазы катализируют реакции прямого дезаминирования некоторых аминокислот; примером может служить аспартат-аммиак-лиаза:

Билет 23
Изомеразы — ферменты, катализирующие превращения в пределах одной молекулы. Они вызывают внутримолекулярные перестройки. Изомеразы подразделяются на пять подклассов. Названия ферментов складываются в зависимости от типа реакции изомеризации: мутазы, таутомераэы, рацемазы, зпимеразы, изомеразы и т. д.:

Изомераэы — небольшая группа ферментов (чуть более 80), играющая важную роль в восстановлении биологической активности молекул, в переключении использования метаболитов на разных путях обмена веществ.
важнейшими изомеразами являются триозофосфатизомераэа, фосфогли-церат-фосфомутаза, альдозомутаротаза и изопентенил-пирофосфатизомераза.
триозофосфатизомераза ускоряет перенос атомов н в процессе превращения 3-фосфоглицеринового альдегида в фосфодиоксиацетон и обратно:

Фосфоглицерат-фосфомутаза обеспечивает достаточную скорость превращения 2-фосфоглицериновой кислоты в 3-фосфоглицериновую кислоту и обратно:

Оба процесса имеют громадное ■ значение в органическом мире, так как представляют важнейшие стадии распада и синтеза углеводов.
Мутаротаза является представителем стереоизомераз, она ускоряет реакцию превращения o-D-глюкопиранозы в p-D-глюкопиранозу:

Лигазы (сннтетазы). Это ферменты, катализирующие соединение двух молекул с использованием энергии фосфатной связи. Источником энергии в реакциях, катализируемых синтетазами, является АТФ или другие нуклеозид-трифосфаты. Например:
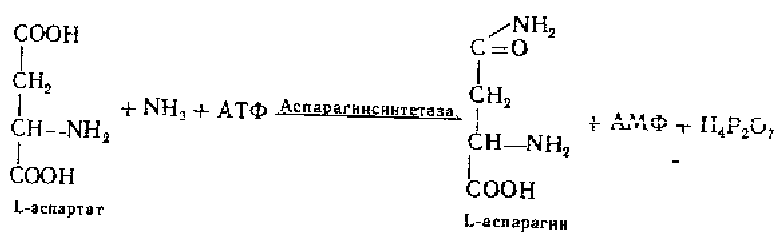
главная их особенность—сопряженность синтеза с распадом веществ, способных поставлять энергию для осуществления биосинтетического процесса. одним из таких природных соединений является атф. при отрыве от ее молекулы в присутствии лигаз одного или двух концевых остатков фосфорной кислоты выделяется большое количество энергии, используемой для активирования реагирующих веществ. лигазы же каталитически ускоряют синтез органических соединений из активированных за счет распада атф исходных продуктов. таким образом, к лигазам относятся ферменты, катализирующие соединение друг с другом двух молекул, сопряженное с гидролизом пирофосфатной связи в молекуле атф или иного нуклеозидтрифосфата.
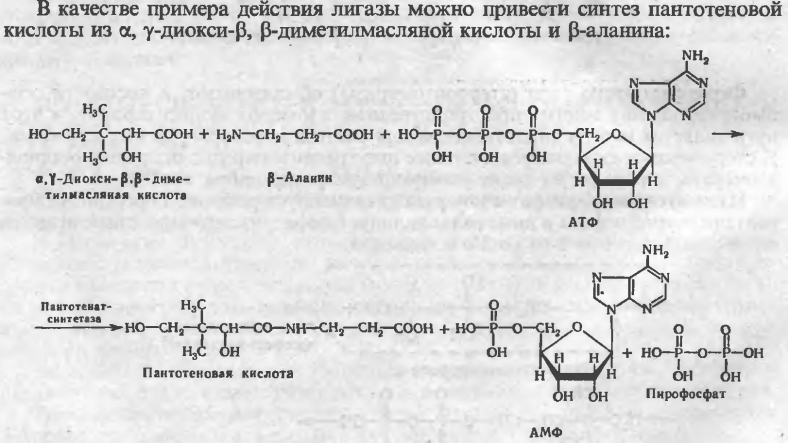
Билет 24
Витамины — это необходимые для нормальной жизнедеятельности низкомолекулярные органические соединения, синтез которых у организмов данного вида отсутствует или ограничен.
Существует условное деление витаминных веществ на собственно витамины и витаминоподобные соединения. Последние похожи по биологическим свойствам на витамины, но требуются обычно в ббльших количествах.
Источником витаминов у человека служат пища и кишечные бактерии. Последние сами синтезируют многие витамины и являются важным источником их поступления в организм.
В отличие от других пищевых веществ витамины участвуют в образовании коферментов, без которых невозможна нормальная функция соответствующих ферментов, или служат регуляторами биохимических процессов.
Классификация витаминов. По физико-химическим свойствам витамины делятся на две группы: жирорастворимые и водорастворимые.
Нарушение баланса витаминов в организме. Дисбаланс витаминов проявляется в форме недостатка {отрицательный баланс) и избытка {положительный баланс). Частичный недостаток витамина (клинически или биохимически проявляющийся отрицательный баланс) называется гиповитаминозом, а крайне выраженный дефицит — авитаминозом. Недостаток одного витамина относят к моногиповитаминозам, а сразу нескольких — к полигиповитаминозам. Избыточное накопление в тканях витаминов (выраженный положительный баланс), сопровождающийся клиническими и биохимическими признаками нарушений, называется гипервитаминозом. Он характерен для жирорастворимых витаминов.
Все гиповитаминозы и авитаминозы проявляются задержкой роста молодого организма. Кроме того, для конкретного гиповитаминоза характерны свои симптомы нарушений обмена веществ и функций, отражающих регулятор ные свойства данного витамина. По этим симптомам выявляют недостаточность соответствующего витамина. Причины гиповитаминозов могут быть экзогенные и эндогенные. К экзогенным относятся, нерациональное питание {однообразная, бедная витаминами пища), изменение состава нормальной кишечной флоры (дисбактериоз), обычно вызываемое длительным применением химнотерапевтических средств {антибиотиков, сульфаниламидов ит. д.); к эндогенным — нарушения всасывания и транспорта витаминов, образования коферментов (вследствие генетически обусловленных дефектов апофермента или ферментов синтеза коферментов), усиление распада витаминов, физиологически обусловленная высокая потребность в витаминах {растущий организм, беременность).
Гипервитаминоз, или витаминная интоксикация, проявляется общими симптомами: потеря аппетита, расстройство моторной функции желудочно-кишечного тракта, сильные головные боли, повышенная возбудимость нервной системы, выпадение волос, шелушение кожи и некоторые специфические признаки, свойственные данному витамину. Гипервитаминоз может закончиться смертельным исходом.
Причиной гипервитаминозов служит избыточный прием продуктов, богатых данным жирорастворимым витамином (например, печени белого медведя или кита, богатых витамином А), или назначение чрезмерных доз витаминов.
Практическое применение витаминов. В настоящее время применяются Отдельные витамины, комбинированные поливитаминные препараты и коферментные препараты витаминов. Последние особенно перспективны, поскольку, будучи введенными в организм, могут сразу участвовать в регуляции обмена веществ. Витамины используются как средство заместительного лечения (при гипо- и авитаминозах) и патогенетического лечения (когда используют отдельные ценные качества витаминов — сосудорасширяющее, регенеративное н т. д.).
Билет 25
2. Жирорастворимые вгитамины Ретинол (витамин А)
Источником витамина являются продукты животного происхождения.
Наиболее'богата нм печень различных рыб, особенно трески и морского окуня. Много витамина А в свиной' и говяжьей печени, желтке яиц, сметане, цельном молоке. В растительных продуктах: моркови, томатах, свекле, салате содержатся каротиноиды, являющиеся провитаминами А. Поэтому частично обеспечение витамином А происходит за счет расти тельных продуктов, если в организме не нарушен процесс превращения пищевых каротиноидов в витамин А. Суточная потребность в витамине А для взрослого человека составляет 1,5 мг (5000 ME).
Химическая природа и биологически активные формы витамина А. Витамин А представляет собой непредельный одноатомный спирт, состоящий из р-иононового кольца и боковой цепи из двух остатков изопрена, имеющей первичную спиртовую группу. Витамин А имеет витамеры А, и Аг. Витамин А2, найденный у пресноводных рыб, имеет дополнительную двойную связь в р-ион'оновом кольце-:-
Биохимические функции. Все формы витамина А {ретиналь, ретинол, ретиноевая кислота и их эфирные производные) регулируют следующие процессы:
1) нормальный рост и дифференцировку клеток развивающегося организма (эмбриона, молодого организма);
2) регуляцию деления и дифференцировки быстро пролиферирующнх (делящихся) тканей — хряща и костной ткани, сперматогенного эпителия и плаценты, эпителия кожи и слизистых;
3) участие в фотохимическом акте зрения.
Ретиноевая кислота в акте зрения и функции размножения, т. е. нормальном развитии сперматозоидов в мужском организме и плаценты при беременности, не участвует. Она стимулирует рост костей н мягких тканей.
Недостаточность витамина А. Наиболее ранним признаком недостаточности является нарушение темновой адаптации и ночная слепота. Кроме того, возможна задержка, роста в молодом возрасте, фолликулярный гиперкератоз (избыточное ороговение кожи, вызванное задержкой смены эпителия), сухость слизистых (гоже вследствие замедленного обновления эпителия), ксерофтальмия (сухость конъюнктивы глаза), помутнение роговицы и размягчение ее (кератомаляция), нарушение функции размножения (оплодотворяющей активности сперматозоидов).
Билет 26
Нафтохиноны (витамин К)
Источником витамина К являются растительные (капуста, шпинат, отчасти^ корнеплоды и фрукты) и животные продукты (печень). Кроме того, он синтезируется бактериями тонкого кишечника. Суточная потребность в нем взрослого человека составляет примерно 2 мг.
Химическая природа и биологически активные формы витамина К- Витамин К по химической природе является хиноном с боковой изопреноидной цепью. Существует два ряда иафтохинонов, или витаминов К,— филлохиноны (витамины К,-ряда) и менахиноны (витамины Ка-ряда):
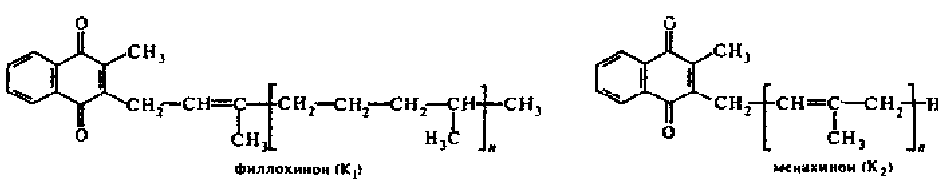
Биохимические функции. Витамин к регулирует в организме процесс свертывания крови путем участия в образовании компонентов ее системы: фактора II (протромбина), фактора vii (проконвертина), фактора ix (фактора Кристмаса) и фактора x (фактора Стюарта). Витамин к участвует в превращении предшественника протромбина, называемого препротромбином, в протромбин. Этот процесс происходит в печени. Витамин К стимулирует у-кар-боксилирование остатков глутаминовой кислоты в молекуле протромбина, активируя микросомальную карбоксилазу. Образовавшийся протромбин связывается с фосфолипндами через ионы Caf<" и подвергается ферментативному расщеплению с образованием тромбина. Последний автоматически злиускает систему свертывания крови с образованием фибринового сгустка.
Недостаточность'витамина К. Признаками недостаточности витамина к является повышенная кровоточивость, особенно при травмах. У взрослых людей кишечная флора полностью обеспечивает организм витамином к- У грудных детей (пока не развита кишечная флора) причиной гиповитаминоза может служить недостаток витамина К в пище. Основными причинами гиповитаминоза К являются: подавление кишечной флоры лекарственными средствами, заболевания печени н желчного пузыря, при которых нарушается образование желчных кислот (необходимых для.всасывания витаминов). к тому же печень служит местом образования активных форм витамина К, синтеза ряда факторов свертывания крови и превращения препротромбина в тромбин.
Токоферолы (витамин Е)
Источником токоферола для человека служат растительные масла: подсолнечное, кукурузное, хлопковое, оливковое. Особенно высоко его содержание в масле, полученном из зародышей пшеницы. Продукты животного происхождения, в том числе молочные, бедны токоферолом. Суточная потребность взрослого человека в токофероле примерно 20—50 мг.
Химическая природа и биологически активные формы витамина Е. К. витамину Е относятся метильные производные токола и токотриенола. Битами-ры Е обозначаются греческими буквами а-, в-, у- и 6-токоферолы и токотрие-нолы. По строению они очень близки. В их структуре имеется ароматический спирт токол и боковая изопреноидная цепь, которая у токоферолов полностью гидрирована, а у токотриенолов нет (рис. 73). Самым активным является а-токоферол, с которым обычно отождествляют Е-внт а минную активность.
Биохимические функции. Токоферол регулирует интенсивность свободно-радикальных реакцчй в живых клетках, поскольку препятствует развитию цепных неуправляемых реакций пероксидного окисления ненасыщенных липидов в биологических мембранах.
По своему механизму токофеоол является биологическим ангиоксидан-том, благодаря чему обеспечивает стабильность, биологических мембран клеток организма. Существует тесная взаимосвязи между токоферолом и селеном в регуляции пероксйдлюго окисления^лилидон. поскольку селен явля-
липидов. Токоферол повышает биологическую активность витамина А, защищая его ненасыщенную бокозую цепь от пероксндного окисления. Возможно, имеются и другие- стороны действия токоферола и его производных, но пока они не раскрыты.
Недостаточность токоферола. Гиповитаминоз Е у человека практически не встречается. Лишь у недоношенных детей встречаются признаки гиповитаминоза, приводящие к гемолитической анемии (из-за низкой устойчивости мембран эритроцитов и их распада). У экспериментальных животных недостаточность токоферола проявляется как своеобразная патология мембран: нарушается устойчивость их к пероксидам, повышается проницаемость и потеря внутриклеточных компонентов, например белков, для которых в норме мембрана непроходима. Патология мембран тканей при гиповитаминозе Е, очевидно, служит причиной разнообразия симптомов заболевания: склонность эритроцитов к пероксидному гемолизу, атрофия семенников (ведущая к бесплодию), рассасывание плода при беременности, мышечная дистрофия и потеря внутриклеточных азотистых компонентов и белков мышц, некроз печени, размягчение участков мозга, особенно мозжечка.
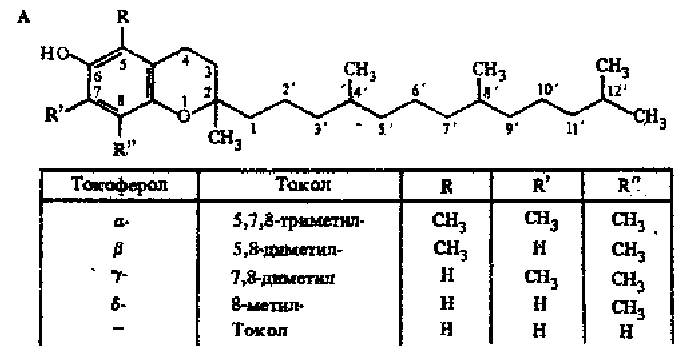
Билет 27
Кальциферолы (витамин D)
Витамин D содержится в ряде продуктов животного происхождения: в печени, сливочном масле, молоке, а также в дрожжах и растительных маслах. Наиболее богата витамином D печень рыб. Из нее получают рыбий жир, используе-' мый для профилактики и лечения D-витаминной недостаточности.
Суточная потребность-в. витамине D для детей колеблется от 12 до 25 мкг (500—1000 ME). Для взрослого человека нужны в десятки раз меньшие количества, чем для детей.
Химическая природа и биологически активные формы витамина D . Витамин D —- групповое обозначение нескольких веществ, относящихся по химической природе к стеринам. Имеется несколько витамеров витамина D. Среди них наиболее активны эргокальциферол (Dz), холекальциферол (D3) и дигид-раэргокальциферал (D4). Витамин D2 образуется из растительного предшественника .(провитамина D) —эргостерина, а витамин D3— из 7-дегидрохоле-стерина (синтезирующегося в коже человека и животных) после облучения ультрафиолетовым светом растений или кожи человека и животных. Последний биологически более активен. Менее активные витамеры витамина D —D4, D5, Dfi, D7 образуются при облучении ультрафиолетом растительных предшественников (соответственно дчгидроэргостерина, 7-дегидроситосте-рина, 7-дегидростигмастерина и 7-дегидрокампестерина).
Однако ни эрго-, ни холекальциферолы биологически не активны и не могут выполнять свои регуляторные функции. Биологически активные формы их образуются в ходе метаболизма.
Метаболизм. Пищевые
кальциферолы всасываются в тонком
кишечнике с помощью желчных кислот.
После всасывания они транспортируются
в -со-
ставе
хнломикронов в кровь и далее в печень.
Сюда же с кроаью поступает и эндогенный
холекальциферол. В* печени холекальциферол
и эргокальциферол подвергаются
гидроксилированию в эндоплазматическом
ретнкулуме с помощью 25-гидроксилазы
холекальцнферола. Образуются
25-гидроксихолекаль-циферол
и
25-гидроксизргокальциферол,
которые принято
считать основной транспортной формой
витамина D.
С кроаью они переносятся в составе спе-.
циального кальциферол связывающего
белка плазмы к почкам, где с участием
i-гидроксилазы
кальциферолов образуются
1,25-дигидроксикальциферолы,
которые и
являются активной формой («гормональной»)
витамина D,
регулирующей обмен кальция и фосфора
в организме.
Биохимические функции. Биологическая активность 1,25-гидрокснкальци-феролов в 10 раз превышает активность исходных кальциферолов. Витамин D регулирует транспорт ионов кальция и фосфора через клеточные мембраны и тем самым их уровень в крови. Эта регуляция основана, по крайней мере, на трех процессах, в которых участвует витамин D:
1) транспорт ионов кальция н фосфата через эпителий слизистой тонкого кишечника при их всасывании;
2) мобилизация кальция из костной ткани;
3) реабсорбция кальция и фосфора б почечных канальцах.
Недостаточность витамина D. Недостаточность витамина D проявляется в виде заболевания, названного рахитом. Развитие рахита у детей вызывается низким содержанием в пище, потребляемой детьми, витамина D, относительно меньшая, чем в старшем возрасте, возможность получать необходимую дозу ультрафиолетового облучения (для образования эндогенного витамина D) и меньшая чувствительность тканей, реагирующих на кальциферолы (очевидно, недостаток калышферолсвязывающих рецепторов). При рахите заторможены все процессы, регулируемые витамином D, а именно: всасывание ионов кальция в фосфатов в кишечнике (хотя ребенок с молочной пищей получает их в достаточных количествах), реабсорбция их в почках. Вследствие этого уровень кальция и фосфора в крови снижается и нарушается минерализация костей, т. е. отложения минеральных веществ на вновь образовавшую колла-геновую матрицу растущих костей не происходит. Поэтому у страдающих рахитом наблюдается деформация костей скелета конечностей, черепа, грудной клетки.
Относительная недостаточность витамина D может быть н при нормальном его поступлении в организм. Она проявляется при заболеваниях печени и особенно почек, так как эти органы принимают участие в образовании, активных форм витамина D.
Билет 28
Тиамин (витамин В1)
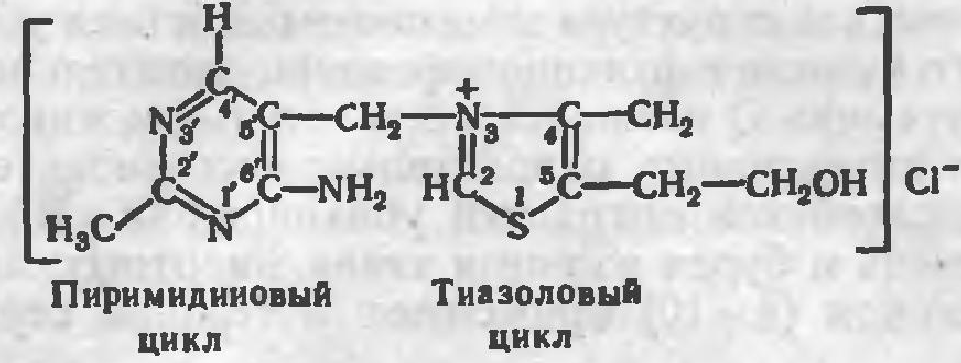
Тиамином богаты хлеб грубого помола, горох, фасоль, а также мясные продукты, с которыми он поступает в организм. Суточная потребность в тиамине взрослого человека составляет около 1—3 мг.
Биохимические функции. Участие тиамина в регуляции метаболизма тканей определяется тиаминдифосфатом (ТДФ), который входит в состав пируватдегидрогеназного или 2-оксоглутаратдегидрогеназного комплексов и транскетолазы. Благодаря этому ТДФ способствует окислению пирувата и 2-оксоглутарата в митохондриях и, следовательно, образованию энергии из углеводов и аминокислот. Как известно, транскетолаза обеспечивает деятельность неокислительной фазы пентозофосфатного цикла, который является главным источником НАДФ ■ И2 н единственным источником рибоэо-5-фос-фата в клетках. Отсюда вытекает, что ТДФ необходим для осуществления всех биохимических процессов, использующих НАДФ • Н2 (синтез жирных кислот, стероидов, обезвреживаний лекарств и ядов и т. д.) и рибозо-5-фосфат (синтез нуклеотидов, нуклеиновых кислот, нуклеотидных коферментов).
Возможно, существуют и другие, даже не коферментные функции тиамина. В частности, в нервной ткани имеется в ощутимых количествах тиамин-трифосфат, который непосредственно или косвенно участвует в синантнческой передаче нервных импульсов.
Не исключено, что-будет обнаружен какой-либо тиаминзависнмый фермент, участвующий в биосинтезе ДНК и кроветворении. На это указывает наличие врожденных тиамннзависимых анемий, которые купируются назначением избытка тиамина.
Недостаточность тиамина Тиаминовая недостаточность, называемая болезнью бери-бери, проявляется нарушениями метаболизма и функций пищеварительной, сердечно-сосудистой и нервной систем.
Гиповитаминоз сопровождается снижением концентрации коферментных форм тиаинна в тканях и, как следствие, понижением обеспеченности витамином организма, падением активности транскетолазы и реакций окислительного декарбоксилирования пирувата и 2-оксоглутарата. Содержание этих хегокислот в крови и выделение их с мочой повышается, уменьшается их использование в энергетическом обеспечении тканей, особенно зависящих от углеводов (прежде всего нервной ткани). Очевидно, нехватка НАДФ - Н2 и риб.озо-5-фосфата при тиаминовой недостаточности влечет за собой торможение многочисленных реакций синтеза, в которых они участвуют. Поэтому в обмене веществ преобладают катаболнческие процессы над анаболическими. Проявлением этого при бери-бери является выраженный отрицательный азотистый баланс, быстрое общее истощение и атрофия органов.
Цепь метаболических нарушений, вызванных недостатком тиамина в клетках, приводит и к патологии функций различных органов и систем. Со стороны пищеварительной системы это выражается в резкой потере аппетита, снижении секреции желудочного сока и соляной кислоты, атонии, диарее Характерным признаком служит резкая атрофия мышечной ткани, следствием чего является снижение сократительной способности скелетных мышц (выраженная мышечная слабость), сердца (уменьшение силы сердечных сокращений, расширение правого отдела сердца, тахикардия и острая сердечная недостаточность) и гладких мышц (снижение тонуса гладких мышц кишечника).
Нарушения со стороны нервной системы проявляются постепенным снижением периферической чувствительности, утратой некоторых периферических рефлексов, сильными болями по ходу нервов, судорогами, расстройством высшей нервной деятельности (страх, снижение интеллекта). Проявление тиаминовой недостаточности часто наблюдается у хронических алкоголиков в виде'энцефалопатического синдрома Вернике, который характеризуется нарушением координации движений, зрительных функций . (офтальмоплегия) и спутанностью сознания.
Частная форма тиаминовой недостаточности имеет место при врожденных нарушениях обмена витамина, например тнамннзавнснмая анемия.
Рибофлавин (витамин B2)

Источником рибофлавина для человека служат продукты питания и частично кишечные бактерии. Богаты рибофлавином печень, почки, желток куриного яйца, творог. В растительных продуктах его меньше. Суточная потребность в нем взрослого человека составляет 1—3 мг.
Биохимические функции. Флавиновые коферменты участвуют в многочисленных реакциях окисления веществ в клетках: переносе электронов и протонов в дыхательной цепи,: окислении пирувата, сукцината, 2-оксоглутарата, а-глицеролфосфата, жирных кислот в митохондриях, окислении биогенных аминов, альдегидов и т. д.
Недостаточность рибофлавина. Недостаточность рибофлавина проявляется в снижении содержания коферментных форм его в тканях, прежде всего ФМН, а также симптомами поражения эпителия слизистых кожи и роговицы глаза. Наблюдается сухость слизистых губ, полости рта. Слизистая ярко-красного цвета, в углу рта и на губах трещины. Повышено шелушение кожи, особенно лица, из-за пониженного обновления эпителия. Имеет место сухость конъюнктивы, ее воспаление, светобоязнь, прорастание роговицы сосудами (васкуляризация), а затем ее помутнение.
Если учесть, что рибофлавин участвует в окислительных процессах, многие из которых протекают с образованием энергии, то становится понятным, почему проявления недостаточности витамина сказываются прежде всего на регенерирующих тканях. Васкуляризация облегчает поступление кислорода В центральную бессосудистую зону роговицы, как бы компенсирует недостаток дыхательной функции роговицы, вызванный дефицитом флавопротеидов, участвующих в окислительно-восстановительных процессах.
Пантотеновая кислота (витамин Вэ)
Источником пантотеновой кислоты для человеческого организма являются кишечные бактерии и продукты питания (дрожжи, печень, куриные яйца, рыба, молоко, мясо, бобовые и т. д.). Потребность в ней взрослого человека около 10 мг.
Ниацин (витамин В5, РР)
В природе ниацин встречается в виде никотиновой кислоты и никотинамида, которые поступают в организм человека с пищей. Источником пищевого ниацнна являются мясные, особенно печень, и многие растительные продукты. Молоко и яйца содержат следы ниацина. Однако в отличие от других витаминов ниацин может синтезироваться в тканях человеческого организма из триптофана, поэтому его нельзя считать обязательным компонентом пищи, если в достатке поступает триптофан. Из 60 молекул триптофана образуется одна молекула никотинамида. Поэтому продукты, богатые триптофаном, но бедные ниацнном (например, те же молоко и яйца)., могут устранять дефицит этого витамина в организме. Суточная потребность в ниацкне зависит от потребления триптофана. Она составляет для взрослого человека около 25 мг.
Биохимические функции. Коферментные формы ниацина НАД и НАДФ определяют его роль в биохимических функциях тканей организма. Функции, выполняемые этими коферментами, можно разделить как бы на три группы:
!) функция переносчиков водорода в окислительно-восстановительных реакциях;
2) функция субстратная для ,интетических реакции:
3) регуляторная функция в качестве аллостерического эффектора Первой из этих функций обычно ограничивалось описание биологического значения ниацина. Действительно, окислительные реакции, в которых НАД и НАДФ выступают в качестве промежуточных переносчиков водорода, очень разнообразны. Они являются коферментами дегидрогеназ, действующих на всех этапах окисления энергетических ресурсов в клетке: на начальных этапах окисления углеводов, жирных кислот, глицерина, аминокислот, на этапе превращения субстратов цикла Кребса и терминальных стадиях дегидрирования в дыхательной цепи и моноокенгеназной цепи. Этим объясняется исключительная роль этих коферментов в биоэнергетике и окислении неполяр ных веществ природного и чужеродного происхождения (т. е. ферментами монооксигеназНой цепи и другими растворимыми ферментами) Кроме того, восстановленная форма НАДФ используется как донор водорода в синтетических восстановительных реакциях, например в синтезе жирных кислот, холестерина и других стероидов.
Вторая функция коферментов ниацина вытекает из участия НАД в качестве субстрата ДНК-лигазной реакции. Как известно, ДНК-лигаза является обязательной реакцией при репликации и репарации. Следовательно, дефнцит НАД в быстро регенерирующих тканях может сказаться на делении клеток и исправлении дефектов участков, в которых участвует ДНК-лигаза. Кроме того, НАД является субстратом для синтеза поли-АДФ-рибозы, участвующей в поли-(АДФ) -рибозилнровании белков хроматина. Этот процесс играет какую-то роль в регуляции матричных синтезов нуклеиновых кислот в клеточном ядре.
Третья, регуляторная, функция состоит в том, что НАД н НАДФ являются не только переносчиками, но и аллостерическим и эффекторами ряда ферментов энергетического обмена. Так, НАД • Н регулирует активность цит-ратсинтазы, малатдегидрогеназы, НАД-изоцитратдегидрогеназы, малатдегид-рогеназы (декарбоксилирующей), фосфопируваткарбоксилазы, пируваткар-боксилазы. НАД • Н является для этих ферментов аллостерическим ингибитором, регулирующим скорость окислительных превращений в цикле Кребса (цитратсинтаза, НАД-изоцитратдегидрогеназа и малатдегидрогеназа — ферменты цикла Кребса) и интенсивность глюконеогенеза (пируваткарбокснла-за и фосфопируваткарбоксилаза — ключевые ферменты глюконеогенеза) Избыток НАДФ • Н вызывает, например, ингибирование глюкозо-6-фосфат-дегидрогеназы, что также можно отнести на счет регуляторной функции кофермента ниациНа.
Недостаточность ниацина. Недостаточность ниацина приводит к заболеванию, называемому пеллагрой. Как правило, гиповитаминоз ниацина сопровождается гиповнтаминозами рибофлавина и пиридоксина, поскольку для образования никотиновой кислоты из триптофана требуются коферменты рибофлавина и пиридоксина.
При пеллагре почти не изменяется скорость окислительных ферментативных реакций в тканях. Более вероятны нарушения других функций ниацина. В частности, НАД участвует в качестве субстрата в процессах репликации и репарации. Поэтому недостаток его сказывается на нормальном делении клеток быстро пролитерирующих тканей (кожа, слизистые и др.). Возможно, отчасти с этим связаны некоторые симптомы пеллагры, хотя многие признаки ее еще ждут своего объяснения.
Пеллагра проявляется в виде дерматита на участках кожи, доступных действию солнечных лучей (фотодерматит), нарушением пищеварения, диареей, слабоумнем и нарушением функции периферических нервов (невриты), атрофией и болезненностью языка (который имеет фуксиноподобный цвет) При тяжелых формах пеллагры наблюдаются кровоизлияния на протяжения всего желудочно-кишечного тракта.
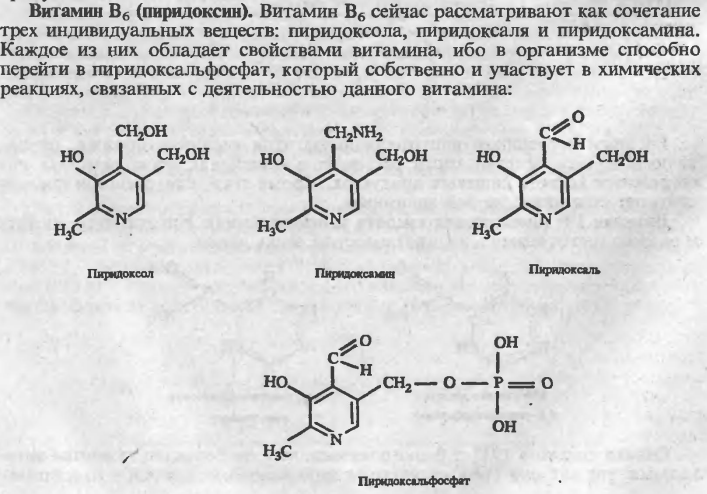
Источником витамина Вв (пиридоксин, пнридоксаль и пиридоксамин) для человека служат кишечные бактерии и пища. Богаты витамином В8 зерновые и бобовые, мясные продукты, рыба. Суточная потребность в нем взрослого человека 2—3 мг.
Биохимические функции. В тканях организма основной коферментной формой является лиридоксаль-5-фосфат. Он входит в состав ферментов почти всех классов: оксидоредуктаз, трансфераз, гидролаз, лиаз и изомераз Слишком большая численность пнридоксальэависимых ферментов создает возможность возникновения многочисленных нарушений в обмене веществ при пищевом дефиците пиридокснна или врожденных нарушениях его об мена.
Недостаточность пиридокснна. Пирндоксиновая недостаточность описана у детей. Она сопровождается повышенной возбудимостью центральной нервной системы и периодическими судорогами, что связано, по всей вероятности, с недостаточным образованием т-амнномасляной кислоты, являющейся тормозным медиатором нейронов мозга. У взрослых людей признаки пиридокснновой недостаточности наблюдаются при длительном лечении противотуберкулезным препаратом изониазидом. который является антагонистом пиридоксаля. При этом также возникают повышенная возбудимость нервной системы, полиневриты и поражения кожи, характерные для недостаточности ниацина.
Билет 29
Кобаламины (витамин В,г) Кобаламины поступают в организм человека с пищевыми продуктами. Богаты ими печень, почки. Растительные продукты бедны кобаламинами. Частично витамин В]2 образуется кишечными бактериями. Суточная потребность в витамине В|2 взрослого человека составляет около 2 мкг.
Биохимические функции." Пока известно, что коферменты витамина В12 участвуют в двух ферментативных реакциях. Метил-В]2 является коферментом гомоцистеинметилтрансферазы, участвующей в переносе метила с N5-метил-ТГФК на гомоцнстеин с образованием метионина. В этой реакции кобаламин действует как синергист с ТГФК.
ДА-В]г является коферментом метилмалонил-КоА-мутазы, катализирующей превращение метилмалонил-КоА в сукцинил-КоА. Эта реакция необходима для сгорания в цикле Кребса остатков пропионил-КоА, образующихся прн fi-окислении жирных кислот с нечетным числом углеродных атомов, при окислении боковой цепи холестерина и углеродных радикалов ряда аминокислот (метион«на, изо-леицнна, тпрпниня, палина), а также при окислении тимина.
Хотя окончательно не расшифрованы другие стороны механизма действия кобаламиноа в биохимических процессах, несомненно, что кобаламииы облегчают депонирование и образование коферментных форм фолиевой кислоты и тем самым посредством коферментов фолиевой кислоты участвуют в синтезе ДНК и пролиферации кроветворных клеток.
Недостаточность кобаламинов. Недостаточность кобаламинов возникает вследствие дефицита их в пище, нарушении всасывания (например, при оперативном удалении желудка или той его части, где образуется внутренний фактор). Недостаточность кобаламинов проявляется в виде мегалобласти-ческой анемии или анемии Адиссон — Бирмера. Нарушение кроветворения выражается теми же признаками, что и при недостатке фолиевой кислоты Отмечаются поражения задних и боковых столбов спинного мозга (фуни кулярный миелоз), повышенное выделение с мочой метилмалоновой кислоты, которая не усваивается.
Обнаружены врожденные дефекты Обмена кобаламинов, связанные с недостаточным образованием внутреннего фактора, транскобаламинов, дефектом метилмалонил-КоА-мутазы.
Метаболизм. Для всасывания кобаламинов необходим внутренний фактор, или фактор Касгла, который продуцируется обкладочными клетками желудка. Он представляет собой гликопротеид с молекулярной массой около 93 000. Всасывание кобаламинов включает следующие стадии:
1) образование комплекса витамин В]2-+- внутренний фактор;
2) связывание комплекса с эпителием слизистой подвздошной кишки с участием нрнов Саг+ (очевидно, имеются мембранные рецепторы для этого комплекса в слизистой подвздошной кишки);
3) транспорт комплекса витамин В]2 -f- внутренний фактор- через слизистую путем эндоцитоза;
4) освобождение витамина В]2 в кровь воротной вены (при этом судьба внутреннего фактора неясна: он либо гидролизуется, либо возвращается в просвет кишечника).
Фолацнн (витамин Be, Вс)
Источником фолацнна является главным образом пища. Богаты им продукты растительного (салат, капуста, томаты, земляника, шпинат) и животного происхождения (печень, мясо, яичный желток). Суточная потребность в нем взрослого человека около 400 мкг. У беременных потребность в нем увеличивается в 2 раза.
Метаболизм. Всасываются пищевые производные фолацина в тонком кишечнике. В слизистой его происходит образование тетрагидрофолиевой кислоты (ТГФК) и ^-метил-ТГФК- В Хрови основная часть фолацина (87%) содержится в эритроцитах, а остальное — в плазме. Депонируется фолацнн в печени, почках и слизистой кишечника. Из организма выводится с мочой, калом и потом.
Биохимические функции. Функции фолацина определяются его коферментами: Ы*-формил-ТГФК, №°-форлшл-ТГФК, N\ N^-метенил-ТГФК N5, Ы™-метилен-ТГФК н ^-метил-ТГФК- Все коферменты взаимопревращаются друг в друга по сх>еме
N5-Формил. ТГФК, N10-Формил-ТГФК,N5,N|0-Метенил-ТГФК ,N5,N|0-Метилен-ТГФК , N5 -Метил-ТГФК
Одноуглеродный остаток ■ может передаваться от одной коферментной формы к другой и использоваться в различных реакциях синтеза пуринов, пнрнмидинов и некоторых аминокислот (глицина из серинэ, метионина из гомоцистеина).
Коферменты фолацина участвуют в биосинтезе 2-го и 8-го углеродны* атомов пуриноаого кольца, а также в образовании дТМФ из дУМФ. Поэтому фолацин играет исключительную роль в биосинтезе нуклеиновых кислот и процессах деления клеток.
Недостаточность фолацина. Недостаточное поступление фолиевой кислоты с пищей или нарушение ее всасывания приводит к развитию мегалоблас тической анемии. Причиной ее служит нарушение биосинтеза пуриновых оснований и дезокснтимидинфосфата, что вызывает угнетение синтеза ДНК и пролиферации (деления) кроветворных клеток. При этой анемии наблюдается снижение -количества эритроцитов и гемоглобина в крови; в периферической крови и костном мозге появляются крупные клетки — мегалобласты Имеет место снижение количества лейкоцитов (лейкопения), так как для их образования в костном мозге также необходим нормальный синтез-ДНК
Билет 30
Аскорбиновая кислота (витамин С)
Свежие фрукты и овощи являются основным источником аскорбиновой кислоты для человека. Особенно богаты ею плоды шиповника. Суточная потребность в ней взрослого человека составляет 50—100 мг.
Биохимические функции. Аскорбиновая кислота является донором водорода в окислительно-восстановительных ферментативных реакциях. Она образует редокс-пару с дегидроаскорбиновой кислотой:
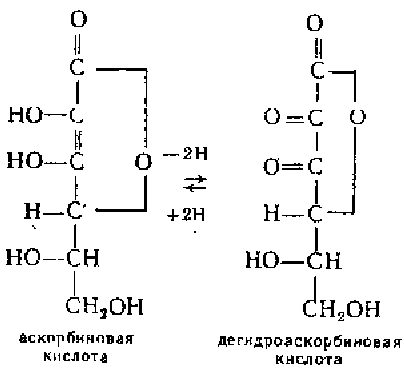
Восстановление дегидроаскорбиновой кислоты в аскорбиновую в тканях осуществляется дегидроаскорбинредуктазой с участием восстановительного глутатнона.
Аскорбиновая кислота участвует в следующих процессах биологического окисления:
1) гидроксилирование триптофана в 5-гидрокситриптофан (при биосинтезе серотонина);
2) превращение 3,4-дигидроксифенилэтиламнна в норадреиалин;
3) гидроксилирование я-гидроксифенилпирувата в гомогентиэиновую кислоту;
4) гидроксилирование стероидов при биосинтезе гормонов коры надпочечников из холестерина;
5) гидроксилирование S'-бутиробетаина при биосинтезе карнитина;
6) ' восстановление ионов Fe^+ до Fe2+ в кишечнике, необходимое для всасывания железа в двухвалентном состоянии;
7) освобождение железа из связи- его с транспортным белком — транс-ферином, что облегчает поступление железа в ткани;
8) превращение фолиевой кислоты в коферментные формы;
9) гидроксилирование остатков пролина и лизина при синтезе коллагена.
Следовательно, аскорбиновая кислота участвует в процессах превращения ароматических аминокислот с образованием некоторых нейромедиаторов, в синтезе кортикостероидов, в процессах кроветворения и в образовании коллагена, являющегося главным внеклеточным компонентом соединительной тканн.
Недостаточность аскорбиновой кислоты. Недостаточность аскорбиновой кислоты приводит к заболеванию, называемого цингой. Прн тяжелых формах этого заболевания наблюдаются выраженные признаки нарушения биохимических функций аскорбиновой кислоты. Они проявляются в нарушении об разования коллагена и хондроитинсульфата соединительной ткани, постепенного разрушения ее вследствие деполимеризации и гидролиза волокнистых структур этой ткани. В результате повышается проницаемость и ломкость капилляров и возникают подкожные кровоизлияния. При недостатке витамина С снижается возможность использования запасов железа для синтеза гемоглобина в клетках костного мозга и участия фолиевой кислоты в проли ферации кроветворных клеток. Все это приводит к развитию анемии.
На основе возникших биохимических нарушений развиваются внешние проявления цинги: расшатывание и выпадение зубов, кровоточивость десен, отеки и боли в суставах, бледность (анемичность) кожных покровов, кровоизлияния, поражения костей, нарушение заживления ран.
Бнофлавоноиды (витамин Р)

Р-Витаминными веществами богаты свежие фрукты и ягоды, особенно черноплодная рябина, черная смородина, яблоки, виноград, лимоны, а также листья чая и плоды шиповника. При употреблении их в пищу обеспечивается потребность человека в биофлавоноидах, которая в сутки составляет для взрослого организма 25—50 мг.
Химическая природа биофлавоноидов. Действующим началом биофлаво-ноидов (Р-витаминных веществ) являются- флавоноиды, представляющие собой растительные полифенольные соединения.
Бнофлавоноиды — очень разнообразная группа 1 ■>■ з" соединений. В растениях обнаружено до 2000 фла-воноидных веществ и родственных им соединений. Р-Витаминными свойствами обладают антоксан-тнны, антоцианы и катехины.
В тканях, возможно, ароматическое кольцо биофлавоноидов используется на построение биологических соединений, например убихинона, или они играют самостоятельную роль в обмене веществ.
. Наиболее ярко проявляется способность флавоноидов снижать проницаемость и ломкость капилляров (капилляроукрепляющее действие). Р-Витаминные вещества взаимодействуют с аскорбиновой кислотой в регуляции образования коллагена соединительной ткани, препятствуют деполимеризации гиалуроновой кислоты гиалуронидазой. Тем самым флавоноиды снижают проницаемость капилляров. Р-Витаминные вещества активируют тканевое дыхание.
Недостаток биофлавонондов. Недостаток в организме биофлавоноидов проявляется симптомами повышенной ломкости и проницаемости капилляров, точечными кровоизлияниями и кровоточивостью десен.
Билет 31
Пантотеновая кислота (витамин Вэ)
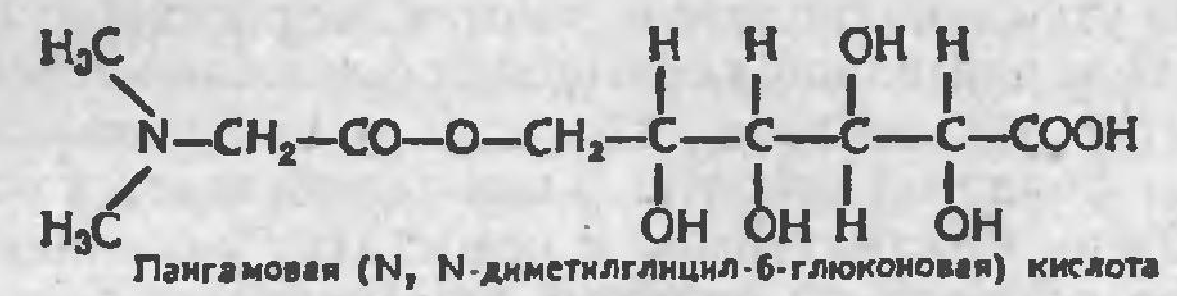
Источником пантотеновой кислоты для человеческого организма являются кишечные бактерии и продукты питания (дрожжи, печень, куриные яйца, рыба, молоко, мясо, бобовые и т. д.). Потребность в ней взрослого человека около 10 мг.
Биохимические функции. Значение пантотеновой кислоты определяется участием ее коферментов в биохимических реакциях. 4-Фосфопантетеин явля ется коферментом а цн л переносящего белка синтетазы жирных кислот, дефос-фо-КоА — кофермент цитратлиазы и частично кофермент многочисленных реакций преврлщения ацилов. КоА — основной кофермент в клетках. С его участием протекают следующие процессы:
1) активирование ацетата и жирных кислот;
2) окисление жирных кислот;
3) синтез холестерина н других стероидных соединений;
4) синтез кетоновых тел;
5) образование цитрата и превращение сукцинил-КоА на стадии субстратного фосфорилирования в цикле Кребса;
6) синтетические реакции с использованием сукцннил-КоА {синтез й-ами-нолевуленовой кислоты);
7) синтез ацетилхолина;
8) синтез ацетилглюкозаминов;
9) реакции апеллирования-биогенных аминов (обезвреживание);
Ю) реакции ацетилнровання чужеродных соединений (обезвреживание) и образования гиг.пуровои кислоты;
]]) окисдение пирувата и 2-оксоглутарата.
Недостаточность пантотеиата. Недостаточность пантотеновой кислоты не обнаружена. Ее изучали на животных и людях-добровольцах путем введения антагонистов пантотеновой кислоты. Из этих наблюдений было выявлено, что пантотеноаый гиповитаминоз проявляется в снижении окисления пирувата, ацетилирования биогенных аминов и чужеродных соединений, а также в поражении кожи, поседении волос,'нарушений функций нервной системы, пониженной приспособляемости к факторам внешней среды.
БиОтин (витамин Н)
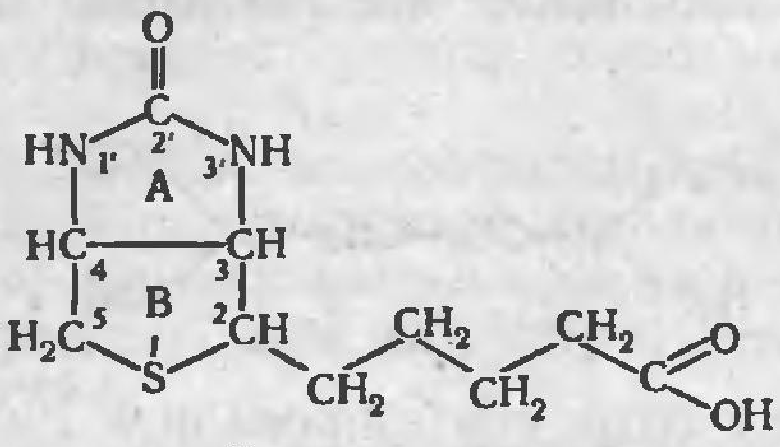
Потребность человеческого организма в биотине покрывается в основном за счет биосинтеза его кищечными бактериями. Некоторая часть поступает с пищей. Богаты биотином горох, соя, цветная капуста, грибы, яичный желток, печень и т. д. Суточная потребность взрослого человека в бнотине составляет около 150—200 мкг.
Метаболизм и биохимические функции. Поступающий с пищей биотнн освобождается с помощью протеиназ кишечника от связи с белками и в свободном виде всасывается в тонком кишечнике. В крови он связывается с альбумином и поступает в ткани. Задерживается бнотии главным образом в печени и почках. Выводится в неизмененном виде с мочой и калом.
В тканях свободный биотин ковалентно связывается e-NH2-группой лизина, находящегося в активном центре «бнотиновых» ферментов. Коферментной формой его считается N5-карбоксибиотин. Кофермент биотина способствует усвоению тканями организма углекислоты (точнее, ионов гидрО-карбоиата). Он участвует в реакциях карбоксилирования, входя в состав пнруваткарбокснлазы, ацетил-КоА-карбоксил азы, пропнонил-КоА-карбоксила-зы, а также в других многочисленных реакциях. Тем самым биотнн обеспечивает течение глюконеогенеза, синтез жирных кислот, окисление остатков пропионовой кислоты в цикле Кребса.
Биотин образует специфический комплекс с авидином, относящимся к гликопротеидам. Авидина много содержится в белке куриных яиц. Недостаточность би'отнна у человека не выявлена. В медицинской прак тнке пока не используются препараты биотина, хотя делаются попытки к его применению при дерматозах.
Билет 32
 делить
центральные
и специальные метаболические
пути. Центральные являются общими
для распада и синтеза основных
макромолекул. Они очень сходны у любых
представителей живого мира. Специальные
циклы характерны для синтеза и распада
индивидуальных мономеров, макромолекул,
кофакторов и т. д. Разнообразие их столь
велико, особенно в растениях, что принято
делить метаболизм растений на первичный
и вторичный.
К первому
относят классические процессы синтеза
и распада основных макромолекул (белков,
углеводов, липидов, нуклеиновых кислот
и т. д.), а ко второму, как бы производному
от первого, относят превращение
специальных биомолекул (например,
алкалоидов, терпенов и т. д.), выполняющих
регуляторные или иные функции, или
просто являющихся побочными конечными
продуктами обмена.
делить
центральные
и специальные метаболические
пути. Центральные являются общими
для распада и синтеза основных
макромолекул. Они очень сходны у любых
представителей живого мира. Специальные
циклы характерны для синтеза и распада
индивидуальных мономеров, макромолекул,
кофакторов и т. д. Разнообразие их столь
велико, особенно в растениях, что принято
делить метаболизм растений на первичный
и вторичный.
К первому
относят классические процессы синтеза
и распада основных макромолекул (белков,
углеводов, липидов, нуклеиновых кислот
и т. д.), а ко второму, как бы производному
от первого, относят превращение
специальных биомолекул (например,
алкалоидов, терпенов и т. д.), выполняющих
регуляторные или иные функции, или
просто являющихся побочными конечными
продуктами обмена.
В обмене веществ принято выделять два противоположных процесса или фазы: катаболизм и анаболизм. Катаболизм представляет собой расщепление крупных молекул на более мелкие. Анаболизм — это синтез сложных молекул из простых.
Катаболизм сопровождается освобождением энергии, которая может аккумулироваться в виде АТФ. Прн анаболических процессах происходит потребление АТФ с образованием АДФ и Н3Р04. Можно сказать, что АТФ является сопрягающим энергетическим звеном обоих путей метаболизма. Однако АТФ не единственный связующий компонент обоих путей. Кроме него прн катаболизме макромолекул и мономеров образуются простейшие метаболиты, которые могут использоваться как исходный материал для биосинтеза мономеров и макромолекул, т. е в процессе анаболизма. Этот связующий путь, или цикл, объединяющий пути распада и синтеза веществ, называют амфиболическим (или двойственным). Значит, катаболические и анаболические пути сопряжены не только через энергетическую систему АТФ—-АДФ, но и через общие метаболиты, что придает гибкость и экономичность обмену веществ. -В случае надобности для биосинтеза используются простейшие промежуточные соединения и отпадает необходимость их поступления извне. Амфиболические пути связаны с терминальной, или окончательной, системой окисления веществ, где они сгорают до конечных продуктов (СОг и Н20) с образованием большого количества энергии. Кроме них конечными продуктами метаболизма являются мочевина и мочевая кислота, образующиеся в специальных реакциях обмена аминокислот и нуклеотндов. Схематически план промежуточного метаболизма показан на рис. 18.
В ходе катаболнческнх и анаболических процессов происходит обновление молекулярных компонентов клеткилСледует отметить самостоятельность путей катаболизма и анаболизма. Если бы эти пути совпадали и различались лишь направлением процесса, то в обмене возникли бы так называемые бесполезные, или футильные, циклы. Такие циклы имеют место при патологии, когда возможен бесполезный круговорот метаболитов. Чтобы этого не происходило, в клетках пути синтеза и распада веществ чаще всего пространственно разделены. Например, окисление жирных кислот происходит в митохондриях, а их синтез вне митохондрий —■ в микросомах.
Билет 33
Совокупность окислительных реакций, происходящих в биологических объектах и обеспечивающих их энергией и метаболитами для осуществления процессов жизнедеятельности, называется биологическим окислением.
Функции этого важнейшего биологического явления даже несколько шире, чем это отмечено в приведенном выше определении, так как при посредстве реакций биологического окисления разрушаются также вредные продукты обмена веществ и проникшие в организм чуждые соединения. Более того, состояние окислительно-восстановительных процессов в клетках сказывается на регуляции обмена веществ в них.
Разнообразные реакции биологического окисления ускоряются многочисленными ферментами, относящимися к классу оксидоредуктаз. Эти ферменты, как правило, встроены в биологические мембраны, причем очень часто в виде ансамблей.
стало понятным существование двух типов биологического окисления.
1. Свободное окисление, не сопряженное с фосфорилированием АДФ, не сопровождающееся трансформацией энергии, выделяющейся при окислении, в энергию макроэргических связей. При свободном окислении высвобождающаяся при сопряженном с окислением распаде химических связей энергия переходит в тепловую и рассеивается.
По типу свободного окисления идут все без исключения оксигеназные реакции, все окислительные реакции, ускоряемые пероксидазами или сопровождающиеся образованием Н202, многие реакции, катализируемые оКсидазами.
Процессы свободного окисления сосредоточены в цитозоле, в мембранах эндоплазматической сети клетки, в мембранах лизосом, пероксисом и аппарата Гольджи, на внешних мембранах митохондрий и хлоропластов. Они идут также в ядерном аппарате клетки.
2. Окисление, сопряженное с фосфорилированием АДФ. Этот тип биологического окисления осуществляется двумя способами.
Если макроэргическая связь возникает в момент непосредственного окисления субстрата, а затем тем или иным путем передается на фосфатный остаток, который, в свою очередь, используется для фосфорилирования АДФ, т. е. синтеза АТФ, то такой вид биологического окисления называют окислением, сопряженным с фосфорилированием АДФ на уровне субстрата. Ранее такой способ называли фосфорилирующим окислением или субстратным фосфорилированием.
Если атомы водорода с коферментов дегидрогеназ, принимающих участие в окислении субстратов, передаются в оксидоредуктазную цепь, где сопряженно с переносом протонов и электронов на молекулярный кислород происходит активирование неорганического фосфата и при его посредстве фосфорилирование АДФ с образованием АТФ, то такое сопряжение окисления с синтезом АТФ называют сопряжением на уровне электронотранспортной цепи. Понятно, что сам окисляемый субстрат в этом случае непосредственного участия в активировании неорганического фосфата не принимает. Ранее этот вид биологического окисления называли окислительным фосфорилированием и отождествляли с дыханием.
Сопряжение окисления с фосфорилированием, т. е. генерирование АТФ для нужд клеток, идет главным образом на внутренних мембранах митохондрий. Именно здесь осуществляется сопряжение окисления с фосфорилированием на уровне электронотранспортной цепи. Что касается субстратного фосфорили-рования, то оно сосредоточено в растворимой части клетки.
Фотосинтетическое и хемосинтетическое фосфорилирование АДФ, сопровождающееся биосинтезом АТФ, также происходит путем сопряжения переноса электронов в электронотранспортных цепях с активированием неорганического фосфата. Механизм этого сопряжения близок к таковому при окислительном фосфорилировании в митохондриях, что подчеркивает единую природу процессов, приводящих к синтезу АТФ у гетеротрофных и аутотроф-ных организмов.
Реакции биологического окисления катализируются ферментами. Окисление может быть связано: 1) с отщеплением водорода от окисляемого субстрата (дегидрирование); 2) с потерей электрона; 3) с присоединением- кислорода. Все три типа реакций равнозначны и имеют место в живой клетке.
Процесс окисления не протекает изолированно, он сопряжен с реакцией восстановления, т. е. с присоединением водорода или электрона. Оба вещества — окисляемое и восстанавливаемое, образуют окислительно-восстановительную парусили редокс-пару.
Окислительную или восстановительную способность разных соединений характеризует их сродство к электрону. Чем легче субстрат отдает электроны, тем сильнее его восстанавливающая способность. Наоборот, высокое сродство к электрону характеризует их окисляющую способность. Способность любой окислительно-восстановительной пары к реакциям восстановления характеризуется стандартным окислительно-восстановительным потенциалом, или редокс-потенциалом. Стандартный редокс-потенциал отражает восстанавливающую активность редокс-пары .В качестве нулевого стандарта принят редокс-потенциал газообразного водорода Отрицательное значение его указывает на выраженные восстановительные свойства. Чем более отрицателен редокс-потенциал, тем сильнее выражена способность данной редокс-пары отдавать электроны, т. е. играть роль восстановителя.Значения редокс-потенциалов позволяют предсказать направление потока электронов при биологическом окислении и рассчитать изменение энергии при переносе электронов от одной редокс-пары к другой.
Субстраты окисления, как уже указывалось, образуются в ходе катаболизма белков, углеводов и липидов. Эти субстраты подвергаются дегидрированию как наиболее распространенному типу биологического окисления, происходящего с участием находящихся в клетке дегидрогеназ. Если акцепто ром водорода в реакциях дегидрирования служит не кислород, а другой субстрат, то такие реакции называют анаэробным окислением;"если же акцептором водорода является кислород и образуется вода, то такие реакции биологического окисления называют тканевым дыханием. Аэробное окисление углеводов - основной путь образования энергии для организма.
Анаэробное окисление есть не что иное, как процесс генерации водорода (второй блок в приведенной выше схеме энергетического аппарата клетки) В этих реакциях участвуют никотинамидэависимые дегидрогеназы, где акцептором отщепляемого От органического субстрата водорода служат НАД+ и НАДФ+, и флавинзависимые дегидрогеназы, где акцептором водорода служат ФМН и ФАД. Субстраты дегидрирования образуются вне митохондрий, но затем транспортируются внутрь митохондрий, где совершаются окислительные превращения веществ. Анаэробный гликолиз, несмотря на небольшой энергетический эффект, является основным источником энергии для скелетных мышц в начальном периоде интенсивной работы, т. е. в условиях, когда снабжение кислородом ограничено
Билет 34
Тканевое дыхание, клеточное дыхание, совокупность ферментативных процессов, протекающих при участии кислорода воздуха в клетках органов и тканей, в результате чего продукты расщепления углеводов, жиров, белков окисляются до углекислого газа и воды, а значит, часть освобождающейся энергии запасается в форме богатых энергией, илимакроэргических соединений. Многие ферменты, катализирующие эти реакции, находятся в особых клеточных органоидах — митохондриях.
В процессе Т. д. можно наметить три основные стадии: 1) окислительное образование ацетилкофермента А (активная форма уксусной кислоты) из пировиноградной кислоты (промежуточный продукт расщепления глюкозы), жирных кислот и аминокислот; 2) разрушение ацетильных остатков в трикарбоновых кислот цикле с освобождением 2 молекул углекислого газа и 4 пар атомов водорода, частично акцептируемых коферментами никотинамидадениндинуклеотидом ифлавинадениндинуклеотидом и частично переходящих в раствор в виде протонов; 3) перенос электронов и протонов к молекулярному кислороду (образование H2O) — процесс, катализируемый набором дыхательных ферментов и сопряжённый с образованием АТФ (так называемое окислительное фосфорилирование). Первые две стадии подготавливают третью, в ходе которой в результате последовательных окислительно-восстановительных реакций происходит освобождение основной части энергии, вырабатываемой в клетке. При этом около 50% энергии в результате окислительного фосфорилирования запасается в форме богатых энергией связей АТФ, а остальная часть её выделяется в виде тепла.
Т. д. обеспечивает образование и постоянное пополнение АТФ в клетках. В случае недостатка в снабжении клеток животных и человека кислородом запасы АТФ не исчерпываются сразу. Их пополнение может происходить в результате включения дополнительных механизмов — систем анаэробного (без участия кислорода) распада углеводов — гликолиза и гликогенолиза. Однако этот путь энергетически во много раз менее эффективен и не может обеспечить функции и целостность структуры органов и тканей. Биологическая роль Т. д. не исчерпывается существенным вкладом в энергетический обмен организма. На различных его этапах образуются молекулы органических соединений, используемых клетками в качестве промежуточных продуктов для различных биосинтезов.
Клеточное или тканевое дыхание — совокупность биохимических реакций, протекающих в клетках живых организмов, в ходе которых происходит окисление углеводов,липидов и аминокислот до углекислого газа и воды. Высвобожденная энергия запасается в химических связях макроэргических соединений (АТФ и др.) и может быть использована по мере необходимости. Входит в группу процессов катаболизма.
В качестве исходных субстратов дыхания могут выступать различные вещества, преобразуемые в ходе специфических метаболических процессов в Ацетил-КоА с высвобождением ряда побочных продуктов. Восстановление НАД (НАДФ) и образование АТФ может происходить уже на этом этапе, однако большая их часть образуется в цикле трикарбоновых кислот при переработке Ацетил-КоА.
Гликолиз — путь ферментативного расщепления глюкозы — является общим практически для всех живых организмов процессом. У аэробов он предшествует собственно клеточному дыханию, у анаэробов завершается брожением. Сам по себе гликолиз является полностью анаэробным процессом и для осуществления не требует присутствиякислорода.
Первый его этап протекает с расходом энергии 2 молекул АТФ и включает в себя расщепление молекулы глюкозы на 2 молекулы глицеральдегид-3-фосфата. На втором этапе происходит НАД-зависимое окисление глицеральдегид-3-фосфата, сопровождающееся субстратным фосфорилированием, то есть присоединением к молекуле остатка фосфорной кислоты и формированием в ней макроэргической связи, после которого остаток переносится на АДФ с образованием АТФ.
Таким образом, уравнение гликолиза имеет следующий вид:
Глюкоза + 2НАД+ + 4АДФ + 2АТФ + 2Фн = 2ПВК + 2НАД∙Н + 2 АДФ + 4АТФ + 2H2O + 4Н+.
Сократив АТФ и АДФ из левой и правой частей уравнения реакции, получим:
Глюкоза + 2НАД+ + 2АДФ + 2Фн = 2НАД∙Н + 2ПВК + 2АТФ + 2H2O + 2Н+.
]Окислительное декарбоксилирование пирувата
Образовавшаяся в ходе гликолиза пировиноградная кислота (пируват) под действием пируватдегидрогеназного комплекса (сложная структура из 3 различных ферментов и более 60 субъединиц) распадается на углекислый газ и ацетальдегид, который вместе с Кофермент А образует Ацетил-КоА. Реакция сопровождается восстановлением НАДдо НАД∙Н.
У эукариот процесс протекает в матриксе митохондрий.
β-окисление жирных кислот
Деградация жирных кислот (у некоторых организмов также алканов) происходит у эукариот в матриксе митохондрий. Суть этого процесса заключается в следующем. На первой стадии к жирной кислоте присоединяется кофермент А с образованием ацил-KoA. Он дегидрируется с последовательным переносом восстановительных эквивалентов на убихинон дыхательной ЭТЦ. На второй стадии происходит гидратирование по двойной связи С=С, после чего на третьей стадии происходит окисление полученной гидроксильной группы. В ходе этой реакции восстанавливается НАД.
Наконец, на четвёртой стадии образовавшаяся β-кетокислота расщепляется β-кетотиолазой в присутствии кофермента А на ацетил-КоА и новый ацил-КоА, в которой углеродная цепь на 2 атома короче. Цикл β-окисления повторяется до тех пор, пока вся жирная кислота не будет переработана в ацетил-КоА.
Цикл трикарбоновых кислот
Ацетил-КоА под действием цитратсинтазы передаёт ацетильную группу оксалоацетату с образованием лимонной кислоты, которая поcтупает в цикл трикарбоновых кислот (цикл Кребса). В ходе одного оборота цикла лимонная кислота несколько раз дегидрируется и дважды декарбоксилируется с регенерацией оксалоацетата и образованием одной молекулы ГТФ (способом субстратного фосфорилирования), трёх НАДН и ФАДН2.
Суммарное уравнение реакций:
Ацетил-КоА + 3НАД+ + ФАД + ГДФ + Фн + 2H2O + КоА-SH = 2КоА-SH + 3НАДH + 3H+ + ФАДН2 + ГТФ + 2CO2
У эукариот ферменты цикла находятся в свободном состоянии в матриксе митохондрий, только сукцинатдегидрогеназа встроена во внутреннюю митохондриальную мембрану.
Окислительное фосфорилирование
Основное количество молекул АТФ вырабатывается по способу окислительного фосфорилирования на последней стадии клеточного дыхания: в электронтранспортной цепи. Здесь происходит окисление НАД∙Н и ФАДН2, восстановленных в процессах гликолиза, β-окисления, цикла Кребса и т. д.. Энергия, выделяющаяся в ходе этих реакций, благодаря цепи переносчиков электронов, локализованной во внутренней мембране митохондрий (у прокариот — в цитоплазматической мембране), трансформируется втрансмембранный протонный потенциал. Фермент АТФ-синтаза использует этот градиент для синтеза АТФ, преобразуя его энергию в энергию химических связей. Подсчитано, что молекула НАД∙Н может дать в ходе этого процесса 2.5 молекулы АТФ, ФАДН2 — 1.5 молекулы.
Конечным акцептором электрона в дыхательной цепи аэробов является кислород.
Билет 35
Дыхательная цепь—-это своеобразный конвейер по переносу протонов и электронов от восстановленного НАД (НАД • Н+Н+), образующегося при действии на субстрат НАД-зависимых дегидрогеназ, или от восстановленного ФАД (ФАД * Н2), образующегося при действии на субстрат флавинзависимых дегидрогеназ, к кислороду. Дыхательная цепь состоит из следующих переносчиков протонов и электронов: флавопротеида-1 (ФП), содержащего в качестве кофермента ФМН, кофермента Q (или убихннона), двух желе-осерных белков, содержащих негеминовое железо, и цитохромов Ь, с,, .с, а, а3 (рис. 36).
Водород в составе НАД * Н подключается . к флавопротеиду, где его первым акцептором является ФМН флавопротеида, а водород в составе ФАД * На подключается на том участке дыхательной цепи, где находится KoQ. Участок дыхательной цепи от НАД • Н до цитохрома Ъ представлен переносчиками протонов н электронов. Начиная с цитохрома b и до Кислорода потоки водорода и электронов разделяются, так как этот участок дыхательной цепи содержит только переносчики электронов (цитохромы и особый железосерный белок).
Организация компонентов дыхательной цепи в митохондриях. Дыхательная цепь имеет структурную организацию, так как ее компоненты находятся не в водорастворимом состоянии, а встроены во внутреннюю мембрану митохондрий. Количество дыхательных цепей в митохондриях разных тканей и органов неодинаково. В печени их число, приходящееся на одну митохондрию, составляет примерно 5000, а в сердце — около 20 ООО. Митохондрии сердца поэтому отличаются более активным дыханием, чем митохондрии печени.
Переносчики дыхательной цепи находятся в липидном окружении («плавают» в липидном слое мембраны) и прочно связаны с мембраной, за исключением цитохрома с, который слабее связан с внешней поверхностью мембраны и относительно легко извлекается водными растворами.
Флавопротеид (ФП) является НАД • Н-дегидрогеназой. Этот белок содержит ФМН — акцептор протонов и электронов от НАД • Н. С ним же связан один нз железо-серных белков, также участвующий в переносе протонов и электронов на KoQ. Активный центр НАД • Н-дегид-рогеназы находится на внутренней стороне внутренней мембраны, поэтому дегидрирование НАД * Н происходит с этой стороны.
Характеристика переносчиков дыхательной цепи. НАД - Н-дегидрогена-за, или флавопротеид-1 СФ/7,), содержит ФМН в качестве кофермента, который акцептирует водород, отщепляемый от НАД • Н. Молекулярная масса НАД • Н-дегидрогеназы около 10е. Этот флавиновый фермент тесно связан с железосерным белком, участвующим в передаче электронов и протонов на кофермент Q.
НАД * Н-дегидрогеназа пересекает поперек внутреннюю мембрану митохондрий, находясь в окружении липидов. Активный центр ее обращен к внутренней поверхности этой мембраны, т. е. к матрнксу.
Железосерные белки участвуют в переносе электронов и протонов в дыхательной цепи на двух участках — между флавопротеидом и KoQ и между цктохромами b и сх. Железосерные белкн имеют небольшую молекулярную массу порядка 10 ООО. Они содержат негеииновое железо и серу. Семейство этих белков отличается разными окислительными свойствами. Оба железо-серных белка, входящих в дыхательную цепь, отличаются друг от друга значением окислительно-восстановительного потенциала. Железосерные белки находятся в липидном слое мембраны.
Кофермент Q, или убихинон, растворен в лнпидной части мембраны. Может диффундировать как поперек, так и вдоль мембраны.
Цитохром Ь имеет различные формы. В дыхательной цепи, очевидно. имеются цитохромы Ьш и Ьш, называемые так по максимуму поглощения света. Они образуют комплекс, пересекающий лнпидную часть мембраны от внутренней (матриксной) к наружной поверхности.
Цитохром Cj расположен в липидном слое ближе к наружной поверхности внутренней-мембраны. Имеет молекулярную .массу около 40 000.
Дитохром с относительно легко переходит в водный раствор. Находится на наружной поверхности внутренней мембраны н, очевидно, может выходить в межмембраиное пространство. Молекулярная масса его 12 000.
Цитохромы а н щ образуют комплекс, называемый цнтохромоксидазой. Этот комплекс пересекает мембрану поперек от внешней стороны, где в липидном слое находится цитохром а, до внутренней стороны, где находится цитохром а3. Активный центр иитохрома а* обращен в матрикс. Молекулярная масса цитохромоксидазы около 450 000." В отличие от других цитохромов цитохромЬксидаза содержит также Си+.
Все цитохромы, будучи гемпротеидами, при переносе электронов подвергаются обратимому окислению — восстановлению путем белок-белковых взаимодействий. При обратимом окислении меняется степень окисления от железа Fe3+ до Fea+.
Направление переноса протонов и электронов определяют окислительно-восстановительные потенциалы, а именно: от НАД * Hs {Eq = —0.32 В) к кислороду (Е0 = +0,81 В). Редокс-потенциалы переносчиков дыхательной цепи указаны на рис. 36.
По существу тканевое дыхание напоминает в упрощенном виде уравнение реакции горения водорода в кислороде: Ня+Оа-»-Н,0, протекающей со взрывом. Разница лишь в том, что при тканевом дыхании используется не молекулярный водород, а водорбд, отщепляемый от органических веществ и связанный с кофермеитами. Поэтому при тканевом дыхании происходит не одномоментное, а поэтапное освобождение энергии. Эта энергия аккумулируется в фосфатных связях АТФ и используется для жизнедеятельности клеток.
Функция дыхательной цепи – утилизация восстановленных дыхательных переносчиков, образующихся в реакциях метаболического окисления субстратов (главным образом в цикле трикарбоновых кислот). Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД.


Билет 36
Митохондрии находятся в животных и растительных клетках. Их форма варьирует от овадьной до палочковидной и нитевидной. Недавно было доказано, что митохондрии, тесно примыкая друг к другу, располагаются в ряд, имея вид митохондриальных сетей, а не рассеянных по клетке изолированных органоидов, как представлялось ранее.
Митохондрии имеют размеры порядка 0,5x3,0 нм. Они состоят нз двух отдельных мембранных мешков: наружного и внутреннего, которые разделены мембранным пространством, заполненным водной средой (рнс. 32). Наружная мембрана состоит наполовину нз белков и липидов. Внутренняя мембрана примерно на 8Д состоит из белков и на '/4 из дипндов, в основном кардиолипи-на. Внутренняя мембрана причудливо укладывается, образуя складки —- кристы. Пространство между, кристами заполнено водной фазой — матриксом. Внутренняя поверхность крнст, обращенная к матрик-су, усеяна грибовидными частицами, называемыми элементарными частицами.
Функции митохондрий: Митохондрии являются «силовой станцией» клетки, поскольку за счет окислительной деградации питательных веществ в них синтезируется большая часть необходимого клетке АТФ (АТР). В митохондриях локализованы следующие метаболические процессы: превращение пирувата в ацетил-КоА, катализируемое пируватдегидрогеназным комплексом: цитратный цикл; дыхательная цепь, сопряженная с синтезом АТФ (сочетание этих процессов носит название «окислительное фосфорилирование»); расщепление жирных кислот путем β-окисленияи частично цикл мочевины. Митохондрии также поставляют клетке продукты промежуточного метаболизма и действуют наряду с ЭР как депо ионов кальция, которое с помощью ионных насосов поддерживает концентрацию Са2+ в цитоплазме на постоянном низком уровне (ниже 1 мкмоль/л).
Главной функцией митохондрий является захват богатых энергией субстратов(жирные кислоты, пируват, углеродный скелет аминокислот) из цитоплазмы и их окислительное расщепление с образованием СО2 и Н2О, сопряженное с синтезом АТФ.
Реакции цитратного цикла приводят к полному окислению углеродсодержащих соединений (СО2) и образованию восстановительных эквивалентов, главным образом в виде восстановленных коферментов. Большинство этих процессов протекают в матриксе. Ферменты дыхательной цепи, которые реокисляют восстановленные коферменты, локализованы во внутренней мембране митохондрий. В качестве доноров электронов для восстановления кислорода и образования воды используются НАДН и связанный с ферментом ФАДН2. Эта высоко экзергоническая реакция является многоступенчатой и сопряжена с переносом протонов (Н+) через внутреннюю мембрану из матрикса в межмембранное пространство . В результате на внутренней мембране создается электрохимический градиент. В митохондриях электрохимический градиент используется для синтеза АТФ из АДФ (ADP) и неорганического фосфата (Рi) при катализе АТФ-синтазой. Электрохимический градиент является также движущей силой ряда транспортных систе
Окислительное фосфорилирование. Главная масса АТФ у аэробных организмов синтезируется путем окислительного фосфорилирования в митохондриях—этих поистине энергетических фабриках клетки.
Атомы водорода, снятые с субстратов в цикле дикарбоновых и трикарбоновых кислот, при р-окислении высших жирных кислот, при пируватдегидрогеназной, глутаматдегидрогеназной и некоторых других реакциях поступают в дыхательную цепь ферментов внутренней мембраны митохондрий. Универсальным донором атомов водорода для дыхательной цепи ферментов служит НАДН. Если при окислении субстрата возникает НАДФН, то осуществляется реакция
![]()
Следовательно, и в этом случае атомы Н перед поступлением в дыхательную цепь передаются на НАД+
Другим первичным источником атомов водорода и электронов в дыхательной цепи служит восстановленный флавопротеин, если он выполняет роль первичной дегидрогеназы, как, например, в случае окисления янтарной кислоты в цикле трикарбоновых и дикарбоновых кислот Флавопротеин, но несколько иной природы, служит передаточной инстанцией для атомов водорода и электронов от НАДН к убихинонпротеину дыхательной цепи.
Естественно, что дыхательная цепь ферментов митохондриальной мембраны открывается НАДН, с которого атомы Н передаются на первый белковый компонент дыхательной цепи—флавопротеин, несущий флавинмононуклеотид (ФМН) в качестве кофермента. Остальные компоненты дыхательной цепи располагаются в порядке возрастания их нормальных (измерены при 1 М концентрации и температуре 25° С, что обозначают индексом Е0 и рН 7,0 и маркируют значком ') окислительно-восстановительных потенциалов (£"0), обеспечивающих упорядоченную передачу атомов водорода и электронов по такой редоксцепи.
Самой примечательной особенностью дыхательной цепи ферментов является наличие в ней участков, где соседние компоненты резко' отличаются значениями окислительно-восстановительных потенциалов

Мембраны, несущие ферменты переноса электронов и сопряженного с ним фосфорилирования, называются сопрягающими. К ним относятся: внутренняя мембрана митохондрий, мембрана тилакоидов хлоропластов зеленых растений, мембрана хроматофоров фотосинтезирующих бактерий и клеточные мембраны аэробных бактерий, обладающих дыхательным типом энергетики. Они характеризуются толщиной в 7,0—9,0 нм, преобладанием белков над липидами (2:1), низким содержанием холестерола и наличием кардиолипина; примерно третья часть входящих в их состав белков принадлежит ферментам дыхательной цепи.Наиболее полно изучены структура и функция сопрягающей мембраны митохондрий. Наряду с дыхательным ансамблем ферментов в ней находится АТФ-синтазный комплекс, ответственный за образование АТФ. И тот и другой ферментные комплексы локализованы во внутренней мембране митохондрий ,причем АТФ-синтазный комплекс представлен так называемыми грибовидными выростами, которые усеивают внутреннюю мембрану и обращены в сторону матрикса митохондриальных частиц.
Согласно хемиосмотической гипотезе, именно структурные и функциональные особенности сопрягающей мембраны обеспечивает биосинтез АТФ. В процессе функционирования дыхательной цепи ферментов в сопрягающей мембране митохондрий, не проницаемой ни для НАДН, ни для протонов, происходит активный перенос шести Н+ из матрикса в межмембранное пространство на каждую пару электронов, проходящих по электронотранспортной цепи. По поводу механизма этого переноса высказаны разные мнения. Предполагают также, что перенос протонов идет при участии протонных транслоказ—специфических белков, локализованных в сопрягающей мембране и обеспечивающих перенос протонов сопряженно с транспортом электронов при помощи белкового комплекса, как, например, в случае цитохромоксидазы или НАДН: б-оксидоредуктазы.
В результате создается трансмембранная разность потенциалов, так как с внешней стороны внутренней мембраны митохондрий, в межмембранном пространстве, накапливаются Н+, а на внутренней ее стороне, в матриксе,— ОН- Возникает градиент электрохимического потенциала Н+ (его обозначают как Дцн+). Он складывается из градиента электрического потенциала—А\|/ и градиента концентрации водородных ионов—АрН и является движущей силой синтеза АТФ.
Естественно, что ионы Н, накопившиеся в межмембранном пространстве митохондрии, перенесенные туда за счет потерянной электронами энергии в процессе их транспорта по дыхательной цепи ферментов и перехода с более высокого энергетического уровня в окисляемом субстрате на более низкий энергетический уровень в активированной молекуле кислорода стремятся вернуться в митохондриальный матрикс. Энергезированная, электрически заряженная внутренняя мембрана митохондрий способна деэнергезироваться, разрядиться. Этот процесс осуществляется при помощи протонной АТФазы.
Протонная АТФаза (Н+-АТФаза)—липопротеиновый комплекс, Гйдролизующий АТФ сопряженно с трансмембранным переносом водородных ионов против их электрохимического градиента (Дцн+). Энергия для такого переноса Н+ против градиента их концентрации черпается за счет энергии распадающейся макроэргической связи в молекуле АТФ при ее гидролизе. В условиях нарушения целостности комплекса БэРж митохондрий, Н+-АТФаза ускоряет именно этот процесс, обеспечивая обратный транспорт Н+ и создание Арн+- Но в составе энергезированной митохондриальной мембраны, при нормальном состоянии комплекса Fo-Fi, функция протонной АТФазы сводится не к переносу ионов водорода из матрикса в межмембранное пространство, а, наоборот, к транспорту протонов внутрь митохондрии, к снятию электрохимического градиента Ни, само собой разумеется, к синтезу (сопряженно с переносом Н+ с внешней стороны сопрягающей мембраны на ее внутреннюю сторону) АТФ. Поэтому ее называют также АТФ-синтазой, что подчеркивает ее истинную функцию в митохондриальной мембране.
АТФ-сннтаза (протонная (АТФаза) представлена двумя белковыми комплексами, состоящими, в свою очередь, из субъединиц .Первый из них, полностью «утопленный» в сопрягающую мембрану и пронизывающий ее насквозь, состоит из трех видов гидрофобных полипептидных цепей Его функция состоит в доставке протонов из межмембранного пространства, куда он открывается, ко второму белковому комплексу, плотно к нему примыкающему.
Второй комплекс включает в свой состав пять различных белков и выступает, будучи частично погруженным, из сопрягающей мембраны в виде грибо видного выступа. Это F1-фактор или сопрягающий фактор, непосредственно ответственный за биосинтез АТФ. Его молекулярная масса, слегка варьирующая в зависимости от объекта выделения, составляет в среднем 368000. Полагают, что каталитический центр, ускоряющий реакцию синтеза АТФ из АДФ и Н3Р04, находится на р-субъединице, а а-субъединица прикрывает его от воздействия ингредиентов митохондриального матрикса. Есть также мнение, что е-субъединица регулирует деятельность протонной АТФазы, ингибируя ее способность гидролизовать АТФ. Аналогично построены и действуют хлоропластная и бактериальная Н+-АТФазы.
Каким же образом возникает АТФ при посредстве АТФ-синтазы? На этот вопрос еще нет исчерпывающего ответа, но предложено несколько заслуживающих внимания концепций.
Первая из них сводится к предположению, что протоны, поступающие по протонпроводящему каналу FQ, активируют неорганический фосфат (Р„), связанный активным центром р-субъединицы, отнимая от него ОН-группу (реакция элиминирования воды). Одновременно ОН-группа концевого фосфата АДФ, также присоединенного к активному центру р-субъедиНицы, теряет протон за счет взаимодействия с ОН "-группой матрикса (где ОН "-группы накапливаются в результате переноса Н+ в межмембранное пространство,. Активированные фосфат и АДФ соединяются и образуют АТФ .
Вторая концепция состоит в допущении, что ионы Н в активном центре сопрягающего фактора активируют фосфат и карбоксильную группу одной из Субъединиц Fx -фактора, в результате чего возникает фосфоэнзим, где фосфат присоединен макроэргической связью. При последующем взаимодействии АДФ и фосфоэнзима образуется АТФ). Здесь в видоизмененном состоянии представлена гипотеза переносчиков.
Третья концепция исходит из предположения, что роль транслоцируемых в F1-фактор протонов состоит в изменении конформации F1-фактора. Обладая не менее чем двумя центрами связывания АДФ и неорганического фосфата, F1 -фактор способен синтезировать АТФ из АДФ и Р„, если связывающий центр находится в закрытом состоянии. При этом АДФ и Р„ в нем находятся в окружении аминокислотных радикалов, способствующих отнятию молекулы воды и синтезу АТФ. При транслокации протонов центр связывания открывается, и АТФ из него поступает в матрикс а ее место занимают АДФ и Рн. Новый цикл конформационных перестроек переводит этот центр связывания в закрытое состояние с одновременным высвобождением готовой АТФ из другого связывающего центра, переходящего в открытое состояние. Легко заметить, что в этом объяснении механизма биосинтеза АТФ использованы идеи конформационной гипотезы сопряжения окисления с форфорилиро-ванием.
В последнее время появились новые точки зрения на механизм АТФ-синтазной реакции. А. Д. Виноградов предложил кинетическую модель, в соответствии с которой синтез АТФ в АТФазном комплексе и гидролиз АТФ .Fx-АТФазой идут разными путями и каталитически ускоряются разными формами фермента, причем синтазные центры локализованы на а-субъединице, а гидролазные—на р-субъединице. Л. Ф. Дмитриев обосновал вариант химической гипотезы, где роль интермедианта играет энергизи-рованный липидный радикал сопрягающей мембраны и учитывается роль электрохимического потенциала и внутримембранных протонов в процессе сопряжения окисления с фосфорилированием.
Кроме биосинтеза АТФ, электрохимический потенциал Арн+> возникающий на сопрягающей мембране и переводящий ее в энергетически заряженное, энергезированное состояние,, является источником энергии для механической работы (например, для движения жгутиков у мутантов бактерий, утративших синтез АТФ за счет сопряжения окисления с фосфорилированием, вращения хлоропластов у харовых водорослей, вбуравливания цианобак-терий в ил и т. п.), для поддержания осмотического давления и переноса веществ против градиента концентрации, для теплопродукции при утрате митохондриями дыхательного контроля .
Источником энергезированного состояния мембраны может быть также возникновение электрохимического потенциала .Сказанное, по мнению В. П. Скулачева, наводит на мысль о том, что возникновение Арн+, а в ряде случаев ApNa+ на сопрягающей мембране есть универсальный способ запасения энергии в клетке, предшествовавший ее консервированию в макроэргических связях АТФ.
Билет 36 –другой вариант
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ, синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живыхклетках, благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного дыхания. В общем виде окислительноефосфорилирование и его место в обмене в-в можно представить схемой:

АН2-орг. в-ва, окисляемые в дыхат. цепи (т. наз. субстраты окисления, или дыхания), АДФ-аденозиндифосфат, Р-неорг. фосфат.
Поскольку АТФ необходим для осуществления мн. процессов, требующих затраты энергии (биосинтез, совершение мех. работы, транспорт в-в и др.), Окислительное фосфорилирование играет важнейшую роль в жизнедеятельности аэробных организмов. Образование АТФ в клетке происходит также благодаря др. процессам, напр. в ходе гликолиза и разл. типов брожения, протекающих без участия кислорода. Их вклад в синтез АТФ в условиях аэробного дыхания составляет незначит. часть от вклада окислительногофосфорилирования (ок. 5%).
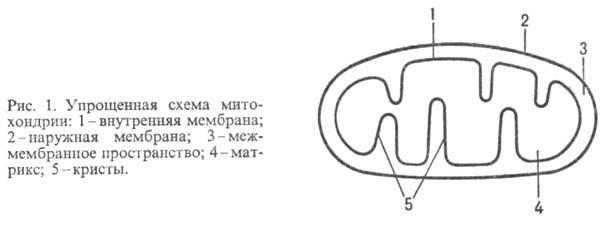
У животных, растений и грибов окислительное фосфорилирование протекает в спе-циализир. субклеточных структурах-митохондриях (рис. 1); у бактерий ферментные системы, осуществляющие этот процесс, находятся в клеточной мембране.
Митохондрии окружены
белково-фосфолипидной мембраной.
Внутри митохондрий (в
т. наз. матриксе) идет ряд метаболич.
процессов распада пищ. в-в,
поставляющих субстраты окисления АН2 для
окислительного фосфорилирования.
Наиб. важные из этих процессов
-трикарбоновых кислот цикл
и т. наз.![]() -окисление
жирных к-т (окислит. расщепление жирной
к-ты с образованием ацетил-кофермента
А и к-ты, содержащей на 2атома С
меньше, чем исходная; вновь образующаяся
жирная к-та также может
подвергаться
-окисление
жирных к-т (окислит. расщепление жирной
к-ты с образованием ацетил-кофермента
А и к-ты, содержащей на 2атома С
меньше, чем исходная; вновь образующаяся
жирная к-та также может
подвергаться ![]() -окислению).Интермедиаты этих
процессов подвергаются дегидрированию (окислению)
при участии ферментов дегидрогеназ;
затемэлектроны передаются
в дыхат. цепь митохондрий-ансамбль
окислит.-восстановит. ферментов,
встроенных во внутр. митохонд-риальную мембрану.
Дыхат. цепь осуществляет многоступенчатый
экзэргонич. перенос электронов (сопровождается
уменьшением своб. энергии)
от субстратов к кислороду,
а высвобождающаяся энергия используется
расположенным в той
же мембране ферментомАТФ-синтетазой,
для фос-форилирования АДФ до АТФ.
В интактной (неповрежденной)
митохондриальной мембране переносэлектронов в
дыхат. цепи и фосфорилирование тесно
сопряжены между собой. Так, напр.,
выключение фосфорилирования по
исчерпании АДФ либо
неорг. фосфата сопровождается
торможением дыхания (эффект
дыхат. контроля). Большое число повреждающих
митохондриальную мембрану воздействий
нарушает сопряжение между окислением и
фосфори-лированием, разрешая идти
переносу электронов и
в отсутствие синтеза
АТФ (эффект
разобщения).
-окислению).Интермедиаты этих
процессов подвергаются дегидрированию (окислению)
при участии ферментов дегидрогеназ;
затемэлектроны передаются
в дыхат. цепь митохондрий-ансамбль
окислит.-восстановит. ферментов,
встроенных во внутр. митохонд-риальную мембрану.
Дыхат. цепь осуществляет многоступенчатый
экзэргонич. перенос электронов (сопровождается
уменьшением своб. энергии)
от субстратов к кислороду,
а высвобождающаяся энергия используется
расположенным в той
же мембране ферментомАТФ-синтетазой,
для фос-форилирования АДФ до АТФ.
В интактной (неповрежденной)
митохондриальной мембране переносэлектронов в
дыхат. цепи и фосфорилирование тесно
сопряжены между собой. Так, напр.,
выключение фосфорилирования по
исчерпании АДФ либо
неорг. фосфата сопровождается
торможением дыхания (эффект
дыхат. контроля). Большое число повреждающих
митохондриальную мембрану воздействий
нарушает сопряжение между окислением и
фосфори-лированием, разрешая идти
переносу электронов и
в отсутствие синтеза
АТФ (эффект
разобщения).
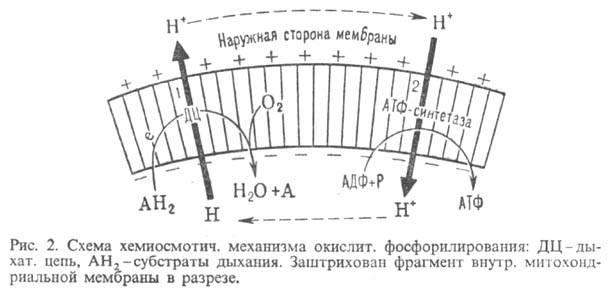
Механизм
окислительного фосфорилирования можно
представить схемой: Перенос электронов (дыхание) ![]() А
~ В
А
~ В![]() АТФ А
~ В-высокоэнергетич. интермедиат Предполагалось,
что А ~ В - хим. соед. с макроэргич. связью,
напр. фосфорилир. фермент дыхат.
цепи (хим. гипотеза сопряжения), или
напряженная конформация к.-л. белка,
участвующего в окислительном фосфорилировании(конформац.
гипотеза сопряжения). Однако эти гипотезы
не получили эксперим. подтверждения.
Наиб. признанием пользуется хемиосмотич.
концепция сопряжения, предложенная в
1961 П. Митчеллом (за развитие этой концепции
в 1979 ему присуждена Нобелевская премия).
Согласно этой теории, своб. энергия
транспорта электронов в
дыхат. цепи затрачивается на перенос
измитохондрий через
митохондриальную мембрану на
ее наружную сторону ионов Н+ (рис.
2, процесс 1). В результате на мембраневозникает
разность электрич. потенциалов
АТФ А
~ В-высокоэнергетич. интермедиат Предполагалось,
что А ~ В - хим. соед. с макроэргич. связью,
напр. фосфорилир. фермент дыхат.
цепи (хим. гипотеза сопряжения), или
напряженная конформация к.-л. белка,
участвующего в окислительном фосфорилировании(конформац.
гипотеза сопряжения). Однако эти гипотезы
не получили эксперим. подтверждения.
Наиб. признанием пользуется хемиосмотич.
концепция сопряжения, предложенная в
1961 П. Митчеллом (за развитие этой концепции
в 1979 ему присуждена Нобелевская премия).
Согласно этой теории, своб. энергия
транспорта электронов в
дыхат. цепи затрачивается на перенос
измитохондрий через
митохондриальную мембрану на
ее наружную сторону ионов Н+ (рис.
2, процесс 1). В результате на мембраневозникает
разность электрич. потенциалов ![]() и
разность хим.активностей ионов Н+
и
разность хим.активностей ионов Н+ ![]() (внутримитохондрий рН
выше, чем снаружи). В сумме эти компоненты
дают трансмембранную разность электрохим.
потенциалов ионов водорода
(внутримитохондрий рН
выше, чем снаружи). В сумме эти компоненты
дают трансмембранную разность электрохим.
потенциалов ионов водорода ![]() между
матриксоммитохондрий и
внеш. водной фазой, разделенными мембраной:
между
матриксоммитохондрий и
внеш. водной фазой, разделенными мембраной:
![]()
где R-универсальная газовая
постоянная,
T-абс. т-ра, F- число Фарадея. Величина ![]() обычно
составляет ок. 0,25 В, причем осн. часть
(0,15-0,20 В) представлена электрич.
составляющей
обычно
составляет ок. 0,25 В, причем осн. часть
(0,15-0,20 В) представлена электрич.
составляющей![]() .
Энергия
.
Энергия![]() ,
выделяющаяся при
движениипротонов внутрьмитохондрий по
электрич. полю в сторону меньшей
их концентрации (рис.
2, процесс 2), используется АТФ-синтетазой
для синтеза
АТФ. Т.
обр., схему окислительного фосфорилирования,
согласно этой концепции, можно представить
в след. виде:
,
выделяющаяся при
движениипротонов внутрьмитохондрий по
электрич. полю в сторону меньшей
их концентрации (рис.
2, процесс 2), используется АТФ-синтетазой
для синтеза
АТФ. Т.
обр., схему окислительного фосфорилирования,
согласно этой концепции, можно представить
в след. виде:
Перенос электронов (дыхание) ![]() АТФ
АТФ
Сопряжение окисления и фосфорилирования через![]() позволяет
объяснить, почему окислительноефосфорилирование,
в отличие от гликолитич.
("субстратного") фосфорилирования,
протекающего в р-ре, возможно лишь в
замкнутых мембранных структурах, а
также почему все воздействия, снижающие
электрич. сопротивление и увеличивающие
протонную проводимостьмембраны,
подавляют ("разобщают")
окислительное фосфорилирование. Энергия
позволяет
объяснить, почему окислительноефосфорилирование,
в отличие от гликолитич.
("субстратного") фосфорилирования,
протекающего в р-ре, возможно лишь в
замкнутых мембранных структурах, а
также почему все воздействия, снижающие
электрич. сопротивление и увеличивающие
протонную проводимостьмембраны,
подавляют ("разобщают")
окислительное фосфорилирование. Энергия ![]() ,
помимосинтеза
АТФ, может
непосредственно использоваться клеткой для
др. целей - транспорта метаболитов,
движения (у
бактерий), восстановления нико-тинамидных коферментов и
др.
,
помимосинтеза
АТФ, может
непосредственно использоваться клеткой для
др. целей - транспорта метаболитов,
движения (у
бактерий), восстановления нико-тинамидных коферментов и
др.
В дыхат. цепи имеется
неск. участков, к-рые характеризуются
значит. перепадом окислит.-восстановит.
потенциала ![]() и
сопряжены с запасанием энергии
(генерацией
и
сопряжены с запасанием энергии
(генерацией![]() ).
Таких участков, наз. пунктами или точками
сопряжения, обычно три: НАДН:
убихинон-редуктазное звено (
).
Таких участков, наз. пунктами или точками
сопряжения, обычно три: НАДН:
убихинон-редуктазное звено (![]() 0,35-0,4
В), убихинол: цитохром-c-редуктазное
звено (
0,35-0,4
В), убихинол: цитохром-c-редуктазное
звено (![]() ~
~ 0,25 В) и цитохром-с-оксидазный комплекс
(
~
~ 0,25 В) и цитохром-с-оксидазный комплекс
(![]() ~
0,6 В)-пункты сопряжения 1, 2 и 3 соотв. (рис.
3). Каждый из пунктов сопряжения дыхат.
цепи м.б. выделен измембраны в
виде индивидуального ферментного
комплекса, обладающего
окислит.-восстановит. активностью.
Такой комплекс, встроенный в
фосфолипидную мембрану,
способен функционировать как
протонный насос.
~
0,6 В)-пункты сопряжения 1, 2 и 3 соотв. (рис.
3). Каждый из пунктов сопряжения дыхат.
цепи м.б. выделен измембраны в
виде индивидуального ферментного
комплекса, обладающего
окислит.-восстановит. активностью.
Такой комплекс, встроенный в
фосфолипидную мембрану,
способен функционировать как
протонный насос.
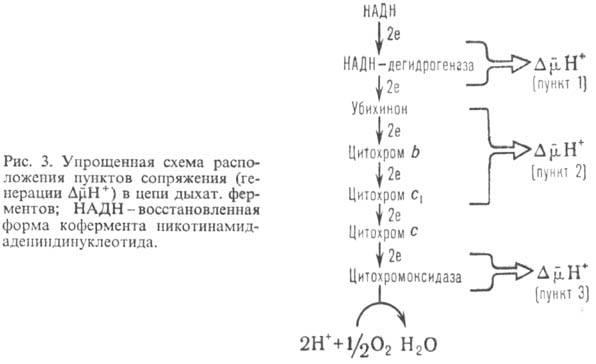
Обычно для характеристики эффективности окислительного фосфорилирования используют величины Н+/2е или q/2e, указывающие сколько протонов (либо электрич. зарядов) переносится через мембрану при транспорте пары электронов через данный участок дыхат. цепи, а также отношение Н+/АТФ, показывающее, сколько протонов нужно перенести снаружи внутрь митохондрий через АТФ-синтетазу для синтеза 1 молекулы АТФ. Величина q/2e составляет для пунктов сопряжения 1, 2 и 3 соотв. 3-4, 2 и 4. Величина Н+/АТФпри синтезе АТФ внутри митохондрий равна 2; однако еще один Н+ может тратиться на вынос синтезированного АТФ4- из матрикса вцитоплазму переносчиком адениновых нуклеотидов в обмен на АДФ -3 . Поэтому кажущаяся величина Н+ / АТФнаружн равна 3.
В организме окислительное фосфорилирование подавляется
мн. токсичными в-вами, к-рые по месту их
действия можно разделить на три группы:
1) ингибиторы дыхат.
цепи, или т. наз. дыхат. яды (см. Дыхание).
2) Ингибиторы АТФ-синтетазы.
Наиб. распространенныеингибиторы этого
класса, употребляемые в лаб. исследованиях,
- антибиотик олигомицин
и модификатор карбоксильных
групп белкадициклогексилкарбодиимид.
3) Т. наз. разобщители
окислительного фосфорилирования.
Они не подавляют ни перенос электронов,
ни собственно фосфорилирование АДФ,
но обладают способностью уменьшать
величину ![]() намембране,
благодаря чему нарушается энергетич.
сопряжение между дыханием и синтезом
АТФ.
Разобщающее действие проявляет большое
число соед. самой разнообразной хим.
структуры. Классич. разобщители - в-ва,
обладающие слабыми кислотными св-вами,
способные проникать черезмембрану как
в ионизованной (депротонированной), так
и в нейтральной (протонированной) формах.
К таким в-вам относят, напр.,
1-(2-дицианометилен)гидразино-4-трифтор-метоксибензол,
или карбонилцианид-n-трифторметокси-фенилгидразон,
и 2,4-динитрофенол (соотв. ф-лы I и II;
показаны протонир. и депротонир. формы).
намембране,
благодаря чему нарушается энергетич.
сопряжение между дыханием и синтезом
АТФ.
Разобщающее действие проявляет большое
число соед. самой разнообразной хим.
структуры. Классич. разобщители - в-ва,
обладающие слабыми кислотными св-вами,
способные проникать черезмембрану как
в ионизованной (депротонированной), так
и в нейтральной (протонированной) формах.
К таким в-вам относят, напр.,
1-(2-дицианометилен)гидразино-4-трифтор-метоксибензол,
или карбонилцианид-n-трифторметокси-фенилгидразон,
и 2,4-динитрофенол (соотв. ф-лы I и II;
показаны протонир. и депротонир. формы).
Двигаясь через мембрану в
электрич. поле в ионизованной форме,
разобщитель уменьшает![]() ;
возвращаясь обратно в протонир. состоянии,
разобщитель понижает
;
возвращаясь обратно в протонир. состоянии,
разобщитель понижает![]() (рис.
4). Т. обр., такой "челночный" тип
действия разобщителя приводит к
уменьшению
(рис.
4). Т. обр., такой "челночный" тип
действия разобщителя приводит к
уменьшению![]()
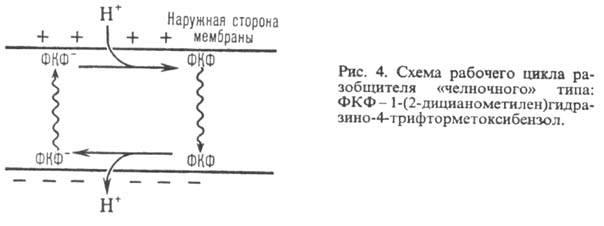
Разобщающим действием обладают также ионофоры (напр., грамицидин), повышающие электропроводность мембраны в результате образования ионных каналов или в-ва, разрушающие мембрану (напр., детергенты).
Билет 37
БИОЭНЕРГЕТИКА
наука о превращении
энергии в живых организмах. Изучает
одну из универсальных ф-ций живых существ
- способность к энергообеспечению
жизнедеятельности в результате
использования внеш. энергетич. ресурсов.
В основе этого процесса лежат мол.
механизмы, гл. роль в к-рых играют ферменты
энергетич. обмена. Процессы, катализируемые
этими ферментами, подразделяют на две
группы. Одна из них включает преобразование
внеш. энергетич. ресурсов в энергию,
аккумулируемую АТФ (см. Аденозинфосфорные
кислоты), или
энергию, обусловленную разностью
трансмембранных электрохимических
потенциалов ионов Н + или
Na+ (соотв.![]() или
или![]() ).
).
Составными
частями ![]() и
и![]() служат
градиенты концентрации ионов Н+ или
Na+ и
разность электрич. потенциалов между
двумя отсеками, разделенными биол.
мембраной. Главную роль среди процессов,
связанных с преобразованием энергии,
играют синтез АТФ из аденозиндифосфата
и Н 3 РО 4 за
счет энергии дыхания, а
у фотосинтезирующих организмов - за
счет энергии света. В обоих случаях на
пути от внеш. энергетич. ресурсов к АТФ
промежут. источником энергии служит
служат
градиенты концентрации ионов Н+ или
Na+ и
разность электрич. потенциалов между
двумя отсеками, разделенными биол.
мембраной. Главную роль среди процессов,
связанных с преобразованием энергии,
играют синтез АТФ из аденозиндифосфата
и Н 3 РО 4 за
счет энергии дыхания, а
у фотосинтезирующих организмов - за
счет энергии света. В обоих случаях на
пути от внеш. энергетич. ресурсов к АТФ
промежут. источником энергии служит ![]() .
Синтез АТФ в результатегликолиза
(брожения )осуществляется
без участия энергии трансмембранного
электрохим. потенциала. Превращение
энергии, выделяющейся в результате
дыхания, локализовано во внутр. мембране
митохондрий и цитоплазматич. мембране
дышащих бактерий. Превращение энергии
света происходит во внутр. мембранах
хлоропластоз растений и в цитоплазматич.
мембране фотосинтезирующих бактерий.
Гликолиз осуществляется вне мембран в
цитоплазме.
.
Синтез АТФ в результатегликолиза
(брожения )осуществляется
без участия энергии трансмембранного
электрохим. потенциала. Превращение
энергии, выделяющейся в результате
дыхания, локализовано во внутр. мембране
митохондрий и цитоплазматич. мембране
дышащих бактерий. Превращение энергии
света происходит во внутр. мембранах
хлоропластоз растений и в цитоплазматич.
мембране фотосинтезирующих бактерий.
Гликолиз осуществляется вне мембран в
цитоплазме.
Др. группа процессов
объединяет многочисл. пути использования
энергии АТФ или ![]() при
совершении разл. типов работы. Так,
биосинтез обеспечивается, как правило,
энергией АТФ, осмотич. работа - энергией
при
совершении разл. типов работы. Так,
биосинтез обеспечивается, как правило,
энергией АТФ, осмотич. работа - энергией![]() .
Механич. работа у бактерий (биение
бактериального жгутика) происходит с
использованием энергии
.
Механич. работа у бактерий (биение
бактериального жгутика) происходит с
использованием энергии![]() ,
а у животных (сокращение актомиозиновых
нитей)-АТФ.
,
а у животных (сокращение актомиозиновых
нитей)-АТФ.
От Б., изучающей один из фундам. аспектов биологии, следует отличать технич. Б. - отрасль пром. энергетики, связанную с переработкой отходов с. х-ва в горючие газы, к-рые можно использовать в кач-ве топлива.
Энергетика биохимических процессов
Возможность спонтанного прохождения какого-либо процесса зависит от того, какой знак будет иметь разность химических потенциалов конечного и исходного состояния системы (ΔΡ = P2 - Р1). Если P2 меньше Р1 и ΔΡ — величина отрицательная, то процесс идет спонтанно и при этом производится работа. Такой процесс носит название экзергонического (1). Если разность потенциалов близка к нулю, то система находится в равновесии (2). В случае эндергонического процесса ΔΡ — величина положительная (3), т. е. процесс не может идти самопроизвольно.
Для того чтобы запустить эндергонический процесс, необходимо воспользоваться принципом энергетического сопряжения. Наиболее наглядно это можно продемонстрировать на примере механической работы (4): когда две массы M1 и M2 связаны шнуром, M1 будет двигаться вверх несмотря на то, что этот процесс эндергонический, т. е. в сопряженной системе определяющим фактором будет сумма разностей потенциалов двух процессов (ΔРЭФФ = ΔP1 + ΔP2). Суммарный процесс возможен при условии, если ΔРЭФФ — величина отрицательная. Благодаря энергетическому сопряжению возможно взаимопревращение одних форм работы и энергии в другие. Например, в батарейке карманного фонарика экзергоническая химическая реакция генерирует электрическое поле, которое используется для эндергонического процесса получения световой энергии. В мышцах химическая Энергия трансформируется в механическую работу и тепловую энергию.
Свободная энергия и законы термодинамики
Живые организмы с точки зрения термодинамики - открытые системы. Между системой и окружающей средой возможен обмен энергии, который происходит в соответствии с законами термодинамики.
1. Законы термодинамики
Первый закон - закон сохранения энергии; его можно сформулировать так: общая энергия системы и окружающей среды - величина постоянная.
Внутри рассматриваемой системы энергия может переходить от одной её части к другой или превращаться из одной формы в другую.
Второй закон гласит, что все физические и химические процессы в системе стремятся к необратимому переходу полезной энергии в хаотическую, неуправляемую форму. Мерой перехода или неупорядоченности системы служит величина, называемая энтропией (S), она достигает максимума, когда система приходит в истинное равновесие с окружающей средой.
2. Свободная энергия
Каждое органическое соединение, поступающее в организм извне или входящее в состав живой материи, обладает определённым запасом внутренней энергии (Е). Часть этой внутренней энергии может быть использована для совершения полезной работы. Такую энергию системы называют свободной энергией (G).
При постоянных температуре и давлении соотношение между изменением свободной энергии системы (ΔG) и изменением энтропии (ΔS) можно представить следующим уравнением:
ΔG = ΔН - T×S, где ΔН - изменение энтальпии (внутренней энергии или теплоты, содержащейся
265
в системе); Т - абсолютная температура. В условиях, при которых протекают биохимические реакции, ΔН приблизительно равно ΔЕ (изменению внутренней энергии системы в результате реакции). Для биологических систем измерение свободной энергии производят обычно при стандартных условиях, когда рН 7,0, температура 25 °С, все растворы находятся в концентрации Г моль/л, а все газы при давлении в 1 атм.
При стандартных условиях все функции обозначают как ΔG0', ΔS0' и ΔН0'. Изменение стандартной свободной энергии (AG0') можно вычислить, зная константу равновесия (K'eq) химической реакции.
3.Эндергонические и экзергонические реакции
Направление химической реакции определяется значением ΔG. Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоническими. Если при этом абсолютное значение ΔG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую.
Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими.
Если абсолютное значение ΔG велико, то система устойчива, и реакция в таком случае практически не осуществляется. При ΔG, равном нулю, система находится в равновесии (табл. 6-1).
4. Сопряжение экзергонических и эндергонических процессов в организме
В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора.
Рассмотрим подробнее энергетику сопряжённых реакций на примере фосфорилирования глюкозы.
Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической:
(1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль).
Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы.
(2) АТФ → АДФ + Н3РО4 (ΔG = -30,5 кДж/моль).
При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой (см. раздел 7), фосфорилирование глюкозы легко протекает в физиологических условиях; равновесие реакции сильно сдвинуто вправо, и она практически необратима:
(3) Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль).
Б. Характеристика высокоэнергетических фосфатов. Цикл АТФ-АДФ
В живых организмах существует целая группа органических фосфатов, гидролиз которых приводит к освобождению большого количества свободной энергии. Такие соединения называют высокоэнергетическими фосфатами
разные фосфорилированные соединения обладают разным запасом свободной энергии. К группе высокоэнергетических фосфатов, помимо АТФ, относят енолфосфаты, ангидриды и фосфогуанидины. Соединения, расположенные в нижней части таблицы, составляют группу низкоэнергетических фосфатов. Центральное место среди этих соединений занимает АТФ' (рис. 6-2).
АТФ - молекула, богатая энергией, поскольку она содержит две фосфоаншдридные связи (β, γ). При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi При этом изменение свободной энергии составляет -7,3 ккал/моль. При условиях, существующих в клетке в норме (рН 7,0, температура 37 °С), фактическое значение ΔG0' для процесса гидролиза составляет около -12 ккал/моль. Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват
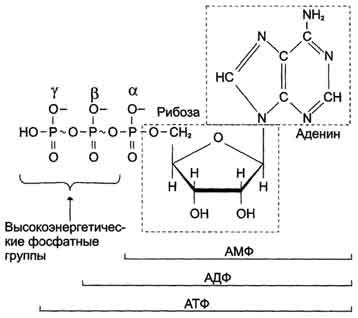
Рис. 6-2. Аденозинтрифосфорная кислота (АТФ). В молекуле АТФ две высокоэнергетические (макроэргические) связи β и γ, они обозначены на рисунке знаком ~ (тильда).
или 1,3-бисфосфоглицерат; в свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина. АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов АТФ; к ним относят гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ) и цитидинтрифосфат (ЦТФ). Все эти нуклеотиды, в свою очередь, образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ.
Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч.
Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счёт энергии окисления органических соединений (рис. 6-3). Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах, а АТФ - универсальная "энергетическая валюта".
Билет 38
Ацетил-КоА, образующийся при окислении пирувата, жирных кислот и аминокислот, включается в цикл Кребса.
1. На первой стадии
происходит синтез лимонной кислоты,
или цитрата, при участии фермента
цитратсинтазы.
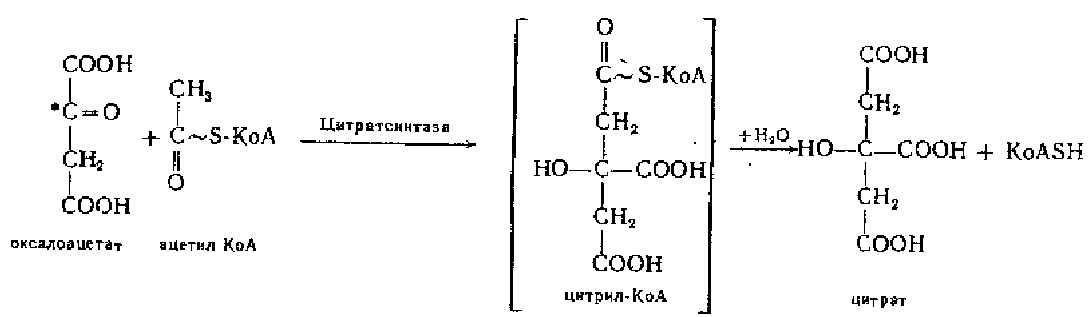
Углерод метилъной группы ацетила взаимодействует с атомом углерода оксалоацетата (помечен звездочкой). Промежуточным соединением является, как считают, цитрил-КоА, который гидролизуется с образованием свободного цитрата. Гидролиз богатой энергией тиоэфирной связи сдвигает равновесие реакции в сторону образования цитрата и делает реакцию практически необратимой (Дб=— 37,5 кДж/моль) в физиологических условиях. Потери энергии в ходе гидролиза цитрил-КоА обеспечивают включение ацетильного фрагмента в цикл Кребса с образованием цитрата.
2. Второй фермент
цикла Кребса — аконитатгидратаза
— катализирует
обратимые превращения трех трикарбоновых
кислот — цитрата,
цис-аконитата и
изоцитрата:
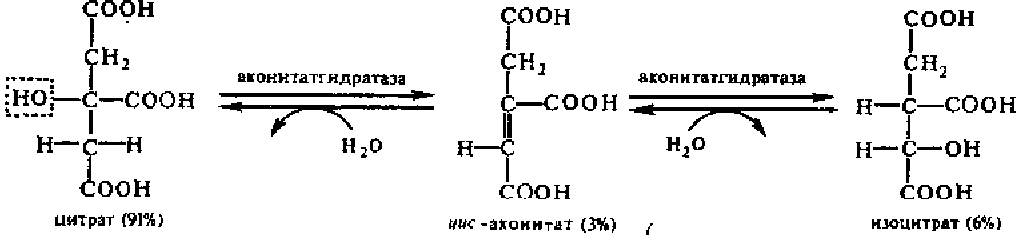
Равновесие в системе устанавливается при соотношении трех субстратов, указанном в уравнении реакции. Аконитатгидратаза катализирует присоединение протона и гидроксила воды в транс-положении по месту двойной связи цис-аконитата. При этом образуется либо цитрат, либо изоцитрат. Особенностью этого фермента является необходимость для реакции ионов Fea+, образующих металлосубстратный комплекс. Чтобы сместить равновесие аконитазной реакции в ту или другую сторону, надо расходовать изоцитрат или цитрат.
3. Ферментов,
расщепляющих цитрат внутри митохондрий,
нет, а превращение изоцитрата
катализируется третьим ферментом цикла
Кребса — изоцитратдегидрогеназой.
Как всякая
дегидрогеназа, этот фермент имеет
кофермент — акцептор водорода, отщепляемый
от субстрата. Истинная изоцитратдегидрогеназа
цикла Кребса — НАД-зависимый фермент,
который содержится только в матриксе
митохондрий и катализирует дегидрирование
изоцитрата по уравнению
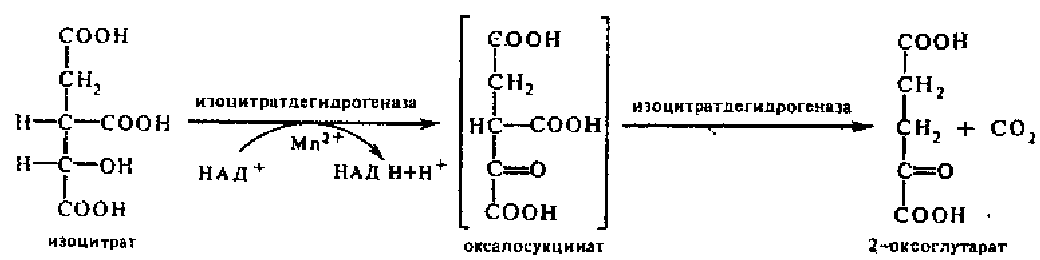
Одновременно идет декарбоксилирование промежуточного продукта реакции (оксалосукцинат) на поверхности фррмента.
Другая, НАДФ-зависимая, изоцитратдегидрогеназа находится в основном в цитоплазме клетки (~80%), и лишь небольшие количества ее присутствуют в митохондриях. Эта дегидрогеназа участвует в реакциях синтеза.
Реакция, катализируемая изоцитратдегидрогеназой, требует присутствия ионов Мn2+ или Mg + н является практически необратимой (ДО = = —20,8 кДж/моль). Потери в энергии при декарбоксилировании обеспечивают непрерывность-утилизации изоцитрата, что в свою очередь способствует смещению равновесия аконитатгидратазной реакции в сторону образования изоцитрата из цис-акоНитата.
4. 2-Оксоглутарат
превращается полиферментным
2-оксоглутаратдегидрогенаэным комплексом,
который по действию сходен с
пируватдегидрогеназным комплексом.
Сходство в их механизме действия не
случайно, так как оба ферментных комплекса
катализируют окисление а-кетокислот,
2-Оксоглутаратдегидрогеназный
комплекс (четвертый
фермент цикла Кребса) окисляет
2-оксоглутарат по уравнению:


Акцептором фосфорила
в этой реакции является ГДФ, поэтому
энергия сначала аккумулируется в
фосфатных связях ГТФ. Затем с помощью
фермента нуклеозиддифосфаткиназы,
связанного с
внутренней мембраной митохондрий,
происходит перенос фосфорила с ГТФ на
АДф с образованием АТФ:
![]()
6. Сукцинат подвергается
превращению с участием сукцинатдегидрогеназы.
Особенностью
этого фермента является то, что акцепторами
электронов и протонов, отщепляемых
от сукцината, служат ФАД и железосеропро-теид,
содержащий негеминовое железо (FeS).
Железосеропротеиды связаны с субъединицами
сукцинатдегидрогеназы. Кроме того, это
единственный фермент цикла Кребса,
прочно связанный с внутренней мембраной
митохондрий. Он как бы «утоплен» своей
гидрофобной частью в липидную часть
мембраны, а активный центр фермента
обращен в матрикс, где в растворенном
виде находится сукцинат. При дегидрировании
сукцнната электроны переходят через
негеминовое железо железосеропротенда
к ФАДу, который является конечным
акцептором электронов и протонов в этой
реакции:
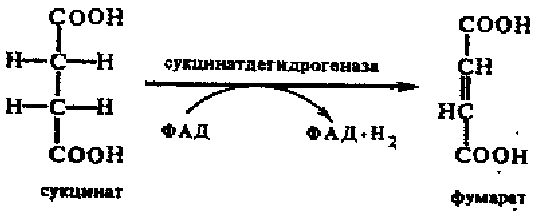
Сукцниатдегидрогеназа катализирует отщепление от сукцината атомов водорода, находящихся в транс-положении. Поэтому образуется транс-форма дикарбоновой кислоты — фумарат, а не цис-форма — малеат. Сукцинат-дегидрогеназная реакция обратима.
7. На следующем этапе
происходит стереоспецифнческое
присоединение протона и гидроксила
воды к фумарату, катализируемое
фумаратгидратазой,
по уравнению
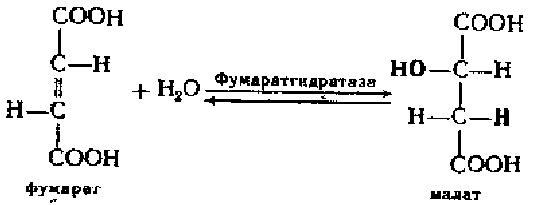
Следовательно, этот фермент цикла Кребса обладает стереохимнческой субстратной специфичностью.
8. Завершающей стадией цикла Кребса является регенерация оксало-ацетата. Это происходит путем окисления палата, катализируемого малат-дегидрогеназой.
Малатдегидрогеназа цикла Кребса- НАД зависимый фермент и имеет несколько изоферментов.
Реакция, катализируемая этим ферментом, обратима и описывается уравнением:
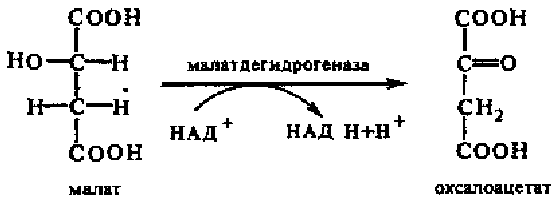
Существует и НАДФ-зависимая малатдегидрогеназа, но она сосредоточена преимущественно вне "митохондрий (в цитозоле). Этот фермент одновременно с дегидрированием катализирует и декарбоксилирование субстрата:
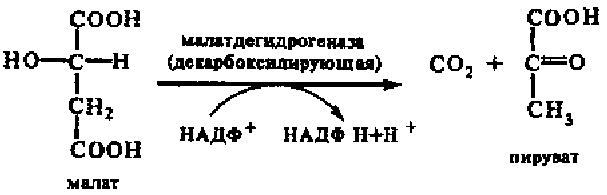
Сравнив эти два фермента, можно видеть, что НАДФ-зависимый фермент не имеет отношения к циклу Кребса, так как под действием этого фермента нe происходит регенерации оксалоацетата, необходимого для замыкания цикла. НАДФ-малатдегидрогеназа необходима как генератор НАДФ-Н2 для синтетических процессов или как фермент, способствующий восполнению малата, расходующегося в других реакциях.
Общая последовательность реакций цикла Кребса представлена на рис. 34. Хотя цикл Кребса изображают в виде замкнутого ферментативного процесса, следует обратить внимание на одну его особенность: обратимость ферментативных реакций на участке от сукцнната до оксалоацетата. Поэтому в митохондриях эта ветвь может работать в обратном направлении, т. е. оксалоацетат может превращаться в метаболиты цикла Кребса вплоть до сукцнната. Такая возможность представляется, когда нарабатывается оксалоацетат из других субстратов с помощью вспомогательных реакций.
Дополнительное образование: молекул оксалоацетата необходимо в ситуациях, при которых в ходе распада веществ образуется много ацетил-КоА (например, при интенсивном окислении жирных кислот, пируваТа, некоторых аминокислот). Если количество оксалоацетата недостаточно для синтеза из него и ацетил-КоА цитрата, то цикл Кребса не успевает перерабатывать ацетильные остатки, и они используются в других ферментативных процессах.
Суммарное уравнение превращения ацетил-КоА ферментами цикла Кребса имеет вид
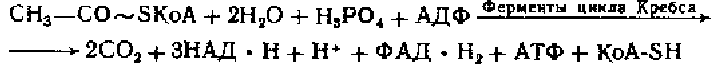
Круговорот веществ а цикле Кребса организован столь целесообразно, что ферменты цикла по ходу его используют молекулы воды, имеющейся в изобилии, для производства водорода. Источником избыточных пяти атомов водорода являются две молекулы воды, присоединяющиеся к субстратам на стадиях превращения цитрнл-КоА в цитрат и фумарата в малат, а также неорганический фосфат, участвующий в реакции субстратного фосфор ил и-ровання — образовании сукцнната из сукцинил-КоА. Поскольку молекулы воды служат источником водорода, можно сказать, что вода выполняет энергетическую роль в животных клетках.
Биохимические функции цикла Кребса
1. Интегративная — цикл Кребса является своеобразным метаболическим «коллектором», который объединяет пути катаболизма углеводов, липидов и белков.
2. Амфмболическая — цикл Кребса выполняет двойственную функцию:, катаболическую, поскольку в нем происходит распад ацетильных остатков, н анаболическую, поскольку субстраты цикла Кребса используются на синтез других веществ. Так, оксалоацетат идет на синтез аспарагиновой кислоты и глюкозы, 2-оксоглутарат — на синтез глутаминовой кислоты, сукцинат — на синтез гема.
3. Энергетическая — в ходе реакций цикла Кребса образуется одна молекула АТФ на уровне субстрата на 1 моль поступившего ацетил-КоА.
4. Водороддонорная (или водородгенерирующая) — цикл Кребса является основным генератором водорода для дыхательной цепи В цикле Кребса
На последней функции цикла Кребса следует остановиться особо. Прежде всего, необходимо напомнить, что все процессы, «питающие» цикл Кребса или остатками уксусной кислоты, т. е. ацетил-КоА, или другими промежуточными продуктами цикла, т. е. ди- и трикарбоновымн кислотами, обеспечивают ' работу цикла Кребса и его функцию генератора водорода для дыхательной цепи. К этим процессам относятся цикл окисления жирных кислот, и пирувата (источники ацетил-КоА), реакции распада углеродного скелета аминокислот (источники ацетил-КоА и дикарбоновых кислот). Торможение процессов, ведущих к образованию ацетил-КоА или метаболитов циила Кребса, из других веществ, выключает цикл Кребса из работы. Дыхательная-цепь лишается главного источника поступления водорода, использующегося на образование энергии.
Биохимические функции цикла Кребса указывают на то, что уксусная кислота и любое вещество, являющееся непосредственным компонентом цикла Кребса, должны быть хорошим источником энергии и их можно потреб-лить с пищей как ценные энергетические вещества, лишь бы они, поступав в клетку, могли достигнуть ферментной системы цикла Кребса, расположенной внутри митохондрий. Ацетат в клетках может активироваться и превращаться в ацетил-КоА, а значит, для уксусной кислоты это предположение справедливо. То же относится к некоторым субстратам цикла, проникающим через митохондркальную мембрану, особенно к субстратам дегидрогеваз: нзо-цитрату, 2-океоглутарату, сукцинату и малату. Возможности их использования
как энергетически ценных препаратов для медицинских целей и показания к назначению сейчас изучаются.
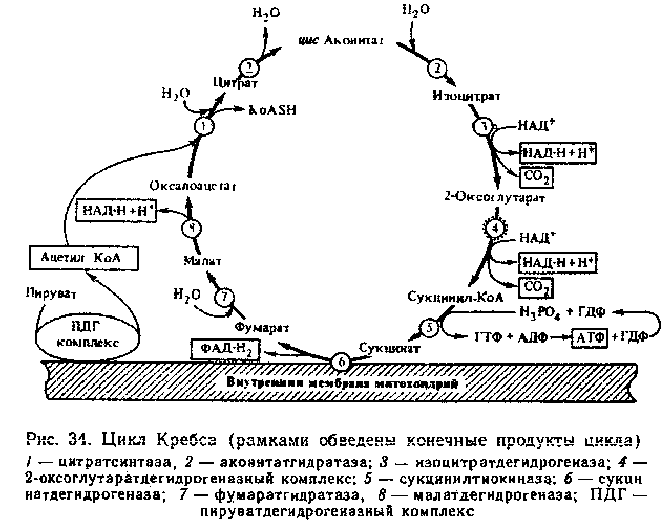
Билет 39
Углеводы наряду с белкамн — наиболее распространенные соединения, участвующие в построении клетки и используемые в' процессе ее жизнедеятельности.
Углеводами (сахарами) называют полиоксикарбоиильные соединения и их производные. Характерным отличительным признаком углеводов является наличие не менее двух гидроксильных групп и карбонильной (альдегидной или кетонной) группы. Следовательно, самыми простыми углеводами можно назвать глицеральдегид и диоксиацетон:

Классификация углеводов основана на их структуре (схема 3) к физико-химических свойствах.
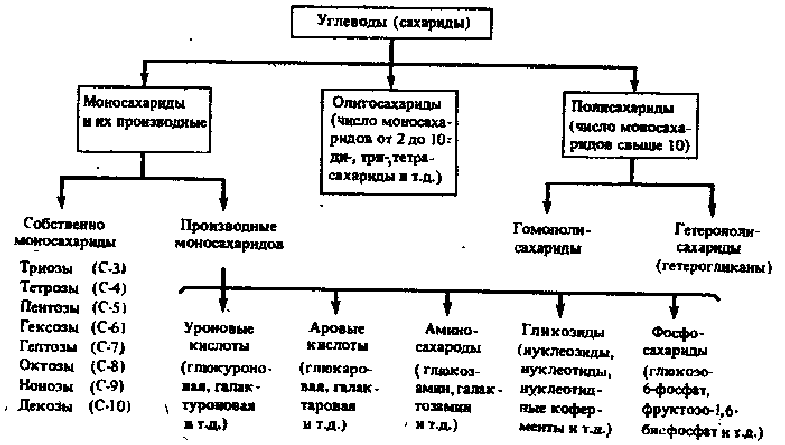
По физико-химическим свойствам углеводы делят на нейтральные, содержащие только гидроксильные и карбонильные группы; основные, включающие кроне названных аминогруппу (амнносахара); кислые, содержащие кроме гидрокенльных и карбонильных групп карбоксильные группы.
