
chudina_himia
.pdf
Министерство образования Республики Беларусь
БЕЛОРУССКИЙ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
«Кафедра Водоснабжение и водоотведение»
ХИМИЯ ВОДЫ И МИКРОБИОЛОГИЯ
Лабораторный практикум
Минск 2007
Составитель:
О.А.Чудина
Настоящий практикум разработан в соответствии с типовой программой «Химия воды и микробиология» (ФЭС – 54/1ТИП), утвержденной 24.12.2002г. для спец. 1-70 04 03 «Водоснабжение, водоотведение и охрана водных ресурсов» с учетом аналогичного лабораторного практикума, утвержденного БПИ, 1981г.
Настоящий практикум рассмотрен и одобрен в качестве временного методической комиссией кафедры «Водоснабжение и водоотведение» БНТУ (протокол №5 от 25 июня 2007г.)

МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ РАБОТЕ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
1.При всех работах соблюдать максимальную осторожность, помня, что неаккуратность, невнимательность, недостаточное знакомство с приборами и свойствами испоьзуемых веществ могут повлечь за собой насчастный случай.
2.Никаких веществ в лаборатории не пробовать на вкус. Нюхать какие бы то ни было вещества с осторожностью, не вдыхая полной грудью, а направляя к себе пары или газ движением руки.
3.Не выпаривать на рабочих столах веществ, образующих вредные газы, как, например, кислот, аммиачных жидкостей, содержащих сероводород, хлор, синильную кислоту и т.д.
4.Не проводить никаких опытов в нечистой посуде.
5.Следить за чистотой реактивов: избыток взятого реактива не выливать обратно в склянку, сухие реактивы брать чистыми шпателями.
6.Уходя из лаборатории, не оставлять включенными нагревательные приборы, горящие горелки.
7.Работы с крепкими щелочными растворами, их соединениями производить с большой осторожностью.
8.При разбавлении концентрированной серной кислоты вливать кислоту в воду, а не наоборот, во избежание разбрызгивания и даже взрыва.
9.Концентрированные кислоты – соляную, азотную и аммиак – разливать под тягой.
10.Не наклоняться над сосудом, в котором что-либо кипит или в который наливается другая жидкость, так как брызги могут попасть в глаза.
11.При перегонке огнеопасных жидкостей учитывать, что колба может лопнуть. В случае воспламенения жидкости при растрескивании колбы выключить ток, отставить сосуд, прикрыть пламя одеялом.
12.Спирты и другие жидкости, растворимые в воде, можно заливать водой.
13.Если загорится платье, не бежать, а гасить пламя одеялом.
14.Если загорятся электрические провода, то необходимо отключить ток, а затем применять воду или огнетушители.
15.При химических ожогах немедленно обмыть водой из-под крана пораженный участок, затем обработать 2%-м раствором NaHCO3 или слабым раствором аммиака – при ожоге кислотами, 1%-м раствором лимонной или уксусной килоты – при ожогах щелочами.
При попадании кислоты или щелочи в глаза:
1.промыть глаза большим количеством воды;
2.промыть разбавленным раствором NaHCO3 (попадание кислоты);
3.помыть насыщенным раствором борной кислоты (попадание щелочи);
Химия воды и микробиология |
3 |

Раздел 1
ОСНОВЫ ХИМИЧЕСКОГО АНАЛИЗА
1.1Понятие о качественных и количественных определениях и основах расчета при анализах
В природе нет абсолютно нерастворимых веществ. Все они в той или иной серени подвергаются воздействию воды, отличаясь друг от друга только количеством перходящего в раствор вещества. Даже горные породы – гранит, базальт – и те постепенно разрушаются водой, обогащая ее растворимыми веществами.
Поэтому в естественном состоянии вода всюду представляет собой сложный раствор различных веществ, который принято называть природной водой в отличие от химически чистой воды H2O.
Сложность состава природных вод подтверждается хотя бы тем, что один и тот же элемент может находиться в воде в различных соединениях.
Так, например, азот находится в воде в виде растовенных свободных молекул N2, раствореннх газообразных соединений NH3, ионов неорганических веществ NO2 и NO3 , а также многочисленных органических веществ в молекулярном и коллоидном состоянии.
Под ъимическим составом природных вод надо понимать весь сложный комплекс минеральных и органических веществ, находящихся в разных вормах ионно-молекулярного и коллоидного состояния.
С некоторой условностью химический состав природных вод можно разделить на следующие пять групп:
1.главные иноы, т.е. содержащиеся в наибольшем количестве (хлоридные Cl , сульфатные SOw2 , гидрокарбонатные HCO3 , карбонатные CO32 , натрия Na+, калия K+, магния Mg2+ и кальция
Ca2+;
2.растворенные газы (кислород O2, азот N2, двуокись углерода CO2, сероводород H2S и др.);
3.биогенные элементы (соединения азота, фосфора, кремния);
4.микроэлементы – соединения всех остальных химических элементов;
5.органические вещества.
Несколько особое положение занимают ионы водорода H+, находящиеся в природных водах в очень небольшом количестве, но играющие большую роль в химических и биологических процессах, протекающих в природных водах.
Анализ воды включает в себя элементы качественнорго и каоличественного анализа.
Цель качественного анализа заключается в открытии отдельных ионов или соединений, содержащихся в исследуемой воде.
Количественный анализ позволяет установить содержание отдельных компонентов в определенных единицах. Качественный анализ предшествует количественному.
Вкачественном анализе используются химические реакции, сопровождающиеся образование труднорастворимого соединения, изменением окраски раствора, выделением газа.
Вводных растворах реакции идут между ионами. Для записи аналитических реакций испоьлзуются ионные уравнения, в которых труднорастворимые, газообразные соединения записываются в молекулярной форме.
Реакции, с помощью которых можно открывать данный ион в присутствии других, называются специфическими. Часто открытию отдельных ионов мешают другие ионы, присутствующие в растворе.
4

Поэтому мешающие ионы предварительно удаляют из раствора, переводя их в труднодорастворимые соединения.
Количественное содержание компонентов в растворе характеризуется концентрацией. Концентрацией раствора называется весовое или объемное содержание растворенного вещества в
определенном объеме или весовом количестве раствора. За единицу объема принимают 1л. Количественное выражение результатов анализа зависит от размерности концентрации растоврен-
ного вещества, формы соединения, в которой выражен результат определения данного вещества; формы выражения концентрации растворенного вещества:
1.Размерность. В настоящее время в гидрохимии приняты следующие выражения размерностей по группам концентраций:
(a)главные ионы при общей минерализации воды более 1 г/кг – в г/кг – в мг/кг или мг/л, так как при данных условиях один литр воды практически равен одному килограмму;
(b)растворенные газы – количеством миллиграммов, растворенных в одном литре воды (мг/л);
(c)биогеные элементы – мг/л;
(d)микроэлементы – мг/л или в виде степенного выражения, например, 4 10 8г/л.
2.Формы соединения. Форма соединения, в которой выражен результат анализа, отражается на количественном содержании данного элемента. К сожалению, иногда это не учитывается и встречаются такие указания, как «фосфатов содержится 0,05 мг/л» или «нитратов 0,3 мг/л» без указания,
ввиде какого соединения выражен результат определения.
Например, нитратный ион изображают в виде NO или NNO – это наиболее общепринятая в
3
3
настоящее время форма соединения, выраженная в виде ионов или элемента, представляющего непосредственный интерес в данном соединении. Способ изображения соединения в виде элемента удобен для сравнения разных соединений одного и того же элемента, например, нитратных, нитритных, аммонийных ионов и органического азота.
Если концентрация нитратных ионов, выраженная в NO3 = 0,5 мг/л, то в виде элемента она будет равна
0; 5 14=62 = 0; 113:
3.Форма выражения концентрации. Наиболее употребительны следующие:
(a)Весовая концентрация показывает. сколько весовых частей растворенного вещества содержится в определенном весовом количестве раствора.
Наиболее часто в этой форме пользуются весовой процентной концентрацией. Она указывает, сколько граммов растворенного вещества содержится в 100г раствора;
(b)Объемная концентрация показывает, сколько весовых частей растворенного вещества содержится в определенном объеме раствора (мг/л);
(c)Нормальная (эквивалентная) концентрация показывает, сколько грамм-эквивалентов (г-экв) растворенного вещества содержится в 1 л раствора (г-экв/л).
Эквивалент равен массе вещества, реагирующей с 1,008 весовыми частями кислорода. Один грамм-эквивалент вещества численно равен его эквиваленту, выраженному в граммах. Грамм-эквивалент простого вещества равен частному от деления 1 моля (г-атома или г-иона) данного вещества на число электронов, которое в данной реакции 1 молекула (1 атом или 1 ион) этого вещества присоединяет или отдает.
Расчет эквивалентов сложных веществ производится следующим образом: для кислот и ос-
нований Э = Ма , для солей Э = аМb , где М – молекулярная масса кислоты, основания или соли; а – число ионов H+ в кислоте или число ионов OH в основании, или число ионов металла в соли; b – степень окисления металла (валентность).
Раствор, содержащий в 1 л 1 ш-экв растворенного вещества, называется однонормальным (1H), 0,1 г-экв – децинормальным (0,1H), 0,01 г-экв – сантинормальным (0,01H). Так как концентрация солей в природных водах невелика, то вместо грамм-эквивалента принимают тысячную долю его – миллиграмм-эквивалент (мг-экв0.
(d)Молярная концентрация показывает, сколько молей растворенного вещества содержится в 1 л раствора (моль/л).
Химия воды и микробиология |
5 |

1.2Выражение результатов анализа воды
Результаты определений выражают в виде концентраций ионов, присутствующих в водных растворах. Существует весовая, эквивалентная и процент-эквивалентная формы выражения результатов анализа воды. При весовой форме содержание ионов выражают в мг/л. Для количественного соотношения между ионами весовое содержание их переводят в эквивалентное, концентрацию отдельных ионов выражают в мг-экв/л.
Процент-эквивалентную форму применяют для сравнения отдельных анализов. При вычислении процент-эквивалентов сумму катионов и анионов принимают за 100%.
Задачи.
1.При анализе воды получено содержание (в мг/л) HCO3 – 128,4; SO42 – 286,5; Ca2+ – 12,6. Выразить эти данные в эквивалентной форме.
2.При анализе воды найдено содержание (в мг-экв/л) SO42 – 0,48; Cl – 0,23; Mg2+. Выразить в весовой форме.
1.3Методы количественного анализа воды
1.3.1Весовой метод анализа
Концентрацию отдельных компонентов природных и сточных вод можно определить. переводя их в труднорастворимые соединения. Получающийся при действии определенного реагента осадок высушивают, прокаливают и взвешивают на аналитических весах с точностью до 0,0002г. Труднорастворимое соединение, образующееся при выделении вещества, называется осаждаемой формой. При прокаливании состав меняется. Остающееся после прокаливания соединение называется весовой формой. весовой анализ состоит из следующих операций: осаждение, фильтрование, промывание, высушивание, прокаливание, взвешивание осадка, вычисление результатов.
1.3.2Объемный метод анализа
Объемный метод количественного анализа основан на точном измерении объемов реагирующих веществ, концентрация одного из которых известна. Растворы с точно установленной концентрацией называют титрованными. Так как они используются для определения концентрации исследуемых растворов, то их называют рабочими или стандартными. процесс прибавления стандартного раствора к раствору исследуемого вещества называется титрованием. Титрование ведется до достижения точки эквивалентности, т.е. до того момента, когда количество прибавленного стандартного раствора будет эквивалентно количеству определяемого вещества. Необходимое условие объемного анализа – точная фиксация точки эквивалентности. Для фиксации точки эквивалентности употребляют специальные вещества, изменяющие цвет с изменением концентрации исследуемого иона. Такие вещества называются индикаторами. Обязательное условие применения индикатор – точное совпадение изменения его окраски с точкой эквивалентности. Так как вещества реагируют между собой в весовых количествах, пропорциональных их эквивалентам, то наиболее удобной формой выражения концентрации растворов в объемном анализе является нормальная.
Растворы одинаковой нормальности реагируют между собой равными объемами. В случае неравенства нормальностей объемы реагирующих растворов обратно пропорциональны нормальным концентрациям
V1 = N2 ;
V2 N1
где V1 и N1 – объем и нормальная концентрация одного раствора, а V2 и N2 – объем и концентрация другого раствора.
Если нужно выразить концентрацию N2 в миллиграмм-эквивалентах C2, то формула приобретает вид:
C2 = V1 N1 1000 мг экв=л:
V2
Если следует выразить найденный результат в весовой форме, то в вышеприведенную формулу вводят эквивалент Е.
6 |
Химия воды и микробиология |

С2 = V1 N1 E 1000 мг=л:
V2
В зависимости от типа реакции, которая протекает при титровании, выделяют следующие методы объемного анализа:
1.Нейтрализация. В основе лежит реакция найтрализации – взаимодействие между кислотой и щелочью.
Этим методом определяют кислотность, щелочность, карбонатную и устранимую жесткость воды.
2.Окислительно-восстановительные методы. Применяются окислительно-восстановительные реакции, в процессе которых исследуемое вещество количественно переводят в окисленную или восстановленную форму.
Окислительно-восстановительными реакциями называются химические реакции, протекающие с изменением валентности некоторых элементов реагирующих веществ.
Окисление – отдача электронов атомом или ионом, при этом возрастает положительная или уменьшается отрицательная валентность.
Вещества, атомы или ионы, отдающие электроны, называются восстановителями.
Восстановление – присоединение атомом или ионом электронов, сопровождающееся уменьшением положительной и увеличением отрицательной валентности. Вещества, атомы или ионы, принимающие электроны, называются окислителями.
К восстановителям относятся большинство металлов, водород, водородные соединения серы, хлора и т.д.
Окислителями являются кислород, озон, перманганат калия KMnO4 хромат K2CrO4 и бихромат калия K2Cr2O7 и т.д.
3.Осаждение. Объемные определения этого метода основаны на осаждении определяемого иона в виде труднорастворимого соединения. В анализе воды метод осаждения применяется для определения хлорид-ионов, которые связываются ионами Ag+ втруднорастворимый хлорид серебра AgCl.
4.Комплексонометрия. В этом методе исследуемый ион связывается вводимым реактивом в малоассоциированный комплекс. Например, определение общей жесткости воды, где используются комплексон-трилон Б, представляющий собой двузамещенную натриевую соль этилендиаминотетрауксусной кислоты.
1.3.3Колориметрический метод анализа
Окрашенные растворы обладают способностью поглощать свет определенной дляны волны. Это свойство окрашенных растворов используют в колометрическом анализе.
При пропускании луча света с интенсивностью J0 через окрашенный раствор вследствие поглощения его интенсивность снизится до Jt.
Чем больше на пути света, проходящего через окрашенный раствор, попадает ионов или молекул вещества и чем больше толщина окрашенного слоя, тем сильнее уменьшается интенсивность проходящего света.
Зависимость между концентрацией растворенного вещества, толщиной окрашенного слоя и степенью ослабления интенсивности света выражается законом Ламберта-Бора:
lg J0 = kch; Jt
где C – концентрация окрашенного вещества, моль/л; K – коэффициент погашения, зависящий от природы растворенного вещества, температуры и длины волны света; h – толщина окрашенного слоя, см.
Величина lg JJ указывает степень ослабления интенсивности света при прохождении через окра-
Jt
шенный раствор. Она называется оптической плотностью, D.
При одинаковой интенсивности падающего и проходящего света концентрации двух растворов одного и того же вещества обратно пропорциональны толщине окрашенного слоя.
Cuc = CCT: hCT:
hUC:
Химия воды и микробиология |
7 |
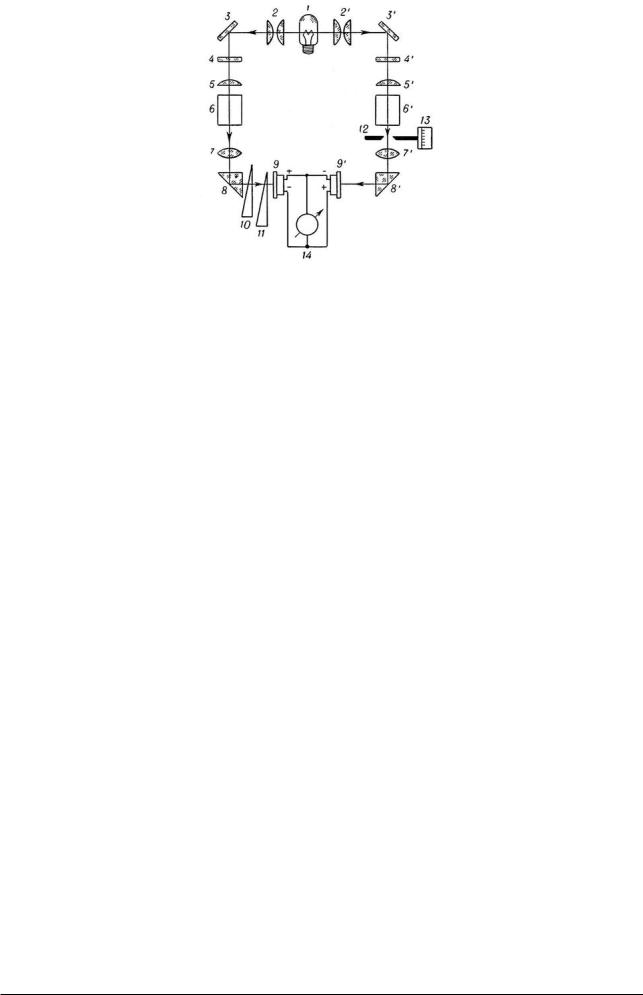
Приборы для определения концентраций исследуемых окрашенных растворов называют колориметрами. Наибольшее распространение получили фотоэлектроколориметры. Они регистрируют ток, возникающий в фотоэлементах при попадании на них луча света который прошел через кювету с раствором. Принцип работы фотоэлектрокалориметров заключается в следующем.
Пучок света, излучаемый лампой О, отражается от зеркал З1 и З2, попадает на светофильтры С 1 и С2, расположенные перед линзами Л1 Л2. Затем он проходит через кюветы с растворами и через линзы Л3 и Л4, проецируется на фотоэлементы Ф1 и Ф2, соединенные с нульгальванометром. При одинаковой интенсивности световых потоков, падающих на фотоэлементы, стрелка гальванометра стоит на нуле. Между Л3 и Ф1 расположены нейтральные клинья К разной плотности, позволяющие изменять интенсивность светового потока. Для регулирования светового потока, падающего на Ф2, между Л4 и фотоэлементом помещена щелевая диафрагма Д, соединенная с отсчетным барабаном. Прибор снабжен набором стеклянных кювет. Для сильноокрашенных растворов используют малые кюветы (l=1 – 30 мм), для слабоокрашенных – большие (l=30 – 50 мм).
Во избежание ошибок следует учитывать следующие условия колоримерических определений:
1.часто образующаяся окраска изменяется во времени, поэтому колориметрирование нужно проводить через строго определенное время;
2.интенсивность окраски растворов не должна быть очень сильной или слабой, так как возрастает ошибка опыта;
3.интенсивность окраски зависит от температуры, поэтому температура исследуемого и стандартного растворов не должна отличаться более чем на 3 град.
Методика определений на фотокалориметре Прибор включают в сеть переменного тока через стабилизатор. Неизменный световой поток уста-
навливается через 10 – 15 минут.
ошибка определения возрастает с увеличением оптической плотности. Во избежание такого рода ошибок проводят определения в пределах от 0,2 до 0,8 по шкале оптической плотности (красного цвета).
В зависимости от интенсивности окраски исследуемого раствора определение проводится двумя способами.
Первый способ используется для сильноокрашенных растворов (оптическая плотность > 0,5). В правый пучок света помещают кювету с исследуемым раствором, а в левый – кювету с чистым растворителем. Шкалу левого барабана устанавливают на нуль отсчета оптической плотности.
Включают гальванометр вначале на малую чувствительность (1) и вращением ручек настройки нейтральных клиньев приводят стрелку гальванометра к нулю. Уточняют показание, переводя переключатель на высокую чувствительность (2). Отключив гальванометр (0), заменяют кювету с исследуемым раствором чистым растворителем. Включают гальванометр и приводят стрелку его к нулю вращением отсчетного барабана. Значение оптической плотности берут по левой шкале.
Второй способ применяется для слабоокрашенных растворов. В правый и левый пучок света помещают кюветы с растворителем. Включают гальванометр и вращением ручек настройки нейтральных клиньев приводят стрелку к нулю. Включают гальванометр, в правый пучок вместо кюветы с растворителем помещают кювету с исследуемым раствором. Включают гальванометр и приводят его стрелку к
8 |
Химия воды и микробиология |

нулю, вращая отсчетный барабан. Оптическую плотность отсчитывают по правой шкале. Концентрацию вещества в исследуемом растворе можно определить методом сравнения или методом калибровочной кривой. Метод сравнения заключается в определении оптической плотности исследуемого и стандартного растворов, и по формуле находят концентрацию исследуемого раствора CUC:
DUC: = CUC: ;
Dст: Cст:
CUC: = DUC: Cст: :
Dст:
Химия воды и микробиология |
9 |

Раздел 2
ОПРЕДЕЛЕНИЕ ОСНОВНЫХ ХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПРИРОДНЫХ И СТОЧНЫХ ВОД
Химический состав природной воды определяет ее качество и, следовательно, возможность использования с той или иной практической целью.
К основным химическим показателям относятся щелочность, кислотность, содержание отдельных ионов, pH воды, десткость, окисляемость, содержание кислорода и др.
Физические показатели природной воды в данном практикуме не рассматрриваются из-за их простоты. Качество сточных вод, образующихся на промышленных предприятиях и концентриация в них загрязнаяющие веществ определяются многими факторами: отраслью промышленного производства, режимом технологических процессов, удельным расходом воды на единицу продукции и др. Мы остановичмя на некоторых важных качественных показателях – ХПК (химическое потребление кислорода)
Лабораторная работа №2 ОПРЕДЕЛЕНИЕ ОБЩЕЙ КИСЛОТНОСТИ ВОДЫ
Кислотность природных вод с pH более 4,5 зависит в основном от содержания свобожной двуокиси углерода и в некоторых случаях от присутствия гуминовых и других слабых органических кислот. Если pH воды менее 4,5 (например, водород-катионированная вода), в ней содержатся также сильные кислоты и соли сильных кислот и слабых оснований.
Различают следующие виды кислотности:
1.Общая кислотность – эквивалентна расходу сильного основания (например, NaOH) на реакцию с сильными и слабыми кислотами (включая CO2) при доведении pH раствора до 8,3.
2.Свободная кислотность – эквивалентна расходу сильного основания на реакцию только с сильными кислотами при доведении pH от величины менее 4,5 до pH = 4,5.
3.Кислотность, зависящая от содержания гуминовых кислот.
Концентрация их эквивалентна расходу сильного основания на титрование пробы воды после удаления из нее свободной двуокиси углерода, от pH 4,5 до pH 8,3 (или от перехода окраски метилоранжа до перехода окраски фенолфталеина).
Задание. Определить свободную и общую кислотность воды в контрольных пробах при pH до 4,5 или pH=4,5; pH от 4,5 до 8,3.
Реактивы:
1.0,1 н NaOH;
2.фенолфталеин (1%-ный раствор в 60%-ом спирте).
Ход работы. В коническую колбу емкостью 250 мл приливают пипеткой 100 мл исследуемой воды. Прибавляют 2-3 капли фенолфталеина. Пробу титруют 0,1 н NaOH до появления слаборозовой окраски, не исчезающей 1-2 мин.
Расчет:
X = V1 N 1000 ;
V2
10
