
28
.docx1. Приведите характеристики разбавленных растворов неэлектролитов.
Свойства идеальных жидких растворов зависят только от концентрации растворенного вещества и природы растворителя и практически не зависят от природы растворенных веществ. Такие свойства обычно называют коллигативными (коллективными). Рассмотрим четыре таких свойства.
1. Давление пара растворителя над раствором. Давление насыщенного пара растворителя над раствором (Р1) всегда меньше, чем над чистым растворителем (Р01)
Р = Р10
· χ2 или 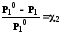
относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Это и есть первый закон Рауля.
2. Температура кипения (Ткип). Ткип прямо связана с давлением насыщенного пара над жидкостью. Любая жидкость начинает кипеть при температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Второй закон Рауля для кипения раствора: повышение температуры кипения раствора (Ткип) пропорционально моляльности раствора (Сm):
Ткип = Кэ·Сm ,
3. температура замерзания Тзам понижается пропорционально (как и Ткип) концентрации: понижение температуры замерзания растворов (𝜟Тзам) пропорционально концентрации растворенных веществ.
𝜟Тзам = Кк•Сm ,
где 𝜟Тзам = (Т0 - Т1); Сm – моляльность, Кк - криоскопическая постоянная растворителя, для воды она равна 1,85 К•кГ/моль.. Температура замерзания (Тзам)
4. осмос явление односторонней диффузии через полупроницаемую перегородку, разделяющую раствор и чистый растворитель или два раствора разной концентрации
2. Поясните следствия из закона Фарадея.
Следствие 1.
Для выделения 1 хим. эквивалента вещества при электролизе надо одно и то же количества электролита равное числу фарадея. ( F=96 485,3383(83) Кл/моль)
m=Mэ Mэ=I *t *Mэ/F
Следствие 2.
При I*t=const массы веществ, выделившихся на электродах относят между собой как их массы эквивалентов.
mx: my = Mэx: Mэy
3.Дайте определение понятию «гидролиз» и приведите примеры.
Гидролиз - химическая реакция обменного разложения воды ионами соли, протекающая без изменения с.о. участников раствора.
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
K2SiO3 + НОH =>KHSiO3 + KОН 2K+ +SiO32- + Н+ + ОH- => НSiO3- + 2K+ + ОН-
Соль, образованная слабым основанием и слабой кислотой ( СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Аl2S3 + 6HOH =>2Аl(ОН)3 + 3Н2S 2Al3+ + 3S2- + 6H+ + 6OH- =>2Аl(ОН)3 + 6Н+ + S2-
В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3, MgSO4) гидролизу подвергается катион:
FeCl2 + HOH =>Fe(OH)Cl + HCl Fe2+ + 2Cl- + H+ + OH- => FeOH+ + 2Cl- + Н+
В результате гидролиза образуется слабый электролит, ион H и другие ионы.
4.
Рассчитайте рН раствора соли
 ,
если а=80%
,
если а=80%
Na2SO3 ⟶2Na++SO32-
SO32-+ H2O⟶HSO3- +OH-
Кг=С(HSO3-)*С(OH-)/C(SO32-)*C(H2O)
С(HSO3-)=С(OH-)=>
C(OH-)2=Кг* C(SO32-)=>
С(OH-)=
Кг= С(HSO3-)*С(OH-)*С(H+)/C(SO32-)*C(H2O) *С(H+): С(OH-)*С(H+)=10-14 C(H2O)=1 Kд(HSO3- или Н2SO3 по 2 ступени )= C(SO32-)*С(H+)/С(HSO3-)=> Кг=14/Kд(HSO3- )
Kд(HSO3- )=справочные данные= 6,2·10-8
Пусть раствор C(Na2SO3)=1 моль/л,
Тогда C(SO3) = a*C(Na2SO3)=0.8 *1 моль/л=0.8моль/л
С(OH-)= =
=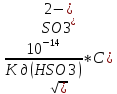 =
0.36*10-3моль/л
=
0.36*10-3моль/л
С(H+)=10-14/ С(OH-)=10-14/0.36*10-3=2.78*10-11
pH=-lgC (H+) = -(0.44-11) = 10.56
Ответ: рН=10.56
5.Рассчитайте степень диссоциации H3PO4 по 3-ей ступени.
По закону Освальда Кд=а2С =>
a=
Пусть С=1 моль/л.
Кд=1.26*10-12(по 3-ей ступени)
а=12*10-6
Ответ: 12*10-6
