
24
.docБилет 24
№1
Закон Гесса
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Докажем справедливость выполнения закона Гесса на конкретном примере, в частности реакции получения Fe2О3.
а) первый путь – окисления железа с образованием высшего оксида Fe2О3
4Fe+ 3O2=2Fe 2O3, ДH= − 821,3 кДж.
б) второй путь – двухстадийный процесс получения Fe2О3, через образование промежуточного продукта – FeО и последующим его окислением до Fe2О3:
2Fe+ O2=2FeO, ДH 2 = − 265,5 кДж.
2FeО + O2=Fe2O3, ДH 3 = − 290,3 кДж.
Алгебраически суммируем два этих термохимических уравнения, предварительно умножив уравнение на два, и далее сократим одинаковые слагаемые в левой и правой части полученного уравнения
2Fe +O2 =2FeO, ДH2 = − 2 ⋅ 265,5 кДж +
2FeО+ O2=Fe2 O3, ДH3 = − 290,3 кДж
2Fe +2FeO+ O2=2FeO+Fe2O3 ДН4 = ( -2*265,5-290,3) кДж
В результате этого получаем:
2Fe( т ) + O 2( г ) =Fe 2 O3( т ) , ДH 4 = − 821,3 кДж.
Сравнивая два термохимических уравнения, мы получаем эквивалентные уравнения. Это свидетельствует о том, что действительно, тепловой эффект реакции не зависит от пути протекания процесса, а зависит только от начального и конечного состояния системы. Таким образом, выбрав для осуществления процесса получения Fe2О3 два различных пути, мы доказали справедливость закона Гесса.
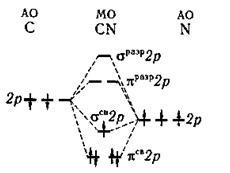
№2 молекулярные орбитали молекулы CN.
№3
sp-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться не поделёнными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра, тогда как ядро центрального атома расположено в центре описанной сферы этого тетраэдра. Угол между любыми двумя осями приближённо равен 109°28'[3], что соответствует наименьшей энергии отталкивания электронов. Также sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться не поделёнными парами электронов. Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных. Примеры: BeF2, CO2, NO2+
sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскостии направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей. Примеры: BF3, NO3-, CO32-
sp3-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра, тогда как ядро центрального атома расположено в центре описанной сферы этого тетраэдра. Угол между любыми двумя осями приближённо равен 109°28'[3], что соответствует наименьшей энергии отталкивания электронов. Также sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных. Примеры: CH4, ClO4-, SO42-, NH4+
№4
H2SO4=2H++SO42-
Пусть V(H2SO4)=10 см3
m(р-ра H2SO4)=1,6 г/см3 * 10 см3=16 г.
m(H2SO4)=16*0.6=9.6 г.
n(H2SO4)=m/M=9.6/98=0.098 моль
СМ(H2SO4)= 0.098 моль/0,01 л=9,8 моль/л
При диссоциации 9,8 моль H2SO4 образуется 19,6 моль ионов H+
pH=lg[H+]
pH=1.29
Ответ: pH=1.29
№5
CH3COONa+HOH = CH3COOH+NaOH
Плотность 10% р-ра CH3COONa= 1.0495
Пусть V(р-ра)=1л
m(р-ра)= 1.0495 г/см3*1000 см3=1049.5 г
m(CH3COONa)=1049.5 * 0.1=104.95 г
M=82
n(CH3COONa)=104.95/82=1.28
CM(CH3COONa)=1.28/1=1.28
Константа гидролиза соли, образованной слабой кислотой и сильным основанием. Kh = Kw/Kd
Kw = 10^(-14) – ионное произведение воды
Kd(CH3COOH) = 1,74*10^(-5) – константа диссоциации уксусной кислоты
Константа гидролиза ацетата натрия Kh(CH3COONa) = Kw/Kd(CH3COOH) = 10^(-14)/1,8*10^(-5) = 5,75*10^(-10)
α =√( Kh(CH3COONa)/См (CH3COONa)) = √(5,75*10^(-10)/1.28)=2.12*10^(-5)
