
- •Тема 3. Биосинтез аминокислот. Особенности обмена глицина, серина, серусодержащих и ароматических аминокислот.
- •3.1. Биосинтез аминокислот в тканях.
- •3.2. Обмен серина и глицина. Образование и перенос одноуглеродных групп.
- •3.3. Обмен метионина и реакции трансметилирования.
- •3.4. Биосинтез креатина и его последующие превращения.
- •3.5. Обмен фенилаланина и тирозина.
Тема 3. Биосинтез аминокислот. Особенности обмена глицина, серина, серусодержащих и ароматических аминокислот.
Практическая значимость темы. Аминокислоты, поступающие в организм с пищей, могут быть источниками атомов углерода и азота для различных небелковых соединений. В частности, аминокислоты могут вступать в реакции взаимопревращения, что обеспечивает потребности организма в заменимых аминокислотах независимо от их поступления извне. К числу физиологически важных продуктов, образующихся из аминокислот, относятся гем, креатин, холин, пуриновые и пиримидиновые нуклеотиды, некоторые гормоны, нейромедиаторы. Знание этих метаболических путей важно для понимания патогенеза некоторых гиповитаминозов и врождённых ферментопатий, разработки методов их биохимической диагностики и коррекции.
Цель занятия. После изучения данной темы студент должен знать основные реакции синтеза заменимых аминокислот в организме человека, пути использования аминокислот для синтеза небелковых азотистых соединений и возможные нарушения этих процессов, уметь применять полученные знания для решения теоретических и практических задач.
Исходный уровень знаний.
Строение аминокислот (глицин, серин, метионин, цистеин, фенилаланин, тирозин).
Реакции переноса функциональных групп в биологических системах.
Восстановительное аминирование α-кетокислот: ферменты, роль в организме.
Трансаминирование аминокислот: реакции, роль в организме.
Коферментные функции витаминов (фолиевой кислоты, цианкобаламина).
Принципы диагностики врождённых дефектов ферментов.
3.1. Биосинтез аминокислот в тканях.
3.1.1. В организме человека возможен синтез заменимых аминокислот, к которым относятся: аланин, аргинин, аспартат, гистидин, глицин, глутамат, глутамин, пролин, серин, тирозин, цистеин. Недостаток в пище любой из этих аминокислот не будет сопровождаться её дефицитом в организме. Основными путями образования заменимых аминокислот являются: 1) трансаминирование α-кетокислот, 2) восстановительное аминирование α-кетокислот, 3) синтез с участием незаменимых аминокислот.
3.1.2. Трансаминирование (см. тему 2). Источниками атомов углерода в этих реакциях служат метаболиты гликолиза и цикла Кребса, источниками атомов азота – другие аминокислоты, чаще всего – глутамат (см. рисунок 7).
3.1.3. Восстановительное аминирование (см. тему 2). Источником атома азота аминогруппы является молекула аммиака, источником углерода - α-кетокислоты, чаще всего - α-кетоглутарат (см. рисунок 3.1).
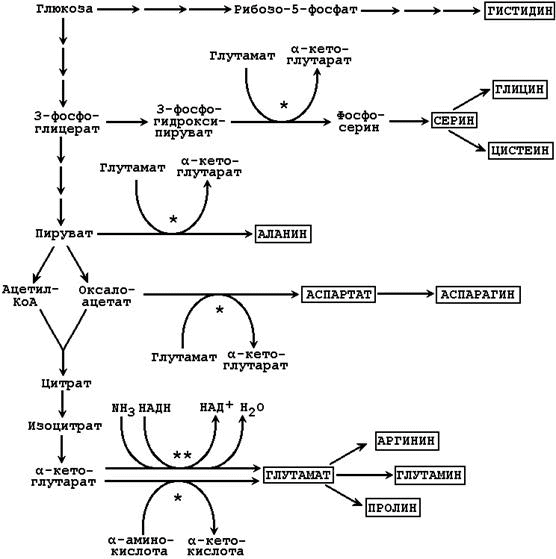
Рисунок 3.1. Биосинтез заменимых аминокислот в тканях с использованием углеродного скелета глюкозы (одной звёздочкой показаны реакции трансаминирования, двумя – восстановительного аминирования).
3.1.4. Синтез с участием незаменимых аминокислот. Заменимая аминокислота тирозин может образоваться из незаменимой аминокислоты фенилаланина:
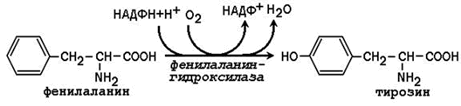
Фенилаланингидроксилаза - типичная цитохром P450-зависимая гидроксилаза со смешанной функцией: один атом кислорода включается в воду и другой в гидроксильную группу тирозина. Восстановителем служит кофактор тетрагидробиоптерин, который поддерживается в восстановленном состоянии НАДФН-зависимым ферментом дигидробиоптерин-редуктазой.
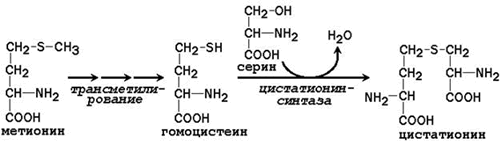
Заменимая аминокислота цистеин синтезируется при участии незаменимой аминокислоты метионина, которая используется как источник атома серы. После отдачи метильной группы в реакциях трансметилирования метионин превращается в гомоцистеин. При его взаимодействии с заменимой аминокислотой серин образуется цистатионин:
Цистатионин подвергается расщеплению с образованием цистеина и гомосерина, который подвергается дезаминированию в α-кетобутират:
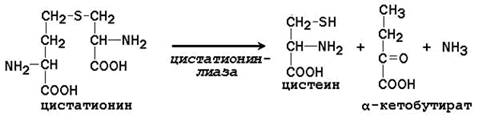
Таким образом, фенилаланин и метионин, поступающие с пищей, частично используются для синтеза заменимых аминокислот. Поэтому суточная потребность в фенилаланине и метионине может быть существенно снижена при поступлении в организм дополнительных количеств тирозина и цистеина соответственно.
