
- •Тема 2. Общие пути катаболизма аминокислот. Образование аммиака в организме и пути его обезвреживания
- •2.1. Общие пути катаболизма аминокислот в тканях.
- •2.1.3.1. Примеры реакций декарбоксилирования. Некоторые аминокислоты непосредственно подвергаются декарбоксилированию:
- •2.2. Пути образования и обезвреживания аммиака.
- •2.2.3. Экскреция аммиака с мочой. Клетки почек поглощают из циркулирующей крови глутамин. Фермент глутаминаза в почках катализирует гидролиз глутамина с образованием глутамата и аммиака.
- •Контрольные вопросы:
Тема 2. Общие пути катаболизма аминокислот. Образование аммиака в организме и пути его обезвреживания
Практическая значимость темы. Для большинства аминокислот характерны общие реакции, связанные с превращениями их амино- и карбоксильных групп - реакции трансаминирования, дезаминирования и декарбоксилирования. Роль этих превращений в организме велика, так как перечисленные типы реакций обеспечивают интеграцию аминокислотного обмена с метаболизмом углеводов и липидов, способствуют перераспределению азота в организме, участвуют в образовании биомолекул, способных регулировать обмен веществ и ряд физиологических процессов.
Аммиак, образующийся в организме человека в реакциях катаболизма азотсодержащих соединений, чрезвычайно токсичен и должен быть обезврежен путём превращения его в мочевину. Поэтому согласованное протекание метаболического превращения аммиака в мочевину имеет важное значение для сохранения здоровья. Понимание патогенеза расстройств, возникающих при заболеваниях печени (гепатит, цирроз) и врождённых дефектах ферментов цикла мочевинообразования, лечение больных, страдающих этими заболеваниями, требуют знания механизмов обезвреживания аммиака в тканях.
Цель занятия. После изучения данной темы студент должен знать общие пути катаболизма аминокислот в тканях и их биологическую роль, основные источники образования аммиака и пути его обезвреживания в организме, их регуляцию, возможные причины нарушений, уметь применять приобретённые знания для решения теоретических и практических задач.
Исходный уровень знаний.
-
Строение аминокислот (аланин, аспартат, аспарагин, аргинин, глутамат, глутамин, гистидин, тирозин, триптофан, цистеин).
-
Кислотно-основные свойства органических соединений.
-
Высокоэнергетические фосфатные соединения: роль в организме.
-
Цикл трикарбоновых кислот: реакции, роль в организме.
-
Принципы диагностики врождённых дефектов ферментов.
2.1. Общие пути катаболизма аминокислот в тканях.
К общим путям катаболизма аминокислот относятся реакции трансаминирования, дезаминирования и декарбоксилирования.
2.1.1. Трансаминирование аминокислот – перенос аминогруппы (NН2-) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования катализируют ферменты – аминотрансферазы (или трансаминазы). Кофермент аминотрансфераз – пиридоксальфосфат (производное витамина В6). В реакции принимает участие альдегидная группа кофермента. Реакция легко обратима. Механизм реакции трансаминирования представлен на рисунке 2.1.

Рисунок 2.1. Механизм переноса аминогруппы с аминокислоты на α-кетокислоту в реакции трансаминирования.
Примеры реакций трансаминирования:
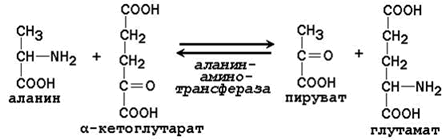

Роль реакций трансаминирования в организме:
-
участие в непрямом дезаминировании аминокислот;
-
путь синтеза заменимых аминокислот;
-
образующиеся в реакции α-кетокислоты могут включаться в общий путь катаболизма и глюконеогенез.
2.1.2. Дезаминирование аминокислот – отщепление аминогруппы от аминокислоты с образованием аммиака (NН3). В тканях человека преобладает окислительное дезаминирование, то есть сопряжённое с переносом водорода.
Большинство ферментов, участвующих в окислительном дезаминировании аминокислот, при физиологических значениях рН малоактивны. Поэтому основная роль в окислительном дезаминировании принадлежит глутаматдегидрогеназе, которая катализирует прямое окислительное дезаминирование глутамата. В качестве кофермента используются НАД+ или НАДФ+ (производные витамина РР). Реакция обратима.

Глутаматдегидрогеназа – аллостерический фермент, его аллостерическими активаторами являются АДФ и ГДФ, аллостерическими ингибиторами – АТФ, ГТФ и НАДН.
Непрямое дезаминирование характерно для большинства аминокислот. Оно называется непрямым, потому что происходит в 2 этапа:
-
на первом этапе аминокислота подвергается трансаминированию с образованием глутамата;
-
на втором этапе происходит окислительное дезаминирование глутамата (см. рисунок 4).

Рисунок 2.2. Схема непрямого дезаминирования аминокислот.
Участие аминотрансфераз в этом процессе позволяет собрать аминогруппы различных аминокислот в составе одной аминокислоты – глутамата, который затем подвергается окислению с образованием аммиака и α-кетоглутарата.
2.1.3. Декарбоксилирование аминокислот – отщепление карбоксильной группы от аминокислоты с образованием СО2. Продуктами реакций декарбоксилирования аминокислот являются биогенные амины, участвующие в регуляции обмена веществ и физиологических процессов в организме (см. таблицу 2.1).
Таблица 2.1
Биогенные амины и их предшественники.
|
Аминокислота |
Биогенный амин |
|
Гистидин |
Гистамин |
|
Глутамат |
γ-аминомасляная кислота (ГАМК) |
|
Тирозин |
Дофамин |
|
Триптофан |
Триптамин |
|
Серотонин |
|
|
Цистеин |
Тиоэтиламин |
|
Таурин |
Реакции декарбоксилирования аминокислот и их производных катализируют декарбоксилазы аминокислот. Кофермент – пиридоксальфосфат (производное витамина В6). Реакции являются необратимыми.
