- •Лабораторная работа 117
- •Кинетическая теория газа
- •Внутренняя энергия идеального газа
- •Определение отношения теплоемкостей ср/сv методом клемана – дезорма
- •Теория метода и описание установки
- •Три состояния воздуха и графики переходных процессов
- •Порядок выполнения работы
- •К о н т р о л ь н ы е в о п р о с ы
- •Литертура
Теория метода и описание установки
 Экспериментальная
установка состоит из стеклянного баллона
емкостью 25 – 30 л, соединенного с
открытым U – образным жидкостным
манометром М и насосом N. Кран К1соединяет сосуд с атмосферой, зажим К2позволяет изолировать насос от сосуда
и манометра. Если, закрыв кран К1,
при помощи насоса накачать в сосуд
некоторое количество воздуха, то давление
и температура воздуха внутри сосуда
повысятся. Вследствие теплообмена с
окружающей средой через некоторое время
температура воздуха внутри сосуда
сравняется с комнатной температурой
Т1. Давление же, установившееся в
баллоне, будет несколько выше атмосферного
Н:
Экспериментальная
установка состоит из стеклянного баллона
емкостью 25 – 30 л, соединенного с
открытым U – образным жидкостным
манометром М и насосом N. Кран К1соединяет сосуд с атмосферой, зажим К2позволяет изолировать насос от сосуда
и манометра. Если, закрыв кран К1,
при помощи насоса накачать в сосуд
некоторое количество воздуха, то давление
и температура воздуха внутри сосуда
повысятся. Вследствие теплообмена с
окружающей средой через некоторое время
температура воздуха внутри сосуда
сравняется с комнатной температурой
Т1. Давление же, установившееся в
баллоне, будет несколько выше атмосферного
Н:
Р1= Н +Н1,
где Н1– добавочное давление, измеряемое разностью h1уровней жидкости в манометре (Н1= ρgh1).
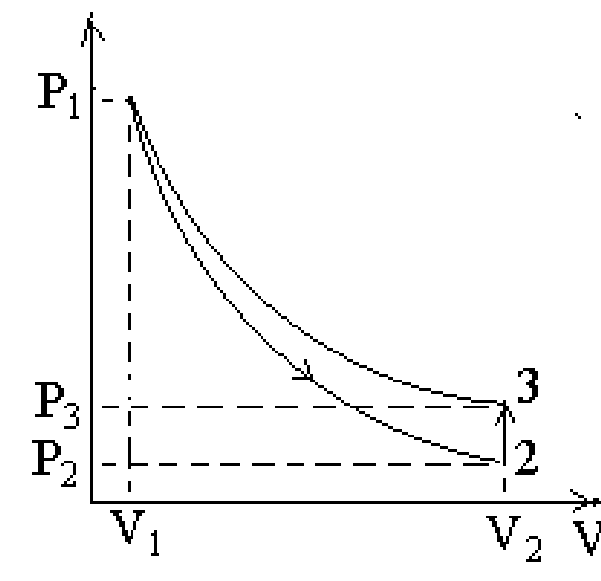
Удельный объем газа (объем единицы массы газа) в сосуде будет равен V1. Это состояние воздуха в сосуде, характеризуемое параметрами р1, V1и Т1, назовем состоянием 1 (точка 1 на графике в табл. 1).
Если на короткое время открыть кран К1и соединить сосуд с атмосферой, то воздух в сосуде будет расширяться. Этот процесс расширения ввиду его кратковременности можно считать адиабатическим. Давление при этом упадет до атмосферного (Р2= Н), температура газа понизится до Т2. Удельный объем возрастет до V2, так как часть воздуха выйдет и на единицу массы придется больший объем. Это состояние 2 (точка 2 на графике). Через 1 ÷ 2 минуты после закрытия крана К1воздух в сосуде вследствие теплообмена снова нагревается до комнатной температуры Т1Так как удельный объем V2останется при этом неизменным (процесс изохорический), давление в сосуде возрастет до р = Н + Н2(Н2= ρgh2, где h2– новая разность уровней жидкости в манометре). Это состояние 3 (точка 3 на графике).
Таблица № 1
Три состояния воздуха и графики переходных процессов
|
Условия опыта |
Состо-яние воздуха |
Уд. объем воздуха |
Давление |
Температура |
Графики процессов |
|
До открытия крана К1 |
1 |
V1 |
р1=Н+Н1 |
Т1 |
|
|
В момент открытия крана К1 |
2 |
V2↑ |
р2=Н |
Т2↓ | |
|
После за- крытия крана К1 |
3 |
V2 |
р3=Н+Н2 |
Т1 |
Адиабатический переход из состояния 1 в состояние 2 происходит по уравнению Пуассона:
![]() .
.(14)
Переход из состояния 1 в состояние 3 можно было бы произвести изотермически, так как температура в обоих состояниях одинаковая (комнатная). К этому возможному переходу применим закон Бойля – Мариотта:
р1V1= р3V3. (15)
Решая совместно уравнения (14) и (15), можно определить γ. Возведем для этого уравнение (15) в степень γ и разделим результаты почленно на уравнение (14):
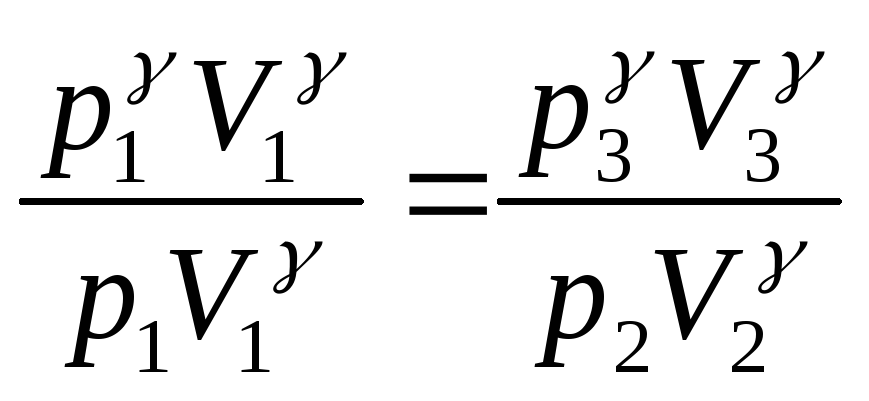 .
.
Поскольку V2 = V3,![]() или
или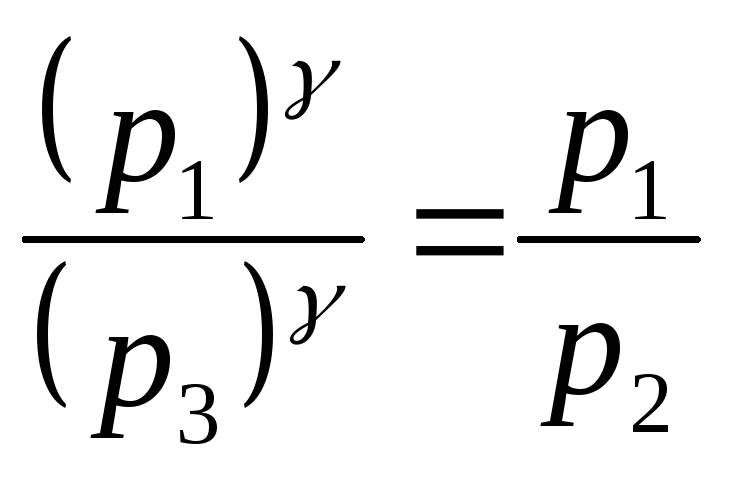 .
.
Логарифмируя последнее выражение, находим:
![]() .
.
В это соотношение подставим значения p1=H+H1,p3=H+H2:
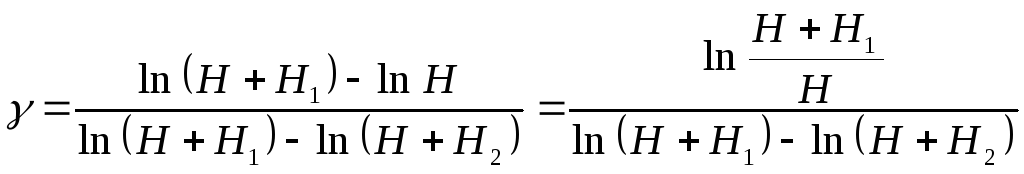 .
.
Вычитая и прибавляя в знаменателе последнего выражения lnH, получим:
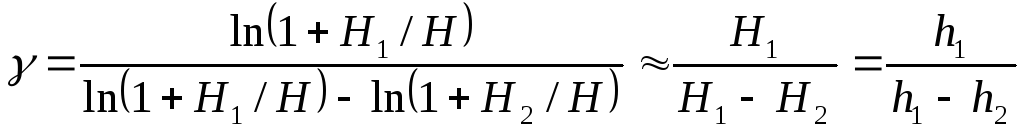 . (16)
. (16)
В нашем случае Н1/Н и Н2/Н достаточно малы, поэтому мы заменили их на
ln(1 +H1/H) ~ Н1/Н иln(1 + Н2/Н) ~ Н2/Н.
Формула (16) является расчетной и позволяет определить γ по двум показаниям манометра: h1и h2.