
Лабораторная работа № 114 введение
ПОНЯТИЕ ИДЕАЛЬНОГО ГАЗА
Идеальным называется газ, при рассмотрении которого пренебрегают силами межмолекулярного взаимодействия и размерами молекул. Все реальные газы при достаточно высоких температурах и достаточно низких давлениях мало отличаются по своим свойствам от идеального газа, поэтому выводы, полученные для идеального газа, широко используются для решения практических задач.
Состояние
газа характеризуют основными параметрами
состояния: давлением p,
температурой Т, удельным
![]() или молярнымVm
объемом.
или молярнымVm
объемом.
Давлением р называется отношение силы dF, действующей перпендикулярно поверхности, к площади dS этой поверхности:
![]() .(1)
.(1)
В СИ единица давления – паскаль (Па): 1 Па = 1 Н/м2. В СГС единица давления – 1дин/см2 = 0,1 Н/м2. Часто используются внесистемные единицы измерения давления – 1 бар = 105Па, физическая атмосфера – 1 атм = 760 мм рт ст. = 1,013·105 Па, техническая атмосфера – 1- ат = 1 кг/см2 = 0,981·105 Па. В области низких давлений обычно пользуются единицей 1 мм рт.ст. (торр) = 1/760 атм = 133,3 Па.
Количество вещества ν – физическая величина, характеризующая число структурных элементов, содержащихся в данной системе, Это могут быть атомы, молекулы, а также ионы, электроны и другие частицы. Единицей количества вещества в СИ является 1 моль. 1 моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в 0,012 кг изотопа углерода 12С. В одном моле любого вещества содержится 6,022·1023 структурных элементов (число Авогадро).
Относительной молекулярной массой Мr вещества называется отношение массы молекулы этого вещества к 1/12 массы атома 12С. Из определения следует, что молекулярная масса является безразмерной величиной.
Молярная масса М вещества равна отношению массы m однородной системы к количеству вещества ν этой системы: М =m/ν. Молярная масса вещества пропорциональна относительной молекулярной массе данного вещества: М = kMr, где k – размерный коэффициент пропорциональности, равный 10-3 кг/моль. Отсюда следует, что молярная масса, выраженная в граммах на моль, численно равна относительной молекулярной массе.
Молярным объемом Vm называется объем одного моля вещества. Объем массы газа можно выразить через молярный объем:
![]() ,(2)
,(2)
где m/M = ν - число молей (количество вещества).
Удельным объемом υ называется объем единицы массы вещества:
![]() . (3)
. (3)
Температура характеризует степень нагретости тела. Для измерения температуры пользуются Международной практической температурной шкалой 1968г. (МПТШ – 1968). По этой шкале температура измеряется в оС (градусах Цельсия) и обозначается через t. При теоретических выкладках пользуются абсолютной температурной шкалой, по которой температура измеряется в К (кельвинах) и обозначается через Т. Соотношение между температурами по любой из этих шкал имеет вид:
Т = t + 273,15. (4)
Температура Т = 0 (по МПТШ – 1968 t = - 273,15оС) называется абсолютным нулем температуры. Единица измерения температуры 1 градус, одинаковая для обеих шкал, определяется как одна сотая часть разности показаний термометров, помещенных в пары кипящей воды и тающий лед, при нормальном давлении (рн = 1,013·1023Па).
Закон Авогадро. Соотношения между макроскопическими (лабораторных масштабов) и молекулярными (атомных масштабов) величинами выражаются с помощью закона и числа Авогадро. Согласно закону Авогадро, моль идеального газа при нормальных условиях (Тн=273,15 К, рн= 760 мм рт.ст. = 1,013·1023 Па) занимает объем Vm = 22,4·10-3 м3/моль и содержит постоянное число молекул NA = 6,022·1023 моль-1, названное числом Авогадро. Число Авогадро является универсальной постоянной (одинаково для моля любого вещества в любом агрегатном состоянии).
Уравнение состояния идеального газа. Равновесное состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р, объемом V и температурой Т. Связь между этими параметрами может быть выражена аналитически формулой F(р,V,T)= 0, называемой уравнением состояния тела или системы.
Уравнением состояния идеального газа является уравнение Менделеева – Клапейрона, которое для одного моля газа имеет вид:
PVm = RT,(5)
где R – молярная (универсальная) газовая постоянная, одинаковая для всех газов.
Численное значение газовой постоянной рассчитывается из закона Авогадро по уравнению (5)
![]() .
.
Уравнение состояния для произвольной массы m идеального газа имеет вид:
![]() .(6)
.(6)
Отношение молярной газовой постоянной R к числу Авогадро NA называется постоянной Больцмана:
![]() .(7)
.(7)
Если в формулу (5) ввести постоянную Больцмана и учесть, что NA/Vm = n – концентрация (число молекул в единице объема), то можно получить уравнение состояния идеального газа, выраженное в другой форме:
P = nkT.(8)
Из соотношения (8) следует, что давление идеального газа при данной температуре определяется только концентрацией и не зависит от рода молекул.
Число молекул в единице объема идеального газа в нормальном состоянии называется числом Лошмидта:
![]() .(9)
.(9)
Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений газов, входящих в смесь:
р = р1 + р2 + р3 + … .(10)
Парциальным давлением компонента газовой смеси называется давление, которое оказывал бы этот газ, если бы он один занимал весь объем смеси.
Закон Дальтона непосредственно следует из уравнения (8) при условии, что n = n1 + n2 + n3 + … .
КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗА
Основное уравнение молекулярно-кинетической теории газов для давления связывает параметры состояния идеального газа с характеристиками движения его молекул:
![]() ,(11)
,(11)
где n – число молекул в единице объема; m0 – масса одной молекулы; v2 – среднее значение квадратов скоростей молекул (средний квадрат скорости).
Перепишите уравнение (11):
![]() ,(12)
,(12)
где
![]() - средняя кинетическая энергия
поступательного теплового движения
точечной молекулы.
- средняя кинетическая энергия
поступательного теплового движения
точечной молекулы.
Таким образом, давление идеального газа пропорционально средней кинетической энергии поступательного движения молекул единицы объема газа. Давление газа является результатом совместного действия всех молекул , находящихся в единице объема – таков статистический смысл понятия давления.
Из
основного уравнения кинетической теории
газов (12) и уравнения состояния газов
Менделеева-Клапейрона (6) имеем, что
средняя кинетическая энергия
![]() пропорциональна абсолютной температуре:
пропорциональна абсолютной температуре:
![]() .(13)
.(13)
Отсюда следует статистический смысл понятия температуры: абсолютная температура есть величина, пропорциональная средней кинетической энергии поступательного движения, приходящейся на одну молекулу идеального газа.
Абсолютный нуль с этой точки зрения является температурой, при которой прекращается тепловое движение молекул идеального газа. Нет методов, которые давали бы возможность полностью прекратить тепловое движение молекул идеального газа. Поэтому абсолютный нуль недостижим, хотя к нему и можно приблизиться сколь угодно близко.
Скорость молекул. Движение молекул газа подчиняется законам статистической физики. Средние скорости и энергии всех молекул постоянны. Однако в каждый момент времени энергии и скорости отдельных молекул могут значительно отличаться от среднего значения, так как при столкновениях скорости изменяются случайным образом как по величине, так и по направлению. В результате в состоянии равновесия существует некоторое стационарное не меняющееся со временем распределение молекул по скоростям.
Распределение Максвелла. С помощью теории вероятностей Максвеллу удалось вывести формулу для числа молекул dN, которые обладают скоростями в пределах между v и v +dv:
![]() ,(14)
,(14)
где N -общее число молекул, m0 - масса молекулы, k - постоянная Больцмана, T – абсолютная температура, е = 2,718… - основание натуральных логарифмов.
Относительное число молекул газа, скорости которых соответствуют единичному интервалу скоростей, вблизи данной скорости v, определяется функцией распределения Максвелла:
![]() .(15)
.(15)
Площадь, ограниченная графиком функции распределения и осью абсцисс, равна единице (рис. 1). Площадь заштрихованной фигуры численно равна доле dN/N общего числа молекул N, скорости которых заключены в интервале от v до v + dv.
Ф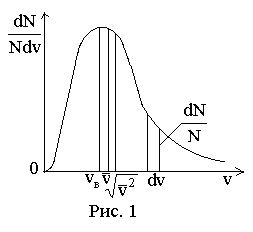 ункцияf(v)
стремится к нулю при v
0 и v
.
Следовательно, относительное число
молекул в газе, обладающих очень малыми
и очень большими скоростями (по сравнению
со средними), ничтожно мало.
ункцияf(v)
стремится к нулю при v
0 и v
.
Следовательно, относительное число
молекул в газе, обладающих очень малыми
и очень большими скоростями (по сравнению
со средними), ничтожно мало.
Характерные скорости максвелловского распределения. Положение максимума характеризует наиболее часто встречающуюся скорость, которую называют наиболее вероятной скоростью:
![]() .(16)
.(16)
График
функции распределения асимметричен.
Скорости, превышающие vв,
встречаются чаще, чем меньшие скорости.
Средняя арифметическая
![]() и средняя квадратичная
и средняя квадратичная![]() скорости сдвинуты относительноvв
несколько вправо. Вычисления показывают,
что
скорости сдвинуты относительноvв
несколько вправо. Вычисления показывают,
что
![]() , (17)
, (17)
![]() .(18)
.(18)
Распределение
Больцмана.
Следует заметить, что распределение
молекул по скоростям не зависит от того,
находятся они в поле тяготения, каком
– либо ином поле или же вообще в
пространстве без поля. Однако в поле
силы тяжести на плотность газа оказывает
влияние соотношение между энергией
теплового движения kT
и потенциальной энергией молекул m0gh.
В результате противоборства двух
тенденций – теплового разброса и
притяжения молекул к Земле – в состоянии
равновесия устанавливается следующее
распределение молекул по высоте:
![]() ,(19)
,(19)
где nn - концентрация молекул на высоте h, n0 -число молекул в единице объема у поверхности Земли.
Больцман доказал, что формула (19) справедлива в случае потенциального силового поля любой природы (а не только для поля силы тяжести), для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения. В связи с этим функцию:
n = n0e-Eр / kT (20)
называют распределением Больцмана. Здесь n0 - плотность частиц, в том месте, для которого Eр принята равной нулю, n - плотность частиц, обладающих потенциальной энергией Eр.
.Зависимость атмосферного давления р от высоты h при постоянной температуре Т описывается барометрической формулой
p = p0e-mgh / kT, (21)
где p0 - давление на уровне h = 0.
С редняя
длина свободного пробега молекул.
Между двумя последовательными
столкновениями молекулы движутся
прямолинейно и равномерно, проходя в
среднем расстояние
редняя
длина свободного пробега молекул.
Между двумя последовательными
столкновениями молекулы движутся
прямолинейно и равномерно, проходя в
среднем расстояние
![]() ,
называемое средней длиной свободного
пробега молекул.
,
называемое средней длиной свободного
пробега молекул.
При рассмотрении вопроса о соударениях молекул нельзя пренебрегать их размерами. Минимальное расстояние d, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы (рис. 2). Он зависит от скорости сталкивающихся молекул, т.е. от температуры (несколько уменьшается с ростом температуры). Обычно для газа d составляет (2 ÷3)*10-10 м.
Средняя длина свободного пробега молекул определяется по формуле
![]() ,(22)
,(22)
где n - концентрация молекул, σ - эффективное сечение молекул.
Средняя
длина свободного пробега молекул
![]() для большинства газов при нормальных
условиях составляет ~10-7
м.
для большинства газов при нормальных
условиях составляет ~10-7
м.
Так
как концентрация молекул газа
пропорциональна его давлению, см.
уравнение (8), то
![]() ~ 1/р.
~ 1/р.
