
- •Лабораторная работа 117
- •Кинетическая теория газа
- •Внутренняя энергия идеального газа
- •Определение отношения теплоемкостей ср/сv методом клемана – дезорма
- •Теория метода и описание установки
- •Три состояния воздуха и графики переходных процессов
- •Порядок выполнения работы
- •К о н т р о л ь н ы е в о п р о с ы
- •Литертура
Кинетическая теория газа
Основное уравнение молекулярно-кинетической теории газов для давления связывает параметры состояния идеального газа с характеристиками движения его молекул:
![]() ,(11)
,(11)
где n – число молекул в единице объема; m0 – масса одной молекулы; v2 – среднее значение квадратов скоростей молекул (средний квадрат скорости).
Перепишите уравнение (11):
![]() ,(12)
,(12)
где
![]() - средняя кинетическая энергия
поступательного теплового движения
точечной молекулы.
- средняя кинетическая энергия
поступательного теплового движения
точечной молекулы.
Таким образом, давление идеального газа пропорционально средней кинетической энергии поступательного движения молекул единицы объема газа. Давление газа является результатом совместного действия всех молекул , находящихся в единице объема – таков статистический смысл понятия давления.
Из
основного уравнения кинетической теории
газов (12) и уравнения состояния газов
Менделеева-Клапейрона (6) имеем, что
средняя кинетическая энергия
![]() пропорциональна абсолютной температуре:
пропорциональна абсолютной температуре:
![]() .(13)
.(13)
Отсюда следует статистический смысл понятия температуры: абсолютная температура есть величина, пропорциональная средней кинетической энергии поступательного движения, приходящейся на одну молекулу идеального газа.
Абсолютный нуль с этой точки зрения является температурой, при которой прекращается тепловое движение молекул идеального газа. Нет методов, которые давали бы возможность полностью прекратить тепловое движение молекул идеального газа. Поэтому абсолютный нуль недостижим, хотя к нему и можно приблизиться сколь угодно близко.
Скорость молекул. Движение молекул газа подчиняется законам статистической физики. Средние скорости и энергии всех молекул постоянны. Однако в каждый момент времени энергии и скорости отдельных молекул могут значительно отличаться от среднего значения, так как при столкновениях скорости изменяются случайным образом как по величине, так и по направлению. В результате в состоянии равновесия существует некоторое стационарное не меняющееся со временем распределение молекул по скоростям.
Распределение Максвелла. С помощью теории вероятностей Максвеллу удалось вывести формулу для числа молекул dN, которые обладают скоростями в пределах между v и v +dv:
![]() ,(14)
,(14)
где N -общее число молекул, m0 - масса молекулы, k - постоянная Больцмана, T – абсолютная температура, е = 2,718… - основание натуральных логарифмов.
Относительное число молекул газа, скорости которых соответствуют единичному интервалу скоростей, вблизи данной скорости v, определяется функцией распределения Максвелла:
![]() .(15)
.(15)
Площадь, ограниченная графиком функции распределения и осью абсцисс, равна единице (рис. 1).
Площадь заштрихованной фигуры численно равна доле dN/N общего числа молекул N, скорости которых заключены в интервале от v до v + dv.
Ф ункцияf(v)
стремится к нулю при v
0 и v
.
Следовательно, относительное число
молекул в газе, обладающих очень малыми
и очень большими скоростями (по сравнению
с средними), ничтожно мало.
ункцияf(v)
стремится к нулю при v
0 и v
.
Следовательно, относительное число
молекул в газе, обладающих очень малыми
и очень большими скоростями (по сравнению
с средними), ничтожно мало.
Характерные скорости максвелловского распределения. Положение максимума характеризует наиболее часто встречающуюся скорость, которую называют наиболее вероятной скоростью:
![]() .(16)
.(16)
График
функции распределения ассиметричен.
Скорости, превышающие vв,
встречаются чаще, чем меньшие скорости.
Средняя арифметическая
![]() и средняя квадратичная
и средняя квадратичная![]() скорости сдвинуты относительноvв
несколько вправо. Вычисления показывают,
что
скорости сдвинуты относительноvв
несколько вправо. Вычисления показывают,
что
![]() , (17)
, (17)
![]() .(18)
.(18)
Распределение Больцмана.
Следует заметить, что распределение молекул по скоростям не зависит от того, находятся они в поле тяготения, каком – либо ином поле или же вообще в пространстве без поля. Однако в поле силы тяжести на плотность газа оказывает влияние соотношение между энергией теплового движения kT и потенциальной энергией молекул m0gh. В результате противоборства двух тенденций – теплового разброса и притяжения молекул к Земле – в состоянии равновесия устанавливается следующее распределение молекул по высоте:
![]() ,(19)
,(19)
где nn - концентрация молекул на высоте h, n0 -число молекул в единице объема у поверхности Земли.
Больцман доказал, что формула (19) справедлива в случае потенциального силового поля любой природы (а не только для поля силы тяжести), для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения. В связи с этим функцию
n = n0e-Eр / kT (20)
называют распределением Больцмана. Здесь n0 - плотность частиц, в том месте, для которого Eр принята равной нулю, n - плотность частиц, обладающих потенциальной энергией Eр.
Зависимость атмосферного давления р от высоты h при постоянной температуре Т описывается барометрической формулой
p = p0e-mgh / kT, (21)
где p0 - давление на уровне h = 0.
С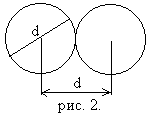 редняя
длина свободного пробега молекул.
Между двумя последовательными
столкновениями молекулы движутся
прямолинейно и равномерно, проходя в
среднем расстояние
редняя
длина свободного пробега молекул.
Между двумя последовательными
столкновениями молекулы движутся
прямолинейно и равномерно, проходя в
среднем расстояние
![]() ,
называемое средней длиной свободного
пробега молекул.
,
называемое средней длиной свободного
пробега молекул.
При рассмотрении вопроса о соударениях молекул нельзя пренебрегать их размерами. Эффективным диаметром молекулы называется минимальное расстояние d, на которое сближаются при столкновении центры двух молекул (рис. 2). Он зависит от скорости сталкивающихся молекул, т.е. от температуры (несколько уменьшается с ростом температуры). Обычно для газа d составляет (2 ÷3)*10-10 м.
Средняя длина свободного пробега молекул определяется по формуле
![]() ,(22)
,(22)
где n - концентрация молекул, σ - эффективное сечение молекул.
Средняя
длина свободного пробега молекул
![]() для большинства газов при нормальных
условиях составляет~10-7
м.
для большинства газов при нормальных
условиях составляет~10-7
м.
Так
как концентрация молекул газа
пропорциональна его давлению, см.
уравнение (8), то
![]() ~ 1/р.
~ 1/р.
