
- •Лабораторная работа 117
- •Кинетическая теория газа
- •Внутренняя энергия идеального газа
- •Определение отношения теплоемкостей ср/сv методом клемана – дезорма
- •Теория метода и описание установки
- •Три состояния воздуха и графики переходных процессов
- •Порядок выполнения работы
- •К о н т р о л ь н ы е в о п р о с ы
- •Литертура
Внутренняя энергия идеального газа
Поскольку молекулы идеального газа не взаимодействуют друг с другом, внутренняя энергия представляет собой суммарную энергию поступательного движения его молекул. Если не пренебрегать размерами и формой молекул, то кроме поступательного необходимо учитывать и вращательное движение. Таким образом, внутренняя энергия такого газа будет состоять из поступательной и вращательной энергии его молекул. При высоких температурах приходится учитывать еще энергию колебательного движения атомов молекулы.
Кинетическая энергия движения одной молекулы рассчитывается согласно предположению Максвелла о равномерном распределении энергии по степеням свободы.
Числом степеней свободы молекулы называется число независимых координат, изменение которых определяет возможные виды движений этой молекулы. Если жесткая молекула имеет i степеней свободы (для одноатомной молекулы i = 3, для двухатомной i = 5, для трех и многоатомной i = 6), то средняя кинетическая энергия отдельной молекулы:
![]() , (23)
, (23)
где (1/2) kT – энергия, приходящаяся на одну степень свободы.
Внутренняя энергия одного моля идеального газа:
![]() (24)
(24)
Определение отношения теплоемкостей ср/сv методом клемана – дезорма
Цель работы: экспериментально определить отношение теплоемкостей ср/сvдля воздуха и сравнить полученные результаты с выводами молекулярно – кинетической теории газов.
Приборы и принадлежности:стеклянный баллон с краном, U – образный открытый жидкостный манометр, насос, соединительные трубки и зажимы.
Удельной теплоемкостьюкакого – либовеществаназывается количество теплоты, необходимое для нагревания единицы массы этого вещества на 1К при данном процессе:
![]() . (1)
. (1)
Если теплоемкость относят к одному молю вещества, то ее называют молярной теплоемкостью С:
![]() , (2)
, (2)
где М – молярная масса, m – масса вещества.
Теплоемкость газа зависит от условий нагревания. Выясним эту зависимость, воспользовавшись уравнением Менделеева – Клапейрона состояния идеального газа
РVм= RT (3)
и первым началом термодинамики
dQ = dUм+dA, (4)
где р – давление, Vм– объем одного моля газа, Т – абсолютная температура,R– молярная газовая постоянная.
Согласно первому началу термодинамики, количество теплоты dQ, переданное системе, затрачивается на увеличение ее внутренней энергии dUм и на работу расширения dA, совершаемую системой против внешних сил.Поскольку dA = pdVмзависит от вида термодинамического процесса и только Uмявляется функцией состояния системы, dQ, а значит и теплоемкость С, также зависит от вида процесса.
В случае нагревания газа при постоянном объеме (изохорический процесс) сообщаемое ему тепло целиком идет на увеличение внутренней энергии газа, так как при неизменном объеме (dVм=0) внешняя работа не совершается. Теплоемкость в этом процессе называется теплоемкостью Cvпри постоянном объеме и может быть найдена из уравнений (2) и (4):
![]() . (5)
. (5)
Здесь индекс v означает изохорический процесс.
Если газ нагревать при постоянном давлении (изобарический процесс), то изменяется не только его внутренняя энергия, но, расширяясь, газ совершает еще и работу против сил внешнего давления. Теплоемкость в таком процессе, очевидно, больше теплоемкости при постоянном объеме, и она называется теплоемкостью при постоянном давлении:
![]()
![]() . (6)
. (6)
Из уравнения (3) при постоянном давлении имеем
pdVм=RdT. (7)
Подставив (7) в уравнение (6) с учетом (5), получим уравнение Мейера:
Сp = Cv + R. (8)
Следовательно, разность молярных теплоемкостей Ср - Сv =R численно равна работе расширения одного моля идеального газа при нагревании его на один градус Кельвина при постоянном давлении.В этом утверждении заключается физический смысл молярной газовой постоянной R.
Для идеального газа расчет теплоемкостей Сри Сvможно провести теоретически. Внутренняя энергия одного моля идеального газа зависит от числа степеней свободы i молекулы и температуры Т:
![]() . (9)
. (9)
Отсюда ![]() ; (10)
; (10)
![]() . (11)
. (11)
В ряде практических и теоретических вопросов физики большое значение имеет отношение теплоемкостей:
![]() . (12)
. (12)
В частности, для идеальных газов так называемый коэффициент γ входит в уравнение Пуассона: pVγ = const. (13)
Адиабатический
процесссовершается без теплообмена
с окружающей средой, поэтому для его
осуществления систему теплоизолируют
или ведут процесс так быстро, чтобы
теплообмен не успел произойти. При
адиабатическом сжатии идеального газа
температура его повышается, а при
расширении понижается.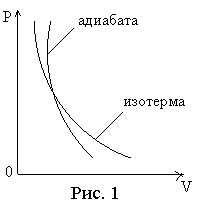 На
рис. 1 в системе координат р и V изображены
изотерма (рV =const) и адиабата
(рVγ= const). Из рисунка видно, что
адиабата проходит круче изотермы.
Объясняется это тем, что при адиабатическом
сжатии увеличение давления газа
происходит не только из–за уменьшения
его объема, как при изотермическом
сжатии, но и за счет повышения температуры.
На
рис. 1 в системе координат р и V изображены
изотерма (рV =const) и адиабата
(рVγ= const). Из рисунка видно, что
адиабата проходит круче изотермы.
Объясняется это тем, что при адиабатическом
сжатии увеличение давления газа
происходит не только из–за уменьшения
его объема, как при изотермическом
сжатии, но и за счет повышения температуры.
