
- •Кемеровский технологический институт
- •Оглавление
- •1.Программа курса
- •2. Конспект лекций
- •2.1 Теоретические представления в органической химии
- •2.2 Углеводороды
- •2.2.1 Алканы (1) с. 4-15; (2) с.157-171; (3) с.133-179
- •1.Систематическая номенклатура (июпак)
- •2.Рациональнаяноменклатура
- •Изомерия
- •2.2.2 Алкены (1) с.15-30; (2) с.182-205; (3) с.237-131306
- •2.Рациональная номенклатура алкенов
- •Изомерия
- •2.2.3 Алкадиены (1) с.30-38; (2) с.205-214; (3) с.337-374
- •Изомерия
- •Химические свойства
- •2.2.4 Алкины (1) с.38 – 45;(2) с.214 – 253; (3) с.306 – 334
- •1.Систематическая номенклатура (июпак)
- •2.Рациональная номенклатура
- •Изомерия
- •2.3 Спирты (1) с. 106 – 114; (2) с. 340 – 385; (3) с.11 – 88(т.2)
- •1.Систематическая номенклатура (июпак)
- •2.Рациональная номенклатура
- •3.Карбинольная номенклатура
- •Изомерия
- •Способы получения
- •Химические свойства
- •2.4 Альдегиды, кетоны (1) с.123-155; (2) с.420-450; (3) с.116-206
- •1.Систематическая номенклатура (июпак)
- •Cпособы получения оксосоединений
- •1.Окисление спиртов
- •Химические свойства
- •2.5. Карбоновые кислоты
- •2.5.1. Одноосновные карбоновые кислоты
- •Номенклатура
- •Рациональная номенклатура
- •Изомерия
- •Способы получения карбоновых кислот
- •1. Оксосинтез.
- •2. Гидролиз тригалогенопроизводных углеводородов.
- •3. Гидролиз нитрилов.
- •2.2. Образование амидов.
- •2.5.2. Непредельные карбоновые кислоты
- •Изомерия
- •1. Дегидрогалогенирование галогенозамещенных одноосновных карбоновых кислот.
- •Химические свойства
- •1. Реакции по двойной связи.
- •1.1. Взаимодействие в галогенами.
- •2.5.3. Двухосновные карбоновые кислоты.
- •1. Систематическая номенклатура.
- •Способы получения
- •2. Гидролиз динитрилов.
- •Химические свойства
3. Гидролиз нитрилов.
При получения нитрила используется реация взаимодействия с цианистым калием или натрием моногалогенопроизводных углеводородов с последующим двухступенчатым гидролизом в кислой среде. Исходное моногалогенопроизводное берется на один атом углерода меньше, чем получаемая кислота.
Пример:
 С2Н5С1
+ КС
С2Н5С1
+ КС![]() N
→ C2H5C
N
→ C2H5C![]() N
H2O
C2H5-C=NH
C2H5C=O
→
N
H2O
C2H5-C=NH
C2H5C=O
→
 -KCl
|
|
-KCl
|
|
OH NH2
этилхлорид этилнитрил амид пропановой
кислоты
H 2O
C2H5-C=O
2O
C2H5-C=O
НC1 |
-NH4C1 ОН
пропановая кислота








 −C1
KCN
−C
−C1
KCN
−C![]() N
H2O
−C=O
H2O
−−COOH
N
H2O
−C=O
H2O
−−COOH

 NH4C1
|
NH4C1
|
| -KC1 | | NH2 HCl | CH3 CH3 CH3 CH3
м-хлортолуол нитрил амид м-толуиловая
м-толуиловой м-толуиловой кислота
кислоты
4. Магнийорганический синтез.
Для получения магнийорганического соединений используется моногалогенопроизводное углеводорода, с последующим действием СО2 и гидролизом промежуточного продукта. Исходное моногалогенопроизводное берется на один атом углерода меньше, чем получаемая кислота.
Пример:
СН3С1 Mg CH3MgC1 CO2 CH3-C=O HOH CH3-C=O


 абс.эфир
| -Mg(C1)OH |
абс.эфир
| -Mg(C1)OH |
OMgCl OH
метилхлорид метилмагнийхлорид смешанная соль этановая
кислота
Ароматические карбоновые кислоты получают аналогично.
5. Гидролиз сложных эфиров.
В качестве исходных продуктов используются сложные эфиры алифатических и ароматических карбоновых кислот.
Пример:
 СН3-(СН2)2-С=О
НОН СН3-(СН2)2-С=О
СН3-(СН2)2-С=О
НОН СН3-(СН2)2-С=О
| -С3Н7ОН |
ОС3Н7 ОН
пропиловый эфир бутановой кислоты бутановая кислота
Ароматические карбоновые кислоты получают аналогично.
Химические свойства карбоновых кислот
Карбоксильная
группа СООН состоит из карбонильной
группы С=О и гидроксильной группы ОН. В
карбонильной группе кислород наиболее
электроотрицательный элемент по
сравнению с углеродом, поэтому электронная
плотность в группе смещена в сторону
кислорода.
![]() +
+
![]() -
-
-С = О
В результате чего, на кислороде создается
избыток электронной плотности
результате чего, на кислороде создается
избыток электронной плотности![]() -,
на углероде – недостаток электронной
плотности
-,
на углероде – недостаток электронной
плотности![]() +.
+.
Вследствие
этого атом углерода притягивает
неподеленные элетронные пары атома
кислорода группы ОН:
![]() +
+
![]() -
-
- С = О
..
 О
Н
О
Н
Э лектронная
плотность в группе ОН смещена в сторону
кислорода, водород приобретает подвижность
и способен отщеплению. Отщепление
протона водорода указывает на кислотные
свойства карбоновых кислот.
В водном растворе карбоновая кислота
диссоциирует с образованием карбосилат
аниона и иона гидроксония:
лектронная
плотность в группе ОН смещена в сторону
кислорода, водород приобретает подвижность
и способен отщеплению. Отщепление
протона водорода указывает на кислотные
свойства карбоновых кислот.
В водном растворе карбоновая кислота
диссоциирует с образованием карбосилат
аниона и иона гидроксония:


 R-C=O
+ H2O
R-C=O + H3O+
R-C=O
+ H2O
R-C=O + H3O+
OH O-
 карбоксилат
гидроксоний
карбоксилат
гидроксоний
анион ион
Факторы, влияющие на кислотные свойства карбоновых кислот
1. Наличие в молекуле донора снижает силу кислоты. (1).
2. Наличие в молекуле акцептора повышает силу кислоты (2).
![]() +
+
![]() -
-
![]() +
+
![]() -
-


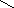
 R
C
= O
(1) R
C
= O
(2)
R
C
= O
(1) R
C
= O
(2)
OH OH
В первом случае, присутствие в молекуле кислоты донора уменьшает недостаток электронной плотности на атоме углерода карбоксильной группы, следовательно, атом углерода с меньшей силой притягивает неподеленные электронные пары атома кислорода группы ОН и, соответственно, подвижность атома водорода в группе ОН снижается.
Во втором случае, наоборот, присутствие в молекуле кислоты акцептора увеличивает недостаток электронной плотности на атоме углерода карбоксильной группы; атом углерода с большей силой притягивает неподеленные электоронные пары атома кислотрода, тем самым, увеличивая подвижность водорода в группе ОН.
К радикалам донорам относятся:
СН3*, С2Н5*, С3Н7* и т.д
Крадикалам акцепторам относятся:
NR2*, OR*, C6H5*, галогены.
3. Чем ближе акцептор к карбоксильной группе, тем сильнее кислота.
4. Чем ближе донор к карбоксильной группе, тем слабее кислота.
Это объясняется усилением или ослаблением взаимного влияния радикала и карбоксильной группы.
5. Чем длиннее углеродная цепочка, тем слабее кислота.
6. Чем ближе разветвление в углеводородном радикале к карбоксильной группе, тем слабее кислота.
Помимо
кислотных свойств для карбоновых кислот
характерна подвижность водорода у 2 (![]() )
углеродного атома.
)
углеродного атома.
Пониженная электронная плотность у атома углерода карбоксильной группы вызывает смещение электронной плотности связи
С-С
и ее понижение у
![]() -
углеродного атома. Следовательно, атомы
водорода, расположенные у
-
углеродного атома. Следовательно, атомы
водорода, расположенные у![]() -
углеродного атома приобретают подвижность:
-
углеродного атома приобретают подвижность:
 Н
Н



 R
C
C
= O
R
C
C
= O
H OH
1. Реакции по разрыву связи О - Н (образование солей).
1.1. Взаимодействие с металлами.
П ример:
ример:
 СН3-СООН
+ Na
CH3-COONa
+ H2
СН3-СООН
+ Na
CH3-COONa
+ H2
уксусная кислота ацетат натрия (натриевая соль уксус-
ной кислоты )

 2НСООН
+ 2 Са (НСОО)2Са
+ Н2
2НСООН
+ 2 Са (НСОО)2Са
+ Н2
муравьиная кислота формиат кальция (кальциевая соль
муравьиной кислоты)
1.2. Взаимодействие со щелочами.


 СН3-СН-СООН
+ NaOH (в)
CH3-CH-COONa
+ H2O
СН3-СН-СООН
+ NaOH (в)
CH3-CH-COONa
+ H2O
| |
CH3 CH3
2-метилпропановая кислота натриевая соль 2-метилпропановой
кислоты
1.3. Взаимодействие с содой.
 СН3-СООН
+ NaHCO3
CH3-COONa
+ CO2
+ H2O
СН3-СООН
+ NaHCO3
CH3-COONa
+ CO2
+ H2O
Данная реакция является качественной на карбоксильную группу.
1.4. Взаимодействие с аммиаком.
НСООН + NH3 HCOONH4
аммонийная соль муравьиной кислоты
 2.
Реакции по
разрыву связи С-ОН
2.
Реакции по
разрыву связи С-ОН
По разрыву С-ОН связи идет реакция нуклеофильного замещения SN.
2.1. Взаимодействие со спиртами (реакция этерификации).
При взаимодействии карбоновых кислот со спиртами образуются сложные эфиры. Условия реакции: температура, серная кислота.
Схема и механизм реакции этерификации.

 R1-COOH
+ R2-OH
t, H2SO4
R1COOR2
+ H2O
R1-COOH
+ R2-OH
t, H2SO4
R1COOR2
+ H2O
к арбоновая
кислота спирт сложный эфир
арбоновая
кислота спирт сложный эфир
 Протон
водорода из молекулы серной кислоты
присоединяется к атому кислорода
карбонильной группы с образованием
протонированной кислоты (1).
Протон
водорода из молекулы серной кислоты
присоединяется к атому кислорода
карбонильной группы с образованием
протонированной кислоты (1).
 R1-COOH
+ H+
R1
–C+-OH
R1-COOH
+ H+
R1
–C+-OH
|
OH (1)
Молекула спирта по одной из неподеленных электронных пар атома кислорода присоединяется к положительно заряженному катиону углерода (2).

 OH
OH
OH
OH



 R1-C+-OH
+ R2-OH
R1-C-OH
(2)
R1-C+-OH
+ R2-OH
R1-C-OH
(2)
R2-OH
+
Образующийся промежуточный продукт переходит в продукт (3).

 OH
OH
OH
OH

 R1-C-OH
R1-C-O
+H
(3)
R1-C-OH
R1-C-O
+H
(3)
R2-O+ -H R2-O −H
Далее происходит отщепление молекулы воды и образование карбкатиона (4).

 OH
OH
OH
OH


 R1
– C - +OH
-H2O
R1
- +C-OH
(4)
R1
– C - +OH
-H2O
R1
- +C-OH
(4)
R2 - O H R2O
Н а
заключительной стадии происходит
отщепление протона водорода, с образованием
сложного эфира (5).
а
заключительной стадии происходит
отщепление протона водорода, с образованием
сложного эфира (5).


 R1-+C-OH
R1-C=O
R1-+C-OH
R1-C=O
R2 –O -H+ R2 – O (5)
На скорость реакции этерификации влияет строение молекулы кислоты и спирта. Чем выше кислотные свойства кислоты и спирта, тем легче они вступают в реакцию этерификации.
Пример реакции этерифиации:
 СН3-СООН
+ С4Н9ОН
t,
H2SO4
CH3COOC4H9
+ H2O
СН3-СООН
+ С4Н9ОН
t,
H2SO4
CH3COOC4H9
+ H2O

 уксусная
кислота бутиловый спирт
уксусно-бутиловый эфир
уксусная
кислота бутиловый спирт
уксусно-бутиловый эфир
