Глава 3. Химическая связь.
Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла. Она образуется, если электроны взаимодействующих атомов получают возможность двигаться одновременно вблизи положительных зарядов нескольких ядер.
Задача заключается в том, чтобы правильно описать главные детали этого движения многих частиц и научиться рассчитывать в различных участках молекулы электронную плотность, обеспечивающую «связывание» атомов. Оказалось, что получить даже качественно правильные решения уравнения Шрёдингера удаётся не всегда. А из методов квантовой химии наиболее известны два приближенных подхода к расчёту молекулярных систем — метод валентных связей и метод молекулярных орбиталей.
#1. История вопроса.
Основные понятия о строении молекул были заложены в теории химического строения А. М. Бутлерова (1861 год).
Основные положения теории:
1) Атомы в молекулах соединены друг с другом в определённой последовательности. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
2) Соединение атомов происходит в соответствии с их валентностью.
3) Свойства вещества зависят не только от состава, но и от их химического строения — порядка соединения атомов в молекулах и характера их взаимного влияния.
Разрабатывая теорию электронной связи, Бутлеров не ставил перед собой задачу выяснения причины химической связи, полагая, что химия ещё не готова к решению данной задачи. Лишь после того, как стали известны основные черты электронной структуры атомов, появилась возможность для разработки такой теории.
В 1916 году Дж. Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам. Эта идея послужила исходным пунктом для разработки теории ковалентной связи.
В том же 1916 году В. Коссель предположил, что при взаимодействии двух атомов один из них отдаёт, а другой принимает электроны. При этом первый атом превращается в положительно заряженный, а другой в отрицательно заряженный ион. Взаимное электростатическое притяжение образовавшихся ионов и приводит к образованию устойчивого соединения. Дальнейшее развитие идей Косселя привело к созданию современных представлений об ионной связи.
Сведения об электронном строении молекулы можно было бы получить из уравнения Шрёдингера для неё. Возникающая при этом трудность заключается в том, что решение этого уравнения возможно только для двух тел. В молекулах практически важных веществ содержится 100 и более электронов и большее число ядер атомов. Поэтому суть возможных теоретических методов исследования строения молекул заключается в нахождении приближенного способа решения уравнения Шрёдингера.
Приближённые способы решения уравнения Шрёдингера для систем, состоящих из многих ядер и электронов, интерпретация полученных решениях в удобных понятиях и терминах и т.п. является объектом изучения квантовой химии.
#2. Понятие о валентности.
Валентность элемента — это мера способности его атомов соединяться с другими атомами в определённых соотношениях.
Первоначально за единицу валентности принята валентность атома водорода. Валентность другого элемента можно выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определённая таким образом валентность называются валентностью в водородных соединениях или валентностью по водороду.
Пример: в HCl валентность равна единице, в H2O двум, в NH3 трём и так далее.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента. Определённая таким образом валентность называется валентностью по кислороду.
Пример: в N2O валентность азота по кислороду равна единице. в CO валентность углерода по кислороду равна двум, в SiO2 валентность кремния равна четырём.
Таким образом, охарактеризовать валентность элемента каким-нибудь числом, как правило, нельзя. Классическое определение валентности как числа ковалентных связей, образованных атомом с одновалентными атомами, не позволяет объяснить существование некоторых молекул.
Пример: CO, O3.
Более содержательное определение валентности v получено на основании метода молекулярных орбиталей и понятий ковалентности (vc) и электровалентности (ve). Валентность равна сумме ковалентности и модуля электровалентности.
v=vc+|ve|
Ковалентность атома характеризует степень участия атома в ковалентных химических связях или степень сосредоточенности электронной плотности в межъядерном пространстве. как правило, она принимает нецелочисленные значения. Аналогично, электровалентность атома определяемая величиной эффективного заряда атома, также бывает нецелочисленной.
#3. Квантово-механические методы описания ковалентной химической связи.
Приближённо ковалентность атома может быть оценена по порядку связи, являющемся в большинстве случаев косвенной характеристикой прочности ковалентной связи. Ковалентность примерно равна сумме порядков связей, образуемых этим атомом со всеми остальными атомами молекулы. Для двухатомных систем порядок связи равен полуразности числа электронов, располагающихся на связывающих молекулярных орбиталях., и числа электронов, располагающихся на разрыхляющих молекулярных орбиталях.
Эти числа электронов, приходящихся на отдельные молекулярные орбитали, называются заселённостями орбиталей. Заселённость любой орбитали обозначается буквой ω. Потому порядок связи (Р) — полуразность заселённостей всех связывающих молекулярных орбиталей ω (Ψсв) и всех разрыхляющих молекулярных орбиталей ω (Ψ*).
vc ≈ P; P = [∑ ω (Ψсв) — ∑ ω (Ψ*)]/2
Первое суммирование ведётся по всем связывающим МО, а второе — по разрыхляющим. Так как наличие электрона на связывающей орбитали понижает энергию электрона, а на разрыхляющей повышает, то больший порядок связи соответствует более прочной ковалентной связи и большей ковалентности атомов.
Ковалентная связь образуется одной или несколькими парами электронов с разными спинами. Происходит перекрывание электронных облаков. В результате атом теряет энергию — энергия связи. Ковалентная связь направлена в сторону максимального перекрывания электронных облаков (существует направленность). Обладает насыщаемостью, определяющейся механизмом образования (обменный или донорно-акцепторный).
#4. Метод валентных связей (ВС).
Приближённое решение уравнения Шрёдингера было впервые произведено в 1927 году В. Гейтлером и Лондоном.
Сначала они рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии (при таком рассмотрении можно учитывать взаимодействие электрона только со своим ядром), получив зависимость волновой функции рассматриваемой системы от координаты, и тем самым определили плотность общего электронного облака (электронную плотность) в любой точке пространства.
Затем они решили, что найденная ими зависимость волновой функции от координат сохраняется при сближении атомов, однако возникают некоторые поправки (возмущения) к исходному состоянию электронов в свободных атомах водорода, которыми они ранее пренебрегали.
В результате были получены уравнения, позволяющие найти зависимость потенциальной энергии Е системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов.
При этом оказалось, что результаты расчёта зависят от того, одинаковые или разные спины у электронов взаимодействующих атомов.
При совпадении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. В последнем случае для сближения атомов требуется затрата энергии, так что такой процесс оказывается энергетически невыгодным и химическая связь между ними не возрастает.
При противоположно направленных спинах сближение атомов до некоторого расстояния ro сопровождается уменьшением энергии системы. При r=ro система обладает наименьшей потенциальной энергией, т.е. находится в наиболее устойчивом состоянии. Дальнейшее сближение атомов приведёт к возрастанию энергии.
Таким образом, в случае противоположно направленных спинов образуется молекула Н2 — устойчивая система из двух атомов водорода, находящихся на определённом расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом «перекрывания» электронных облаков, происходящего при сближении взаимодействующих атомов. Вследствие такого «перекрывания» плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра притягиваются к области взаимного проникновения электронных облаков. Это притяжение преобладает над взаимным отталкиванием между электронами и молекула становится устойчивой.
Таким образом, исследование позволило сделать вывод, что химическая связь в молекуле водорода осуществляется путём образования пары электронов с противоположными спинами, принадлежащих обоим атомам. Разработанная на этой основе теория химической связи и для более сложных молекул получила название метода валентных связей.
Наличие спаренных электронов является «индикатором» наличия химической связи, но не причиной её образования. Изучение причины образования химической связи показало, что энергия системы из двух атомов понижается тогда, когда электроны с большой вероятности находятся в межъядерном пространстве. Такая задержка приводит к понижению их кинетической энергии. В результате отрицательная составляющая полной энергии молекулы преобладает, молекула становится устойчивой и образуется химическая связь.
Основные положения метода ВС:
-
Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причём эта электронная пара принадлежит двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающих электронную структуру молекулы, получили название валентных схем.
-
Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
При оценке степени перекрывания электронных облаков следует учитывать знаки волновых функций электронов. Поскольку электронам присущи волновые свойства, то при взаимодействии двух электронов образуется общая «электронная волна». Там, где амплитуды исходных волн имеют одинаковые знаки, при их сложении возникает суммарная волна с амплитудой, имеющей большее абсолютное значение, чем исходные амплитуды. Напротив, там, где амплитуды исходных волн имеют различные знаки, волны будут «гасить» друг друга.
Роль амплитуды электронной волны играет волновая функция — атомная орбиталь (АО). Поэтому в тех областях пространства, где атомная орбиталь взаимодействующих электронов имеют одинаковые знаки, абсолютное значение волновой функции образующегося общего электронного облака будет больше, чем значения АО у изолированных атомов.
При этом будет возрастать и плотность электронного облака. Здесь происходит положительное перекрывание электронных облаков, которое приводит к взаимному притяжению ядер. В тех же областях пространства, где знаки волновых функций взаимодействующих электронов противоположны, абсолютное значение суммарной волновой функции будет меньше, чем у изолированных атомов. Здесь плотность электронного облака будет уменьшаться. В таком случае имеет место отталкивание ядер.
#5. Гибридизация атомных орбиталей.
Гибридизация атомных орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Химическая связь, образуемая с участием электронов гибридных орбиталей, более прочная, чем связь с участием электронов негибридных s- и р-орбиталей, так как происходит большее перекрывание.
|
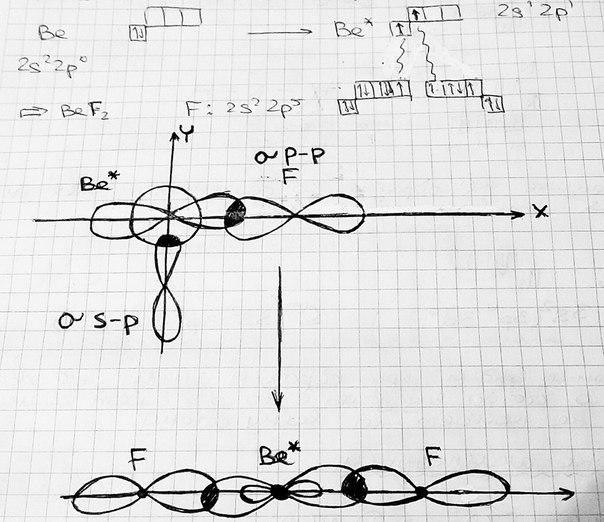
Различают следующие виды гибридизации: sp1-гибридизация
– одна s-орбиталь
и одна p-орбиталь превращаются в две
одинаковые «гибридные» орбитали, угол
между осями которых равен 180°. Молекулы,
в которых осуществляется sp-гибридизация,
имеют линейную геометрию (Например,
BeF2).
sp1 - гибридизация
плоская фигура
|
sp2-гибридизация – одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°. Молекулы, в которых осуществляется sp2-гибридизация, имеют плоскую геометрию (Например, BH3).
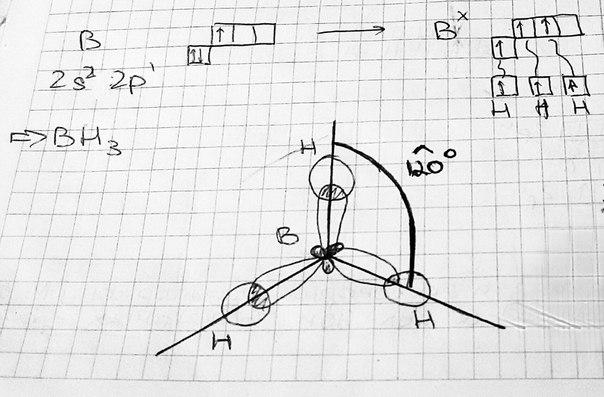
плоская фигура
sp3-гибридизация
– одна s-орбиталь и три p-орбитали
превращаются в четыре одинаковые
«гибридные» орбитали, угол между осями
которых равен 109°28'. Молекулы, в которых
осуществляется sp3-гибридизация,
имеют тетраэдрическую геометрию
(Например, CH4).

sp3-гибридизация
тетраэдр
#6. Метод молекулярных орбиталей (МО).
Метод
молекулярных орбиталей
– это линейная комбинация атомных
орбиталей.
Ѱ=(Ѱ1+(Ѱ2+…
H2 1s1
Ѱ=Ѱ1+Ѱ2
всплеск
электронной плотности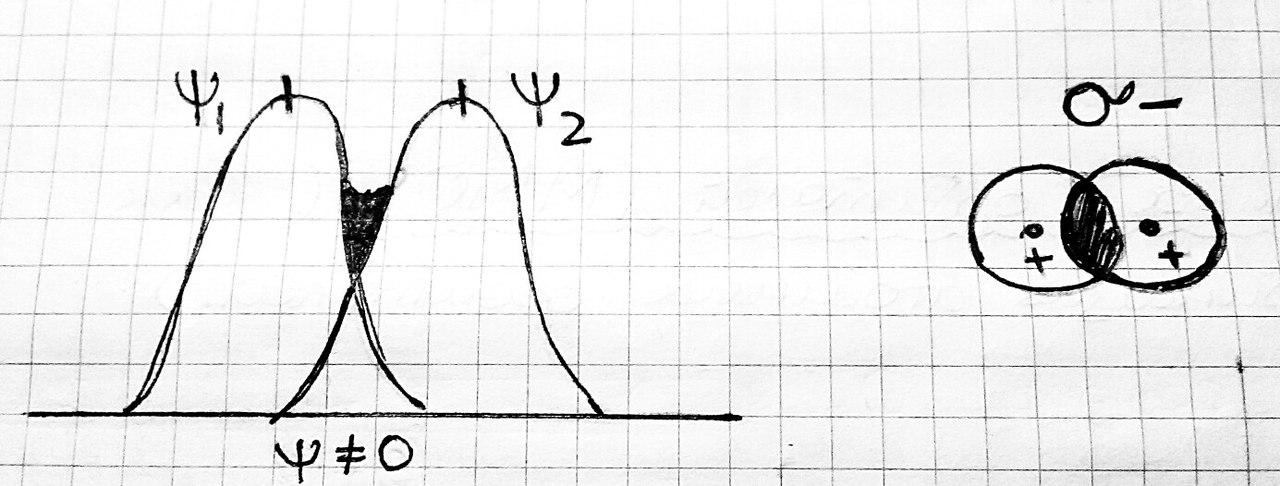
Типы молекулярных орбиталей:
-
Несвязывающая молекулярная орбиталь находится в межъядерном пространстве ближе к «хозяину»;
-
Связывающая молекулярная орбиталь имеет энергию ниже, чем исходная орбиталь. Когда атом переходит на неё, он теряет энергию;
-
Разрыхляющая молекулярная орбиталь: энергия выше, чем исходная орбиталь, следовательно, молекула будет образовываться, когда заселённость связывающей орбитали выше, чем энергия разрыхляющей орбитали.
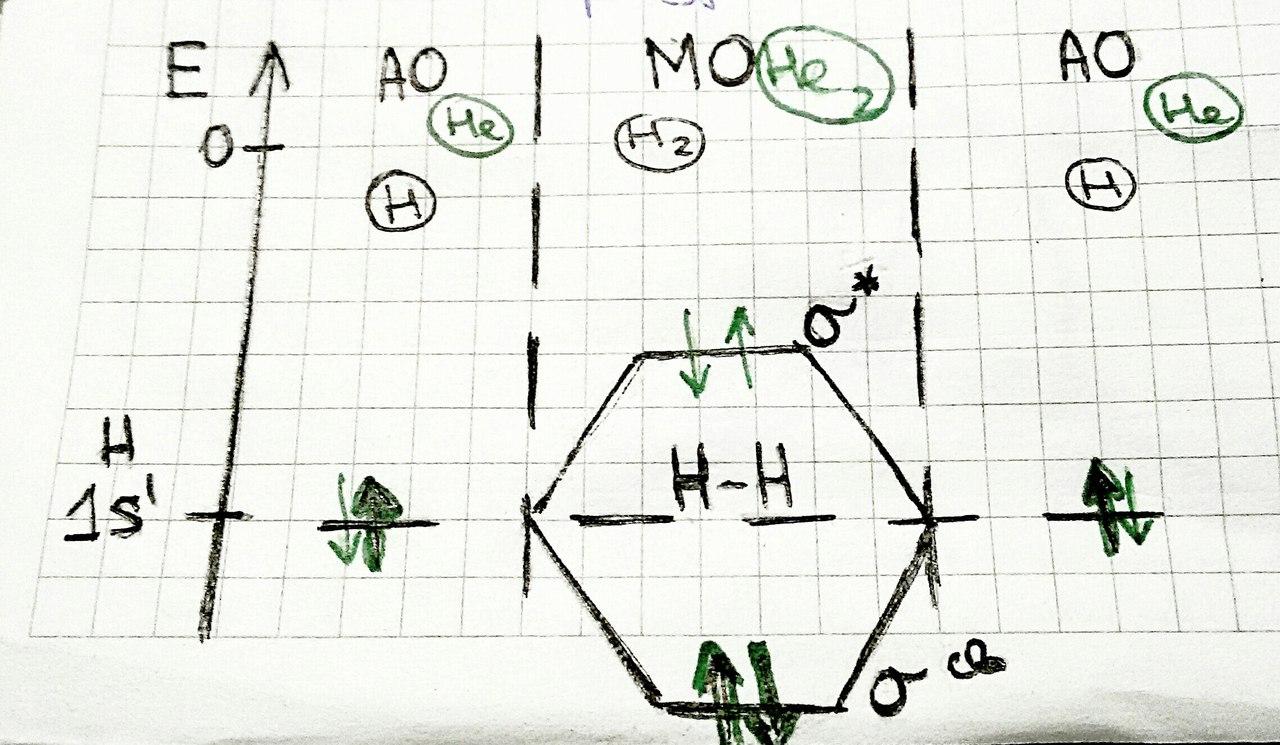
Таким образом, He2 не существует, так как Eσсв=Eσ* .
Порядок связи = (Nσсв - Nσ*)/(Nядер)
Не2+
:
выполняется правило: Eσсв < Eσ*
#7. Энергетические диаграммы гомо- и гетеро-атомных молекул.
N2: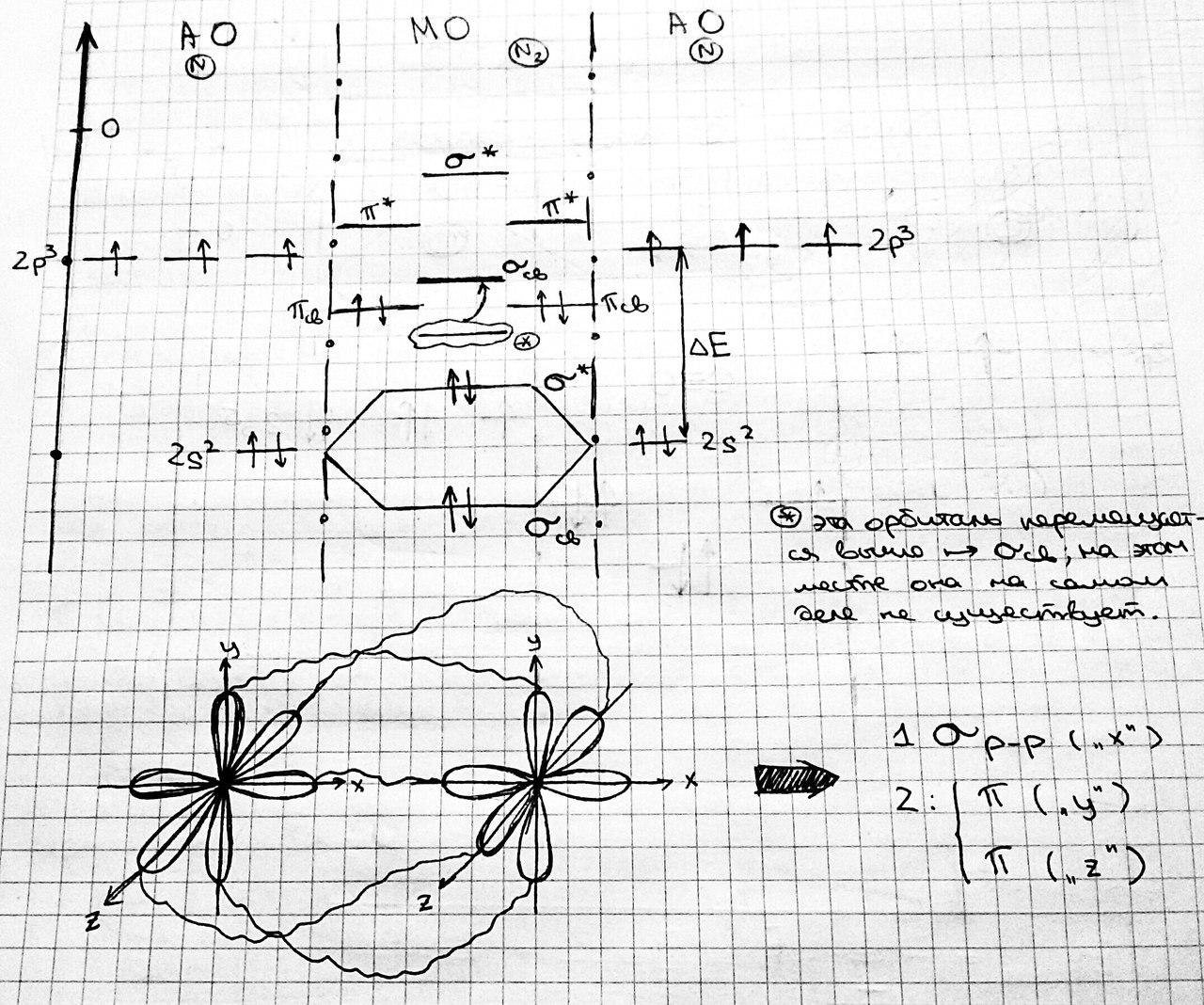
O2:
CO: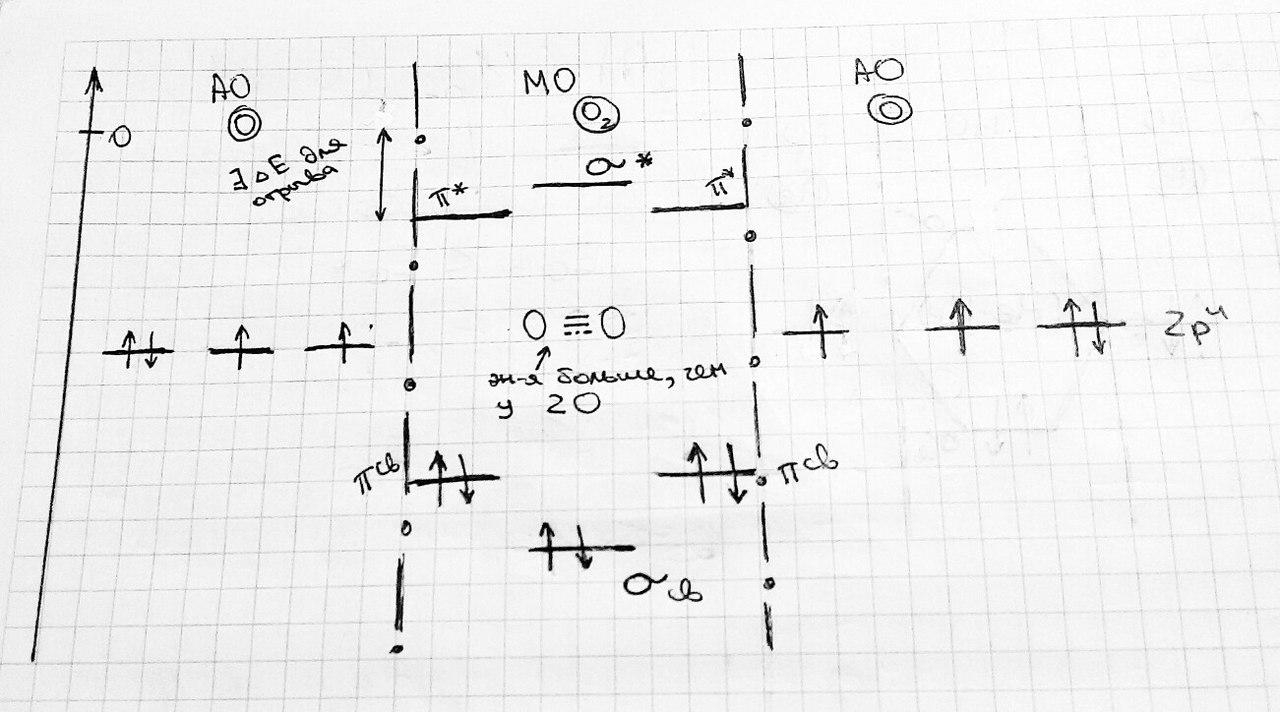

#8. Основные свойства ковалентной связи (дли-на, энергия, кратность, направленность, насы-щаемость).
СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ:
Ковалентная связь образуется одной или несколькими парами электронов с разными спинами. В ходе образования ковалентной связи происходит перекрывание электронных облаков, в результате чего атом теряет энергию, называемую энергия связи.
Ковалентная связь характеризуется:
-
длиной связи;
-
энергией связи;
-
направленностью связи;
-
насыщаемостью связи;
-
кратностью связи.