
I и II начала термодинамики.
IНТД: Теплота, переданная системе идёт на увеличение внутренней энергии системы и на работу против внешних сил (работа по расширению).
Q=ΔU+A, где A=pΔV
или δQ=dU+ δA, где δA=pdV
IIНТД: уравнения Гиббса
В изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к росту энтропии (∆S>0).
QP=ΔH=ΔG+TΔS (при p, T = const)
QV=ΔF=ΔU-ΔS (при V, T=const)
Направленность самопроизвольного протекания химических процессов.
Согласно принципу Бертло-Томсена самопроизвольно протекают только экзотермические реакции.
В изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к росту энтропии (∆S>0).
#2. Термохимия: тепловой эффект реакций, закон Гесса и следствия из него, термохимические рас-чёты.
Термохимия — это раздел химии, который изучает тепловые эффекты тепловых реакций в пересчёте на 1 моль вещества.
Закон Лапласа-Лавуазье:
Если при образовании какого-либо соединения выделяется некое количество теплоты Q, то и для разложения этого соединения при тех же условиях потребуется такое же количество теплоты Q.
Энтальпия образования — то количество теплоты Q, которое выделяется при образовании 1 моль вещества из простых веществ. Используется наиболее устойчивое (пример: из O2 и O3 выбираем О2).
Теплота сгорания — то количество теплоты, которое выделяется при сгорании 1 моль вещества, измеренное тогда, когда продукты реакции охлаждены до комнатной температуры.
Закон Гесса:
Теплота реакции зависит только от начального и конечного состояний вещества. Не зависит от промежуточной стадии процесса — функция состояния (при условии, что работа положительна, т.е. работа по расширению; p, T=const).
Выводы из закона Гесса:
1) Энтальпия образования не зависит от способа получения вещества;
2) Теплота разложения вещества до одинаковых продуктов равна и противоположна по знаку его теплоте образования этих продуктов;
3) Тепловой эффект реакции равен алгебраической сумме теплот образования реагентов из простых веществ, т.е.
ΔH=Σ (ΔHобр)продуктов - Σ (ΔHобр)исходных
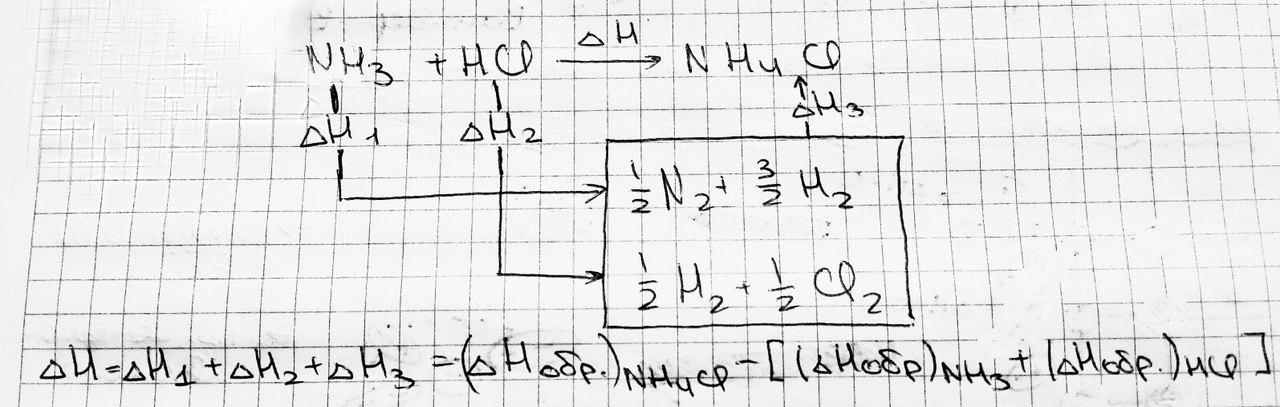
4) Тепловой эффект реакции равен сумме теплот сгорания реагентов до одинаковых продуктов, т.е.
ΔH=
Σ
(ΔHсгор)исходных
- Σ
(ΔHсгор)продуктов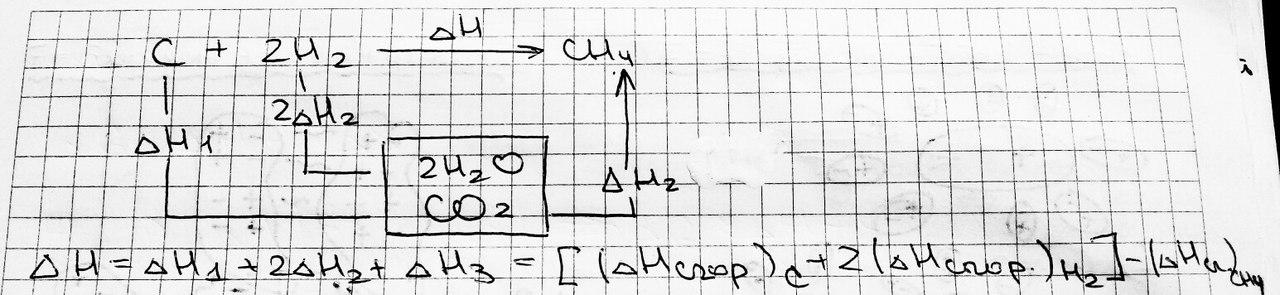
#3. Химическая кинетика. Основные понятия химической кинетики. Гомогенные и гетероген-ные химические реакции. Зависимость скорости гомогенных и гетерогенных реакций от кон-центрации реагирующих веществ, температуры, давления. Влияние других факторов. Энергия активации, активированный комплекс. Гомоген-ный и гетерогенный катализ.
Химическая кинетика — это раздел химии, который изучает скорости химических превращений.
Либо гетерогенных систем — две и более фаз, либо гомогенных систем — одна фаза.
Фаза — это часть системы, которая отделена от других частей системы поверхностью системы, причём при переходе из одной фазы в другую свойства меняются скачком. Пример: смеси газов.
Гомогенные реакции идут по всему объёму системы.
Гетерогенные реакции идут на поверхности раздела фаз.
Интермедиальные реакции — реакции с участием промежуточных веществ.
Прекурсор — промежуточное или исходное вещество; конечный продукт реакции — токсин, наркотик или взрывчатое вещество. Пример: соляная кислота, ацетон.
vгомогенной реакции = Δn/Δt*ΔV=ΔCM/Δt=± dCM/dt
ΔV – единица объёма
vгетерогенной реакции = Δn/Δt*S
S – единица площади
Принципы химической кинетики:
1. принцип детального равновесия: скорость прямой и обратной реакции в состоянии химического равновесия равны;
2. В случае стационарного процесса в любом бесконечно малом объёме этот стационарный процесс характеризуется независимостью всех термодинамических параметров.
Влияние параметров на скорость реакции:
aA+bB → cAB
