
6. Лигазы.
Ферменты этого класса участвуют в реакциях соединения двух и более простых веществ с образованием нового вещества более сложного. Реакции называются реакции синтеза. Для синтетических реакций необходим источник энергии. Если источником является молекула АТФ, то фермент называется синтетаза, если источник энергии другое вещество, то фермент называется синтаза.

Номенклатура ферментов.
1.Тривиальная номенклатура. ПРИМЕР: пепсин, трипсин.
2.Рабочая номенклатура:
название S + тип превращения + окончание «аза».
ПРИМЕР: ЛАКТАТДЕГИДРОГЕНАЗА.
3. согласно правилу номенклатуры. По этим правилам фермент имеет кодовое четырехзначное обозначение: 1 цифра – класс, 2 – подкласс, 3 – подподкласс, 4 – порядковый номер фермента данной группы.
ЕДИНИЦЫ АКТИВНОСТИ ФЕРМЕНТОВ.
Мерой активности фермента могут быть скорость превращения субстрата и концентрация образующегося продукта реакции. Согласно современной классификации по системе СИ, единицей активности является КАТАЛ. КАТАЛ - это количество фермента, которое способно осуществить превращение 1 молекулы субстрата в 1 секунду при стандартных условиях.
ФЕРМЕНТЫ В МЕДИЦИНЕ.
Основное направление медицинской ЭНЗИМОЛОГИИ:
1.ЭНЗИМОПАТОЛОГИЯ (патологическое состояние, связанное с полным отсутствием фермента в организме).
2.ЭНЗИМОДИАГНОСТИКА (определение активности ферментов в диагностических целях). 3.ЭНЗИМОТЕРАПИЯ (использование ферментов в лечебных целях).
Лекция № 7. Основной путь катаболизма (ОПК).
1 .ПОНЯТИЕ ОБ ОБМЕНЕ ВЕЩЕСТВ.
2.ЭТАПЫ ОБМЕНА ВЕЩЕСТВ.
3.ОПК, ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (ЦТК).
ПОНЯТИЕ ОБ ОБМЕНЕ ВЕЩЕСТВ.
Обмен веществ - необходимое условие жизни, но он протекает и вне живой природы. Обмен веществ всегда связан с обменом энергии. Системы, обменивающиеся с окружающей средой веществом и энергией, называются открытыми (живой организм). Закрытые системы обмениваются только энергией. В соответствии со 2 законом термодинамики, открытые системы являются более устойчивыми. Отличительной особенностью обмена веществ в живой природе от обмена веществ в неживой системе является способность образовывать дочерние структуры из поступивших веществ.
Обмен веществ - это процессы взаимоотношения организма с внешней средой, представляющие совокупность химических реакций, которым подвергаются различные вещества с момента их поступления в организм до момента их выделения в виде конечных продуктов. Основные компоненты живых систем - белки, жиры, углеводы. В организм человека должно поступать: Белков - 100 г в сутки, Жиров - 100 г в сутки, Углеводов - 400 г в сутки.
За сутки при обмене этих веществ образуется 2000-3000 ккал энергии.
ЭТАПЫ ОБМЕНА ВЕЩЕСТВ.
1.Поступление веществ из внешней среды посредством питания и дыхания.
2.Превращение веществ в организме - МЕЖУТОЧНЫЙ обмен
3.Выделение конечных продуктов.

Распад БЖУ до ПИРУВАТА идёт индивидуально для каждой группы органических соединений и носит название специфического пути катаболизма. С образованием ПИРУВАТА начинается общий путь катаболизма, идентичный для обмена всех питательных веществ.

ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ. ОПК можно разделить на несколько стадий:
1.Превращение ПВК в АЦЕТИЛ-КОА.
2.Распад АЦЕТИЛ-КОА в ЦТК (образование СО2).
3.Образование воды как конечного продукта в ЦПЭ (цикле переноса электронов).
ПРЕВРАЩЕНИЕ ПИРУВАТА В АЦЕТИЛ-КОА.

ПИРУВАТ подвергается реакции ОКИСЛИТЕЛЬНОГО ДЕКАРБОКСИЛИРОВАНИЯ. Этот процесс катализируется комплексом ферментов - ПИРУВАТДЕКАРБОКСИЛАЗНЫМ комплексом (ПДК), с участием в процессе 5 КОФЕРМЕНТОВ:
1 .ДЕКАРБОКСИЛАЗЫ (включают КОФЕРМЕНТ - ТДФ).
2.АЦЕТИЛТРАНСФЕРАЗЫ (включают КОФЕРМЕНТ - ЛК, HSKOA).
3.ДЕГИДРОГЕНАЗЫ (включают КОФЕРМЕНТ - НАД, ФАД, ЛК).
ЦТК (цитратный цикл, цикл КРЕБСА).
В цикле КРЕБСА АЦЕТИЛ-КОА распадается до СО2 с образованием восстановленных КОФЕРМЕНТОВ – НАДН

АТФ в реакции не участвует, а используется энергия макроэргической связи АЦЕТИЛ-КОА ЦИТРИЛ-КОА не устойчив и очень быстро распадается под влиянием воды.

Лимонная кислота далее превращается в свой изомер (ИЗОЦИТРАТ) под влиянием фермента АКОНИТАЗЫ.

ИЗОЦИТРАТ подвергается далее ДЕГИДРИРОВАНИЮ под влиянием фермента ИЗОЦИТРАТДЕГИДРОГЕНАЗЫ.

ЩАВЕЛЕВО-ЯНТАРНАЯ К-ТА подвергается ДЕКАРБОКСИЛИРОВАНИЮ достаточно легко и не требует участия дополнительных ферментов - ПРЯМОЕ ДЕКАРБОКСИЛИРОВАНИЕ.

-КГК подвергается реакции ОКИСЛИТЕЛЬНОГО ДЕКАРБОКСИЛИРОВАНИЯ, катализируемой комплексом ферментов (КЕТОГЛУТАРАТДЕГИДРОГЕНАЗНЫЙ комплекс), включающий 3 фермента и 5 КОФЕРМЕНТОВ.

СУКЦИНИЛ-КОА подвергается реакции субстратного ФОСФОРИЛИРОВАНИЯ.

ГТФ + АДФ = ГДФ + АТФ

Т.о. происходит распад АЦЕТИЛ-КОА до СО2 и восстановленного HSKOA.
ФУНКЦИИ ЦТК.
1 .Катаболическая - распад АЦЕТИЛА.
2.Анаболическая. Компоненты ЦТК могут использоваться для синтеза др. соединений
ЩУК - синтез АСП, МАЛAT - синтез глюкозы и т.д.
3.Интегративная. Взаимосвязь обмена БЖУ.
4.Энергетическая. Образование 1 молекулы АТФ. Если ЦТК работает вместе с дыхательной цепью, то образуется ещё 1 молекул АТФ.
5.ВОДОРОДГЕНЕРИРУЮЩАЯ - в результате ЦТК образуется 3 молекулы НАДН2 и 1 молекула ФАДН2, т.е. 4 пары молекул водорода. Они транспортируются в ЦТЭ.
Лекция № 8.
Образование воды как конечного продукта биологического окисления.
1.ИСТОРИЯ УЧЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ.
2.СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ.
3.КОМПОНЕНТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ.
4.ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ. ИСТОРИЯ УЧЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ.
Первые представления о биологическом окислении были высказаны ЛАВУАЗЬЕ, который говорил, что биологическое окисление - медленное горение. С химической точки зрения, горение - это взаимодействие углерода с кислородом с образованием СО2. Но в организме образование СО2 идёт путём ДЕКАРБОКСИЛИРОВАНИЯ, а биологическое окисление протекает при низкой температуре, не путём образования СО2, в присутствии воды и без образования пламени. Исходя из этого, были выдвинуты следующие настоящие представления о биологическом окислении в начале 20 в:
1.Теория «активации» кислорода академика БАХА. Ведущей ролью в процессе биологического окисления он представлял образование ПЕРОКСИДОВ.

![]()
Эти взгляды поддержали ботаники, т.к. в растениях много ПЕРOКСИДАЗ, а учёные, изучающие животные ткани, не поддержали эти взгляды, т.к. в них не обнаруживаются ПЕРОКСИДАЗЫ.
2.Теория активирования водорода академика ПАЛЛАДИНА. Он исходил из того, что в животных тканях много фермента - ДГ.

Конечным продуктом биологического окисления является вода. Взгляды БАХА и ПАЛЛАДИНА трансформировали. В настоящее время считается, что в биологическом окислении принимают участие ДГ и ОКСИДАЗЫ.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ.
1. Биологическое окисление, как и окисление вообще, есть процесс переноса электронов. То вещество, что отдаёт электроны окисляется то, что принимает, восстанавливается. Если акцептором электронов является кислород, то такой процесс называется ТКАНЕВЫМ ДЫХАНИЕМ. Биологическое окисление предполагает ДЕГИДРИРОВАНИЕ с образованием воды.
![]()
Если водород взаимодействует с кислородом с образованием воды вне организма, то это сопровождается взрывом.
2. Биологическое окисление - это процесс многоступенчатый - многоступенчатая передача электронов с постепенным выделением энергии, что исключает взрыв.
3. Биологическое окисление - это процесс, требующий много ферментов. Т.о. биологическое окисление - это многоступенчатый процесс транспорта электронов, осуществляемый комплексов ферментов. Этот комплекс ферментов называется ЭЛЕКТРОН-ТРАНСПОРТНОЙ ЦЕПЬЮ (ЭТЦ), или ЦЕПЬЮ ПЕРЕНОСА ЭЛЕКТРОНОВ (ЦПЭ), или дыхательной цепью. ЭТЦ - это своеобразный КОНВЕЕР по переносу электронов и протонов от субстрата к кислороду.
КОМПОНЕНТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ.
1 .НИКОТИНЗАВИСИМЫЕ ДГ, т.е. содержащие КОФЕРМЁНТЫ - НАД, НАДФ 2.ФЛАВИНЗАВИСИМЫЕ ДГ, т.е. содержащие КОФЕРМЁНТЫ - ФМН, ФАД.
З.УБИХИНОН (Ko-Q).
4.ЦИТОХРОМЫ: в, с, c1., а, а3.
Почти все эти компоненты, за исключением первого, встроены во внутреннюю мембрану МИТОХОНДРИЙ. В печени таких дыхательных цепей до 5000, а в сердце - до 20000.
СТРОЕНИЕ КОМПОНЕНТОВ ДЫХАТЕЛЬНОЙ ЦЕПИ.
1 .В НАД и НАДФ рабочей частью является витамин РР - НИКОТИНАМИД.

НАД*2Н + 2е = НАДН+Н
2.В ФАД и ФМН рабочей частью является ФЛАВИИ (компонент витамина В2)

ФАД + 2Н + 2е = ФАДН2
3.УБИХИНОН легко переходит в восстановленную форму KOQ +2Н + 2е = KOQ*H2
4.ЦИТОХРОМЫ - это ГЕТЕРОПРОТЕИНЫ. Их белковой частью является ГЕМ, структура которого представляет собой 4 ПИРРОЛЬНЫХ кольца и атом железа, который легко меняет валентность. Также могут включать медь.
ФЕРМЕНТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ.
1.ДГ субстратов находятся в цитоплазме клетки, могут быть в МАТРИКСЕ МИТОХОНДРИЙ.
2.НАДН-ДГ(ФМН).
3.KOQ
4.Q*H2 - ДГ (ЦИТОХРОМЫ в, с 1).
5.ЦИТОХРОМ с.
6.ЦИТОХРОМОКСИДАЗА участвует в передаче электронов на кислород (включает ЦИТОХРОМЫ а, а3).
ФУНКЦИОНИРОВАНИЕ ДЫХАТЕЛЬНОЙ ЦЕПИ.

Полная ЭТЦ - взаимодействие субстрата с НАД. Укороченная ЭТЦ - взаимодействие субстрата с ФАД и последующий транспорт электронов и протонов сразу на КОФЕРМЕНТ Q.
Порядок компонентов дыхательной цепи обусловлен величиной их red-ox потенциалов. Он изменяется от -0,32В до +0,81В
-0,32 характерно для НАДН2
+0,81 характерно для О2.
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ.
В дыхательной цепи создаются условия для синтеза АТФ, т.е. выделяется достаточное количество энергии. Процесс образования АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов дыхательной цепи называется ОКИСЛИТЕЛЬНЫМ ФОСФОРИЛИРОВАНИЕМ.
СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ - это процесс образования АТФ из АДФ и Н3РО4 за счёт энергии распада какого-либо субстрата. В дыхательной цепи выделяются 3 пункта, где может образоваться АТФ:
1.НАД KOQ
2.ЦИТ. в. ЦИТ. с
З.ЦИТ. а. ЦИТ. A3
НАДН2 — 3 АТФ
ФАДН2 — 2 АТФ
Процесс освобождения АТФ с транспортом электронов в дыхательной цепи называется
СОПРЯЖЕНИЕМ ОКИСЛЕНИЯ И ФОСФОРИЛИРОВАНИЯ. Но может быть разобщение
ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ (свободное окисление), т.е. окисление идёт, а
ФОСФОРИЛИРОВАНИЯ нет, вся энергия выделяется в виде тепла. Это обуславливает
ПИРОГЕННЫЙ эффект ряда лекарственных веществ.
Лекция № 9. Биологическое окисление (продолжение).
1 .МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ.
2.АЛЬТЕРНАТИВНЫЕ ПУТИ БИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ.
3.СВОБОДНО-РАДИКАЛЬНОЕ ОКИСЛЕНИЕ.
МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ.
Теория ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ выдвинута английским учёным П. МИТЧЕЛОМ в 1961 г. и названа ХЕМИООСМОТИЧЕСКОЙ ТЕОРИЕЙ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ. Он объяснил процесс синтеза АТФ с биохимической позиции, но его взгляды не получили признания. Однако в последующем его теория подтвердилась, и через 17 лет он был удостоен Нобелевской премии.
Основные положения теории:
1.Мембрана МИТОХОНДРИЙ не проницаема для протонов.
2.Образуется протонный потенциал в процессе транспорта электронов и протонов.
3.Обратный транспорт протонов в МАТРИКС сопряжен с образованием АТФ.
Процесс транспорта электронов происходит во внутренней мембране. Первые реакции окисления происходят в матрице. Протоны переносятся в межмембранное пространство, а электроны продвигаются по дыхательной цепи. В процессе работы дыхательной цепи внутренняя мембрана со стороны матрицы заряжается отрицательно, а со стороны межмембранного пространства положительно. Следовательно, возникает разность потенциалов, градиент концентрации ионов, и, соответственно, градиент РН. Т.о. РН со стороны матрицы будет менее кислая. Во время дыхания создаётся ЭЛЕКТРО-ХИМИЧЕСКИЙ градиент: концентрационный и разности потенциалов. Электрический и концентрационный градиент составляет ПРОТОНДВИЖУЩУЮ силу, которая даёт силу для синтеза АТФ. На определённых участках внутренней мембраны есть протонные каналы, образованные АТФ-СИНТЕТАЗОЙ. Протоны могут проходить обратно в матрицу, при этом образующаяся энергия идёт на синтез АТФ.
УСЛОВИЯ ОБРАЗОВАНИЯ АТФ.
1. Целостность мембраны - непроницаемость её для протонов.
2. Наличие специальных каналов.
3. Движение протонов в матрицу сопровождается выделением энергии, используемой для синтеза АТФ.
Вопрос о том, что позволяет протонам переходить в межмембранное пространство остаётся не вполне ясным.
Основные компоненты ЭТЦ представляют собой интегральные белки и фиксированные в мембране: 1.НАДН-ДГ.
2.QН2-ДГ.
3.ЦИТОХРОМОКСИДАЗА.
4.KOQ не связан с белками.
5.ЦИТОХРОМ с - не фиксирован к мембране.
Выдвигается теория Q-цикла транспорта протонов.
2Н + 2е + KOQ KOQ*H2
KOQ*H2 KOQ + 2Н + 2е - на наружной поверхности внутренней мембраны.
Т.о. в соответствии с ХЕМИООСМОТИЧЕСКОЙ теорией МИТЧЕЛА окисление НАДН2 и ФАДН2 в дыхательной цепи создаёт сначала ЭЛЕКТРОНО-ХИМИЧЕСКИЙ протонный потенциал, градиент концентрации ионов на внутренней мембране, а обратный транспорт протонов через мембрану сопряжен с ФОСФОРИЛИРОВАНИЕМ, т.е. образованием АТФ.
АЛЬТЕРНАТИВНЫЕ ПУТИ БИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ.
В организме возможен и ОКСИГЕНАЗНЫЙ путь биологического окисления. Он не относится к процессам, сопровождающимся выделением энергии, он не снабжает клетку энергией. Ферменты этого пути включают кислород и субстрат. Этот путь характерен для ДЕГИДРАТАЦИИ различных метаболитов, чаще всего чужеродных.
Стадии ОКСИГЕНАЗНОГО ПУТИ:
1.Связывание кислорода с активным центром фермента.
2.Восстановление кислорода и перенос его на субстрат.
Выделяют 2 типа ОКСИГЕНАЗ:
1.ДИОКСИГЕНАЗЫ - ферменты, включающие в субстрат молекулу кислорода.
А + О2 = АО2
В живых тканях этот процесс практически не встречается.
2.МОНООКСИГЕНАЗЫ - они катализируют включение в субстрат 1 атома кислорода, др. атом кислорода восстанавливается до воды. Для реакций катализируемых МОНООКСИГЕНАЗАМИ необходим КОСУБСТРАТ - донор электронов.
А-Н + О2 + ZH2 А-ОН + Z + Н2О
Где А-Н - субстрат
ZH2 - КОСУБСТРАТ
А-ОН - окисленный субстрат.
В организме есть несколько видов МОНООКСИГЕНАЗ и прежде всего МИКРОСОМАЛЬНЫЕ МОНООКСИГЕНАЗЫ, содержащие ЦИТОХРОМ Р-450.Т.к. образуется -ОН группа, то реакции называются ещё реакциями ГИДРОКСИЛИРОВАНИЯ. МИКРОСОМАЛЬНАЯ система участвует в деградации многих умеренно токсических соединений, лекарственных веществ. Восстановленным КОСУБСТРАТОМ в этих реакциях является НАДФ*Н2. Этот путь окисления иногда называют ГИДРОКСИЛАЗНЫМ ЦИКЛОМ.
СВОБОДНОЕ РАДИКАЛЬНОЕ ОКИСЛЕНИЕ.
Свободные радикалы - это молекулярные частицы, у которых на внешней оболочке имеется не спаренный электрон. Они могут образовываться: при окислении (отрывании атома водорода)
![]()
при восстановлении
О2 + е О2-
Атомарный кислород имеет на внешнем электронном уровне 2 неспареных электрона. Он
не слишком активный, но может образовывать высоко активные формы.
О2+4е + 4Н 2Н2О
Этот процесс, в тканях, идёт постепенно, с переносом 1е на каждом этапе.
О2 + е = 02- - СУПЕРОКСИДНЫЙ АНИОН
2-02 + 2е = 022- - ПЕРОКСИДНЫЙ АНИОН
НО, - ГИДРОКСИЛ РАДИКАЛ
Н2О2, О2-, О22-, ОН, - активные формы кислорода (АФК)
Они образуются в организме при различных физиологических и патологических процессах. Все свободные радикалы в организме классифицируют:
1. Первичные радикалы (О2, N,O). Они образуются в результате ферментативных реакций. Они являются физиологическими. Способствуют образованию РАДИКАЛОБРАЗНЫХ молекул, к которым относятся НООН, они вызывают образование вторичных радикалов.
2. Вторичные радикалы (ОН, ЛИПИДНЫЕ радикалы – L,, LO,, LOO,) Их образование происходит с участием железа (11). Это патологические продукты.
3. Третичные радикалы (АНТИОКСИДАНТЫ) - образуются под влиянием вторичных радикалов.
СУПЕРОКСИДНЫЙ АНИОН легко присоединяет Н+, е. Он хорошо растворяется в жирах, следовательно, следовательно, легко взаимодействует с ЛИПИДАМИ мембран, и особенно хорошо взаимодействует с ПОЛИНЕНАСЫЩЕННЫМИ ЖИРНЫМИ КИСЛОТАМИ, отнимая у них водород.


Этот процесс называется ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ (ПОЛ). Это патологическое явление, приводящее к нарушению целостности мембран клеток. Процессы свободного радикального окисления идут в норме, но на низком уровне. Поэтому в организме есть система, которая предотвращает ПОЛ - АНТИОКИСЛИТЕЛЬНАЯ СИСТЕМА (АОС), препятствующая образованию свободных радикалов.
Она включает:
1 .Фермент - СУПЕРОКСИДДИСМУТАЗА (СОД).
![]()
ГЛУТАТИОНПЕРОКСИДАЗА (восстановление Н2О2 за счет окисления ГЛУТАТИОНА).
2.Альфа- ТОКОФЕРРОЛ (вит. Е) - основной не ферментный АНТИОКСИДАНТ.
3.УБИХИНОН.
4.МОЧЕВАЯ К-ТА.
5.БИЛИРУБИН.
6.ГЛУТАТИОН.
7.КОМПЛЕКСОНЫ ЖЕЛЕЗА (связывают железо, потенцирующего образование свободных радикалов).
СЕНЕРГИСТЫ АНТИОКСИДАНТОВ соединения, которые восстанавливают АНТИОКСИДАНТЫ, способствуя возвращению их в активную форму. В организме основным источником свободных радикалов являются фагоциты. При встрече фагоцита с чужеродным субстратом, он прикрепляется к нему и начинает выделять АФК. Они активируют свободно-радикальный процесс ПОЛ, поражают мембрану чужеродного агента, вызывая его гибель. К активации свободных радикалов в организме приводят:
1. НЕДОСТАТОК БИООКСИДАНТОВ.
2. ВНЕШНИЕ ФАКТОРЫ.
3. ХРОНИЧЕСКИЙ СТРЕСС.
4. ГИПОДИНАМИЯ.
5. ИЗБЫТОК ЖИРНОЙ ПИЩИ.
6. МНОГИЕ ПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ.
Лекция № 10. Обмен углеводов.
1. ОСНОВНЫЕ УГЛЕВОДЫ ЖИВОТНОГО ОРГАНИЗМА, ИХ КЛАССИФИКАЦИЯ И БИОЛОГИЧЕСКАЯ РОЛЬ.
2. ПРЕВРАЩЕНИЕ УГЛЕВОДОВ В ОРГАНАХ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ.
3. БИОСИНТЕЗ И РАСПАД ГЛИКОГЕНА.
4. ГЛИКОГЕНОВЫЕ БОЛЕЗНИ.
ОСНОВНЫЕ УГЛЕВОДЫ ЖИВОТНОГО ОРГАНИЗМА.
Углеводы - это ПОЛИОКСИКАРБОНИЛЬНЫЕ соединения и их производные.
![]()
МОНОСАХАРИДЫ: ТРИОЗЫ (ГЛИЦЕРАЛЬДЕГИД, ДИОКСИАЦЕТОН), ТЕТРОЗЫ (ЭРИТРУЛОЗА), ПЕНТОЗЫ (РИБОЗА, ДЕЗОКСИРИБОЗА, КСИЛУЛОЗА), ГЕКСОЗЫ (ГЛЮКОЗА, ГАЛАКТОЗА, ФРУКТОЗА).
ОЛИГОСАХАРИДЫ (в состав молекулы входят 2-12 МОНОСАХАРИДОВ, соединённых между собой): МАЛЬТОЗА, ЛАКТОЗА, САХАРОЗА.
ПОЛИСАХАРИДЫ делятся на ГОМОПОЛИСАХАРИДЫ и ГЕТЕРОПОЛИСАХАРИДЫ. ГОМОПОЛИСАХАРИДЫ - КРАХМАЛ, ГЛИКОГЕН. ГЕТЕРОПОЛИСАХАРИДЫ ХОНРОЭТИНСЕРНАЯ К-ТА, ГИАЛУРОНОВАЯ К-ТА, НЕЙРАМИНОВАЯ К-ТА, ГЕПАРИН.
БИОЛОГИЧЕСКАЯ РОЛЬ УВ.
1. ЭНЕРГЕТИЧЕСКАЯ. При окислении 1 гр. УВ до конечных продуктов (СО2 и Н2О) выделяется 4,1-ккал-60-70 % всей калорийности пищи. Суточная потребность в УВ для взрослого человека с массой 60-70 кг составляет около 400-500 гр.
2. Структурная. УВ используется как строительный материал для образования структурных компонентов клеток (ГЛИКОЛИПИДЫ, ГЛИКОПРОТЕИНЫ, ГЕТЕРОПОЛИСАХАРИДЫ межклеточного вещества).
3.Резервная. УВ в виде гликогена могут откладываться в запас.
4. Защитная. ГЛИКОПРОТЕИНЫ принимают участие в образовании антител. ГИАЛУРОНОВАЯ К-ТА препятствует проникновению чужеродных веществ. ГЕТЕРОПОЛИСАХАРИДЫ участвуют в образовании слизи слизистых оболочек дыхательных путей, ЖКТ.
5. Регуляторная. Некоторые гормоны являются ГЛИКОПРОТЕИНАМИ (ТИРИОГЛОБУЛИН)
6.Участвуют в процессах распознавания клеток (СИАЛОВАЯ и НЕЙРОМИНОВАЯ К-ТЫ).
7 Входят в состав оболочек эритроцитов, определяют группы крови.
8. Участвуют в процессах свёртывания крови, входя в состав ФИБРИНОГЕНА и ПРОТРОМБИНА. Препятствуют свёртыванию крови, входя в состав ГЕПАРИНА.
ПРЕВРАЩЕНИЕ УГЛЕВОДОВ В ОРГАНАХ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ.
Основными УВ для организма человека являются УВ пищи: крахмал, сахароза, лактоза.
Поступивший с пищей крахмал в ротовой полости будет подвергаться гидролизу под действием альфа -АМИЛАЗЫ слюны. Она расщепляет альфа (1,4)-ГЛИКОЗИДНЫЕ связи. РН оптимум в слабощелочной среде (6,8). Поскольку пища в ротовой полости задерживается недолго, то крахмал здесь переваривается лишь частично. Гидролиз крахмала завершается образованием АМИЛОДЕКСТРИНОВ (с йодом дают фиолетовое окрашивание). Далее пища поступает в желудок. Слизистой оболочкой желудка ГЛИКОЗИДАЗЫ не вырабатываются. В желудке среда резко кислая, поэтому действие альфа -АМИЛАЗЫ прекращается. Однако в более глубоких слоях действие фермента продолжается (пищевой комок полностью желудочным соком не пропитывается), крахмал проходит следующую стадию гидролиза- ЭРИТРОДЕКСТРИНОВ (с йодом дают красное окрашивание). Основным местом переваривания крахмала служит тонкий отдел кишечника. Здесь наиболее важная фаза гидролиза крахмала. В 12 п.к. открываются протоки ПЖЖ. Под действием фермента в её секрете будет идти гидролиз крахмала. Выделяющийся панкреатический сок содержит БИКАРБОНАТЫ, которые нейтрализуют желудочное кислое содержимое. Образующийся при этом Н2СОЗ распадается. СО2 «вспенивает» пищевой комок, способствуя его перемешиванию. Создаётся слабощелочная среда. Катионы натрия и калия способствуют активации панкреатических ГЛИКОЗИДАЗ: альфа -АМИЛАЗЫ, АМИЛО-1,6-ГЛИКОЗИДАЗЫ, ОЛИГО-1,6-ГЛИКОЗИДАЗЫ. Эти ферменты завершают гидролитический разрыв внутренних ГЛИКОЗИДНЫХ связей. ЭРИТРОДЕКСТРИНЫ переходят в ОХРОДЕКСТРИНЫ (с йодом жёлтое окрашивание).
Альфа -АМИЛАЗА завершает разрыв внутренних альфа(1,4)-ГЛИКОЗИДНЫХ связей с образованием ДИСАХАРИДОВ (МАЛЬТОЗ). Альфа(1,6)-ГЛИКОЗИДНЫЕ связи в точках ветвления крахмала гидролитически расщепляются под действием АМИЛО-(1,6)-ГЛИКОЗИДАЗЫ и ОЛИГО-(1,6)-ГЛИКОЗИДАЗЫ, которая является терминальной в этом процессе. Т.о. 3 панкреатических фермента завершают гидролиз крахмала в кишечнике с образованием МАЛЬТОЗ. Образованная МАЛЬТОЗА - временный продукт гидролиза, т.к. она в клетках кишечника быстро гидролизуется под действием МАЛЬТАЗ. Из тех же остатков, которые в молекулах крахмала были соединены альфа(1,6)-ГЛИКОЗИДНЫМИ связями, образуются ДИСАХАРИДЫ - ИЗОМАЛЬТОЗЫ. Они будут гидролизоваться ИЗОМАЛЬТАЗАМИ. В составе пищи в организм человека поступают и ДИСАХАРИДЫ: лактозы и сахарозы, которые подвергаются гидролизу только в тонком кишечнике. В ЭНТЕРОЦИТАХ синтезируются ЛАКТАЗЫ и САХАРАЗЫ, которые осуществляют гидролиз с образованием глюкозы, галактозы, фруктозы.
Продукты полного гидролиза - МОНОСАХАРИДЫ - всасываются в кровь. На этом завершается начальный этап пищеварения. С пищей в организм человека поступает клетчатка, которая в ЖКТ не переваривается, поскольку отсутствуют бета -ГЛИКОЗИДАЗЫ. Однако биологическая роль клетчатки велика: 1.формирование пищевого комка,
2.она раздражает слизистую оболочку ЖКТ, усиливая секрецию желёз.
3.усиливает сокращение кишечника,
4.в толстом кишечнике под действием ферментов условно-патогенной микрофлоры клетчатка подвергается брожению с образованием глюкозы, лактозы и газообразных веществ.
БИОСИНТЕЗ ГЛИКОГЕНА.
Было установлено, что гликоген может синтезироваться практически во всех органах и тканях. Однако наибольшая его концентрация обнаружена в печени (2-6%) и мышцах (0,5-2%). Т.к. мышечная масса велика, то большая часть гликогена содержится в мышцах. Глюкоза из крови легко проникает в клетки органов и тканей, проходя через биологические мембраны клеток. Как только глюкоза заходит в клетку, она запирается в ней в результате первой метаболической реакции - ФОСФОРИЛИРОВАНИЕ в присутствии АТФ и фермента - ГЕКСОКИНАЗЫ. Глюкоза превращается в глюкозо-6-фосфат. Теперь он будет использоваться в АНАБОЛИЧЕСКИХ и КАТАБОЛИЧЕСКИХ реакциях. Глюкоза из клетки может выйти, если в реакции гидролиза при участии глюкозо-6-фосфатазы освободится от остатка фосфорной кислоты. Этот фермент находится в печени, почках, эпителии кишечника. В других органах его нет. Проникновение глюкозы в клетки этих органов и тканей необратимы. Процесс биосинтеза протекает в 4 стадии:



![]()
![]()
ГЛИКОГЕНСИНТАЗА - ТРАНСФЕРАЗА, которая переносит остатки глюкозы, входящие в УДФ- глюкозу, на ГЛИКОЗИДНУЮ связь остаточного в клетке гликогена, при этом образуется альфа(1,4)-ГЛИКОЗИДНЫЕ связи. Образование альфа(1,6)-ГЛИКОЗИДНЫХ связей в точках ветвления гликогена катализирует специальный ГЛИКОГЕН-ВЕТВЯЩИЙ фермент. Образовавшийся в последней реакции УДФ, превращается в УТФ, при этом поглощается I молекула АТФ. На каждую молекулу глюкозы, включающуюся в структуру гликогена, расходуется 2 молекулы АТФ. Гликоген в клетках накапливается во время пищеварения и рассматривается как резервная форма глюкозы, которая используется клетками в промежутках между приёмами пищи.
РАСПАД ГЛИКОГЕНА.
Может идти 2 путями:
1. ОСНОВНОЙ ФОСФОРОЛИТИЧЕСКИЙ ПУТЬ
Он протекает в печени, почках, эпителии кишечника. Схематично можно записать в виде 3 реакций.

2.НЕОСНОВНОЙ АМИЛОЛИТИЧЕСКИЙ.
Его доля мала и незначительна. Протекает в печени при участии 3 ферментов: альфа -
АМИЛАЗА, АМИЛО-1,6-ГЛИКОЗИДАЗА, гамма -АМИЛАЗА.
ГЛИКОГЕНОВЫЕ БОЛЕЗНИ.
Это наследственное нарушение обмена гликогена, которое связано с недостатком какого-либо из ферментов, участвующих в синтезе или распаде гликогена. Как правило эта недостаточность выражается либо в снижении активности, либо в полном отсутствии какого либо фермента. ГЛИКОГЕНОЗЫ - болезни, связанные с нарушением процессов распада гликогена, при этом в клетках печени, почек, мышц гликоген накапливается в большом количестве. Клинически проявляются увеличением печени, мышечной слабостью, ГИПОГЛЮКОЗЭМИЕЙ натощак. В норме уровень глюкозы в крови равен 3,3 - 5,5 ммоль/л. Смерть наступает в раннем детском возрасте. Наиболее часто встречаются:
1.болезнь ФЕРСА - ФОСФОРИЛАЗА ПЕЧЕНИ.
2.Болезнь МАК-АРДЛЯ - ФОСФОРИЛАЗА МЫШЦ.
3.Болезнь ПОМПЕ - альфа- 1,4-ГЛИКОЗИДАЗА.
4.Болезнь КОРИ - АМИЛО-1.6-ГЛИКОЗИДАЗА.
5.Болезнь ГИРКЕ - ГЛЮКОЗО-6-ФОСФОТАЗА.
АГЛИКОГЕНОЗЫ характеризуются признаками нарушения синтеза. Клинически проявляются резкой ГИПОГЛЮКОЗЭМИЕЙ натощак, рвотой, судорогами, потерей сознания, углеводное голодание клеток, следовательно, отставание психо-физического развития, смерть в раннем детском возрасте. Наиболее часто встречаются:
1 . болезнь ЛЬЮИСА - ГЛИКОГЕНСИНТЕТАЗА.
2. Болезнь АНДЕРСЕНА - ГЛИКОГЕН-ВЕТВЯЩИЙ фермент.
Лекция №11. Обмен углеводов (продолжение).
1. АНАЭРОБНЫЙ ГЛИКОЛИЗ, ХИМИЗМ РЕАКЦИИ И БИОЛОГИЧЕСКАЯ РОЛЬ.
2.АЭРОБНЫЙ ГЛИКОЛИЗ, (ГЕКСОЗОДИФОСФАТНЫЙ ПУТЬ), ХИМИЗМ РЕАКЦИИ И БИОЛОГИЧЕСКАЯ РОЛЬ.
В зависимости от функционального состояния организма, клетки органов и тканей могут находиться в условиях достаточного снабжения кислородом, так и испытывать кислородное голодание. Т.о. катаболизм глюкозы или глюкозного остатка гликогена может рассматриваться с двух позиций:
1.В АНАЭРОБНЫХ УСЛОВИЯХ
2.В АЭРОБНЫХ УСЛОВИЯХ.
АНАЭРОБНЫЙ ГЛИКОЛИЗ протекает в цитоплазме клеток. Окисление глюкозы или глюкозного остатка гликогена всегда завершается образованием конечного продукта этого процесса- молочной кислоты.
Окисление глюкозы и глюкозного остатка гликогена в тканях отличается в начальных стадиях превращения, до образования глюкозо-6-фосфата. Дальнейшее окисление с этого этапа в тканях как в АНА-, так и в АЭРОБНЫХ условиях полностью совпадает до стадии образования ПИРУВАТА.
Процесс АНАЭРОБНОГО ГЛИКОЛИЗА сложный и многоступенчатый. Условно его можно
разделить на 2 стадии:
-первая стадия заканчивается образованием из ГЕКСОЗЫ двух ТРИОЗ -ДИОКСИАЦЕТОНФОСФАТА и ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА.
-Вторая стадия наиболее важная. Её называют стадией ГЛИКОЛИТИЧЕСКОЙ ОКСИДОРЕДУКЦИИ. Она сопряжена с образованием АТФ за счёт реакций СУБСТРАТНОГО ФОСФОРИЛИРОВАНИЯ, окислением ГЛИЦЕРАЛЬДЕГИД -3-ФОСФАТА, восстановлением ПИРУВАТА до ЛАКТАТА.


Т.о. окислительный процесс в безкислородных условиях завершается образованием ЛАКТАТА. В процессе превращения глюкозы было израсходовано 2 молекулы АТФ (ГЕКСОКИНАЗНАЯ и ФОСФОФРУКТОКИНАЗНАЯ реакции). С этапа образования ТРИОЗ идёт одновременное их окисление. В результате этих реакций образуется энергия в виде АТФ за счёт реакций СУБСТРАТНОГО ФОСФОРИЛИРОВАНИЯ (ГЛИЦЕРАТКИНАЗНАЯ и ПИРУВАТКИНАЗНАЯ).
На этапе ГЛИКОЛИТИЧЕСКОЙ ОКСИДОРЕДУКЦИИ идёт окисление ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА в присутствии НЗРО4 и НАД - зависимой ДГ, которая на этом этапе восстанавливается до НАДН2. МИТОХОНДРИИ в АНАЭРОБНЫХ условиях блокированы, поэтому НАДН2 находится в среде до тех пор, пока не образуется субстрат, способный принять его. ПВК, принимая НАДН2, восстанавливается с образованием ЛАКТАТА, завершая тем самым внутренний окислительно-восстановительный этап ГЛИКОЛИЗА. НАД-окисленный выделяется и может участвовать в окислительном процессе, выполняя роль переносчиков водорода.
3 реакции ГЛИКОЛИЗА являются необратимыми:
1.ГЕКСОКИНАЗНАЯ.
2.ФОСФОФРУКТОКИНАЗНАЯ.
3.ПИРУВАТКИНАЗНАЯ.
Энергетический эффект глюкозы и глюкозного остатка гликогена:
АТФ = (2*2)-2 = 2 глюкоза
АТФ = (2*2)-1 =3 гликоген
Биологическая роль АНАЭРОБНОГО ГЛИКОЛИЗА энергетическая. АНАЭРОБНЫЙ ГЛИКОЛИЗ является единственным процессом продуцирующим энергию в форме АТФ в клетке в безкислородных условиях в кризисных ситуациях. А в эритроцитах ГЛИКОЛИЗ является единственным процессом поддерживающим биоэнергетику, для сохранения их функции и целостности.
ГЕКСОЗОДИФОСФАТНЫЙ ПУТЬ - это аэробное превращение глюкозы в тканях. При поступлении кислорода в клетке происходит подавление анаэробного ГЛИКОЛИЗА. При этом понижается потребление глюкозы, блокируется образование ЛАКТАТА. Эффект торможения анаэробного гликолиза дыханием получил название эффекта ПАСТСРА. Процесс окисления начинается в цитоплазме до стадии образования ПИРУВАТА. Затем ПВК поступает в МИТОХОНДРИИ, где в матрице подвергается ОКИСЛИТЕЛЬННОМУ ДЕКАРБОКСИЛИРОВАНИЮ. Образующийся АЦЕТИЛ-КОА поступает для дальнейшего окисления в основной метаболический ЦТК КРЕБСА. С участием ферментов ЦТК и сопряженных с ним ферментов дыхательной цепи происходит образование конечных продуктов (СО2 и Н2О) и выделяется 38 АТФ, а при окислении глюкозного остатка гликогена - 39 АТФ.
Н2О образуется на этапе превращения:
1. ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТ
2. 2-ФОСФОГЛИЦЕРИНОВАЯ К-ТА
3. ПИРУВАТА
4. Альфа- КЕТОГЛУТАРОВАЯ К-ТА
5. СУКЦИНАТ
6. ИЗОЦИТРАТ
7. МАЛАТ
СО2 образуется на этапе превращения:
1. ПИРУВAT
2. ОКСАЛОСУКЦИНАТ
3. Альфа - КЕТОГЛУТАРОВАЯ К-ТА.
АТФ образуется:
А. За счёт реакций субстратного ФОСФОРИЛИРОВАНИЯ на этапе превращения:
1. 1,3-ДИФОСФОГЛИЦЕРИНОВАЯ К-ТА
2. 2-ФОСФОЕНОЛПИРУВАТ
3. СУКЦИНИЛ-КОА
В. За счёт реакций ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ на этапе превращения:
1. ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТ
2. ПИРУВАТ
3. ИЗОЦИТРАТ
4. альфа -КГК
5. СУКЦИНАТ
6. МАЛАТ.
Энергетический эффект окисления глюкозы и глюкозного остатка гликогена в аэробных условиях:
АТФ = 2*(3+1 +1 +3+12) - 2 = 38 глюкоза
АТФ = 2*(3+1+ 1 +3+12) - 1 =39 гликоген
Лекция № 12.
Обмен углеводов (продолжение).
1.ГЕКСОЗОМОНОФОСФАТНЫЙ ПУТЬ ПРЕВРАЩЕНИЯ УГЛЕВОДОВ В ТКАНЯХ. ХИМИЗМ РЕАКЦИЙ, БИОЛОГИЧЕСКАЯ РОЛЬ.
2.ОСНОВНЫЕ ИСТОЧНИКИ ГЛЮКОЗЫ ДЛЯ ОРГАНИЗМА ЧЕЛОВЕКА, ГЛЮКОНЕОГЕНЕЗ И ЕГО БИОЛОГИЧЕСКАЯ РОЛЬ.
3.ПАТОЛОГИЯ УГЛЕВОДНОГО ОБМЕНА.
ГЕКСОЗОМОНОФОСФАТНЫЙ ПУТЬ (ПЕНТОЗНЫЙ, АПОТОМИЧЕСКИЙ) протекает в цитоплазме клетки и представлен 2 ветвями: окислительной и неокислительной. Особенно активно этот путь протекает в тех органах и тканях, в которых активно синтезируются жиры (печень, почки, жировая и эмбриональная ткань, молочные железы). Биологическая роль этого пути окисления глюкозы связывается прежде всего с производством двух веществ:
1.НАДФ*Н2, который в отличие от НАДН2 не используется в дыхательной цепи МИТОХОНДРИЙ, а поступает клетке для реакций синтеза и восстановления веществ.
2.РИБОЗО-5-ФОСФАТА и др. ПЕНТОЗ, которые используются в клетке для синтеза важнейших биологических молекул: ДНК, РНК, НТФ (АТФ, ГТФ, ЦТФ, ТТФ), Н5КОА, НАД, ФАД.
Следовательно, основная биологическая роль - АНАБОЛИЧЕСКАЯ. Неокислительная стадия ПЕНТОЗНОГО ПУТИ окисления глюкозы даёт субстраты, которые в анаэробных условиях поддерживают ГЛИКОЛИЗ (ФРУКТОЗО-6-ФОСФАТ, ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТ). Т.о. поддерживается биоэнергетика клетки в ГИПОКСИЧЕСКИХ ситуациях. Окислительная стадия представляет 5 реакций и предусматривает образование ПЕНТОЗ. ГЕКСОЗОМОНОФОСФАТНЫЙ путь отличается от ГЕКСОЗОДИФОСФАТНОГО пути с этапа превращения глюкозо-6-фосфата.



При определенных условиях на этом заканчивается окислительная стадия. Между ПЕНТОЗАМИ устанавливается подвижное равновесие.
![]()
Неокислительная стадия ГЕКСОЗОМОНОФОСФАТНОГО пути представлена двумя ТРАНСКЕТЛАЗНЫМИ реакциями и одной ТРАНСАЛЬДОЛАЗНОЙ. Особенно активно эти реакции протекают в анаэробных условиях. В результате этих реакций образуются субстраты для ГЛИКОЛИЗА, а также вещества характерные для ПЕНТОЗНОГО пути.
1. ТРАНСКЕТОЛАЗНЫЕ реакции:
![]()
2. ТРАНСАЛЬДОЛАЗНАЯ реакция:
А) СЕДОГЕПТУЛОЗО-7-Ф + ГЛИЦЕРАЛЬД-3-Ф = ФРУКТОЗО-6-Ф + ЭРИТРОЗО-4-Ф.
Было установлено, что за счёт ГЕКСОЗОМОНОФОСФАТНОГО пути клетки на 100% обеспечиваются ПЕНТОЗАМИ, на 50% - молекулами НАДФ*Н2. Баланс окислительной и неокислительной стадий ПЕНТОЗНОГО пути превращения ПЕНТОЗЫ можно записать в виде суммарного уравнение:
![]()
Основные источники глюкозы для организма человека:
1. УВ пищи,
2. гликоген тканей
3. ГЛЮКОНЕОГЕНЕЗ.
ГЛЮКОНЕОГЕНЕЗ - это биосинтез глюкозы из не углеводных предшественников, главными из которых являются ПИРУВАТ, ЛАКТАТ, ГЛИЦЕРИН, ряд АК (АСП, ФЕН, АЛА, ТИР, ТРИ, ВАЛ, ЛЕЙ, ИЛЕ, МЕТ, ПРО, ГИС, АРГ), тем или иным путем превращающиеся в метаболит ЦТК - ФУМАРАТ, который в дальнейшем превращается в ЩУК. Другие АК превращаются в ПИРУВАТ –субстрат ГЛЮКОНЕОГЕНЕЗА, ГЛЮКОНЕОГЕНЕЗ возможен не во всех тканях. Главным местом синтеза глюкозы является печень, в меньшей степени процесс идёт в почках и слизистой кишечника. ГЛЮКОНЕОГЕНЕЗ обеспечивает синтез глюкозы, а также возврат ЛАКТАТА, образованного в реакциях анаэробного ГЛИКОЛИЗА, в клеточный фонд углеводов. За счет этого процесса поддерживается уровень глюкозы при углеводном голодании, сахарном диабете. Большинство реакций ГЛЮКОНЕОГЕНЕЗА представляют собой обратные реакции ГЛИКОЛИЗУ, за исключением трёх (ГЕКСОКИНАЗНОЙ, ФОСФОФРУКТОКИНАЗНОЙ, ПИРУВАТКИНАЗНОЙ), которые при ГЛЮКОНЕОГЕНЕЗЕ имеют обходные пути. Первая обходная реакция ГЛЮКОНЕОГЕНЕЗА связана с образованием 2-ФОСФОЕНОЛ ПВК и протекает в две стадии:


Вторая обходная реакция связана с образованием фруктозо-6-фосфата.

Образовавшаяся глюкоза может вновь использоваться клетками как пластический и энергетический материал, откладываться про запас в виде гликогена. В организме взрослого человека за сутки может быть образованно 80 гр. глюкозы.
ПАТОЛОГИЯ УГЛЕВОДНОГО ОБМЕНА.
Глюкоза является основным углеводом пищи, который используется всеми тканями для метаболизма. Концентрация глюкозы в крови для взрослого человека с массой 70 кг. составляет 3,3-5,5 ммоль/л.
Концентрация глюкозы в крови поддерживается за счёт УВ пищи, гликогена тканей и ГЛЮКОНЕОГЕНЕЗА и зависит от содержания УВ в пище, частоты приёма пищи и интенсивности затрат энергии. Нарушение углеводного обмена может быть на различных этапах. Объективными показателями этих нарушений является нарушение доступных биологических сред на содержание глюкозы. ГИПО-, ГИПЕРГЛЮКОЗЭМИЯ, ГЛЮКОЗУРИЯ является показателями углеводного обмена. ГЛЮКОЗУРИЯ возможна в том случае, если превышается величина почечного порога больше 10 ммоль/л.
Наиболее часто нарушения углеводного обмена возможны на следующих этапах:
1.на этапе поступления углеводов с пищей. Причины, которые могут вести к АЛИМЕНТАРНОМУ ОЖИРЕНИЮ, связаны прежде всего с употреблением пищи богатой углеводами и малоподвижным образом жизни, когда интенсивность окисления понижается. Большая нагрузка углеводов ведёт к переполнению резервом гликогена клеток печени, мышц, развитию ГИПЕРГЛЮКОЗЕМИИ, ГЛЮКОЗУРИИ, усиленному биосинтезу жира, развитию ожирения.
2.При поражении слизистых оболочек ЖКТ. При поражении слизистой желудка нарушается выработка соляной кислоты. Она обладает антибактериальным действием. Поступающие с пищей углеводы при недостатке соляной кислоты под действием ферментов микрофлоры сбраживаются с образованием ЛАКТАТА, что создаёт благоприятные условия для развития анаэробной микрофлоры и расстройства пищеварения в целом. При поражении слизистой оболочки тонкого отдела кишечника нарушается всасывание и гидролиз ДИСАХАРИДОВ пищи: переваривание МАЛЬТОЗ, ЛАКТОЗ, САХАРОЗ, а также транспорт глюкозы, галактозы, фруктозы через БИОМЕМБРАНУ ЭНТЕРОЦИТОВ в капиллярную сеть. При поражении ПЖЖ нарушается переваривание гликогена, крахмала пищи под влиянием ферментов.
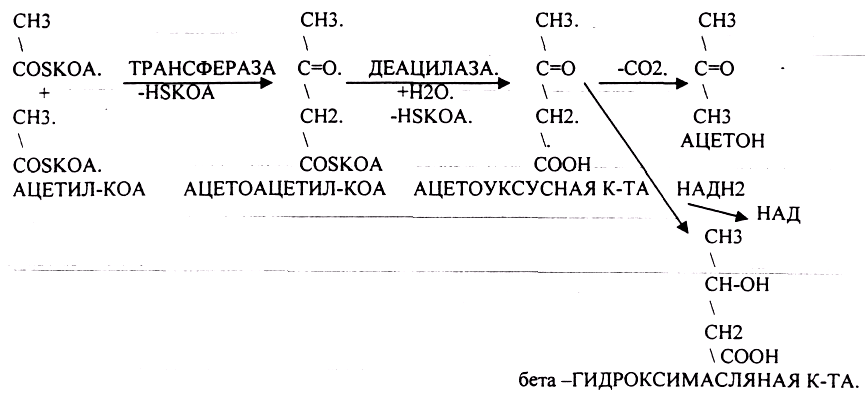
Наиболее грозным заболеванием, ведущим к нарушению углеводного обмена, является сахарный диабет. В ПЖЖ в В -клетках синтезируется белок - инсулин, который обеспечивает транспорт глюкозы из крови в ткани. В случае недостаточной выработки инсулина развивается ГИПЕРГЛЮКОЗЕМИЯ, ГЛЮКОЗУРИЯ, КЕТОНУРИЯ. В клетках развивается энергетический голод, который компенсируется за счёт процессов ГЛЮКОНЕОГЕНЕЗА и усиления процессов окисления белков и жиров, что сопровождается избыточной продукцией АЦЕТИЛ-КОА, NH3. NH3 токсичный продукт, для связывания которого откликаются основные КЕТОКИСЛОТЫ цикла КРЕБСА, а это в свою очередь понижает интенсивность окислительных процессов и создаёт предпосылки для конденсации АЦЕТИЛ-КОА и образования кетоновых тел (АЦЕТОУКСУСНАЯ К-ТА, АЦЕТОН, бета -ГИДРОКСИМАСЛЯНАЯ К-ТА).
При поражении печени нарушается процесс биосинтеза и распада гликогена. Наследственные заболевания наблюдаются при генетических дефектах ферментов, участвующих в метаболизме углеводов. Наиболее часто встречаются ГЛИКОГЕНОЗЫ (ГИРКЕ, ПОМПЕ) и АГЛИКОГЕНОЗЫ (ЛЬЮИСА, АНДЕРСЕНА), которые связаны с недостаточной активностью или полным отсутствием ферментов, участвующих в распаде или синтезе гликогена. У детей встречается АЛАКТОЗИЯ - непереносимость лактозы в виду генетического дефекта ЛАКТАЗЫ ЭНТЕРОЦИТОВ. Наблюдается вздутие живота, обезвоживание, резкое похудание. Лечение заключается в замене лактозы на другие сахара.
Лекция № 13. Обмен ЛИПИДОВ.
1.ЛИПИДЫ, ИХ КЛАССИФИКАЦИЯ И БИОЛОГИЧЕСКАЯ РОЛЬ.
2.ПРЕВРАЩЕНИЕ ЛИПИДОВ В ОРГАНАХ ПИЩЕВАРЕНИЯ.
З.ЖЕЛЧНЫЕ КИСЛОТЫ, ИХ БИОЛОГИЧЕСКАЯ РОЛЬ. РЕСИНТЕЗ ЖИРА В СТЕНКАХ
КИШЕЧНИКА.
ЛИПИДАМИ называются сложные органические вещества биологической природы нерастворимые в воде, но растворимые в органических растворителях. ЛИПИДЫ являются основным продуктом питания. Они поступают в организм с продуктами растительного и животного происхождения. Суточная потребность в ЛИПИДАХ для взрослого человека составляет 80-100 гр.

Воска - это сложные эфиры одно- или двухатомных спиртов с количеством углеводных звеньев в цепи 16-35 и ВЖК. Они входят в состав ЛИПИДОВ, покрывающих листья и плоды растений, шерсть животных, перья птиц. К природным воскам относятся пчелиный воск, спермацет, ланолин. В организме человека ЛИПИДЫ представлены:
1.структурными липидами.
2.резервными липидами.
3.свободными липидами. — хиломикроны,
- липопротеины низкой плотности (лпнп),
- липопротеины очень низкой плотности (лпонп),
- липопротеины высокой плотности (лпвп).
ЛИПИДЫ - трудно растворимые в воде вещества, поэтому для транспорта их кровью нужны —специальные-транспортные частицы. Ими являются ЛИПОПРОТЕИНЫ крови, где роль стабилизатора выполняют белки. ЛИПОПРОТЕИНЫ осуществляют транспорт ЛИПИДОВ от органов и тканей, где они синтезируются к местам их потребления. С их помощью осуществляется транспорт ВЖК и жирорастворимых витаминов A, D, Е, К..
БИОЛОГИЧЕСКАЯ РОЛЬ ЛИПИДОВ.
1 .Структурная. ЛИПИДЫ являются обязательным структурным компонентом биологических мембран клеток.
2.Резервная. ЛИПИДЫ могут откладываться в запас.
3.Энергетическая. Было установлено, что при окислении 1 гр. ЛИПИДОВ до конечных продуктов выделяется 9,3 ккал энергии.
4.Механическая. ЛИПИДЫ подкожной жировой клетчатки, соединительной ткани предохраняют внутренние органы от механических повреждений.
5 .Теплоизолирующая. Защищают организм от переохлаждения и перегревания.
6.Транспортная. ЛИПИДЫ мембран клеток участвуют в транспорте катионов.
7.Регуляторная. Некоторые гормоны являются СТЕРОИДАМИ (АНДРОГЕНЫ, ЭСТРОГЕНЫ, ГЛЮКО- и МИНЕРАЛОКОРТИКОИДЫ), «Местные» гормоны - ПРОСТАГЛАНДИНЫ, ПРОСТАЦИКЛИНЫ, тромбоксаны, лейкотриены образуются в организме из ПОЛИНЕНАСЫЩЕННЫХ ВЖК, входящих в состав ЛИПИДОВ.
8.Участвуют в передаче нервного импульса.
9.Являются источником эндогенной воды. При окислении 100 гр. ЛИПИДОВ выделяется 107гр эндогенной воды.
10.Растворяющая роль. В ЛИПИДАХ растворяются витамины A, D, E, К.
11.Питательная. С пищей в организм поступают незаменимые ВЖК, которые имеют 2 и более связи (ЛИНОЛЕВАЯ, ЛИНОЛЕНОВАЯ, АРАХИДОНОВАЯ).
БИОЛОГИЧЕСКАЯ РОЛЬ ПОЛИНЕНАСЫЩЕННЫХ ВЖК:
1. Они являются обязательным структурным компонентом мембран клеток.
2. Являются источником гормон подобных веществ.
3. Стимулируют синтез желчных кислот в печени.
4. Предупреждают развитие атеросклероза, ограничивая всасывание холестерина пищи в кишечнике, тормозя образование АТЕРОГЕННОЙ фракции ЛИПОПРОТЕИНОВ.
5. Понижают свёртываемость крови и уменьшают возможность тромб образования.
6. Повышают защитные силы организма.
ПЕРЕВАРИВАНИЕ ЛИПИДОВ.
Поступающие с пищей ЛИПИДЫ в ротовой полости подвергаются только механической переработке. ЛИПОЛИТИЧЕСКИЕ ферменты - ЭСТЕРАЗЫ - в ротовой полости не образуются. Переваривание жиров у взрослого человека будет происходить в кишечнике, где для этого имеются все условия:
1. Наличие желчных кислот.
2. Наличие ферментов.
3. Оптимальная рН среды.
У детей до 1 года в кишечнике выделяется ЛИПАЗА, рН оптимум которой = 5-5,5. Под влиянием этого фермента расщепляются только жиры молока. У взрослого человека она не активна, т.к. рН желудочного содержимого =1,5 - 2,5. Следовательно, переваривание жиров в желудке не происходит (в норме).
Переваривание ЛИПИДОВ пищи в кишечнике происходит при наличии желчных кислот, образованных печенью, и ЛИПОЛИТИЧЕСКИХ ферментов ПЖЖ. При поступлении пищи из желудка в двенадцатиперстную кишку в слизистой оболочке тонкой кишки начинают выделяться регуляторы: СЕКРЕТИН, ХОЛЕЦИСТОКИНИН, ХИМОДЕНИН, ИНТЕРОКЛИИН. Они обеспечивают:
-образование желчи в печени,
-сокращение желчного пузыря,
-выделение панкреатического сока,
-секрецию желез тонкого отдела кишечника. Всё это в целом обеспечивает быстрое переваривание пищи.
Особую роль в переваривании играют желчные кислоты. Все они образуются в печени и являются конечным продуктом окисления холестерина в организме. В основе их строения лежит структура ЦИКЛОПЕНТАНПЕРГИДРОФЕНАНТРЕН.

По своей химической природе все желчные кислоты являются производными ХОЛЕВОЙ К-ТЫ, у которой в 3, 7, 12 положениях имеются ОКСИГРУППЫ. Если у ХОЛЕВОЙ кислоты присутствует две группы в 3 и 7 положениях, то её называют ХЕНОДЕЗОКСИХОЛЕВОЙ. Если присутствует две группы в 3 и 12 положении, то она называется ДЕЗОКСИХОЛЕВОЙ. Если одна группа в 3 положении, кислота называется ЛИТОХОЛЕВАЯ.
БИОЛОГИЧЕСКАЯ РОЛЬ ЖЕЛЧНЫХ КИСЛОТ:
1. Эмульгируют пищевые жиры.
2. Активируют ЛИПОЛИТИЧЕСКИЕ ферменты.
3. Выполняют роль переносчиков трудно растворимых в воде продуктов гидролиза жира и жирорастворимых витаминов A, D, Е, К.
При ЭМУЛЬГИРОВАНИИ жир дробится на мелкие частички. Желчные кислоты адсорбируются на поверхности жира, значительно уменьшает поверхностное натяжение, при этом жир дробится на частички, которые вновь обволакиваются желчными кислотами, препятствуя их слиянию. В результате происходит стабилизация жира и значительно увеличивается поверхность контактов с ЛИПОЛИТИЧЕСКИМИ ферментами. Стабилизированная эмульсия жира далее подвергается гидролизу под влиянием панкреатических ферментов (ЛИПАЗ, ФОСФОЛИПАЗ, ХОЛЕСТЕРОЛЭСТЕРАЗ).
В переваривании жира принимает участие и КОЛИПАЗЫ кишечника. Помогают гидролизу жира ионы кальция, которые образуют комплексы со свободными ВЖК.

Т.о. в результате гидролиза пищевого жира образуются глицерины, холестерины, ВЖК, фосфаты, азотистые основания. Необходимо отметить, что в расщеплении жиров принимают участие и кишечные ЛИПАЗЫ, но их активность невысока, к тому же они расщепляют только МОНОГЛИЦЕРИДЫ и не действуют на ДИ- и ТРИГЛИЦЕРИДЫ. Установлено, что всасывание продуктов гидролиза жира имеет свою особенность. Легко всасываются слизистой кишечника спирты, фосфаты, АК, коротко цепочные ВЖК, азотистые основания. Трудно растворимые в воде продукты гидролиза (холестерин, ВЖК, МОНОГЛИЦЕРИДЫ), жирорастворимые витамины всасываются только в комплексе с желчными кислотами. Эти комплексы называются ХОЛЕИНОВЫМИ. В таком виде трудно растворимые в воде соединения проходят через мембраны ЭНТЕРОЦИТОВ. В этих клетках ворсинок кишечника происходит их распад. При этом желчные кислоты сразу же поступают в ток крови и через систему воротной вены доставляются в печень. Оттуда они в составе желчи вновь попадают в кишечник и могут участвовать в новом акте переваривания жира, либо удаляются из организма в составе каловых масс – КОПРОСТЕРИН. Установлено, что обязательный фонд желчных кислот у взрослого человека составляет 2,8 -3,5гр., при этом они совершают 5-6 оборотов в сутки за счёт печёночно-кишечной циркуляции. После того как продукты гидролиза жира поступили в ЭНТЕРОЦИТЫ, в стенке кишечника начинают синтезироваться жиры, специфические для данного организма, которые по своему строению отличаются от пищевого жира. Механизм синтеза жира в стенке кишечника сводится к следующему: Сначала происходит активация глицерина и ВЖК затем последовательно будет происходить АЦИЛИРОВАНИЕ альфа -ГЛИЦЕРОФОСФАТА с образованием МОНО- и ДИГЛИЦЕРИДОВ. Активная форма ДИГЛИЦЕРИДА - ФОСФАТИДНАЯ К-ТА занимает центральное место в синтезе жира к стенке кишечника. Из неё после активации в присутствии ЦТФ образуется ЦДФ -ДИАЦИЛГЛИЦЕРИД, который даёт начало сложным жирам.




При укусе змей повышается активность ФОСФОРИЛАЗЫ А2. При этом в положении С2 у ФОСФАТИДИЛХОЛИНОВ и ФОСФАТИДИЛЭТАНОЛАМИНОВ отщепляется ПОЛИНЕНАСЫЩЕНЫЕ ВЖК и образуются токсические соединения -ЛИЗОФОСФОЛИПИДЫ, обладающие ГЕМОЛИТИЧЕСКИМ действием.
Лекция № 14. Обмен ЛИПИДОВ (продолжение).
1.ТРАНСПОРТНЫЕ ЛИПОПРОТЕИНЫ КРОВИ. СОСТАВ И БИОЛОГИЧЕСКАЯ РОЛЬ. 2.ПРОСТАГЛАНДИНЫ, ПРОСТАЦИКЛИНЫ, ТРОМБОКСАНЫ, ЛЕЙКОТРИЕНЫ. МЕХАНИЗМ ИХ ОБРАЗОВАНИЯ И БИОЛОГИЧЕСКАЯ РОЛЬ.
3.ОКИСЛЕНИЕ ГЛИЦЕРИНА И ВЖК В ТКАНЯХ.
ЛИПИДЫ являются нерастворимыми в воде соединениями, поэтому для их переноса кровью необходимы специальные переносчики, которые растворимы в воде. Такими транспортными формами являются ЛИПОПРОТЕИНЫ. Они относятся к свободным ЛИПИДАМ. Синтезированный жир в стенке кишечника, либо жир синтезированный в других тканях органах может быть транспортирован кровью лишь после включения в состав ЛИПОПРОТЕИНОВ, где роль стабилизатора играют белки.
По своему строению мицеллы ЛИПОПРОТЕИНЫ имеют наружный слой и ядро. Наружный слой формируется из БЕЛКОВ, ФОСФОЛИПИДОВ и ХОЛЕСТЕРИНА, которые имеют гидрофильные полярные группы и проявляют сродство к воде. Ядро состоит из ТРИГЛИЦЕРИДОВ, ЭФИРОВ ХОЛЕСТЕРИНА, ВЖК, витаминов A, D, Е, К. Т.о. нерастворимые жиры легко транспортируются по всему организму после синтеза в стенке кишечника, а также синтеза в других тканях между клетками, которые их синтезируют и используют.
Выделяют 4 класса ЛИПОПРОТЕИНОВ крови, которые отличаются друг от друга по своему химическому состоянию, размерам мицелл и транспортируемым жирам. Поскольку они имеют различную скорость оседания в растворе поваренной соли, их разделяют на:
1. ХИЛОМИКРОНЫ. Образуются в стенке кишечника и имеют самый крупный размер частиц.
2. ЛПОНП. Синтезируются в стенке кишечника и печени.
3. ЛПНП. Образуются в эндотелии капилляров из ЛПОНП.
4. ЛПВП. Образуются в стенке кишечника и печени.
Т.о. транспортные ЛП крови синтезируются двумя видами клеток - ЭНТЕРОЦИТАМИ и
ГЕПАТОЦИТАМИ. Было установлено, что ЛП крови при электрофорезе белков движутся в зоне
альфа и бета -ГЛОБУЛИНОВ, поэтому их по электрофоретической подвижности ещё
обозначают как:
Пре бета- ЛП - ЛПОНП,
Бета-ЛП-ЛПНП,
Альфа-ЛП-ЛПВП.
ХИЛОМИКРОНЫ как самые крупные частицы при электрофорезе остаются на старте.
Максимальная их концентрация достигается к 4 - 6 часам после приёма пищи. Расщепляются они
под действием фермента - ЛИПОПРОТЕИДЛИПАЗЫ, которая образуется в печени, легких,
эндотелии сосудов, жировой ткани.
Принято считать, что ХИЛОМИКРОНЫ отсутствуют в крови натощак и появляются только
после приёма пищи. В основном они транспортируют ТРИГЛИЦЕРИДЫ (83 - 85 %).
ЛПОНП и ЛПНП в основном транспортируют холестерин и его эфиры в клетки органов и
тканей. Эти фракции относятся к АТЕРОГЕННЫМ. ЛПВП в основном осуществляют транспорт ФОСФОЛИПИДОВ и ХОЛЕСТЕРИНА. Холестерин транспортируется в печень для последующего окисления с образованием желчных кислот и выделяется из организма в виде КОПРОСТЕРИНОВ. Эту фракцию называются АНТИАТЕРОГЕННОЙ.
Распадаются ЛИПОПРОТЕИНЫ крови:
ХИЛОМИКРОНЫ - под действием ЛИПОПРОТЕИДЛИПАЗЫ печени, жировой ткани, эндотелия капилляров. Продукты гидролиза вовлекаются в клеточный метаболизм. ЛПНП и ЛПВП путём эндоцитоза поглощаются клетками печени, почек, надпочечников, жировой ткани и кишечника, разрушаются в ЛИЗОСОМАХ и МИКРОСОМАХ.
ПРОСТАГЛАНДИНЫ , ПРОСТАЦИКЛИНЫ, ТР0МБОКСАНЫ , относящиеся к ПРОСТАНОИДАМ, а также ЛЕЙКОТРИЕНЫ являются гормон подобными веществами, которые в организме человека образуются из ЭССЕНЦИАЛЬНЫХ ВЖК. Главным их предшественником являются АРАХИДОНОВАЯ кислота (С19Н31СООН). Она не может существовать в клетке в свободном виде. Она очень активная и как только, выделяется в результате гидролиза, сразу же включается в клеточный метаболизм - образование гормон подобных веществ.
В настоящее время установлено, что они могут образовываться практически во всех клетках организма, за исключением эритроцитов. Образуются они в микро-количествах и по мере необходимости. Свой биологический эффект они оказывают в клетках тех органов и тканей, в которых образуются. Они выполняют роль местных гормонов, которые координируют функцию соседних клеток или удалённых на незначительные расстояния друг от друга органов. Все эти
40
вещества коротко живущие, т.е. они имеют период полураспада от нескольких секунд
(ТРОМБОКСАНЫ) до 20 минут (ПРОСТАГЛАНДИНЫ). Выполнив свою роль, они инактивируются и выводятся из организма с мочой. Биосинтез этих соединений начинается с того момента, когда из ФОСФОЛИПИДА под действием ФОСФОЛИПАЗЫ А2 высвобождается АРАХИДОНОВАЯ кислота. Центральные реакции метаболизма кислоты катализирует фермент: ЦИКЛООКСИГЕНАЗА. а в лейкоцитах ЛИПООКСИГЕНАЗА. В результате реакции синтеза в структуру АРАИДОНОВОЙ кислоты включается молекула кислорода. В случае образования ПРОСТАНОИДОВ происходит циклизация. ПРОСТАГЛАНДИНЫ и ПРОСТАЦИКЛИНЫ представляют собой пяти-членные циклы, ТРОМБОКСАНЫ - шести членные циклы, ЛЕЙКОТРИЕНЫ - ненасыщенные производные, ациклические соединения АРАХИДОНОВОЙ К-ТЫ.
Биологическая роль:
1.ПРОСТАГЛАНДИНЫ:
A) В эндокринных железах стимулируют образование гормонов (щитовидная железа, ПЖЖ, надпочечники).
Б) В жировой ткани тормозят ЛИПОЛИЗ.
B) Регулируют сокращение гладких мышц кишечника, бронхов, матки.
Г) Оказывают влияние на сокращение миокарда.
Д) Регулируют кровоток в почках, контролируют выведение электролитов и воды с мочой.
Е) Регулируют тромб-образование и проницаемость капилляров.
Ж) В ЦНС раздражают центры терморегуляции, вызывая повышение температуры тела -
лихорадку.
3) Повышая чувствительность нервных окончаний к ГИСТАМИНУ, они вызывают боль.
2.ПРОСТАЦИКЛИНЫ образуются в сердце и сосудах. Препятствуют образованию тромбов,
способствуют расширению сосудов, понижению артериального давления.
3.ТРОМБОКСАНЫ образуются из тучных клеток и тромбоцитов. Они запускают механизм
тромбобразования, способствуя слипанию тромбоцитов.
4.ЛЕЙКОТРИЕНЫ. Их биологическая роль связывается с воспалительными реакциями,
аллергическими реакциями и иммунитетом. Они способствуют прилипанию лейкоцитов к стенке
сосудов в местах воспаления. Они способствуют сокращению гладкой мускулатуры дыхательных
путей, ЖКТ. Регулируя тонус сосудов, они вызывают их сужение, повышение АД, стимулируют сокращение
коронарных сосудов.

Основную массу ЛИПИДОВ организма человека составляют нейтральные жиры, которые в клетках находятся в виде включений. Период обновления ТРИГЛИЦЕРИДОВ в разных тканях составляет от 2 до 18 суток. В клетках постоянно идут процессы распада и синтеза жиров. Распад жиров в клетках происходит в лизосомах, меньше в микросомах и цитоплазме при участии тканевых ЭСТЕРАЗ. В результате гидролиза жира образуются общие метаболиты: глицерины и ВЖК, окисление которых сопровождается образованием конечных продуктов -воды и углекислого газа -и выделением энергии в форме АТФ. Окисление глицеринов в тканях тесно связано с ГЛИКОЛИЗОМ, в который вовлекаются метаболиты обмена глицерина по следующей схеме:


Т.о. при окислении глицерина образовались конечные продукты:
Н2О на этапе превращения:
1 . альфа -ГЛИЦЕРОФОСФАТА
2. ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА
3. 2-ФОСФОГЛИЦЕРИНОВОЙ К-ТЫ
4. ПВК
5. ИЗОЦИТРАТА
6. Альфа-КЕТОГЛУТАРАТА
7. СУКЦИНАТА
8. МАЛАТА
СО2 на этапе превращения:
1. ПВК
2. ОКСАЛОСУКЦИНАТА
3. Альфа-КЕТОГЛУТАРАТА АТФ на этапе превращения:
1 . альфа -ГЛИЦЕРОФОСФАТА
2. ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА
3. 1,3-ДИФОСФОГЛИЦЕРИНОВОЙ К-ТЫ (СУБСТРАТНОЕФОСФОРИЛИРОВАНИЕ)
4. 2-ФОСФОЕНОЛПИРУВАТА (СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ)
6. ИЗОЦИТРАТА
7. Альфа-КЕТОГЛУТАРАТА
8. СУКЦИНИЛ-КОА (СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ)
9. СУКЦИНАТА
10. МАЛАТА
АТФ = (3+3+1 + 1+3+12) -1 =22
Окисление ВЖК в тканях изучалось Ф. КНООПОМ (1904г.), который назвал окисление ВЖК бета- окислением. Он показал, что процесс этот циклический, что все ВЖК, имеющие чётное количество углеродных звеньев в цепи обязательно проходят окисление, когда цепь периодически укорачивается на 2 углеродных звена. Последняя стадия окисления - стадия превращения масляной кислоты имеет свои особенности, когда в результате 1 цикла окисления образуется 2 молекулы АЦЕТИЛ-КОА. Одна проходит окисление с выделением 5 АТФ, а другая нет.
В 1949г. А. ЛЕНИНДЖЕР установил, что бета-окисление ВЖК происходит в МИТОХОНДРИЯХ. Д. ЛИНЕН (1954г.) детально описал все стадии бета-окисления.
В настоящее время бета-окисление называют ЦИКЛОМ КНООПА - ЛИНЕНА. Установлено, что процесс бета -окисления начинается в цитоплазме клеток с активации ВЖК. Мембрана МИТОХОНДРИЙ для ВЖК не проницаема. Транспорт ВЖК внутрь возможно только при участии азотистого основания - КАРНИТИНА. АЦИТИЛ-КОА в цитоплазме соединяется с КАРНИТИНОМ при участии фермента АЦЕТИЛ-КОА-КАРНИТИНТРАНСФЕРАЗЫ. Образуется комплекс, который легко проникает через мембрану. В межмембранном пространстве уже при участии МИТОХОНДРИАЛЬНОЙ ТРАНСФЕРАЗЫ комплекс распадается. КАРНИТИН возвращается в цитоплазму, а ВЖК в матрице подвергается окислению.


![]()
Т.о. завершая 1 цикл бега -окисления ВЖК, в результате которого ВЖК укоротилось на 2 углеродных звена. При бета -окислении выделилось 5АТФ и 12АТФ выделилось при окислении АЦЕИЛ-КОА в ЦТК и сопряженных с ним ферментов дыхательной цепи. Окисление ВЖК будет происходить циклически одинаково, но только до последней стадии - стадии превращения масляной кислоты (БУТИРИЛ-КОА), которая имеет свои особенности. Их надо учитывать при подсчёте энергетического эффекта окисления ВЖК, когда в результате одного цикла образуется 2 молекулы АЦЕТИЛ-КОА, одна из них проходила бета -окисление с выделением 5АТФ, а другая нет.


Энергетический эффект окисления ВЖК: АТФ = n/2 * 17 - 6, где n - число углеродных звеньев в цепи ВЖК, 17 - количество молекул АТФ, которые выделяются в результате окисления 2 углеродных звеньев цепи до конечных продуктов 5АТФ+12АТФ, 6 - то количество АТФ, которое не выделяется, поскольку 1 АТФ тратится на активацию ВЖК, а 5 АТФ не выделяются на последнем этапе - превращения молочной кислоты.
ВЖК, имеющие нечётное количество углеродных звеньев, поступают в организм человека в составе пищи. Окисление таких ВЖК происходит также как и ВЖК, имеющих чётное количество углеродных звеньев в цепи, но только до последней стадии - стадии превращения ПРОПИОНИЛ-КОА. которая имеет свои особенности:

Т.о. образованная молекула СУКЦИНИЛ-КОА, которая для дальнейшего окисления в МИТОХОНДРИЯХ поступает в ЦТК КРЕБСА, одним из основных субстратов которого она является.
Лекция № 15.
Обмен ЛИПИДОВ (продолжение).
1.БИОСИНТЕЗ ВЖК В ТКАНЯХ, ХИМИЗМ РЕАКЦИЙ, БИОЛОГИЧЕСКАЯ РОЛЬ. 2.ХОЛЕСТЕРИН, БИОЛОГИЧЕСКАЯ РОЛЬ, БИОСИНТЕЗ, ОКИСЛЕНИЕ. 3.ПАТОЛОГИЯ ЛИПИДНОГО ОБМЕНА.
Биосинтез ВЖК протекает в ЭПС клеток. Исходным материалом для синтеза заменимых ВЖК является АЦЁТИЛ-КОА, который поступает для биосинтеза при распаде белков, жиров и углеводов.
Условия для биосинтеза ВЖК:
1.Наличие АТФ, СО2, Н2О, НАДФ*Н2, поступающий из ГЕКСОЗОМОНОФОСФАТНОГО пути превращения глюкозы.
2.Наличие специальных белков-переносчиков (HS -АПБ). 3.Наличие специальных ферментов синтеза.
Процесс биосинтеза циклический. Каждый цикл включает в себя 6 этапов. АЦЕТИЛ-КОА используется на первом этапе, как «затравка» синтеза.
Первый этап. Этап образования 3-углеродного соединения - МАЛОНИЛ-КОА.

Второй этап. Этап переноса МАЛОНИЛА и АЦЕТИЛА на специальные белки - HS-АПБ.

Третий этап. Этап конденсации МАЛОНИЛА-АПБ и АЦЕТИЛА-АПБ с участием ТРАНСФЕР АЗЫ - СИНТАЗЫ.

Четвёртый этап. Этап восстановления бета -КЕТОАЦИЛ-АПБ.

Пятый этап. Этап ДЕГИДРАТАЦИИ бета-ГИДРОКСИАЦИЛ-АПБ.

Шестой этап. Этап восстановления ЕНОИЛАЦИЛ-АПБ.

Т.о. завершается 1 цикл синтеза ВЖК образованием масляной кислоты (БУТИРИЛ-АПБ). В дальнейшем последовательно и циклично к 4-углеродному фрагменту будут присоединяться молекулы МАЛОНИЛ-КОА. Для подсчёта количества циклов синтеза ВЖК, подсчёта молекул АТФ, МАЛОНИЛ-КОА можно пользоваться формулой: N/2 - 1, где N-это число углеродных звеньев в молекуле ВЖК. Завершается биосинтез любой ВЖК в тканях ДЕАЦИЛАЗНОЙ реакцией.

Так в организме человека происходит синтез всех заменимых ВЖК - всех предельных и непредельных ВЖК, имеющих одну двойную связь.

Холестерин является одноатомным циклическим спиртом, который в тканях легко образует ХОЛЕСТЕРИДЫ (в положении 3). В организм человека поступает в составе пищи и синтезируется г.о. в печени, тонком отделе кишечника и коже.
Биологическая роль холестерина:
1.Структурная. Свободный холестерин является, обязательным структурным компонентом мембран клеток.
2.Метаболическая. Холестерин является предшественником биологически активных веществ: витамина D3
СТЕРОИДНЫХ гормонов (АНДРОГЕНОВ, ЭСТРОГЕНОВ, КОРТИКОИДОВ) При окислении холестерина в печени при участии ЦИТОХРОМА Р-450 образуются желчные кислоты, которые принимают участие в переваривании жиров пищи. Наиболее богаты холестерином плазматические мембраны ГЕПАТОЦИТОВ, где на его долю приходится 30% всех мембранных липидов. Содержание холестерина в миелине составляет 20%. В свободном виде холестерин транспортируется по организму с помощью транспортных ЛИПОПРОТЕИНОВ крови.
Источники холестерина:
1. Пища. За сутки в организм взрослого человека поступает 0,3гр. холестерина.
2. У человека в среднем с массой 65-70кг за сутки синтезируется 3.5 -4,2гр. холестерина. Печень занимает главное место в синтезе холестерина (85%), в меньшей степени холестерин синтезируется в кишечнике (10%) и коже (5%). На экспорт холестерин синтезируется только в печени и кишечнике.
Процесс биосинтеза сложен и многоступенчат. Он включает в себя 35 реакций. Схематично его можно представить следующим образом:

Образовавшийся в результате распада мембранных ЛИПИДОВ, а также излишки холестерина с помощью ЛПВП доставляется для окисления в печень, и в составе желчных кислот удаляется из организма с каловыми массами в виде КОПРОСТЕРИНОВ.
ПАТОЛОГИЯ ЛИПИДНОГО ОБМЕНА.
1 .На этапе поступления жиров с пищей:
A. Обильная жирная пища на фоне ГИПОДИНАМИИ приводит к развитию АЛИМЕНТАРНОГО ОЖИРЕНИЯ.
B. Недостаточное поступление жиров или их отсутствие приводит к ГИПО- и АВИТАМИНОЗАМ A, D. Е, К. Могут развиваться ДЕРМАТИТЫ, СКЛЕРОЗ сосудов, когда с пищей не поступают ЭССЕНЦИАЛЬНЫЕ ВЖК. Также нарушается процесс синтеза ПРОСТАГЛАНДИНОВ, ПРОСТАЦИКЛИНОВ, ТРОМБОКСАНОВ и ЛЕЙКОТРИЕНОВ местных гормонов.
C. Недостаточное поступление с пищей ЛИПОТРОПНЫХ веществ приводит к развитию жировой инфильтрации тканей. К ЛИПОТРОПНЫМ веществам относятся:
ХОЛИН, ИНОЗИТ, СЕРИИ вещества, принимающие участие в синтезе
ФОСФОЛИПИДОВ. Витамин В6 (ПЕРИДОКСАЛЬФОСФАТ), входящий в состав ДК СЕРИНА. МЕТИОНИН поставщик МЕТИЛЬНЫХ групп при биосинтезе ХОЛИНА из ЭТАНОЛАМИНА.
Витамин BI2 и ФОЛИЕВАЯ К-ТА, которые являются КОФЕРМЕНТАМИ МЕТИЛТРАНСФЕРАЗ.
2.На этапе пищеварения.
A. При поражении печени и кишечника нарушается образование и транспорт ЛП крови.
B. При поражении печени и желчевыводяицих путей нарушается образование и экскреция желчных кислот, участвующих в переваривании жиров пищи. В случае нарушения оттока желчи происходит насыщение её холестерином, что ведёт в этих условиях к застою и образованию холестериновых камней, центрами образования которых служат слущивающиеся клетки эпителия. Развивается ЖЕЛЧЕКАМЕННАЯ БОЛЕЗНЬ. В крови отмечается ГИПЕРХОЛЕСТЕРИНЕМИЯ.
C. Если поражается слизистая оболочка кишечника и нарушается выработка и поступление ферментов ПЖЖ, содержание жира в кале увеличивается. Если содержание жира будет превышать 50%, развивается СТЕАТОРЕЯ. Кал становится бесцветным.
D. Наиболее часто в последнее время среди населения встречается поражение бета -клеток ПЖЖ, что ведйт к развитию сахарного диабета, который сопровождается интенсивным окислением в клетках белков и жиров. В крови у таких больных отмечается ГИПЕРКЕТОНЕМИЯ, ГИПЕРХОЛЕСТЕРИНЕМИЯ. Кетоновые тела и холестерин синтезируются из АЦЕТИЛ-КОА.
3.На этапе обмена холестерина наиболее частым заболеванием является АТЕРОСКЛЕРОЗ, когда в клетках органов и тканей откладывается холестерин. Если холестерин откладывается в стенках сосудов, то происходит нарушение образования крови, следовательно, развиваются тромбозы, инфаркты.
Болезнь развивается тогда, когда между клетками тканей и ЛП крови растёт содержание АТЕРОГЕННЫХ ФРАКЦИЙ и понижается содержание ЛПВП, назначение которых удалять холестерин из клеток тканей в печень для последующего его окисления. Все ЛП за исключением ХИЛОМИКРОНОВ, которые содержат много белков и ФОСФОЛИПИДОВ быстро метаболизируются. ЛПНП задерживаются в сосудистой стенке. Они содержат много ТРИГЛИЦЕРИДОВ и ХОЛЕСТЕРИНА. Они, фагоцитируясь, разрушаются ферментами ЛИЗОСОМ, за исключением холестерина. Он накапливается в клетке в большом количестве. Клетки разрушаются и гибнут. Холестерин откладывается в межклеточном пространстве и инкапсулируется соединительной тканью. В сосудах образуются АТЕРОСКЛЕРОТИЧЕСКИЕ БЛЯШКИ. Способствуют развитию заболевания: повреждение сосудов токсинами при курении, алкоголизации, сахарном диабете (кетоновые тела), употребление обильной жирной пищи.
Лекция № 16. Обмен белков.
1. БЕЛКОВОЕ ПИТАНИЕ.
2. ПРЕВРАЩЕНИЕ БЕЛКОВ В ОРГАНАХ ПИЩЕВАРЕНИЯ.
3. ГНИЕНИЕ БЕЛКОВ. ОБРАЗОВАНИЕ ТОКСИЧЕСКИХ ПРОДУКТОВ И МЕХАНИЗМ ИХ ОБЕЗВРЕЖИВАНИЯ.
47.
ПАТОЛОГИЯ ЛИПИДНОГО ОБМЕНА.
1 .На этапе поступления жиров с пищей:
A. Обильная жирная пища на фоне ГИПОДИНАМИИ приводит к развитию АЛИМЕНТАРНОГО ОЖИРЕНИЯ.
B. Недостаточное поступление жиров или их отсутствие приводит к ГИПО- и АВИТАМИНОЗАМ A, D. Е, К. Могут развиваться ДЕРМАТИТЫ, СКЛЕРОЗ сосудов, когда с пищей не поступают ЭССЕНЦИАЛЬНЫЕ ВЖК. Также нарушается процесс синтеза ПРОСТАГЛАНДИНОВ, ПРОСТАЦИКЛИНОВ, ТРОМБОКСАНОВ и ЛЕЙКОТРИЕНОВ местных гормонов.
C. Недостаточное поступление с пищей ЛИПОТРОПНЫХ веществ приводит к развитию жировой инфильтрации тканей. К ЛИПОТРОПНЫМ веществам относятся:
ХОЛИН, ИНОЗИТ, СЕРИИ вещества, принимающие участие в синтезе
ФОСФОЛИПИДОВ. Витамин В6 (ПЕРИДОКСАЛЬФОСФАТ), входящий в состав ДК СЕРИНА. МЕТИОНИН поставщик МЕТИЛЬНЫХ групп при биосинтезе ХОЛИНА из ЭТАНОЛАМИНА.
Витамин BI2 и ФОЛИЕВАЯ К-ТА, которые являются КОФЕРМЕНТАМИ МЕТИЛТРАНСФЕРАЗ.
2.На этапе пищеварения.
A. При поражении печени и кишечника нарушается образование и транспорт ЛП крови.
B. При поражении печени и желчевыводяицих путей нарушается образование и экскреция желчных кислот, участвующих в переваривании жиров пищи. В случае нарушения оттока желчи происходит насыщение её холестерином, что ведёт в этих условиях к застою и образованию холестериновых камней, центрами образования которых служат слущивающиеся клетки эпителия. Развивается ЖЕЛЧЕКАМЕННАЯ БОЛЕЗНЬ. В крови отмечается ГИПЕРХОЛЕСТЕРИНЕМИЯ.
C. Если поражается слизистая оболочка кишечника и нарушается выработка и поступление ферментов ПЖЖ, содержание жира в кале увеличивается. Если содержание жира будет превышать 50%, развивается СТЕАТОРЕЯ. Кал становится бесцветным.
D. Наиболее часто в последнее время среди населения встречается поражение бета -клеток ПЖЖ, что ведйт к развитию сахарного диабета, который сопровождается интенсивным окислением в клетках белков и жиров. В крови у таких больных отмечается ГИПЕРКЕТОНЕМИЯ, ГИПЕРХОЛЕСТЕРИНЕМИЯ. Кетоновые тела и холестерин синтезируются из АЦЕТИЛ-КОА.
3.На этапе обмена холестерина наиболее частым заболеванием является АТЕРОСКЛЕРОЗ, когда в клетках органов и тканей откладывается холестерин. Если холестерин откладывается в стенках сосудов, то происходит нарушение образования крови, следовательно, развиваются тромбозы, инфаркты.
Болезнь развивается тогда, когда между клетками тканей и ЛП крови растёт содержание АТЕРОГЕННЫХ ФРАКЦИЙ и понижается содержание ЛПВП, назначение которых удалять холестерин из клеток тканей в печень для последующего его окисления. Все ЛП за исключением ХИЛОМИКРОНОВ, которые содержат много белков и ФОСФОЛИПИДОВ быстро метаболизируются. ЛПНП задерживаются в сосудистой стенке. Они содержат много ТРИГЛИЦЕРИДОВ и ХОЛЕСТЕРИНА. Они, фагоцитируясь, разрушаются ферментами ЛИЗОСОМ, за исключением холестерина. Он накапливается в клетке в большом количестве. Клетки разрушаются и гибнут. Холестерин откладывается в межклеточном пространстве и инкапсулируется соединительной тканью. В сосудах образуются АТЕРОСКЛЕРОТИЧЕСКИЕ БЛЯШКИ. Способствуют развитию заболевания: повреждение сосудов токсинами при курении, алкоголизации, сахарном диабете (кетоновые тела), употребление обильной жирной пищи.
Лекция № 16. Обмен белков.
1. БЕЛКОВОЕ ПИТАНИЕ.
2. ПРЕВРАЩЕНИЕ БЕЛКОВ В ОРГАНАХ ПИЩЕВАРЕНИЯ.
3. ГНИЕНИЕ БЕЛКОВ. ОБРАЗОВАНИЕ ТОКСИЧЕСКИХ ПРОДУКТОВ И МЕХАНИЗМ ИХ ОБЕЗВРЕЖИВАНИЯ.
В нашем организме идёт постоянный синтез и распад белков. Ежесуточно распадается 400гр. белка и столько же синтезируется. Из общей массы организма белка приходится 15кг. Синтез обновленного белка происходит из аминокислот, которые образуются при распаде.
Все АК можно разделить на 4 группы:
1 .Заменимые - синтезируются в организме: АЛА, АСП, АСН, ГЛУ, ГЛН, ГЛИ, ПРО, СЕР.
2.Незаменимые - не синтезируются в организме и поступают с пищей: ВАЛ, ЛЕЙ, ИЛЕ. ЛИЗ. ТРЕ, МЕТ, ФЕН, ТРИ.
3.Частично заменимые - синтезируются в организме, но очень медленно и не покрывают всех потребностей организма: ГИС, АРГ.
4.Условно заменимые - синтезируются из незаменимых аминокислот: ЦИС (МЕТ), ТИР (ФЕН). Полноценность белкового питания определяется:
1. Наличием всех незаменимых аминокислот. Отсутствие даже одной незаменимой аминокислоты нарушает биосинтез белка, т.е. каждая незаменимая АК может быть лимитирующей в процессе синтеза белка.
2. Аминокислотным составом белка. Все АК могут содержаться в продуктах как животного, так и растительного происхождения. Суточная потребность человека в белках составляет 100гр.
Пищевые белки подвергаются гидролитическому расщеплению под действием целой группы ферментов ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ (ПЕПТИДАЗЫ). Большинство этих ферментов вырабатывается в неактивной форме, т.е. в форме ПРОФЕРМЕНТОВ, а затем активируется путём ЧАСТИЧНОГО ПРОТЕОЛЗА. Это предохраняет стенки органов ЖКТ от само переваривания. Поверхность желудка и кишечника покрыта слизью, в составе которой содержаться ГЕТЕРОПОЛИСАХАРИДЫ. Они не подвергаются действию ферментов. Проферменты вырабатываются слизистой желудка или кишечника и поступают в полость этих органов, где происходит их активация. В пристеночном слое вырабатываются БИКАРБОНАТЫ, которые создают среду близкую к нейтральной (рН=5-6). В ротовой полости белки не подвергаются каким-либо химическим превращениям, т.к. здесь отсутствуют ферменты, действующие на белки. Здесь происходит лишь механическая переработка пищи. В желудке начинается химическое превращение белков. Здесь действуют два основных фермента: ПЕПСИН и ГАСТРИКСИН.
ПЕПСИН вырабатывается главными клетками слизистой желудка в неактивной форме -ПЕПСИНОГЕН, который под действием соляной кислоты активируется и превращается в пепсин. Процесс активации является АУТОКАТАЛИТИЧЕСКИМ. ПЕПСИНОГЕН активируется очень медленно, а пепсин потом становится активатором молекул ПЕПСИНОГЕНА. От ПЕПТИДНОЙ цепи неактивного ПЕПСИНОГЕНА со стороны N-конца отрывается один ПЕПТИД, содержащий 42 аминокислоты - активация путём ЧАСТИЧНОГО ПРОТЕОЛИЗА. Затем из остатка цепи формируется новая трёхмерная структура фермента - пепсина и новый активный центр. Соляная кислота вырабатывается обкладочными клетками слизистой желудка и играет очень важную роль в переваривании белков:
активирует ПЕПСИНОГЕН, превращая его в пепсин, создаёт оптимум рН для действия пепсина (1,5 - 2), обладает бактерицидным действием, денатурирует белки, которые потом гидролизуются. Внутренние ПЕПТИДНЫЕ связи становятся доступными для действия пепсина, способствует продвижению желудочного содержимого далее в кишечник. Пепсин - это фермент, который является ЭНДОПЕПТИДАЗОЙ, т.е. действует на внутренние ПЕПТИДНЫЕ связи, в образовании которых участвуют ароматические аминокислоты (ФЕН, ТИР, ТРИ) своими АМИДНЫМИ группами. ГАСТРИКСИН по действию аналогичен пепсину. Это тоже ЭНДОПЕПТИДАЗА. Его оптимум рН = 3 - 3,5. Действует на ПЕПТИДНЫЕ связи, в образовании которых участвуют ДИКАРБОНОВЫЕ аминокислоты (ГЛУ, АСП) своими КАРБОКСИЛЬНЫМИ группами. В желудке под действием ПЕПСИНА и ГАСТРИКСИНА сложные белковые молекулы распадаются на высокомолекулярные ПОЛИПЕПТИДЫ. Ими являются так называемые АЛЬБУМОЗЫ, ПЕПТОНЫ, которые поступают в тонкий кишечник.
В тонком кишечнике эти ПОЛИПЕПТИДЫ подвергаются действию целого ряда протеолитических ферментов ПЖЖ, которые вырабатываются в неактивной форме: ТРИПСИНОГЕН, ХИМОТРИПСИНОГЕН, ПРОЭЛАСТАЗА, ПРОКАРБОКСИПЕПТИДАЗА.
Механизм активации всех этих ферментов - ЧАСТИЧНЫЙ ПРОТЕОЛИЗ по каскадному механизму.

ТРИПСИН, ХИМОТРИПСИН, ЭЛАСТАЗА - ЭНДОПЕПТИДАЗЫ.
ТРИПСИН разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие ЛИЗ и АРГ. ХИМОТРИПСИН разрушает внутренние связи, в образовании которых принимают участие ароматические аминокислоты (ТИР, ТРИ, ФЕН). ЭЛАСТАЗА разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие АЛА, ГЛИ, ПРО, ЦИС. В результате действия ПЕПСИНА, ХИМОТРИПСИНА и ЭЛАСТАЗЫ высокомолекулярные ПЕПТИДЫ расщепляются до низкомолекулярных, которые подвергаются действию ЭКЗОПЕПТИДАЗ, действующих на крайние связи, отщепляя отдельные концевые аминокислоты. КАРБОКСИПЕПТИДАЗА разрушает крайние связи, отщепляя аминокислоты с С-конца. АМИНОПЕПТИДАЗА действует на крайние ПЕПТИДНЫЕ связи со стороны N-конца, отщепляя отдельные аминокислоты. ДИПЕПТИДЫ подвергаются действию ДИПЕПТИДАЗ, продуцирующихся слизистой кишечника сразу в активной форме. Т.о. в результате действия всей этой группы ферментов в ЖКТ белки пищи расщепляются до аминокислот. Образующиеся аминокислоты всасываются стенкой кишечника в кровь и поступают во все органы и ткани. Не всосавшиеся аминокислоты поступают в толстую кишку, где подвергаются процессам гниения. Это процесс бактериального распада веществ под действием микрофлоры или ферментов, вырабатывающихся этой микрофлорой. В норме в толстой кишке подвергаются аминокислоты, а при патологии - белки. Это происходит и в других отделах ЖКТ: в желудке (при понижении кислотности), ротовой полости (при кариесе).
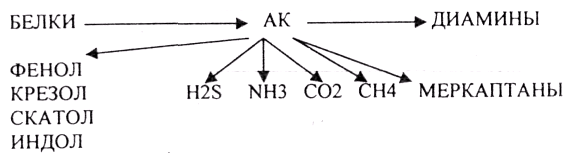
1.РЕАКЦИЯ ДЕКАРБОКСИЛИРОВАНАЯ.
А ОРНИТИН в состав белков не входит, но обязательно содержится в организме

В. ЛИЗИН

ПУТРЕСЦИН и КАДАВЕРИН являются токсическими веществами. Они входят в состав трупных
ядов.
2.ВОССТАНОВИТЕЛБНОЕ ДЕЗАМИНИРОВАНИЕ.

З.ДЕСУЛЬФИРОВАНИЕ - восстановительный процесс.

4.распад боковой цепи циклических аминокислот.

Все эти вещества токсические, образующиеся при гниении поступают в печень, где и происходит их обезвреживание. В печени имеется две системы, участвующие в обезвреживании этих веществ:
1. УДФГК - УРИДИНДИФОСФОГЛЮКУРОНОВАЯ К-ТА.
2. ФАФС - ФОСФОАДЕНОЗИНФОСФОСУЛЬФАТ.
Процесс обезвреживания - это процесс конъюгации токсических веществ с одной из этих систем и образование конъюгатов, которые являются уже нетоксическими веществами.

50.
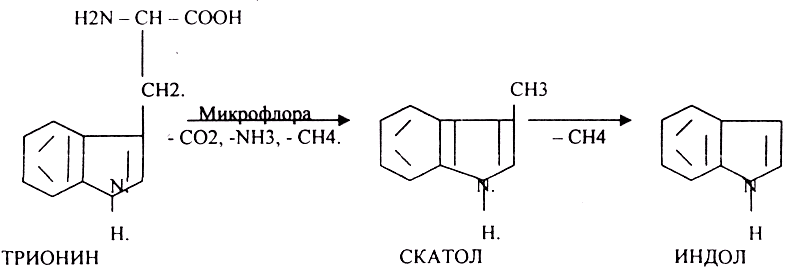
Индол предварительно подвергается ГИДРОКСИЛИРОВАНИЮ.

ИНДОКСИЛСУЛЬФАТ нейтрализуется и превращается в натриевую или калиевую соль.

Все эти вещества выводятся из организма с мочой. В норме реакция на индол должна быть отрицательна. При положительной реакции на индол - нарушена детоксикационная функция печени. Положительная реакция на ИНДИКАН наблюдается при очень активном гниении белков в толстом кишечнике.
Лекция № 17.
Обмен белков (продолжение).
1. ИСТОЧНИКИ АМИНОКИСЛОТ В КЛЕТКЕ И ПУТИ ИХ ИСПОЛЬЗОВАНИЯ.
2. МЕТАБОЛИЗМ АМИНОКИСЛОТ.
3. ОБРАЗОВАНИЕ АММИАКА И ПУТИ ЕГО ОБЕЗВРЕЖИВАНИЯ. СИНТЕЗ МОЧЕВИНЫ.
Источниками аминокислот в клетке являются:
1. белки пищи после их гидролиза в органах пищеварения,
2. синтез заменимых аминокислот,
3. распад тканевых белков.
Тканевые белки подвергаются гидролитическому расщеплению при участии тканевых ПРОТЕАЗ - КАТЕПСИНОВ, которые в основном находятся в ЛИЗОСОМАХ, но могут быть и в МИТОХОНДРИЯХ и ЭПС.
Эти ферменты обладают специфичностью действия. Выделяют разные КАТЕПСИНЫ. которые отличаются оптимумом рН и специфичностью действия на ПЕПТИДНЫЕ связи. Распад тканевых белков необходим для обновления белков, а также для устранения дефектных молекул белка.
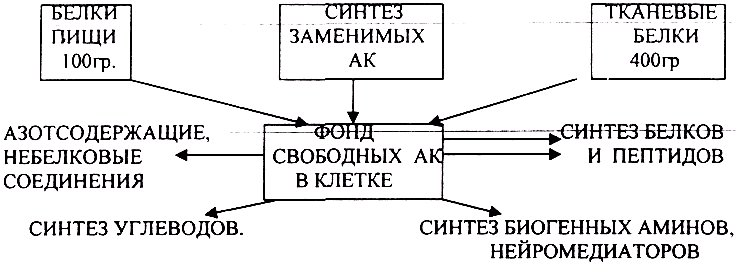
Часть аминокислот в тканях подвергается различным метаболическим превращениям.
1. Основной путь превращения аминокислот в тканях - это реакции ПЕРЕАМИНИРОВАНИЯ -реакции между АМИНО- и КЕТОКИСЛОТАМИ, когда они обмениваются своими функциональными группами, при этом аминокислоты являются донорами аминогрупп, а кетокислоты - их акцепторами. Эти реакции катализирует фермент -
51.
АМИНОТРАНСФЕРАЗА. Она локализуется в МИТОХОНДРИЯХ и ЦИТОПЛАЗМЕ. ТРАНСАМИНИРОВАНИЮ могут подвергаться все аминокислоты кроме ЛИЗ и ТРЕ. В организме человека обнаружено 10 различных АМИНОТРАНСФЕРАЗ. Наибольшее значение имеют AT, донорами аминогрупп которых являются АЛА, АСП, ГЛУ. ГЛУТАМИНОВАЯ кислота является универсальным донором, а альфа -КГК - универсальным акцептором аминогрупп.

Роль реакций ТРАНСАМИНИРОВАНИЯ:
1. используются для синтеза заменимых аминокислот. При этом происходит перераспределение азота в органах и тканях.
2. Является начальным этапом катаболизма аминокислот
3. В результате ТРАНСАМИНИРОВАНИЯ образуются альфа -КЕТОКИСЛОТЫ, которые поступают в ЦТК и включаются в ГЛЮКОНЕОГЕНЕЗ.
4. Протекают в разных тканях, но более всего в печени. Определение активности AT имеет диагностическое значение в клинике. АСАТ наиболее активна в миокарде, следовательно, повышение в сыворотке крови АСАТ можно предположить патологию в сердечной мышце. АЛАТ (АЛАНИНОВАЯ AT) особенно активна в печени, следовательно, повышение её в сыворотке крови свидетельствует о деструктивных изменениях в печени. При избытке АЛАНИНА или недостатке АСПАРАГИНОВОЙ К-ТЫ:
1. АЛА + альфа-КГК ↔ ГЛУ + ПВК
2. ГЛУ + ЩУК ↔АСП + альфа-КГК
2.Реакции ДЕКАРБОКСИЛИРОВАНИЯ - разрушение СООН-группы с выделением СО2. При этом аминокислоты в тканях образуют биогенные амины, которые являются биологически активными веществами (БАВ). Среди них могут быть соединения, которые выполняют функции:
1. НЕЙРОМЕДИАТОРОВ (СЕРЕТОНИН, ДОФАМИН, ГАМК),
2. Гормоны (АДРЕНАЛИН, НОРАДРЕНАЛИН),
3. Регуляторы местного действия ( ГИСТАМИН).

ГАМК является НЕИРОМЕДИАТОРОМ тормозного действия, поэтому препараты на основе ГАМК используются в клинике для лечения некоторых заболеваний ЦНС. Эта реакция используется в педиатрической практике: детям при сильном возбуждении используют раствор витамина В6, который стимулирует процесс образования ГАМК. ДОФАМИН является НЕИРОМЕДИАТОРОМ возбуждающего действия. Он является основой для синтеза АДРЕНАЛИНА и НОР АДРЕНАЛИНА.
52.

ГИСТАМИН повышает секрецию желудочного сока, поэтому применяется в клинической практике при зондировании. Обладает сосудорасширяющим действием, понижает АД.

3.Реакции ДЕЗАМИНИРОВАНИЯ - разрушение NН2-группы с выделением аммиака. В организме возможны следующие виды ДЕЗАМИНИРОВАНИЯ.
1. Восстановительное

2.ГИДРОЛИТиЧЕСКОЕ:

3. Внутримолекулярное:

Эти три вида ДЕЗАМИНИРОВАНИЯ имеют место при гниении, т.е. идут в толстой кишке.
4. Окислительное. Протекает в клетке. Непосредственно, ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергается только ГЛУ. 53.

ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергаются и другие аминокислоты, но этот путь является непрямым. Он идёт через ГЛУ и называется процессом НЕПРЯМОГО ОКИСЛИТЕЛЬНОГО ДЕЗАМИНИРОВАНИЯ. Аммиак образуется из аминокислот при распаде других азотсодержащих соединений (биогенных аминов, НУКЛЕОТИДОВ). Значительная часть аммиака образуется в толстой кишке при гниении. Он всасывается в кровь системы воротной вены, здесь концентрация аммиака больше, чем в общем кровотоке.
Аммиак образуется в различных тканях. Концентрация его в крови незначительна, т.к. он является токсичным веществом (0,4 - 0,7мг/л). Особенно выраженное токсическое действие он оказывает на нервные клетки, поэтому значительное его повышение приводит к серьёзным нарушениям обменных процессов в нервной ткани.
ПУТИ ОБЕЗВРЕЖИВАНИЯ АММИАКА.
1. образование АМИДОВ

ГЛУТАМИН и АСПАРАГИН - нетоксические вещества. Их называют транспортной формой аммиака в организме. Они не проникают через мембраны и в почках распадаются до аминокислот и аммиака.
2. Восстановительное АМИНИРОВАНИЕ.

3. Образование солей АММОНИЯ.
![]()
4. Синтез мочевины - основной путь обезвреживания аммиака - ОРНИТИНОВЫЙ ЦИКЛ.
КАРБОМОИЛФОСФАТ
![]()
54.


АРГИНАЗА обладает абсолютной специфичностью и содержится только в печени. В составе
мочевины содержится два атома азота: один поступает из аммиака, а другой выводится из АСП.
Образование мочевины идёт только в печени.
Две первые реакции цикла (образование ЦИТРУЛЛИНА и АРГИНИНОСУКЦИНАТА) идут в
МИТОХОНДРИЯХ, остальные в цитоплазме.
В организме в сутки образуется 25гр мочевины. Этот показатель характеризует мочевино-
образующую функцию печени. Мочевина из печени поступает в почки, где и выводится из
организма, как конечный продукт азотистого обмена.
Лекция № 18.
Распад НУКЛЕОПРОТЕИНОВ. Нарушение обмена белков.
1.ОСОБЕННОСТИ МЕТАБОЛИЗМА НУКЛЕОПРОТЕИНОВ.
2.ОБРАЗОВАНИЕ МОЧЕВОЙ КИСЛОТЫ. 3.ОБРАЗОВАНИЕ КРЕАТИНИНА. 4.НАРУШЕНИЕ ОБМЕНА БЕЛКОВ.
ОСОБЕННОСТИ МЕТАБОЛИЗМА НУКЛЕОТИДОВ.
1. НУКЛЕОТИДЫ и АЗОТИСТЫЕ ОСНОВАНИЯ (АО), поступающие с пищей, не включаются в НУКЛЕОТИДЫ и НУКЛЕИНОВЫЕ К-ТЫ организма.
55.
2. Клетки организма человека синтезируют предшественники НУКЛЕОТИДОВ. Исходя из этого, доказательств опасности употребления в пищу генно-инженерных продуктов в настоящий момент нет.
3. Помимо синтеза включаются механизмы реутилизации ПУРИНОВЫХ и ПИРИМИДИНОВЫХ оснований, образующихся при деградации нуклеиновых кислот.
4. Можно использовать аналоги ПУРИНОВ и ПИРИМИДИНОВ как антиканцерогенные вещества путём включения их в ДНК и РНК.
БИОСИНТЕЗ ПУРИНОВЫХ ОСНОВАНИЙ. Для биосинтеза ПУРИНОВЫХ оснований доносами атомов и атомных групп являются:

Для биосинтеза ПИРИМИДИНОВЫХ оснований донорами атомов и атомных групп являются АСП, ГЛУ, производные ФОЛИЕВОЙ кислоты. Распад НП происходит одинаково и в тканях, и в ЖКТ.

Окисление мочевой кислоты - окисление ПУРИНОВЫХ НУКЛЕОЗИДОВ.
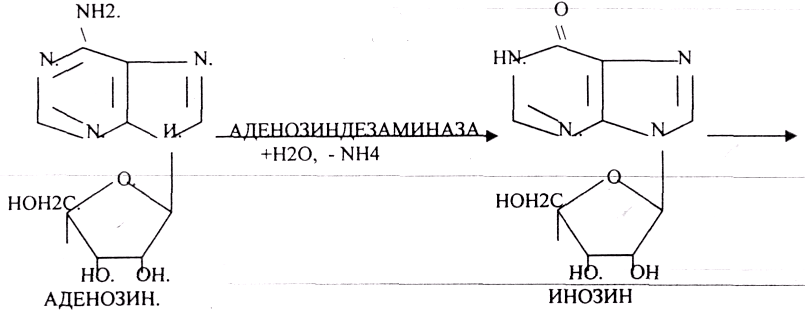

56.
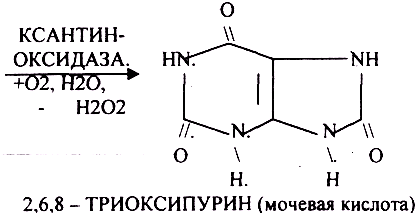
Мочевая кислота является конечным продуктом распада ПУРИНОВЫХ НУКЛ.

Уровень мочевой кислоты будет свидетельствовать об интенсивности распада ПУРИНОВЫХ оснований тканей организма и пищи. При распаде ПИРИМИДИНОВЫХ оснований из них образуется:
l.B-аланин СО2 NH3 МОЧЕВИНА


2.бета -АМИНОИЗОБУТИРАТ.
НАРУШЕНИЕ ОБМЕНА НУКЛЕОТИДОВ.
ГИПЕРУРИКЕМИЯ - повышение уровня мочевой кислоты в крови указывает на повышенный распад нуклеиновых кислот или пуриновых нуклеотидов. Мочевая кислота плохо растворима и выпадает в кристаллы в кислой среде. Развивается подагра, артриты, инициируется развитие МКБ (моче каменной болезни). В этих случаях рекомендуется содовое питьё. Образуются УРАТЫ натрия, которые являются растворимыми и легко выводятся из организма.
ОБРАЗОВАНИЕ КРЕАТИНИНА.
КРЕАТИНИН образуется из креатина, который в свою очередь синтезируется в печени из аминокислот, затем транспортируется в мышечную ткань, где взаимодействует с АТФ.

КРЕАТИНИН является конечным продуктом распада креатина. Он поступает в кровь и выделяется с мочой. КРЕАТИНИН не подвергается обратному всасыванию и является показателем фильтрационной способности почек. При её нарушении уровень КРЕАТИНИНА в моче будет понижаться, а в крови - повышаться,._
ОСТАТОЧНЫЙ АЗОТ - это содержание в крови азота всех азотсодержащих соединений, остающихся после осаждения белков. Его содержание колеблется 14 - 28ммоль/л. К остаточному азоту относится:
1.Азот промежуточных продуктов (ПЕПТИДЫ, АО, АК, КРЕАТИН, ИНДОЛ, СКАТОЛ и т.д.)
2.Азот конечных продуктов (МОЧЕВИНА, МОЧЕВАЯ К-ТА, ИНДИКАН, КРЕАТИНИН)—
ГИПЕРАЗОТЕМИЯ - повышение содержания в крови остаточного азота. Она может быть:
1.продукционная - повышение образования компонентов остаточного азота, главным образом
вследствие распада белков.
2.ретенционная - задержка азотистых шлаков из-за нарушения выделительной функции почек.
В клинике чаще встречается РЕТЕНЦИОННАЯ ГИПЕРАЗОТЕМИЯ.
Азотистый баланс - это разность азота, поступившего с пищей, и азота, выделяющегося с мочой. В физиологическом состоянии у здорового человека с пищей поступает 16гр азота и выделяется столько же. Азотистый баланс равен 0. Это называется азотистым равновесием.
57.
Положительный азотистый баланс связан с преобладанием процессов синтеза над процессами
распада. Азот задерживается в организме. Характерно для растущего организма или росте
опухолей. Отрицательный азотистый баланс указывает на преобладание процессов распада над процессами
синтеза. Может наблюдаться в пожилом и старческом возрасте у здоровых людей. В патологии
может быть при ожоговой болезни, деструкции опухоли.
ПАТОЛОГИЯ БЕЛКОВОГО ОБМЕНА.
1. Нарушение на этапе поступления белков. В норме в организм должно поступать 80 - ЮОгр белков. Обязательно поступление всех незаменимых АК.
Клинические проявления при недостатке определённых АК:
Лизин -тошнота, глаукома, повышение чувствительности к шуму: ГИС - понижение гемоглобина; МЕТ - жировая инфильтрация печени и почек.
При общем белковом голодании развивается белковая недостаточность, которая проявляется понижением уровня белка в сыворотке крови, ГИПОПРОТЕИН- и ГИПОГЛОБУЛИНЕМИЕЙ. Понижается онкотическое давление, и вода устремляется в ткани (развиваются отёки).
2. Нарушение на этапе пищеварения:
A) в желудке: ГИПОАЦИДОЗ, следовательно, пепсин неактивен и нарушается распад белков;
АХЛОРГИДРИЯ, следовательно, белки не расщепляются в желудке, подвергаются гниению.
B) в тонком кишечнике:
Связан с поражением ПЖЖ (панкреатиты), следовательно, недостаточность выработки трипсина и других гидролитических ферментов.
C) в толстой кишке:
Запоры, непроходимость, следовательно, усиление процессов гниения.
3. Нарушение МЕЖУТОЧНОГО обмена - нарушение обмена аминокислот в тканях.
A) Приобретенные - часто связаны с отсутствием витаминов (г.о. В6), следовательно, нарушение процессов ПЕРЕАМИНИРОВАНИЯ, ДЕЗАМИНИРОВАНИЯ. Это приводит к ГИПЕРАЦИДОАМИНЕМИИ, АМИНОАЦИДУРИИ.
B) Наследственные. Чаще всего встречаются нарушения обмена ФЕНИЛАЛАНИНА. В норме ФЕН трансформируется в ТИР.
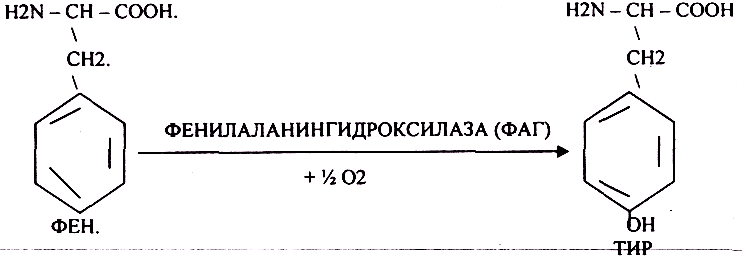
Отсутствие ФАГ приводит к так называемому метаболическому блоку.
![]()
Эти соединения накапливаются в тканях, повышаются в крови, появляются в моче -
ФЕНИЛКЕТОНУРИЯ (ФКУ). Они токсичны, особенно для тканей мозга. Ребёнок отстаёт в умственном развитии ФЕНИЛПИРОВИНОГРАДНАЯ ОЛИГОФРЕНИЯ. Назначается специальная диета, исключающая ФЕНИЛАЛАНИН.
При нарушении метаболизма ТИРОЗИНА не синтезируется МЕЛАНИН, следовательно, нарушается пигментация кожи, радужки. Моча окрашивается в бурый цвет, а затем в чёрный - АЛКАПТОНУРИЯ.
Нарушение на стадии ОРНИТИНОВОГО ЦИКЛА, следовательно накопление промежуточных продуктов (ЦИТРУЛИНА, АРГИНИНСУКЦИНАТА) ЦИТРУЛЛИНУРИЯ, АРГИНИНСУКЦИНАТНОЕ СЛАБОУМИЕ.
Нарушение на уровне выведения конечных продуктов. ЦИСТИНОЗ - нарушение РЕАБСОРБЦИИ АК и повышение их экскреции в 5 -10 раз (ЦИСТИН, ЦИСТЕИН).
58.
Лекция № 19. Матричный биосинтез.
РЕПЛИКАЦИЯ, И ЕЁ ЭТАПЫ.
РЕПАРАЦИЯ ДНК.
ТРАНСКРИПЦИЯ ГЕНА. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О ГЕНЕ.
СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ДНК.
Генетическая догма: информация записана в ДНК и передаётся на дочерние молекулы ДНК
из поколения в поколение с помощью процесса репликации. ДНК РНК белок
РЕПЛИКАЦИЯ - процесс самоудвоения ДНК. Этот процесс стал полностью изучен только после того, как УОТСОН и КРИК предложили структуру ДНК в виде двойной спирали, полинуклеотидные цепи которой связаны комплиментарными, азотистыми основаниями (А:::Т, Г:::Ц). Если азотистые основания комплиментарны друг другу, то и полинуклеотидные цепи тоже комплиментарны. В основе механизма репликации лежит принцип комплиментарности. К механизму репликации относится матричный биосинтез. Репликация ДНК идёт полуконсервативным способом: на каждой материнской полинуклеотидной цепи синтезируется дочерняя цепь.
Условия необходимые для репликации:
1. Матрица - нити ДНК. Расщепление нити называется РЕПЛИКАТИВНАЯ ВИЛКА. Она
может образовываться внутри молекулы ДНК. Они движутся в разных направлениях,
образуя РЕПЛИКАТИВНЫЙ ГЛАЗОК. Таких глазков в молекуле ДНК ЭУКАРИОТ
несколько, каждый имеет две вилки
![]()
2. Субстрат. Пластическим материалом являются ДЕЗОКСИНУКЛЕОТИДТРИФОСФАТЫ: дАТФ, дГТФ, дЦТФ, дТТФ. Затем происходит их распад до ДЕЗОКСИНУКЛЕОТИДМОНОФОСФАТОВ, двух молекул фосфата неорганического с выделением энергии, т.е. они одновременно являются источником и энергии, и пластического материала.
Д-АТФ Д-АМФ + ФФ + Е.
3. Ионы магния.
Репликативный комплекс ферментов:
A) ДНК -раскручивающие белки:
1. DNA-A (вызывает расхождение нитей)
2. ХЕЛИКАЗЫ (расщепляют цепь ДНК)
3. ТОПОИЗОМЕРАЗЫ 1 и 2 (раскручивают сверх спирали). Разрывают (3',5') -
фосфодиэфирные связи. ТОПОИЗОМЕРАЗА 2 у ПРОКАРИОТ называется ГИРАЗА.
B) Белки, препятствующие соединению нитей ДНК (SSB -белки)
C) ДНК-ПОЛИМЕРАЗА (катализирует образование фосфодиэфирных связей). ДНК- ПОЛИМЕРАЗА только удлиняет уже существующую нить, но не может соединить два свободных НУКЛЕОТИДА.
D) ПРАЙМАЗА (катализирует образование «затравки» к синтезу). Это по своей структуре РНК-ПОЛИМЕРАЗА, которая соединяет одиночные НУКЛЕОТИДЫ.
Е)ДНК-ЛИГАЗА.
5. ПРАЙМЕРЫ - «затравка» для репликации. Это короткий фрагмент, состоящий из РИБОНУКЛЕОТИДТРИФОСФАТОВ (2 - 10). Образование ПРАИМЕРОВ катализируется ПРАЙМАЗОЙ.
Основные этапы репликации.
1.ИНИЦИАЦИЯ репликации.
Происходит под влиянием внешних стимулов (факторов роста). Белки соединяются с рецепторами на плазматической мембране и вызывают репликацию в синтетическую фазу клеточного цикла. Смысл инициации заключается в присоединении в точку репликации DNA-A, стимулирующего расхождение двойной спирали. В этом принимает участие и ХЕЛИКАЗА. Действуют ферменты (ТОПОИЗОМЕРАЗЫ), вызывающие раскручивание сверх спирали. SSB-белки препятствуют соединению дочерних цепей.
Образуется РЕПЛИКАТИВНАЯ ВИЛКА.
Образование дочерних нитей.
Этому предшествует образование ПРАИМЕРОВ с помощью фермента ПРАЙМАЗЫ. Действует ДНК-ПОЛИМЕРАЗА и образуется дочерняя нить ДНК. Этот процесс происходит в соответствии с принципом комплиментарности, и синтез идёт от 5' к 3' концу синтезируемой нити.

На одной из материнских нитей будет строиться непрерывная цепь, а на противоположной нити - цепь из коротких фрагментов (фрагментов ОКАЗАКИ) Удаление ПРАИМЕРОВ с помощью ЭКЗОНУКЛЕАЗЫ.
Соединение коротких фрагментов с помощью ДНК-ЛИГАЗЫ.
Дочерние нити КОМПЛИМЕНТАРНЫ материнским. Дочерние молекулы ДНК являются копией материнской ДНК. Значение репликации: воспроизведение генотипа в поколениях.
2. РЕПАРАЦИЯ ДНК.
ДНК человека содержит примерно 3 млрд. НУКЛЕОТИДОВ. Если появится одна ошибка на 1млн. НУКЛЕОТИДОВ, то в целом в молекуле ДНК будет 3000 ошибок за один процесс репликации. Ошибки в репликации могут привести к летальному исходу. В организме существует система, исправляющая ошибки - система репарации ДНК. Она состоит из трёх ферментов:
- ЭНДОНУКЛЕАЗА,
- ЭКЗОНУКЛЕАЗА,
- ДНК-ПОЛИМЕРАЗА РЕПАРИРУЮЩАЯ.
- ЭНДОНУКЛЕАЗА вызывает разрыв фосфодиэфирных связей повреждённого НУКЛЕОТИДА с соседним, с той или с другой стороны. В результате образуется два конца. В действие вступает ЭКЗОНУКЛЕАЗА, отщепляющая НУКЛЕОТИДЫ с образующихся концов ДНК в обе стороны. В результате действия этих ферментов на одной нити ДНК возникает дефект. В работу вступает ДНК-ПОЛИМЕРАЗА РЕПАРИРУЮЩАЯ. Она достраивает повреждённую цепь в соответствии с принципом комплиментарности. Т.о. повреждённый НУКЛЕОТИД удаляется.
3. ТРАНСКРИПЦИЯ ГЕНА.
Транскрипция - передача информации с ДНК на РНК (биосинтез РНК). Транскрипции, в отличие от репарации, подвергаются только определённые части молекулы ДНК. Эта часть называется ТРАНСКРИПТОНОМ - фрагмент ДНК, транскрибируемый в РНК. ДНК эукариот прерывистая: участки, несущие информацию (ЭКЗОНЫ), чередуются с участками, не несущими информацию (ИНТРОНЫ). В ДНК с 5'-конца выделяют ПРОМОТОРНУЮ область - место присоединения РНК-ПОЛИМЕРАЗЫ. С 3'-конца - ТЕРМИНАТОРНАЯ зона. Эти области не транскрибируются.
УСЛОВИЯ ТРАНСКРИПЦИИ.
1. Матрица - 1 нить ДНК. Образуется транскрипционный глазок.
2. Структурные компоненты - РИБОНУКЛЕОЗИД-3-ФОСФАТЫ (АТФ, ГТФ, ЦТФ, УТФ). Они будут распадаться до МОНОФОСФАТОВ с выделением энергии.
3. ДНК-зависимая РНК-ПОЛИМЕРАЗА.
ОСНОВНЫЕ ЭТАПЫ ТРАНСКРИПЦИИ.
1. ИНИЦИАЦИЯ.
Заключается в присоединении РНК-ПОЛИМЕРАЗЫ к ПРОМОТОРУ, что приводит к расхождению нитей ДНК. Импульсом к присоединению РНК-ПОЛИМЕРАЗЫ является присоединение ТВР-белка к TATA-САЙТУ.
2. ЭЛОНГАЦИЯ (удлинение).
Соединение РИБОНУКЛЕОЗИДМОНОНУКЛЕОТИДОВ и образование фосфодиэфирных связей между НУКЛЕОТИДАМИ с помощью РНК-ПОЛИМЕРАЗЫ, которая передвигается вдоль нити ДНК. Присоединение НУКЛЕТИДОВ идет в соответствии с принципом комплиментарности, только вместо ДЕЗОКСИНУКЛЕОТИДОВ будут РИБОНУКЛЕОТИДЫ, и вместо ТМФ - УМФ.синтез идёт со скоростью 30 - 50 НУКЛЕОТИДОВ в секунду, пока не дойдёт до Т-зоны.
3. ТЕРМИНАЦИЯ (окончание).Заключается в том, что со стороны 3'-конца образованной РНК присоединяется множество (до 200 - 300) АДЕНИЛОВЫХ НУКЛЕОТИДОВ - поли А. Образуется точная копия гена. АДЕНИЛОВЫЕ НУКЛЕОТИДЫ защищают 3'-конец от действия ЭКЗОНУКЛЕАЗ. С 5'-конца образуется защита, так называемый «САР» (чаще всего УДФ). Эта образовавшаяся копия гена называется ТРАНСКРИПТ.
4. ПРОЦЕССИНГ (созревание).
Заключается в СПЛАЙСИНГЕ удаление неинформативных участков, и соединение ЭКЗОНОВ между собой. Играет важную роль в эволюции организмов, т.к. возможен альтернативный СПЛАЙСИНГ. Это свидетельствует о том, что из одной пре-ИРНК образуется несколько ИРНК и соответственно несколько белков, что проявляется в разнообразии признаков у организмов.
Лекция № 20. Биосинтез белка.
1.БЕЛОКСИНТЕЗИРУЮЩИЙ АППАРАТ.
2.ТРАНСЛЯЦИЯ.
3.РЕГУЛЯЦИЯ БИОСИНТЕЗА БЕЛКА.БИОСИНТЕЗ БЕЛКА.
Трансляция или собственно биосинтез белка - это перевод генетического текста М-РНК в последовательность аминокислот в белке. Характеристика белоксинтезирующего аппарата клетки.
1. МРНК - источник информации.
У эукариот имеется особенность - САР (шапка, кепка), представленная МЕТИЛ-ГТФ. САР защищает МРНК от гидролиза и способствует её соединению с РИБОСОМАМИ. С САР связываются САР-связывающие белки. На МРНК находится стартовый кодон, представленный триплетом АУГ, представленный аминокислотой - МЕТ.
РИБОСОМЫ - комплексы РРНК с порядка 80 белками, включая ферменты. РИБОСОМА состоит из двух единиц- большой и малой. Она у ЭУКАРИОТ более крупная, её формула 80S (40S и 60S). У ПРОКАРИОТ она имеет формулу 70S (30S и 50S)
Аминокислоты (20 видов).
ТРНК(31 вид).
Несоответствие числа транспортных РНК и числа кодонов (61) снимается за счёт возможности узнавания одной транспортной РНК нескольких кодонов данной аминокислоты (ГЛИЦИН имеет три варианта ДНК-кода - ГГУ, ГГЦ, ГГА). Все эти 3 варианта узнаются одним видом Т-РНК - ЦЦН. В состав транспортной РНК входят минорные азотистые основания, способные узнавать вариабельный участок разных кодонов одной и той же аминокислоты. Транспортная РНК выполняет функцию АДАПТОРА между МРНК и белком.
Фермент синтеза комплекса транспортной РНК с аминокислотой - АМИНОАЦИЛ-ТРНК-СИНТЕТАЗА (требует энергии АТФ).
Белковые факторы:
факторы ИНИЦИАЦИИ (ФИ) начала трансляции, факторы ЭЛОНГАЦИИ (ФЭ) - продолжатели, факторы ВЫСВОБОЖДЕНИЯ (R-факторы).
Ионы магния, как КОФАКТОРЫ.
АТФ, ГТФ - поддержка энергией.
Этапы трансляции:
1.РЕКОГНИЦИЯ (распознавание) - узнавание между аминокислотами и их транспортной
РНК.
2.АК + ТРНК аминоацил-т-РНК-синтетаза АК-ТРНК
 АТФАМФ
+ ФФ
МЕТИОНИЛ-ТРНК
АТФАМФ
+ ФФ
МЕТИОНИЛ-ТРНК
РЕКОГНИЦИЯ происходит столько раз, сколько аминокислот входит в состав белка.
3. ИНИЦИАЦИЯ - начало процесса трансляции.
На этом этапе РИБОСОМА взаимодействует с МРНК и находит стартовый кодон. Малая её единица взаимодействует с МЕТИОНИЛ-ТРНК и образует инициирующий комплекс, способный распознавать стартовый кодон. Этому предшествует разделение РИБОСОМЫ с помощью ФИ-3. Образование инициирующего комплекса происходит с помощью ФИ-2. Затем инициирующий комплекс присоединяется к МРНК с 5'-конца. Узнаванию 5'-конца способствуют САР и САР-связывающие белки. Реакцию обеспечивают ФИ-1. Сканирование инициирующим комплексом матричной РНК путём продвижения от 5' к 3'-концу до обнаружения стартового кодона антикодоном МЕТ-ТРНК. Данный процесс энергозависим, требует энергии АТФ. После обнаружения стартового кодона собирается полностью РИБОСОМА путём фиксации 60S единицы, и высвобождаются белковые ФИ-1,2,3 и САР-связывающие белки. В РИБОСОМЕ выделяют Р-участок и А-участок. Р-участок (ПЕПТИДИЛЬНЫЙ) - в нём происходит образование ПЕПТИДНЫХ связей. Это закрытая область РИБОСОМЫ. Вход в неё извне запрещён. А-участок (АМИНОАЦИЛЬНЫЙ). Это открытая область РИБОСОМЫ - для поступления следующей аминокислоты.
4. ЭЛОНГАЦИЯ (продолжение) протекает циклически в виде последовательной смены трёх фаз:
- присоединение следующей АМИНОАЦИЛ-ТРНК в соответствии со смыслом следующего кодона. Для процесса требуется энергия ГТФ и ФЭ-1 (проникновение в РИБОСОМУ).
- ПЕПТИЗАЦИЯ. Фермент ПЕПТИДИЛТРАНСФЕРАЗА образует ПЕПТИДНУЮ связь между двумя аминокислотными остатками и одновременно разрушает сложноэфирную связь между первой аминокислотой и её ТРНК. В результате идёт образование растущего ПЕПТИДА в А-участке и высвобождение первой ТРНК.
- ТРАНСЛОКАЦИЯ (перемещение).
При этом происходит перемещение РИБОСОМЫ на один кодон в направлении 3'-конца. При этом все остальные компоненты (МРНК, ТРНК) остаются на месте. Для процесса требуется энергия ГТФ и белковый ФЭ-2. Процесс циклический, т.е. фазы чередуют друг друга. Это происходит до обнаружения стоп (нонсенс)-кодона. Он не кодирует ни одну аминокислоту. Элонгация становится невозможной. Элонгацию и инициацию обозначают как собственно трансляцию.
5. ТЕРМИНАЦИЯ (прекращение).
Стоп -кодон распознаётся R-факторами (РЕЛИЗИНГ). Эти факторы высвобождают из связи все компоненты белоксинтезирующего комплекса: РИБОСОМУ, МРНК, ПОЛИПЕПТИД. Помогает фермент - ПЕПТИДИЛТРАНСФЕРАЗА, отщепляющий транспортную РНК от образованного ПОЛИПЕПТИДА. Для ТЕРМИНАЦИИ нужна энергия ПГФ. РИБОСОМА может повторно использоваться в трансляции. Матричная РНК или повторно используется в трансляции, или гидролизуется. ПОЛИПЕПТИД вступает в этап ПРОЦЕССИНГА белка.
6. БРОЦЕССИНГ белка (созревание) совокупность химических модификаций
ПОЛИПЕПТИДА, заканчивающихся формированием зрелой белковой молекулы. ПРОЦЕССИНГ белка может быть:
КОНТРАНСЛЯЦИОННЫЙ (во время трансляции)
ПОСТТРАНСЛЯЦИОННЫЙ. Варианты ПРОЦЕССИНГА:
A) ограниченный протеолиз: отщепление N-концевой аминокислоты (МЕТ), отщепление ПЕПТИДНОГО фрагмента.
АЦИЛИРОВАНИЕ (присоединение остатка СНЗСООН)
ФОСФОРИЛИРОВАНИЕ
ГЛИКОЗИЛИРОВАНИЕ - образование ГЛИКОПРОТЕИНОВ и ПРОТЕОГЛИКАНОВ.
E) ГИДРОКСИЛИРОВАНИЕ аминокислот
F) ОКИСЛЕНИЕ аминокислот
G) Образование четвертичной структуры в случае ОЛИГОМЕРНОСТИ белка. ПРОЦЕССИНГ включает в себя наивысшую точку - ФОЛДИНГ - сворачивание, обретение белком высших уровней пространственно-структурной организации, заканчивающееся формированием структурно и функционально зрелой молекулы.
ШАПЕРОНЫ - над молекулярные комплексы белковой природы, способствующие быстрому и
правильному ФОЛДИНГУ. В большом числе представлены белками теплового шока.
ШАПЕРОНЫ препятствуют приобретению белком неправильной конформации. Неудачный ФОЛДИНГ заканчивается появлением аномальных белков, которые должны быть элиминированы.
УБИКВИТИН белок, присутствующий в каждой клетке организма. Это «билет» на уничтожение аномального белка. Белок, меченый УБИКВИТИНОМ, разрушается в ПРОТЕОСОМАХ. В норме обеспечивается гомеостаз структуры белка, сохранение его нативной структуры. При заболеваниях образуются аномальные белки, которые не утилизируются - ПРИОНЫ -ПРОТЕИНОГЕННЫЕ, информативные частицы. Это продукты неправильного ФОЛДИНГА, которые, попадая в организм извне, трансформируют нормальные белки данного организма в виде цепной реакции. ПРИОННЫЕ белки не расщепляются в ЖКТ, а всасываются в неизменённом виде. По сути ПРИОНЫ - это отрицательные ШАПЕРОНЫ. КОМПАРТМЕНТАЛИЗАЦИЯ БЕЛКОВ (механизмы адресования).
Белки должны быть правильно распределены в клетке или выделены из неё на экспорт. За этот процесс отвечает сигнальный участок - это фрагмент аминокислотной последовательности синтезированного ПОЛИПЕПТИДА, содержащего условный адрес размещения белка. Известно, что преобладание гидрофобных аминокислот в сигнальном участке, направляет белок в мембранную структуру клетки. Преобладание гидрофильных аминокислот в сигнальном участке способствует проникновению белка в цитоплазму и выделение на экспорт. Синтезированные белки могут быть в виде над молекулярных комплексов (ШАПЕРОНЫ, ПРОТЕОСОМЫ, белки мокро трубочек).
БИОСИНТЕЗ ИНСУЛИНА.
ПРЕПРОИНСУЛИН - ПОЛИПЕПТИД, содержащий 110 аминокислотных остатков. Он содержит сигнальный участок, представленный гидрофильными аминокислотами, которые адресуют ПРЕПРОИНСУЛИН в ЭПР. После этого сигнальный участок отщепляется и образуется ПРОИНСУЛИН, содержащий 84 аминокислотных остатка. Он подвергается ОГРАНИЧЕННОМУ ПРОТЕОЛИЗУ путём вырезки внутреннего участка С-ПЕПТИДА. Образуется две цепочки из 21 и 30 аминокислот, которые затем соединяются дисульфидными связями с образованием молекулы инсулина из 51 аминокислотного остатка.
РЕГУЛЯЦИЯ БИОСИНТЕЗА БЕЛКА.
Несмотря на единство общего генотипа, в организме человека присутствует примерно 200 фенотипов клеток, и фенотипические различия определяются экспрессией генов. В каждой клетке, независимо от фенотипа, экспрессируются гены «домашнего хозяйства» обеспечивающие элементарные процессы жизнедеятельности, характерные для каждой клетки. Регуляция биосинтеза белка у ПРО- и ЭУКАРИОТ различна. У ПРОКАРИОТ основные положения теории регуляции изложены в 1961г. Ф. ЖАКОБОМ и Ж. МОНО.
1. Регуляция происходит только на уровне транскрипции. Первичные транскрипты генов у них транслируются до завершения транскрипции.
2. Неоднородность ГЕНОМОВ. В геноме есть структурные гены и есть регуляторные области, которые могут включать регуляторные элементы и регуляторные гены. Структурные гены кодируют синтез структурных и функциональных белков. Регуляторные элементы не кодируют синтез белков вообще, но влияют на процесс транскрипции.
Регуляторными элементами являются:
- ПРОМОТОР - место прикрепления к ДНК РНК-ПОЛИМЕР АЗЫ, ОПЕРАТОР - место взаимодействия регуляторных белков с ДНК. Регуляторные гены кодируют синтез регуляторных белков. К ним относится белок -РЕПРЕССОР, который Может блокировать считывание информации, связываясь с оператором. Фрагмент ДНК, подверженный транскрипции называется ОПЕРОН (ПРОМОТОР, ОПЕРАТОР, структурный ген). За пределами ОПЕРОНА находятся гены-регуляторы, кодирующие синтез белка - РЕПРЕССОРА.
3. Регуляция биосинтеза белков у ПРОКАРИОТ протекает альтернативно путём репрессии и индукции.
ПРИМЕР: ЛАКТОЗНЫЙ ОПЕРОН. В микробной клетке лактоза с помощью лактазы расщепляется до галактозы и глюкозы. Лактозный ОПЕРОН регулирует синтез лактазы. Если в среде присутствует лактоза, то БЕЛОК-РЕПРЕССОР вытесняется из связи с оператором и гены лактазы транскрибируются. Лактоза выступает индуктором.
Регуляция биосинтеза белка у ЭУКАРИОТ происходит на всех уровнях матричных биосинтезов.
1. На уровне транскрипции - групповая репрессия гистонами. У человека 90% ДНК репрессировано.
2. Амплификация генов - повышение числа копий гена в геноме (повышается площадь транскрипции).
3. Регуляция транскрипции сигналами-регуляторами (усилителями и душителями). Для сигналов усилителей принят термин ЭНХАЙСЕР. Они не кодируют синтез белка, чрезвычайно эффективны, может наблюдаться 200-кратное усиление транскрипции. Действие не специфично (одновременно может влиять на группу генов). Значительно удалён от ПРОМОТОРА гена-мишени. Подвержен влиянию регуляторных факторов (гормонов). Сигналы-душители называются САЙЛЕНСЕРЫ - угнетатели транскрипции. Особенности действия подобны ЭНХАЙСЕРАМ, только действие противоположное.
4. Регуляция на уровне процессинга МРНК разрешение или запрещение процессинга
дифференциальный процессинг включает альтернативный СПЛАЙСИНГ - сборка РНК из разных экзонов, и редактирование МРНК - замена одного из нуклеотидов с изменением генетической информации, приводящее к образованию изменённых белков
5. На уровне стабильности и активности МРНК. МРНК в клетке образует комплекс с белками, который называется ИНФОРМОСОМА. В их составе МРНК не разрушается ферментами, сохранения в активном, стабильном состоянии. При необходимости она высвобождается из комплекса и транслируется. Процесс образования и распада ИНФОРМОСОМ регулируется гормонами. С одной молекулы РНК транслируется большое количество белков.
6. Регуляция на уровне трансляции:
Тотальная регуляция может быть в виде тотальной репрессии или индукции за счёт
изменения концентрации белковых факторов трансляции
Избирательная дискриминация. Определённые виды МРНК избирательно не
транслируются. С них не синтезируется белок. Трансляция с альтернативных стартовых участков. Т.о. образом может происходить выбор исходной стартовой точки трансляции.
Лекция №21.
Ключевые позиции и проблемы молекулярной биологии геномного периода.
1. ПЕРВЫЕ ПРЕДСТАВЛЕНИЯ О ГЕНЕ.
2. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О ПРИРОДЕ БИОХИМИЧЕСКОГО ПОЛИМОРФИЗМА.
3. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ СТРУКТУРНО-ФУНКЦИОНАЛЬНОЙ ОРГАНИЗАЦИИ ДНК.
Прочтение генома привело к формированию новой биологии. Предпосылки возможности биологии нового времени: 1953г. Д. УОТСОН и Ф. КРИК открыли структуру ДНК. 1961г. Ф. КРИК расшифровал генетический код. 1970г. Г. ТЕМЕН и Д. БАЛТИМОР открыли ОБРАТНУЮ ТРАНСКРИПТАЗУ (способность на основе РНК синтезировать ДНК). Значение: возможность изучения изолированных генов. 1983г. К. МЮЛЛИС - реакция PCR (ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ) - управляемое тиражирование ДНК в пробирке. 2001г. первая версия генома человека.
ЭТАПЫ И ПРИНЦИПЫ PCR.
PCR - это метод, позволяющий в пробирке получать любое количество копий заданного участка молекулы ДНК. Стадии метода PCR:
1. Выделение ДНК из биологического материала.
2. Амплификация - репликация на органическом участке молекулы ДНК. Производится за счёт работы ферментов и смены температурных режимов.
3. ДЕТЕКЦИЯ продуктов PCR (копий заданного участка) Схема PCR:
ДНК
Т= 90, Денатурация (расплетение) ДНК
Т=50. Отжиг ПРАЙМЕРОВ
Т=70. Синтез ДНК
ПРАЙМЕРЫ специфические ОЛИГОНУКЛЕОТИДНЫЕ последовательности комплиментарные изучаемому участку ДНК. Они синтезируются в искусственных условиях на основе НУКЛЕОТИДНОЙ последовательности ДНК. ПРАЙМЕРЫ ограничивают зону копирования, являются закладками в ДНК. Синтез ДНК идёт с помощью ДНК-ПОЛИМЕРАЗЫ. Этот фермент выделен из микроорганизмов, обитающих в горячих источниках. Т.о. в результате первого цикла вместо одной молекулы ДНК образуется две. На следующий цикл матрицей будут являться все продукты предшествующего цикла. За 20 - 30 циклов количество фрагментов ДНК вырастает в 1000000 раз. Эти реакции производят в АМПЛИФИКАТОРЕ - приборе, где чередуются циклы нагревания и охлаждения. Продолжительность каждого этапа измеряется секундами. Факторы необходимые для PCR:
1. изучаемая ДНК,
2. ПРАЙМЕРЫ изучаемого участка,
3.Термостабильная ДНК-ПОЛИМЕРАЗА,
4. Строительный материал. Он же является источником энергии,
5. Оборудование для АМПЛИФИКАЦИИ. Сферы применения PCR.
В 1993г. К. МЮЛЛЕСУ была присуждена Нобелевская премия в области химии, за открытие
PCR.
1. изучение генома микроорганизмов
2. клиническая лабораторная диагностика. PCR даёт возможность обнаружения наследственных заболеваний, а также обнаружить чужеродный геном в тканях человека (микроорганизмы, вирусы и т.д.). Реакция пойдёт или не пойдёт. В настоящее время PCR - самый точный метод микробиологической диагностики.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О СТРУКТУРНО-ФУНКЦИОНАЛЬНОЙ ОРГАНИЗАЦИИ ДНК. 95% ДНК человека представляет не генная часть. 5% - собственно гены. Не генная часть представлена:
1. ТАНДЕМНЫЕ ПОВТОРЫ монотонные повторы НУКЛЕОТИДОВ, как правило дуплетного характера, не имеющие смысла. Это так называемые «пустынные участки» ДНК. В настоящее время смысл этих участков: выполнение структурной функции и площадки для образования генов в эволюции (эволюционный резерв).
2. ПСЕВДОГЕНЫ - неактивные, но стабильные генетические элементы, возникающие в результате мутации в ранее работавших генах (гены, выключенные мутацией). Это побочный продукт и генетический резерв эволюции. Составляют 20 - 30% не генной части ДНК.
3. Мобильные генетические элементы:
-ТРАНСПОЗОНЫ - участки ДНК, способные вырезаться и встраиваться в другие области
ДНК. Это так называемые «странники генов».
-РЕТРОТРАНСПОЗОНЫ - участки ДНК, копирующиеся в пределах генома, как внутри
хромосомы, так и между ними. Могут изменять смысл структурных генов человека, приводят к мутациям. Геном человека изменяется в течении жизни на 10 - 30%.
- поврежденные неактивные, мобильные генетические элементы. Не могут ни вырезаться, ни встраиваться из-за отсутствия в клетке ОБРАТНОЙ ТРАНСФЕРАЗЫ. Если фрагмент поступает в клетку с вирусом, то тогда эти гены начинают транскрибироваться. ФУНКЦИОНАЛЬНЫЕ ЭЛЕМЕНТЫ ГЕНОМА:
1. СТРУКТУРНЫЕ ГЕНЫ
2. РЕГУЛЯТОРНЫЕ ЭЛЕМЕНТЫ
Структурные гены кодируют синтез МРНК, ТРНК, РРНК.
Регуляторные элементы не кодируют РНК и, соответственно, белков; влияют на работу
структурных генов.
ГЕНОМИКА - отрасль молекулярной биологии, изучающая структуру и механизмы работы гена. В настоящее время установлено и изучено 35000 генов человека. Из них в каждой клетке работает 25%.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О ПРИРОДЕ БИОХИМИЧЕСКОГО ПОЛИМОРФИЗМА.
В 40-е годы 20в БИДЛОМ и ТЕЙТУМОМ выдвинут принцип: 1 ген - I фермент. Они исходили из общей схемы биосинтеза белка, однако этот принцип не объясняет:
1. Фенотипическое различие между клетками,
2. Индивидуальные различия между организмами одного вида. Каждый человек отличается от другого человека на 0,1% генома.
3. Широкое разнообразие белков. На основе 35000 генов синтезируются около 5000000 белков. В настоящее время нельзя сказать точно, что изучать важнее - геном или белковый состав организма.
ПРОТЕОМИКА - отрасль молекулярной биологии, изучающая структуру и функцию белков, взаимосвязь между ними.
ПРОТЕОМ - совокупность белков клетки или организма. В настоящее время можно составить протеомный портрет человека, существует ПРОТЕОМНАЯ ДАКТИЛОСКОПИЯ.
Развитие ГЕНОМИКИ и ПРОТЕОМИКИ невозможно без компьютерного обеспечения. Компьютеры помогают расшифровать геном, определять структуру белков, моделировать функции и признаки.
БИОДЕКОДОМИКА- раздел молекулярной биологии, занимающийся расшифровкой биологических тестов.
МЕТОДЫ И ПРИНЦИПЫ ГЕНОТЕРАПИИ.
ГЕНОТЕРАПИЯ - введение конструкции в организм человека с лечебной целью.
ГЕНОТЕРАПИЯ подразделяется на:
1. ГЕНОТЕРАПИЯ ex vivo, т.е. коррекция генов в клетках, выведенных за пределы организма, коррекция и возвращение клеток в организм. Появилась в 1986г. - впервые был вылечен иммунодефицит, что необходимо повторять 2 - 3 года, т.е. временные ограничения.
2. ГЕНОТЕРАПИЯ in vivo - системная генотерапия с заменой или введением вновь нормального гена во все клетки организма. Сложна и пока менее используется.
3. ГЕНОТЕРАПИЯ in situ - генетическую конструкцию вводят в зону патологического процесса. Например, блокаторы онкогенов вводят в место локализации опухоли после её удаления.
ГЕНОТЕРАПИЯ может быть фетальная (в настоящее время запрещена) и соматическая.
Способы доставки генов. Частицы, доставляющие фрагмент ДНК, называются векторами.
1. Вирусные - вирусные частицы, лишённые возможности вызывать заболевание, но сохраняют способность проникать в геном клетки и встраиваться в него. В них искусственно вводится нужный ген.
2. невирусные:
белковые - белок как доставляющая частица;
наначастицы - мельчайшие капсулы, представленные фосфолипидами, содержащие в
себе ген. Виды терапевтического переноса генов:
ИНТРО- или ЭКСТРОХРОМОСОМНАЯ КОРРЕКЦИЯ (за пределами хромосом),
Введение системы, продуцирующей нормальный белок взамен патологического - генно- клеточная патология.
3. Блокада аномальных генов - обеспечивается комплиментарной последовательностью ДНК. На 2001г. в мире было 3500 пациентов, получающих ГЕНОТЕРАПИЮ, более 2000 из них по поводу раковых заболеваний. В мире утверждено 320 клинических протоколов ГЕНОТЕРАПИИ. Перспективы: переход от генной к генно-клеточной терапии.
Лекция № 22. Матричные биосинтезы (окончание).
1.ВИДЫ ГЕННЫХ МУТАЦИЙ.
2.БИОХИМИЧЕСКИЙ ПОЛИМОРФИЗМ И ЕГО ПОСЛЕДСТВИЯ.
3.ОБРАТНАЯ ТРАНСКРИПЦИЯ. ВЛИЯНИЕ АНТИБИОТИКОВ И ТОКСИНОВ НА 4.БИОСИНТЕЗ БЕЛКА.
5.ТЕЛОМЕРЫ И ТЕЛОМЕРАЗЫ. ИХ РОЛЬ В РАЗВИТИИ ОПУХОЛЕВОГО РОСТА.
ВИДЫ ГЕННЫХ МУТАЦИЙ.
ДЕПУРИНИЗАЦИЯ - потеря или замена пуриновых оснований. За 70 лет теряется до 40%. С меньшей скоростью происходит ДЕЗАМИНИРОВАНИЕ и ДЕПИРИМИДИРОВАНИЕ. Белок Р-53 метит повреждённый участок ДНК. Если он работает, то включаются механизмы репарации. Если этого белка нет, то наступают мутации - нерепарированные изменения первичной структуры ДНК. Генные мутации затрагивают небольшой участок ДНК в пределах гена. Виды генных мутаций:
1. замена:
а) одного нуклеотида на другой без изменения смысла кода
ААГ ААА (ЛИЗИН)
КВАЗИДУПЛЕТНОСТЬ - смысловую нагрузку несут в коде только два нуклеотида
б) замена одного нуклеотида на другой с изменением смысла кодона - МИССЕНС-МУТАЦИЯ
в) замена с образованием терминирующего кодона- НОНСЕНС-МУТАЦИЯ.
2. вставка:
а) вставка одного или нескольких кодонов без сдвига рамки считывания. В результате образуется белок, удлинённый на одну или несколько аминокислот.
б) вставка 1, 2 (но не кратного 3) нуклеотидов. Происходит сдвиг рамки считывания. В результате синтезируется белок со случайной аминокислотной последовательностью.
3. ДЕЛЕЦИЯ (выпадение):
а) выпадение одного или нескольких кодонов без сдвига рамки считывания. Образуется полипетид, укороченный на одну или несколько аминокислот.
б) выпадение одного или нескольких (но не кратное 3) нуклеотидов со сдвигом рамки считывания. Образуется ПОЛИПЕПТИД со случайной последовательностью аминокислот . По биологическим последствиям все мутации делятся на:
1. Нейтральные. В результате образуются белки с неизменёнными свойствами. Может произойти замена одной аминокислоты на другую, эквивалентную по свойствам (ВАЛ — АЛА, АСП — ГЛУ). Последствия не проявляются.
2. «Молчащие». В результате одна аминокислота заменяется на другую близкую по свойствам, но не эквивалентную. Свойства белка близки, но не совсем идентичные. Эта мутация в физиологических условиях может никак не проявиться, а в экстремальной ситуации может выявиться (обуславливает предрасположенность к заболеваниям)
3. Патогенные. Например, в гемоглобине А ГЛУТАМИНОВАЯ кислота даёт дополнительный отрицательный заряд, что способствует устойчивости белка в растворе. При замене её на ВАЛ устойчивость утрачивается и гемоглобин выпадает в осадок.
4. Полезные. Организм получает преимущества для выживания. Играют роль в эволюции
организмов.
БИОХИМИЧЕСКИЙ ПОЛИМОРФИЗМ И ЕГО ПОСЛЕДСТВИЯ.
В результате мутаций могут возникнуть варианты разных генов или одного и того же гена. Если они летальные, то наступает АПОПТОЗ. Если эти варианты не летальные, то они наследуются. Формируется генотипическая гетерогенность, следовательно, фенотипическая неоднородность.
Следствием генотипической гетерогенности является ПОЛИМОРФИЗМ белков -существование одного и того же белка в разных формах. Например, насчитывается около 700 вариантов гемоглобина. Каждый человек неповторим, биохимически уникален.
ПОСЛЕДСТВИЯ БИОХИМИЧЕСКОГО ПОЛИМОРФИЗМА.
1. Лежит в основе развития предрасположенности к заболеваниям (атеросклероз)
2. Лежит в основе непереносимости пищевых компонентов (лактозы)
3. Лежит в основе непереносимости лекарственных средств. ВЛИЯНИЕ АНТИБИОТИКОВ И ТОКИНОВ НА БИОСИНТЕЗ БЕЛКА.
Антибиотики - продукты жизнедеятельности микроорганизмов, образуемые с целью гибели других микроорганизмов. Антибиотики поражают самые важные процессы - матричные биосинтезы.
1. Вызывают структурную модификацию матрицы.
2. Вызывают модификацию РИБОСОМ.
3. Инактивируют ферменты.
4. Действуют на процессы биосинтеза белка у микроорганизмов, обычно на этапе трансляции. СТРЕПТОМИЦИН нарушает инициацию трансляции. КИРРОМИЦИН препятствует высвобождению ФЭ трансляции. ЭРИТРОМИЦИН и ХЛОРАМФЕНИКОЛ ингибируют ПЕПТИДИЛТРАНСФЕРАЗУ.
Антибиотики на процессы трансляции у эукариот не влияют.
Токсины - вещества, действующие на процессы трансляции у эукариот.
Дифтерийный токсин ингибирует ФЭ и ТРАНСЛОКАЦИЮ. РИЦИН ингибирует большую единицу РИБОСОМ.
ОБРАТНАЯ ТРАНСКРИПЦИЯ. УОТСОН и КРИК считали, что информация может идти только в одном направлении: ДНК
РНКбелок.
В 1970г. американский учёный ТЕМЕН открыл ревертазу (ОБРАТНУЮ ТРАНСКРИПТАЗУ), обосновав возможность передачи информации в обратном направлении. Сейчас этот фермент называется РНК-зависимой ДНК-полимеразой. Он имеется у всех РНК содержащих вирусов (лейкоз мышей, ВИЧ).
Интеграция - внедрение вирусной ДНК в ДНК хозяина. При репликации последней образуется РНК вируса. Она покрывается оболочкой, выходит из клетки хозяина и начинает поражать другие клетки.
Многие вирусы являются ОНКОГЕННЫМИ. Они живут в ДНК человека. Онкогены несут информацию о белках опухолевого роста. Они определённое время неактивны -ПРОТООНКОГЕНЫ.
ТЕЛОМЕРЫ И ТЕЛОМЕРАЗЫ. ИХ РОЛЬ В РАЗВИТИИ ОПУХОЛЕВОГО РОСТА.
ТЕЛОМ ЕРЫ - это специализированные кольцевые районы хромосомной ДНК, состоящие из многократно повторяющихся НУКЛЕОТИДНЫХ последовательностей. При каждой репликации их количество уменьшается.
ТЕЛОМЕРАЗЫ - ферменты, синтезирующие теломеры. По свойствам представляют РНК -зависимую ДНК-полимеразу. В своей структуре содержат участок РНК, по которому синтезируется ДНК.
Количество теломер определяет длительность жизни. Если теломераза активна, то клетка бессмертна.
В 1960г. Л. ХЕЙФЛИК открыл феномен - лимит ХЕЙФЛИКА, который заключается в том, что клетка делится ограниченное количество раз, и оно зависит от возраста. У новорожденных клетка делится 80 - 90 раз, в 70лет 20 -30 раз. В среднем у взрослого человека клетки делятся 50 -60 раз. Это связано с эффектом «КОЦЕВОЙ НЕДОРЕПЛИКАЦИИ». Её существование предложил ОНОВНИКОВ.
При каждом раунде репликации одна нить ДНК укорачивается из-за удаления ПРАЙМЕРА. Если есть ТЕЛОМЕРЫ и ТЕЛОМЕРАЗА, то нить ДНК достраивается, если их нет, то с каждым моментом ДНК становится короче. Все соматические клетки содержат 10000-15000 пар нуклеотидов и отсутствует ТЕЛОМЕРАЗНАЯ активность. Клетки с теломеразной активностью бессмертны. Обнаружено, что в раковых клетках активируется теломераза и постоянно количество теломер. Макрофаги, лейкоциты, половые клетки, стволовые клетки костного мозга содержат теломеразную активность.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ОНКОГЕНЕЗА.
Рак - это болезнь генов. Поражение клеточных структур связано или с потерей, повреждением какого-то гена, активацией какого-то гена, или внесением его извне.
ОНКОГЕНЫ - это часто нормальные гены, функционирующие в эмбриональном периоде, но с возрастом утратившие свою активность. Механизм активации - мутации. В настоящее время насчитывается 100 онкогенов. Открыты и антионкогены. ОНКОГЕНЫ и АНТИОНКОГЕНЫ возникают среди генов, которые кодируют белок - передатчик сигналов. Более 100 мутаций ведёт к развитию опухоли. У 50% опухолей содержится мутация гена белка Р-53, участвующего в процессах репарации ДНК. Его отсутствие приводит к накоплению мутаций.
Лекция № 23. Сигнальные молекулы.
Основные задачи регуляции метаболизма и клеточных функций:
1.внутриклеточное и межклеточное согласование клеточных процессов,
2.исключение «холостых» циклов метаболизма, продукты которых не востребованы,
3.эффективное образование и использование энергии,
4.поддержание гомеостаза,
5.приспособление организма к условиям окружающей среды.
Регуляция метаболизма: внутренняя и внешняя. Внутренняя регуляция - управляющие сигналы образуются и действуют внутри одной и той же клетки (само-регуляция). Внешняя регуляция - управляющие сигналы поступают к клетке из внешней среды. Внутренняя регуляция осуществляется путём изменения активности ферментов активаторами или ингибиторами. Особенно активно при внутренней регуляции работают аллостерические ферменты (ФОСФОРИЛАЗА). Внешняя регуляция обеспечивается специализированными сигнальными молекулами - эндогенные химические соединения, которые в результате взаимодействия с ферментами, обеспечивают внешнее управление биохимическими процессами в клетках-мишенях.
Клетка-мишень - это клетка, имеющая специализированные воспринимающие рецепторы для данного вида сигнальных молекул. Сигнальные молекулы являются лигандами для рецепторов клеток-мишеней.
Характерные особенности сигнальных молекул.
1.малый период жизни (динамичность, оперативность регуляции).
2.высокая биологическая активность (действие развивается при очень низких концентрациях).
3.уникальность, неповторимость действия. Эффекты одного типа сигнальных молекул не могут быть смоделированы другим. Это обеспечивает разнообразие регуляции.
4.наличие эффекта усиления (одна сигнальная молекула может усиливать каскады биохимических реакций).
5.один вид сигнальных молекул может иметь несколько клеток-мишеней.
6.реакция разных клеток-мишеней на одну и ту же сигнальную молекулу отличается (объясняется многообразием рецепторов и их своеобразием).
Способы внешнего управления клетками-мишенями.
1.Управление экспрессией генов (биосинтез белков и ферментов). Это медленный способ регуляции.
2.Управление активностью ранее синтезированных белков:
- управление активностью ферментов, следовательно, изменение биохимических процессов;
- изменение активности функциональных белков, следовательно, прямое изменение функции клеток. Например, влияние сигнальных молекул на ионный канал вызывает деполяризацию мембраны и формирование потенциала действия. Чрезвычайно быстрый эффект.
Виды регуляторных эффектов сигнальных молекул:
1.Эндокринный. Сигнальные молекулы поступают с током крови из желудочно-воротной системы к клеткам-мишеням. Так действует большинство гормонов.
2.Паракринный - сигнальные молекулы вырабатывают в пределах одного органа или участка ткани. Таким образом действуют большинство факторов роста.
3.Аутокринное - сигнальные молекулы действуют на клетку, их образовавшую.
КЛАССИФИКАЦИЯ СИГНАЛЬНЫХ МОЛЕКУЛ.
1)По химической природе:
1.Органические (производные аминокислот, жиров). СТЕРОИДЫ, ПРОСТОГЛАНДИНЫ.
2.Неорганические - 1992г. МОНООКСИДАЗОТА (NO). 2)По физико-химическим свойствам:
1.Липофобные - не могут проникать через мембрану клетки. Они растворимы в воде.
2.Липофильные - растворяются в жирах. Свободно проникают через ЦПМ и действуют на рецепторы внутри клетки. Например, производные холестерина: МИНЕРАЛО-, ГЛЮКОКОРТИКОИДЫ, ЭСТРОГЕНЫ, АНДРОГЕНЫ, ЙОДТИРОНИНЫ, NO.
3)По биологическому принципу:
1.Гормоны - сигнальные молекулы с выраженным эндокринным эффектом.
2.Цитокины - факторы роста. Это сигнальные молекулы белковой природы, которые выделяются неспециализированными клетками организма. Они регулируют рост, дифференцировку, пролиферацию соседних клеток. Действие пара- и аутокринно.
3.Нейромедиаторы сигнальные молекулы, вырабатывающиеся нервными клетками, координирующие работу нейронов и управление периферическими тканями. Их действие связано с влиянием на ионные каналы. Они изменяют их проницаемость и вызывают деполяризацию мембраны.
МЕХАНИЗМ ДЕЙСТВИЯ СИГНАЛЬНЫХ МОЛЕКУЛ.
Механизм действия ОРГАНИЧЕСКИХ ЛИПОФИЛЬНЫХ сигнальных молекул.
1.взаимодействие с внутриклеточными рецепторами,
2.регуляторный эффект связан с изменением количества белков в результате влияния на экспрессию генов (действуют через геном),
3. биологическое действие продолжительное, но развивается медленно в пределах часов. Факторы, необходимые для их действия:
- сигнальные молекулы,
- воспринимающий внутриклеточный рецептор, связанный с шапероном.
- участок ДНК, регулирующий транскрипцию определённых генов (ЭНХАНСЕР, САЙЛЕНСЕР),
- белок синтетический аппарат клетки. Этапы действия:
1. проникновение внутрь клетки,
2. связывание с внутриклеточным рецептором,
3. освобождение шаперона (запуск таймера действия),
4. взаимодействие комплекса сигнальных молекул с регуляторными элементами ДНК, изменение биосинтеза некоторых белков, в том числе и их ферментов.
5. изменение метаболизма и клеточных функций.
Механизм прекращения действия органических липофильных сигнальных молекул:
1. разрушение рецепторов, обусловленное отсутствие защиты со стороны шаперона,
2. протеолиз синтезированных белков,
3. разрушение факторов транскрипции, участвующих в передаче сигналов к структурному гену.
По перечисленному механизму действуют СТЕРОИДНЫЕ гормоны и ЙОДТИРОНИН.
Механизм действия ЛИПОФОБНЫХ сигнальных молекул:
1. взаимодействие с поверхностными рецепторами,
2. сигнал передаётся от рецептора внутрь клетки (ТРАНСДУКЦИЯ) и устанавливается с помощью внутриклеточных регуляторов: высоко- и низкомолекулярных.
Высокомолекулярные регуляторы - это регуляторные белки. Они опосредуют действие сигнальной молекулы внутри клетки.
Низкомолекулярные регуляторы небелковой природы. Его называют второй МЕССЕНДЖЕР (первый МЕССЕНДЖЕР - сама сигнальная молекула) - полноправный представитель сигнальной молекулы внутри клетки. Это ионы кальция, ДИАЦИЛГЛИЦЕРОЛ, ИНОЗИТОЛТРИФОСФАТ, цАМФ и цГМФ.


3. биологическое действие обусловлено сочетанием регуляции активности ранее синтезированных белков и регуляция экспрессии генов. Регуляторный эффект двухфазный:
- первая фаза быстрая, но не продолжительная, она обеспечивает изменение структуры и активности ферментов;
- вторая фаза медленная за счёт изменения количества ферментов.
МЕХАНИЗМ ДЕЙСТВИЯ, ЗАВИСИМЫЙ ОТ ЦАМФ.
Факторы, необходимые для этого:
1. растворимая в воде сигнальная молекула;
2. поверхностные рецепторы клетки-мишени;
3. внутриклеточный трансдуктор G-белок. Состоит из 3 единиц: альфа, бета, гамма.
G-белок может быть ингибирующий и активирующий. Он находится в непосредственной близости к рецептору. При взаимодействии сигнальной молекулы с рецептором он активируется, его активность обусловлена альфа единицей. Она оказывает влияние на внутриклеточный фермент - АДЕНИЛАТЦИКЛАЗУ (превращает АТФ в ЦАМФ). Альфа-S повышает активность. альфа-I понижает активность G-белка. G-белок способен присоединять ГДФ или ГТФ. Альфа-единица активна, когда связана с ГТФ.
4. АДЕНИЛАТЦИКЛАЗА(АЦ);
5. ПРОТЕИНКИНАЗА-А ЦАМФ-зависимая. Она катализирует реакцию фосфорилирования белков. В результате белки изменяют активность;
6. Регуляторные элементы ДНК (ЭЕХАНСЕР и САЙЛЕНСЕР);
7. ФОСФОДИЭСТЕРАЗА - разрушает ЦАМФ;
8. ФОСФАТАЗА - дефосфорилируют белки;
9. Белок-синтетический аппарат клетки.
Этапы, стимулирующие ЦАМФ -зависимый механизм:
1. взаимодействие сигнальной молекулы с рецептором;
2. изменение конформации G-белка;
3. замена ГДФ на ГТФ в альфа-S единице G-белка;
4. альфа-S ГТФ активирует АЦ;
5. АЦ синтезирует ЦАМФ;
6. ЦАМФ активирует ПРОТЕИНКИНАЗУ-А (ПКА);
7. ПКА фосфорилирует белки и белковые факторы транскрипции, изменяющие активность и количество ферментов;
8. Прекращение действия, если рецептор освободился - альфа-5-С-ГТФ-азная активность:
альфа-единица может разрушать ГТФ - это таймер действия.
- ФОСФОДИЭСТЕРАЗА - разрушает ЦАМФ.
- ФОСФАТАЗА - ДЕФОСФОРИЛИРУЕТ белки. Этапы, ингибируюшие ЦАМФ -зависимый механизм:
С первого по третий те же самые этапы, отличие в G-белке (альфа-I единица). Четвёртый этап - связывание ГТФ с альфа-I единицей будет ингибировать АЦ. Ингибируюший механизм противодействует и прекращает эффекты ЦАМФ в клетке.
ЦГМФ -зависимый стимулирующий механизм действия.
Рецептор встроен в мембрану клетки и связан с ферментом ГУАНИЛАТЦИКЛАЗОЙ (ГЦ). При присоединении сигнальной молекулы ГЦ активируется и катализирует реакцию ГТФ * ЦГМФ. Последний активирует ПРОТЕИНКИНАЗУ-G (ПКО), а она запускает реакцию фосфорилирования белков (ферментов и факторов транскрипции).
ТИРОЗИНКИНАЗНЫЙ МЕХАНИЗМ ДЕЙСТВИЯ.
ТИРОЗИНКИНАЗА - фермент, фосфорилирующий белки. По этому механизму действует большинство факторов роста и пролиферации. Рецептор представлен дуплетом, который после взаимодействия с сигнальной молекулой ДИМЕРАЛИЗУЕТСЯ, что запускает АУТОФОСФОРИЛИРОВАНИЕ остатков тирозина в центральной части рецептора. Наблюдается отсутствие МЕССЕНДЖЕРОВ. Рецептор оказывает влияние на ферментные системы клетки. Он может поступать в ядро вместе с сигнальными молекулами и усиливать транскрипцию генов и изменять митотическую активность клетки.
Механизм действия НЕОРГАНИЧЕСКИХ ЛИПОФОБНЫХ сигнальных молекул (NO). NO беспрепятственно проникает через мембрану клетки. Это короткоживущая молекула, образующаяся в организме под действием NO-СИНТАЗЫ из аминокислоты АРГ. В клетке NO взаимодействует с ГЦ, активирует её, что вызывает накопление в клетке ЦГМФ. который активирует ПКО, и развивается клеточный ответ по выше рассмотренному механизму.
Эффекты NO:
1. фактор расширения сосудов;
2. регулятор АПОПТОЗА (запрограммированной клеточной смерти);
3.NO является свободным радикалом, поэтому способен влиять на процесс перекисного окисления жиров и регулировать функции МИТОХОНДРИЙ;
4. является ИММУНОМОДУЛЯТОРОМ.

Лекция № 24. Сигнальные молекулы (продолжение).
1.РОЛЬ ГИПОТАЛАМУСА В РЕГУЛЯЦИИ ОБМЕНА ВЕЩЕСТВ.
2.ГОРМОНЫ ГИПОФИЗА.
ГИПОТАЛАМУС является компонентом и своеобразным «выходным каналом» лимбической системы. Это отдел промежуточного мозга, контролирующий различные параметры гомеостаза. С одной стороны он связан с ЦНС (центры ВНС), с другой - с гипофизом через нервные проводники и особую портальную систему.
ГИПОТАЛАМУС участвует во многих функциях нервной регуляции, выделяя НЕЙРОТРАНСМИТТЕРЫ и НЕЙРОМОДУЛЯТОРЫ. а также регулирует эндокринную систему. Внешние или внутренние факторы среды
ЦНС
ГИПОТАЛАМУС
АДЕНОГИПОФИЗ
ТРОЙНЫЕ ГОРМОНЫ
ИПОФИЗЗАВИСИМЫЕ
ЖВС ГОРМОНЫ ЖВС
летки-мишени
Физиологический или биохимический ответ.
Функция ГИПОТАЛАМУСА не всегда строго зависима от ЦНС.

|
Гормоны ГИПОТАЛАМУСА |
Сокращение |
Гормоны гипофиза |
|
ЛИБЕРИНЫ: КОРТИКОТРОПИНРЕЛИЗИНГ ГОРМОН ТИРЕОТРОПИНРЕЛИЗИНГ ГОРМОН ГОНАДОТРОПИНРЕЛИЗИНГ ГОРМОН ГОРМОН РОСТА РЕЛИЗИНГ ГОРМОН |
КРГ
ТРГ
ГнРГ
СтГ-РГ
|
АКТГ
ТТГ
ФСГ и ЛГ
СТГ |
|
СТАТИНЫ: ГОРМОН ИНГИБИРУЮЩИЙ ОСВОБОЖДЕНИЕ ГОРМОНА РОСТА (СОМАТОСТАТИН) ГОРМОН ИНГИБИРУЮЩИЙ ОСВОБОЖДЕНИЕ ПРОЛАКТИНА |
СС ПИГ |
ГР ПРЛ |
Многие из факторов ГИПОТАЛАМУСА образуются в периферических тканях (ТРГ, КРГ, СС). СС больше всего в D-клетках ПЖЖ. Действуют через ЦАМФ (АДЕНИЛАТЦИКЛАЗУ). Гормоны ГИПОТАЛАМУСА стимулируют транскрипцию генов гормонов гипофиза.
ГИПОФИЗ. В нём выделяют три доли:
1. Передняя
2. Промежуточная
АДЕНОГИПОФИЗ
(выделяет тропные гормоны)
3. Задняя - НЕЙРОГИПОФИЗ.
ТРОПНЫЕ гормоны можно разделить на 3 группы в зависимости от их химической природы:
1. простые белки;
2. ГЛИКОПРОТЕИНЫ;
3. ПЕПТИДЫ, образующиеся из предшественников ПРООПИОМЕЛАНОКОРПИНА (ПОМК).
ПРОСТЫЕ БЕЛКИ.
К ним относятся: ГР, ПРЛ, ПЛАЦЕНТАРНЫЙ ХОРИОНИЧЕСКИЙ СОМАТОМАММОТРОПИН (ХС). Состоят из 191 - 198 аминокислот. ГР близок по строению с ХС на 85%, ПРЛ - на 35%.Среди этих гормонов наибольшую концентрацию имеют ГР. Секреция ГР эпизодическая. Максимальная секреция в момент засыпания или перед пробуждением. На секрецию влияют стресс, голод, физические упражнения. ГР сберегает глюкозу для тканей.
Он повышает ЛИПОЛИЗ, повышается концентрация жирных кислот, повышает
транспорт в клетку повышает концентрацию аминокислот повышает
ГЛЮКОНЕОГЕНЕЗ повышение глюкозы мозг.
ГР действует через инсулиноподобный фактор роста (ИФР), близкий по строению к проинсулину. Выделяют ИФР 1 и ИФР 2, но главным посредником действия ГР является ИФР 1. Влияние ГР на обмен веществ:
1. Стимуляция синтеза белка: (через ИФР I.)_
- повышение транспорта аминокислот в клетки,
- повышение интенсивности процесса трансляции,
- повышение синтеза РНК и ДНК
2. Влияние на углеводный обмен:
- повышение глюкозы (уменьшение утилизации глюкозы периферическими тканями, стимуляция процессов ГЛЮКОНЕОГЕНЕЗА),
3. Влияние на минеральный обмен (через ИФР1) - задержка кальция, фосфора, магния в организме,
4. Влияние на липидный обмен (не через ИФР 1):
повышение ЛИПОЛИЗА, повышение окисления ВЖК.
ГИПОСЕКРЕЦИЯ в детском возрасте приводит к нарушению синтеза белка, понижению минерализации костной ткани, задержке роста и развитию карликовости в нескольких вариантах.
ГИПЕРСЕКРЕЦИЯ гормона роста в детском возрасте приводит к развитию гигантизма, во взрослом развитию акромегалии. Нарушение синтеза гормона роста на умственную деятельность не влияет.
ПРЛ состоит из 198 аминокислот. Синтезируется при беременности и лактации. Функция заключается в инициации и поддержании лактации.
ХС проявляет ЛАКТОГЕННУЮ и МОТЕОТРОПНУЮ активность. Функция заключается в регуляции синтеза молока, развития желтых тел и развития плода.
ГЛИКОПРОТЕИНЫ. К ним относятся ТТГ, гонадотропины (ЛГ, ФСГ, ПЛАЦЕНТАРНЫЙ ХОРИОНИЧЕСКИЙ ГОНАДОТРОПИН (ХГЧ)). Действуют через ЦАМФ.
ФСГ:
Женские клетки-мишени - фолликулярные клетки яичника,
Мужские клетки-мишени - клетки СЕРТОЛИ семенников.
В женском организме стимулирует рост фолликулов, подготавливают их к действию ЛГ. В мужском организме индуцирует синтез АНДРОГЕНСВЯЗЫВАЮЩЕГО белка. Стимулирует рост семенных канальцев семенников и сперматогенез.
Л Г:
Женские клетки-мишени - клетки желтых тел, Мужские клетки-мишени - клетки ЛЕЙДЕГА.
Стимулирует образование в женском организме ПРОГЕСТЕРОНА, а в мужском -ТЕСТОСТЕРОНА. Предшественником их является ХОЛЕСТЕРОЛ. ЛГ индуцирует овуляцию у женщин. ХГЧ синтезируется в плаценте и близок по эффектам к ЛГ. Появляется в моче после имплантации зародыша. Его определение служит диагностическим маркером беременности.
ТТГ: Клетки-мишени - ТИРЕОЦИТЫ.
- Повышает синтез ТРИЙОДТИРОНИНА и ТИРОКСИНА.
- Повышает гидролиз белка - ТИРЕОГЛОБУЛИНА.
- Повышает включение йода в структуру ТИРЕОИДНЫХ гормонов.
- Стимулирует синтез белка и нуклеиновых кислот в щитовидной железе (способствует
- повышению количества и росту ТИРЕОИДНЫХ гормонов)
ПЕПТИДЫ СЕМЕЙСТВА ПОМК.
ПОМК - белок, состоящий из 285 аминокислот. Процессинг его происходит в передней и промежуточной доле гипофиза. Из него образуются пептиды: АКТГ. бета ЛИПОТРОПИН. N-концевой пептид. АКТГ:
1. альфа -МЕЛАНОЦИТСТИМУЛИРУЮЩИЙ гормон (МСГ) (промежуточная доля).
2. КОРТИКОТРОПИНОПОДОБНЫЙ ПЕПТИД. Бета-ЛИПОТРОПИН:
1. бета -ЭНДОРФИНЫ: альфа -ЭНДОРФИНЫ, гамма -ЭНДОРФИНЫ.
2. Альфа-ЛИПОТРОПИН.
3. Бета -МСГ.
N-концевой ПЕПТИД: гамма -МСГ.
АКТГ - полипептид, состоящий из 39 аминокислот. Клетки-мишени - клетки коры надпочечников. Стимулирует синтез стероидов коры надпочечников из холестерина через ЦАМФ.
Повышается АДЕНИЛАТЦИКЛАЗА в жировой ткани.
Усиливается ЛИПОЛИЗ ВЖК АЦЕТИЛ-КОА ХОЛЕСТЕРОЛ
СТЕРОИДНЫЕ ГОРМОНЫ.
АКТГ стимулирует процессы пентозного цикла и является поставщиком НАДН2 Повышает синтез белка и нуклеиновых кислот в надпочечниках. ГИПЕРСЕКРЕЦИЯ проявляется в виде синдрома КУШИНГА:
1. повышение пигментации,
2. отрицательный азотистый баланс, выход азота, калия, фосфора.
3. задержка в организме натрия (отёки, повышение АД).
Бета -ЛИПОТРОПИН усиливает липолиз.
Бета -ЭНДОРФИНЫ в гипофизе связаны и неактивны. В гипоталамусе и ЦНС они переходят в активную форму и играют роль нейромедиаторов, трансмиттеров. Понижают чувствительность к боли. Играют важную роль в эмоциональных состояниях. МСГ стимулирует образование меланина.
ГОРМОНЫ ЗАДНЕЙ ДОЛИ ГИПОФИЗА.
1. Вазопрессин (АДГ).
2. Окситоцин.
Образуются в ядрах гипоталамуса. Являются циклическими НАНАПЕПТИДАМИ (9
аминокислот)
АДГ: клетки-мишени - клетки кровяных сосудов, дистальных извитых канальцев и
собирательных трубочек почек. Повышают реабсорбцию воды в почках. Действует через ЦАМФ.
ГИПОСЕКРЕЦИЯ - несахарный диабет.
ОКСИТОЦИН: клетки-мишени - главные миоциты матки, клетки молочных желез. Повышает
сокращение матки и секрецию молока. Используется для стимуляции родовой деятельности.
Лекция № 25.
Сигнальные молекулы (продолжение).
1. ГОРМОНЫ ЩИТОВИДНОЙ И ПАРАЩИТОВИДНОЙ ЖЕЛЕЗ.
2. ГОРМОНЫ ПЖЖ.
3. ГОРМОНЫ НАДПОЧЕЧНИКОВ.
ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ: В щитовидной железе синтезируется и выделяется 3 гормона:
1. ТРИЙОДТИРОНИН (ТЗ).
2. ТЕТРАЙОДТИРОНИН (Т4).
3. КАЛЫДИТОНИН.
Трийодтиронин и тетрайодтиронин синтезируются из аминокислоты тирозина, включённой в состав тиреоглобулина. Он подвергается нормированию с образованием 3-МОНОЙОДТИРОЗИНА, 3,5-ДИЙОДТИРОЗИН, ТЕТРАЙОДТИРОНИН.

Через СООН- и NН2-группы тироксин встроен в структуру тиреоглобулина. Две молекулы тироксина связываются с помощью конденсирующего фермента. Для синтеза тироксина требуется йодид. Превращение йода в йодид происходит путём окисления с помощью ТИРЕОПЕРОКСИДАЗЫ. Синтез тиреоидных гормонов происходит в составе тиреоглобулина. В свободном виде гормоны из железы выделяются в кровь после гидролиза тиреоглобулина с образованием свободных ТЗ и Т4. Этот процесс стимулирует ТТГ гипофиза. Тормозит распад тиреоглобулина ионы йода. т.е. с одной стороны ионы йода необходимы для синтеза тиреоглобулина, с другой стороны при их избытке они тормозят его гидролиз. Поэтому для лечения гипертириоза используют KI. ТЗ и Т4 плохо растворимы в воде и транспортируются с кровью тироксин связывающим глобулином (ТСГ). В клинической практике большой интерес представляет определение свободных ТЗ и Т4.
МЕХАНИЗМ ДЕЙСТВИЯ ТИРЕОИДНЫХ ГОРМОНОВ.
Т.к. они гидрофобны. то легко проникают через мембрану клетки. Рецепторы к ним находятся внутри клетки, главным образом в ядре, небольшая часть в цитоплазме. Сродство рецепторов к ТЗ больше, чем к Т4 в 10 раз, несмотря на то, что образуется больше Т4. Рецептор внутри ядер -негистоновый белок хроматина. ВЛИЯНИЕ НА МЕТАБОЛИЗМ.
1. Повышение поглощения тканями кислорода за исключением мозга, ретикуло-эпителиальной системы и гонад.
2. Повышается активность натрий-калттевой АТФ-азы, при этом уровень АТФ понижается.
3. Повышается синтез белка, положительный азотистый баланс - эффект физиологической концентрации гормонов. При повышении концентрации тиреоидных гормонов синтез белка понижается и наблюдается отрицательный азотистый баланс.
4. Повышает транскрипцию гена гормона роста. НАРУШЕНИЕ ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ.
ГИПОФУНКЦИЯ (ГИПОТИРЕОЗ):
1. У детей возникает кретинизм, проявляющийся:
В отставании в росте;
В отставании в физическом развитии;
В отставании в умственном развитии.
2. У взрослых возникает МИКСДЕМА (слизистый отёк):
понижается распад гликопротеинов; повышение онкотического давления; отёк тканей.
3. ЭНДЕМИЧЕСКИЙ ЗОБ возникает в регионах с недостатком йода в воде и пище. Понижается объём железистой ткани, но увеличивается объём самой железы за счёт соединительной ткани. ГИПЕРФУНКЦИЯ (ГИПЕРТИРЕОЗ) проявляется:
- Повышением потоотделения.
- Экзофтальм.
- Повышение окислительных процессов.
- Повышение температуры тела.
- Похудание и т.д.
КАЛЬЦИТОНИН - полипептид, синтезирующийся К-клетками щитовидной железы. Снижает уровень кальция в крови.
ГОРМОНЫ ПАРАЩИТОВИДНОЙ ЖЕЛЕЗЫ.
Синтезирует ПАРАТИРЕОИДНЫЙ ГОРМОН (паратгормон) ПТГ. Это пептид, состоящий из 84 аминокислотных остатка. Увеличивает уровень кальция в крови за счёт:
1. стимулирует выход кальция и фосфора из костей в кровь,
2. повышает реабсорбцию кальция в почках,
3. стимулирует образование из витамина D3 гормона кальцитриола в почках, который стимулирует всасывание кальция в кишечнике.
ГОРМОНЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ.
ПЖЖ -это смешанная железа, осуществляющая эндокринную и экзокринную функцию. Эндокринная функция осуществляется островками ЛАНГЕРГАНСА. В них образуется 4 гормона четырьмя видами клеток:
1. ИНСУЛИН (70%) синтезируется в В-клетках.
2. ГЛЮКАГОН (25%) синтезируется в А-клетках.
3. СОМАТОСТАТИН (5%) синтезируется в D-клетках.
4. ПАНКРЕАТИЧЕСКИЙ ПОЛИПЕПТИД синтезируется в F-клетках. Инсулин - это пептид, состоящий из 51 аминокислотных остатка в двух цепях.

ПРИНСУЛИН состоит из 84 АК.
Процессинг: ПРОИНСУЛИН ИНСУЛИН + С -ПЕПТИД
В клинике определяется количество инсулина и С-пептида. МЕХАНИЗМ ДЕЙСТВИЯ ИНСУЛИНА.
Клетки-мишени: клетки печени, миоциты, жировой ткани.
Рецепторы находятся на поверхности ЦПМ, т.к. инсулин не может проникать в клетки без связи с
рецептором. Может встречаться явление интернализации рецепторов, т.е. проникновение
комплекса инсулин - рецептор в клетку путём эндоцитоза и последующее его разрушение. Т.о.
количество рецепторов к инсулину снижается. С этим явлением связано возникновение инсулин
независимого сахарного диабета. ВЛИЯНИЕ НА МЕТАБОЛИЗМ:
1. Углеводный обмен:
это единственный гормон, понижающий уровень глюкозы в крови, за счёт повышения транспорта глюкозы через мембрану клеток жировой и мышечной ткани. В печени глюкоза легко проникает в гепатоциты в силу разницы её концентрации в крови и в клетках. Но в печени инсулин повышает активность фермента ГЛКЖОКИНАЗЫ, катализирующего превращение глюкозы в глюкозо-6-фосфат. Повышает активность процессов гликолиза.
Повышает активность фермента ГЛЮКОГЕНСИНТЕТАЗЫ (синтез гликогена). Понижает активность глюкозо-6-фосфатазы, катализирующей превращение глюкозо-6-фосфата в глюкозу.
Инсулин необходим для усвоения глюкозы.
2. ЛИПИДНЫЙ ОБМЕН:
- ингибирует липолиз.
- стимулирует липогенез из углеводов.
3. Обмен белков:
Стимулирует синтез белков.
Стимулирует транспорт аминокислот в клетку.
Тормозит распад белков.
Активизирует процесс транскрипции и трансляции.
Стимулирует пролиферацию клеток за счёт повышения секреции фактора роста фибробластов, тромбоцитарного фактора роста, фактора роста эпидермиса. Дефицит инсулина проявляется в виде сахарного диабета.
1. Инсулин зависимый сахарный диабет связан с нарушением секреции инсулина ( генетические нарушения, поражение ПЖЖ). Встречается у 10%.
2. Инсулин независимый сахарный диабет - уменьшение количества рецепторов к инсулину в результате интернализации. Встречается у 90%.
Предрасполагающий фактор - ожирение. Клинические проявления:
1. голод клеток на фоне ГИПЕРГЛИКЕМИИ,
2. ПОЛИФАГИЯ,
3. ПОЛИДИПСИЯ,
4. ГЛЮКОЗУРИЯ (более 10 ммоль/л),
5. ПОЛИУРИЯ,
6. КЕТОЗ - повышение кетоновых тел (за счёт не окисления АЦЕТИЛ-КОА),
7. КЕТОАЦИДОЗ (диабетическая кома).
ГЛЮКАГОН -полипептид, состоящий из 29 аминокислот.
МЕХАНИЗМ ДЕЙСТВИЯ.
Клетки-мишени: гепатоциты.
Рецепторы лежат на поверхности мембраны клеток. Действует через циклическую АМФ.
Активизирует превращение фосфорилазы В в фосфорилазу А, в результате гликоген
расщепляется с образованием глюкозы.
ВЛИЯНИЕ НА МЕТАБОЛИЗМ:
1. Повышает концентрацию глюкозы в крови,
2. Усиливает процессы глюконеогенеза,
3. Повышает интенсивность липолиза.
СОМАТОСТАТИН - пептид, состоящий из 14 аминокислот. Подавляет образование других
гормонов ПЖЖ.
Функция ПАНКРЕАТИЧЕСКОГО ПОЛИПЕПТИДА недостаточно изучена.
ГОРМОНЫ НАДПОЧЕЧНИКОВ.
1. Мозговой слой
А) Адреналин (гормон) образуются из аминокислоты тирозина.
В) Норадреналин (нейромедиатор).


Это гормоны стресса. Их действие близко.
МЕХАНИЗМ ДЕЙСТВИЯ.
Клетки мишени: клетки печени, скелетных мышц, сердца, слюнных желез, матки.
Рецепторы находятся на поверхности мембран. Посредником является ЦАМФ, которая
активизирует протеинкиназу.

ВЛИЯНИЕ НА МЕТАБОЛИЗМ.
1. Повышает уровень глюкозы в крови.
2. Адреналин действует не только на печень, но и на мышцы, где из глюкозы образуется молочная кислота.
3. Усиливают липолиз.
4. Повышается содержание не этерефицированных жирных кислот.
5. Повышает АД, частоту сердечных сокращений и т.д.
2. Корковый слой (более 30 стероидов)
1. ГЛЮКОКОРТИКОИДЫ (кортикостерон, кортизол, кортизон).

В организме человека наибольшую роль играет кортизол - производное ЦИКЛОПЕНТАНПЕРГИДРОФЕНАНТРЕНА
2. МИНЕРАЛОКОРТИКОИДЫ (альдостерон).

МЕХАНИЗМ ДЕЙСТВИЯ.
Механизм действия цитозольный (проникают через мембрану). Рецепторы находятся внутри клетки. Действуют по принципу гормон ген белок. В печени, почках усиливают синтез белков; в лимфатической ткани, соединительной ткани, скелетных мышцах - тормозят синтез белка.
ВЛИЯНИЕ НА МЕТАБОЛИЗМ.
1. Глюкокортикоиды:
- повышают глюконеогенез,
- повышают синтез гликогена,
- усиливают липолиз,
- усиливают образование кетоновых тел,
- понижают синтез антител, следовательно, противовоспалительное противоаллергическое действие.
2. Минералокортикоиды:
- повышают транспорт натрия через мембрану,
- задерживают натрий, хлор в организме,
- понижают содержание калия в организме.
Недостаточность гормонов коры ведёт к АДДИСОНОВОЙ болезни:
- пигментация кожи,
- ГИПЕРКАЛИЕМИЯ,
- ГИПОТОНИЯ,
- Понижение резистентности к стрессовым воздействиям.
-
ПОНЯТИЕ О ВИТАМИНАХ, КЛАССИФИКАЦИЯ.
-
ПОНЯТИЕ ОБ АВИТАМИНОЗАХ, ГИПО- И ГИПЕРВИТАМИНОЗАХ.
-
ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ A, D.
Возникновение научной витаминологии относят к 19 в. Французский патолог МАЖАНДИ впервые установил, что для обеспечения нормального роста молодых животных недостаточно только основных поддерживающих жизнь веществ. Русский врач ЛУНИН в эксперименте на животных установил, что животные, которых кормили казеином, жирами, лактозой, водой и минеральными солями болели и погибали, в отличие от животных, получавших свежее молоко.
В 1911г. учёный ФУНД выделил и кристаллизовал азотсодержащее вещество, которое вылечивало экспериментальную бери-бери. Это вещество он назвал ВИТАМИНОМ (амином жизни).
Витамины - это низкомолекулярные органические соединения различного строения, синтез которых в организме отсутствует или ограничен. Особенности витаминов:
-
не синтезируются в организме или синтезируются в недостаточном количестве;
-
не выполняют пластической функции, т.е. не являются структурным компонентом клеток;
-
не выполняют энергетической функции;
-
выполняют специфические функции, которые не могут быть восполнены другими соединениями, т.е. это вещества, которые функционально нельзя ничем заменить;
-
при дефиците витаминов в организме развивается патологическое состояние с характерными клиническими признаками;
-
витамины - это метаболиты, суточная потребность в которых выражается в миллиграммах, микрограммах или международных единицах (ME).
КЛАССИФИКАЦИЯ ВИТАМИНОВ.
В зависимости от растворимости витамины делятся на жирорастворимые (A, D, E, К) и водорастворимые (РР, С, В1, В2, ВЗ, В6, В10, В12, Н)/ Витамин подобные вещества: инозит, парааминобензойная кислота, холин, липолевая кислота.
НОМЕНКЛАТУРА: Каждый витамин имеет:
-
буквенное название: аскорбиновая кислота - вит.С; ретинол - вит.А.
-
химическое название: вит.В1 -тиамин.
-
Клиническое название, которое формируется из клинической картины патологического состояния, которое развивается при дефиците витамина в организме с приставкой «анти»: Вит.D - антирахитический;
Вит.С - антискорбутный (скорбут- цинга).
ФУНКЦИИ ВИТАМИНОВ В ОРГАНИЗМЕ.
1. Выделяют группу энзимовитаминов - это предшественники коэнзимов или простетических групп ферментов:
Функциональное производное вит.РР: НАД и НАДФ. Функциональное производное вит.В2: ФМН и ФАД.
-
Гормоновитамины или предшественники гормонов: последовательная активация вит.DЗ приводит к образованию кальцитриола.
-
Редоксвитамнны или витамины- антиоксиданты - это вещества, которые препятствуют развитию процессов свободно-радикального окисления. Это природные оксиданты: Е, С, А.
4. Участвуют в синтезе медиаторов (вит.С - серотонин), стероидных гормонов. АВИТАМИНОЗ - это патологическое состояние, которое развивается в результате отсутствия
витаминов организме, характеризуется чёткой клинической симптоматикой.
ГИПОВИТАМИНОЗ - патологическое состояние, связанное с недостатком витаминов в организме. В зависимости от причины гиповитаминоз может быть:
-
Первичный (ЭКЗОГЕННЫЙ), связанный с дефицитом витаминов в употребляемой пище.
-
Вторичный, связанный с причинами эндогенного характера:
нарушение всасывания витаминов в ЖКТ;
недостаточный синтез витаминов микрофлорой кишечника (вит.В и вит.К), например,
при дисбактериозе; наличие паразитарной инвазии (особенно в детстве), которые используют питательные вещества человека;
поступление в пищу пищевых или лекарственных антивитаминов, которые препятствуют активации и всасыванию витаминов; нарушение активации при усвоении витаминов в организме при патологии печени и почек; повышенные потери витаминов; относительная недостаточность из-за повышенной нагрузке, беременности, кормлении грудью и другие состояния, требующие повышенного количества витаминов. Гиповитаминозам способствуют:
-
высококалорийное питание,
-
преобладание консервированных продуктов в рационе, рафинированных или высокоочищенных продуктов,
-
малое движение (ГИПОДИНАМИЯ).
Состояние недостаточной витаминной обеспеченности патологии и симптомов гиповитаминоза нет, но недостаток в витамине уже проявляется. Характеризуется следующими признаками: сонливость, утомляемость, понижение работоспособности, повышение заболеваемости, слабость. Это свидетельствует о том, что следует употреблять комплексы витаминов (не менее 8-9 витаминов в комплексе).
ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ.
Витамин А (ретинол, антиксерофтальмический).
В эту
группу включаются и его производные:
РЕТИНАЛЬ, РЕТИНОЕВАЯ КИСЛОТА и
предшественники -
альфа, бета, гамма -КАРОТИНЫ. Химическая
структура РЕТИНОЛА:
РЕТИНОЛ всасывается в тонком кишечнике вместе с эмульсией жиров и ненасыщенных жирных кислот. При недостаточном выделении желчи всасывание его будет нарушено. В энтероцитах каротины превращаются в ретинол. Наибольшей метаболической активностью обладает бета-каротин. При распаде он даёт две молекулы витамина А. Контролируют процесс превращения каротинов гормоны щитовидной железы. Далее ретинол в составе хиломикрон транспортируется в печень, где создаётся его депо. По мере
необходимости витамин освобождается из депо под действием фермента РЕТИНОЛЭСТЕРАЗЫ и направляется в клетки, где связывается специфическим РЕТИНОЛ-СВЯЗЫВАЮЩИМ белком. Особенно богаты этим белком эмбриональные ткани.
МЕТАБОЛИЧЕСКИЕ ФУНКЦИИ РЕТИНОЛА.
1. Он принимает участие в дифференцировке эпителиальных тканей, а также участвует в регуляции роста и дифференцировке эмбриональных тканей. В эмбриональных тканях
витамин А стимулирует синтез ХОНДРОЭТИНСУЛЬФАТОВ.
2. Витамин А принимает участие в обеспечении фоточувствительности сетчатки глаза. Производное ретинола - 11-ЦИСРЕТИНАЛЬ - вместе с белком ОПСИНОМ формирует зрительный пигмент РОДОПСИН. Под действием фотонов света родопсин расщепляется на ОПСИН и ТРАНС-РЕТИН АЛЬ. При этом возникает потенциал действия, который передаётся в ЦНС и формирует зрительное ощущение. В темноте ТРАНС-РЕТИНАЛЬ превращается изомеразой в ЦИС-РЕТИНОЛ. Под действием фермента алкоголь -ДГ ЦИС- РЕТИНОЛ превращается в ЦИС-РЕТИНАЛЬ. Постоянное осуществление цикла требует восполнения цис-ретиналя из запасов ретинола, но при его дефиците родопсин не может восстанавливаться в темноте. Суточная потребность в витамине А: 1,5-2 мг.
81.
Продукты богатые витамином А: рыбий жир, печень тунца, палтуса, полярных млекопитающих,
трески, яичный желток, сливочное масло. Продукты богатые каротином: красно-оранжевые овощи и плоды (облепиха, морковь, курога, томаты), некоторые зелёные (петрушка, лук порей).
Для витамина А описан как гипервитаминоз, так и гиповитаминоз.
ГИПОВИТАМИНОЗ проявляется:
1. нарушение дифференцировки эпителия - кератинизация.
Например, ороговение эпителия выводных протоков слёзных желез ведёт к сухости коньюктивы и роговицы - КСЕРОФТАЛЬМИЯ, и к воспалительному размягчению роговицы - КЕРАТОМАЛЯЦИЯ.
2. нарушение восприятия света и сумеречного зрения - ГЕМЕРОЛАПИЯ («куриная слепота»). При хроническом гиповитаминозе вит.А развивается дистрофия и необратимая дегенерация палочек.
ГИПЕРВИТАМИНОЗ - это состояние, связанное с избытком витамина в организме человека. Растворимые в воде витамины не накапливаются в организме, их избыток выводится из организма с мочой. Жирорастворимые витамины депонируются, причём их депо включает печень и жировая ткань. Запас вит.А в печени на 2-3 года. Чаще гипервитаминоз возникает при передозировке витамином или самостоятельном лечении. Тяжелый гипервитаминоз А может привести к некрозу клеток печени и почечного эпителия.
Витамин D( антирахитический).
Включает несколько витаминов: D2 - ЭРГОКАЛЬЦИФЕРРОЛ (производное ЭРГОСТЕРИНА),
D3 - ХОЛЕКАЛЬЦИФЕРРОЛ (производное холестерина). Химическая структура витамина D3:

Витамин D поступает в организм и направляется в печень, где гидроксилируется и образуется 25-ГИДРОКСИХОЛЕКАЛЬЦИФЕРРОЛ. В почках происходит повторное гидроксилирование и образуется 1,25-ДИГИДРОКСИХОЛЕКАЛЬЦИФЕРРОЛ (КАЛЬЦИТРИОЛ). Это и есть метаболическое активное производное витамина D.
МЕТАБОЛИЧЕСКИЕ ФУНКЦИИ КАЛЬЦИТРИОЛА:
-
Стимулирует всасывание кальций и фосфор из кишечника, синтез кальций -связывающего белка в кишечнике, а также реабсорбцию кальция и фосфора в почках.
-
Повышает уровень кальция и фосфора в плазме крови.
-
Способствует минерализации костной ткани.
-
Стимулирует синтез кальций -связывающего белка в костной ткани.
-
Способствует созреванию остеокластов.
ГИПОВИТАМИНОЗ витамина D в детском возрасте приводит развитию рахита.
-
Понижается уровень кальция и фосфора в крови (ГИПОКАЛЬЦИЕМИЯ и ГИПОФОСФОРЕМИЯ).
-
Нарушается минерализация костной ткани. Кости становятся более податливыми из-за понижения резорбции избыточного хряща и остеоида. Формируются специфические деформации черепа, рахитические чётки и браслетки. По мере развития моторных навыков ребёнка формируются искривления позвоночника и конечностей. Задерживается закрытие родничков и прорезывание зубов.
-
Нарушается деятельность ЦНС и развивается мышечная гипотония.
У взрослых гиповитаминоз приводит к ОСТЕОПОРОЗУ и ОСТЕОМАЛЯЦИИ.
Суточная потребность в витамине D: у взрослых - 2,5 мг (100 ME); у детей и беременных -
12,5мг (500 ME).
82.
Лекция № 27.
Витамины (продолжение).
1 ВИТАМИН К и ВИТАМИН Е.
2 ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ.
Витамин К (АНТИГЕМОРРАГИЧЕСКИЙ - предупреждает кровоточивость). Изоформы:
-
К1 -ФИЛЛОХИНОН.
-
К2-МЕНАХИНОН.
-
КЗ - НАФТОХИНОН.
Метаболические функции витамина К.
1. Является КОФАКТОРОМ карбоксилирования ГЛУ в протромбине, т.е. необходим для его поевпашения в тромбин.

2. Участвует в превращении ПРОКОНВЕРТИНА в КОНВЕРТИН
Суточная потребность в витамине К - 1мг. Он синтезируется микрофлорой кишечника.
Продукты богатые витамином К: шпинат, капуста, крапива, томат, картофель, печень, яйца,
молоко, мука из гниющей рыбы. Авитаминоз проявляется в виде ГЕМОРРАГИИ (кровотечения носовые, маточные). Причины: нарушение усвоения жира, нарушение функции печени, заболевания ЖВП.
ВИКАСОЛ (синтезирован в Харькове).

Витамин Е (ТОКОФЕРРОЛ, АНТИСТЕРИЛЬНЫЙ - предупреждает стерильность самок животных; АНТИОКСИДАНТНЫЙ). Наиболее активен альфа -ТОКОФЕРРОЛ, он устойчив к нагреванию, обработке. Всасывается с помощью желчных кислот.
Метаболические функции витамина Е.
-
Регулирует интенсивность свободно радикальных процессов. Препятствует активации перекисного окисления жиров, обеспечивая тем самым стабильность биологических мембран.
-
Витамин Е повышает биологическую активность витамина А.
Гиповитаминоз у человека не выявлен, лишь у недоношенных детей наблюдаются признаки в виде гемолитической анемии. При недостаточной обеспеченности витамином Е наблюдается патология мембран, что может быть при других заболеваниях.
Суточная потребность в витамине Е: 20 -25мг.
83.
Источники витамина Е: растительное масло, горох, печень, проросшая пшеница, капуста, яичный желток, шиповник, дрожжи.
ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ. Витамин С (аскорбиновая к-та, антискорбутный).
Химическая структура:

L-аскорбиновая кислота. L-дегидроаскорбиновая кислота
Витамин С легко окисляется в нейтральной и щелочной среде в присутствии кислорода. Метаболические функции витамина С.
1. Участие в окислительно-восстановительных реакциях:
антиоксидант, гидроксилирование катехоламинов, ДОФА НОРАДРЕНАЛИН
гидроксилирование аминокислот, входящих в состав коллагена ПРОЛИН ОКСИПРОЛИН
2. Синтез кортикостероидов
Суточная потребность в витамине С - 100 - 120мг.
Источниками витамина С являются: лимон, грецкие орехи, смородина, шиповник, яблоки,
красный перец, картофель, зелёный лук. укроп, квашеная капуста. Дефицит вит.С приводит к активации свободно радикальных процессов (стресс, ОРВИ). Гиповитаминоз проявляется в виде нарушения синтеза коллагена: увеличивается проницаемость сосудов, следовательно, кровоточивость десен, патехии на коже, кариес. Причины гиповитаминоза:
-
высокая потребность,
-
неустойчивость химической структуры,
-
отсутствие депо.
Витамин Р (витамин проницаемости, РУТИН, КАТЕХИНЫ, ПОЛИФЕНОЛЫ).
Обладает антиоксидантной активностью, участвует в окислительно-восстановительных реакциях.
Тормозит активность гиалуронидазы - фермента, разрушающего гиалуроновую кислоту
(компонент соединительной ткани). Суточная потребность не установлена. Источниками витамина Р являются апельсины, лимон, шиповник, смородина, грецкий орех,
салат, томат, капуста, картофель, чай, сухое красное вино.
Гиповитаминоз проявляется аналогично гиповитаминозу С.

ТИАМИН не растворим в воде и выпускается в виде соли. Устойчив в кислой среде, неустойчив в щелочной и нейтральной. Выдерживает нагревание в кислой среде до 120.
Метаболические функции вит.В1
1. Входит в состав ТДФ: ТИАМИН(АТФ) ® ТДФ
- КОФЕРМЕНТ декарбоксилаз альфа -КЕТОКИСЛОТ (ПВК, альфа -КГК)
-
КОФЕРМЕНТ транскетолазы (фермент пентозного цикла).
2.Участвует в передаче нервного импульса.
Суточная потребность в витамине B1 - 2-Змг. Она возрастает при употреблении в пищу легко усваиваемых углеводов. 1000 ккал требует 0,5мг ТИАМИНА. Источниками витамина В1 являются дрожжи, гречневая и овсяная крупа, пшеничная мука грубого помола, печень, мясо, яйцо, картофель. При его недостатке в тканях накапливаются ПВК, альфа -КГК. Страдает в первую очередь нервная ткань, что проявляется ПОЛИНЕВРИТОМ. Авитаминоз В1 проявляется в виде заболевания бери-бери:
ПОЛИНЕВРИТЫ (онемение конечностей, парастезии),
Сердечно-сосудистая недостаточность,
Нарушение водного обмена (отёки),
Нарушение функции ЖКТ (нарушение секреции и перистальтики). Особенно нарушается усвоение витамина В1 у хронических алкоголиков.

Устойчив в кислой среде, но разрушается в нейтральной и щелочной среде.
Метаболические функции витамина В2.
1. Участвует в окислительно-восстановительных реакциях, т.к. входит в состав фермента ФМН
и ФАД.
-
Компонент дыхательной цепи, входит в состав НАДН - ДГ.
-
Принимает участие в окислении жирных кислот, янтарной кислоты, аминокислот. Суточная потребность в витамине В2 - 2-4мг.
Источниками витамина В2 являются дрожжи, печень, мясо, хлеб, соя, яйцо.
Гиповитаминоз и авитаминоз проявляется поражением эпителия слизистых, роговицы глаз, кожи;
сухость губ, поражение слизистой полости рта, трещины на губах, кератиты, васкуляризация
глаз.

Участвует в образовании НАД и НАДФ.
-
Компонент дыхательной цепи.
-
КОФЕРМЕНТ различных дегидрогеназ. Суточная потребность в витамине РР 20 - 25мг.
Источниками витамина РР являются дрожжи, говяжья печень, рыба, грибы, мука пшеничная, соя, бобы, хлеб, картофель, мясо. Может синтезироваться в организме при поступлении с пищей белков и витамина В6. Гиповитаминоз проявляется в виде пеллагры:
-
Дерматит с повреждением симметричных участков кожи, повреждённых УФО.
-
Диарея.
-
Деменция.
Причины гиповитаминоза: белковое голодание, недостаток витамина В6.

Участвует в образовании ПФ:
-
КОФЕРМЕНТАМИНОТРАНСФЕРАЗ.
-
КОФЕРМЕНТДЕКАРБОКСИЛАЗ.
-
Принимает участие в ДЕЗАМИНИРОВАНИИ.
-
Необходим для образования витамина РР из триптофана.
-
Сигма-АМИНОЛЕВУЛИНОВАЯ кислота ® гем.
Т.о. витамин В6 участвует в обмене аминокислот, следовательно, необходим для нормального
обмена белков. Суточная потребность-2мг. Источники вит.В6: картофель, пшеница, рис, отруби, печень, дрожжи. Гиповитаминоз приводит к нарушению белкового обмена, что проявляется развитием анемии, дерматита, стоматита, глоссита.
Лекция № 28. Витамины (продолжение).
-
ВИТАМИН В12, ВИТАМИН Н и ПАНТОТЕИНОВАЯ КИСЛОТА.
-
ВИТАМИНОПОДОБНЫЕ СОЕДИНЕНИЯ И АНТИВИТАМИНЫ.
-
СОСТОЯНИЕ ВИТАМИННОЙ ОБЕСПЕЧЕННОСТИ В СОВРЕМЕННЫХ УСЛОВИЯХ.
Витамин В12 (кобаломин, антианемический).
По структуре геминоподобное соединение. Устойчив при нагревании, но не образуется ни в организме человека, ни в организме животных, ни в растениях, но синтезируется микроорганизмами.
Метаболические функции витамина В12.
В процессе метаболизма из КОБАЛОМИНА образуются МЕТИЛКОБАЛОМИН и АДЕНОЗИНКОБАЛОМИН. МЕТИЛКОБАЛОМИН участвует в транспорте метильных групп
I. МЕТИЛИРОВАНИЕ В12
ГОМОЦИСТЕИН ® МЕТИОНИН ® ХОЛИН ® ФОСФОТИДИЛХОЛИН
2.ДЕМЕТЕЛИРОВАНИЕ В12 МЕТИЛТЕТРОГИДРОФОЛЕВАЯ К-ТА ® ТЕТРОГИДРОФОЛЕВАЯ К-ТА
II. АДЕНОЗИЛКОБАЛАМИН В12
МЕТИЛМАЛОНИЛ-КОА ® СУКЦИНИЛ-КОА
Суточная потребность в витамине 1,5-Змкг. В клинике используют до 200мкг. В этом случае он усваивается без внутреннего фактора КАСТЛА. Источниками витамина В12 являются печень говяжья и трески, мясо, сыр, яйцо, молоко коровье, козье. Витамин В12 синтезируется микрофлорой кишечника. Он депонируется в печени. Его запасов хватает на 2 - 3 месяца.
86.
Гиповитаминоз В12:
1 .Клетки теряют фолевую кислоту, а её дефицит проявляется в виде мегалобластической анемии.
2.Поражение слизистой ЖКТ.
3.Накопление МЕТИЛМАЛОНИЛ-КОА. следовательно, повышение синтеза жирных кислот с
нечётным количеством атомов углерода.
4.Нарушение синтеза ХОЛИНА и ФОСФОЛИПИДОВ, следовательно, повышается синтез
нейтральных жиров, приводящее к жировой инфильтрации печени.
5.Повышение ГОМОЦИСТЕИНА в крови приводит к развитию атеросклероза.
Причины гиповитаминоза. Для всасывания витамина В12 необходим МУКОПРОТЕИН (фактор КАСЛА), который синтезируется обкладочными клетками слизистой желудка.
-
Недостаточность или нарушение рецепторов.
-
Дефицит мукопротеина (иммунные расстройства, заболевания слизистой желудка).
-
Дефицит витамина В12 (длительное вегетарианство, энтериты, дсбактериозы).
В крови витамин В12 транспортируется с помощью белка ТРАНСКОБАЛОМИНА. Выделяют его несколько форм. С помощью транскобаломина-2 витамин транспортируется в печень и там депонируется, связывается с транскобаломином-1 и поступает снова в кровь. Транскобаломин-3 предупреждает потери витамина. Курение понижает активность витамина В12.
Витамин Н (биотин, антисеборейный).
Метаболические функции витамина Н
1. Является КО-ферментом карбоксилаз ПВК, ацетил -КОА, пропионил-КОА.
ПВК + CО2 (нит.Н) ® ЩУК
2. Участвует в реакциях синтеза жирных кислот и стерина.
Суточная потребность в витамине Н 0,15 - 0,2мг. Источниками витамина Н являются печень, соя, молоко, яйца, мука, лук, морковь, апельсины, дрожжи, арахис. Синтезируется микрофлорой кишечника. Гиповитаминоз проявляется в виде чешуйчатого дерматита (носогубной треугольник и волосистая часть головы), конъюктевита, анемии, себореи. Причины гиповитаминоза: дисбактериозы. Употребление сырых яиц. содержащих АВИДИН, связывающий витамин Н, и этот комплекс не усваивается. Заболевания ПЖЖ, в которой синтезируется фермент БИОТИНИДАЗА, освобождающий биотин от белка; если этого фермента нет, то БИОТИН не усваивается.
ПАНТОТЕИНОВАЯ КИСЛОТа (витамин ВЗ или В5).
Является производной бета -АЛАНИНА, соединенной с производным масляной кислоты. Метаболические функции ПАНТОТЕИНОВОЙ кислоты.
1. Входит в состав КО-фермента А, следовательно, участвует в синтезе АЦЕТИЛ-КОА, различных АЦИЛ-КОА, образующихся в результате следующих реакций:
ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ альфа –КЕТОКИСЛОТ. Синтез и окисление жирных кислот, синтез СТЕРОИДОВ.
2. Участвует в синтезе более 80 различных ферментов.
Суточная потребность 10-15мг. Источники: печень, дрожжи, пчелиное молочко. Синтезируется микрофлорой кишечника. Гиповитаминоз характеризуется поражением -малых -артерий нижних конечностей. В эксперименте наблюдался некроз надпочечников.
ВИТАМИНОПОДОБНЫЕ ВЕЩЕСТВА.
Синтезируются в организме, но в недостаточном количестве. Потребность в них измеряется в граммах. Например, витамин F, содержащий три незаменимые аминокислоты (ЛИНОЛЕВУЮ, ЛИНОЛЕНОВУЮ, АРАХИДОНОВУЮ). Его относят в настоящее время к витаминподобным веществам. Т.к. суточная потребность в нём до 10гр.
ПАБК (ПАРААМИНОБЕНЗОЙНАЯ К-ТА)

-
Участвует в образовании ФОЛИЕВОИ кислоты,
-
Участвует в образовании ряда ферментов,
-
Является фактором пигментации.
Недостаточность ПАБК проявляется в виде нарушения
пигментации. Суточная потребность не установлена. Источники: печень, дрожжи и другие продукты.
87.

-
Донор - СНЗ групп для образования ПУРИНОВЫХ и ПИРИМИДИНОВЫХ оснований.
-
Необходим для образования АЦЕТИЛ ХОЛИ НА.
Суточная потребность: 0,5 - 1 гр. Источники: желток яиц, печень, почки и др. продукты.
ОРОТОВАЯ КИСЛОТА ( является пиримидиновым основанием)
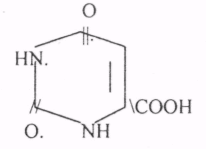
азотистых оснований, предшественников аминокислот. Содержится в дрожжах и печени.
ПАНГАМОВАЯ КИСЛОТА - производное глюкуроновой кислоты и диметилглицина. В организме быстро гидролизуется. ИНОЗИТ (производное циклогексана)

АНТИВИТАМИНЫ - это вещества, нарушающие усвоение витаминов или понижающие
биологическую активность витаминов.
По действию различают АНТИВИТАМИНЫ:
1. Прямо воздействующие:
белок яйца АВЕДИН + БИОТИН не усваиваются ТИАМИНАЗА - разрушение тиамина.
2. Структуры аналогичные витаминам:

СА включается в ферменты микроорганизмов, не отличающие их по структуре. Функции
ферментов нарушается, и микроорганизмы погибают.
МЕТОТРИКСАН - антивитамин фолиевой кислоты. Используется как противоопухолевый
препарат, снижает белок синтетические процессы в клетках.
ДИКУМАРИН - антивитамин К, снижающий свёртываемость крови.
ФТИВАЗИД, ТУБАЗИД - антивитамин В6.
СОСТОЯНИЕ ВИТАМИННОЙ ОБЕСПЕЧЕННОСТИ В СОВРЕМЕННЫХ УСЛОВИЯХ.
В результате многочисленных исследований витаминной обеспеченности было установлено, что глубокий дефицит витаминов наблюдается менее чем у 20% населения, а содержание витаминов ниже нормы наблюдается у 50 - 90% населения. Содержание витаминов определяется в крови. Дают нагрузку витамином с последующим его определением в моче. Если наблюдается дефицит витамина в организме, то в моче он не определяется даже после нагрузки. Недостаточная витаминная обеспеченность проявляется: (1) повышенная утомляемость; (2) повышенная сонливость; (3) повышенная восприимчивость к заболеваниям; (4) повышена частота сердечно-сосудистых заболеваний; (5) повышение тяжести переноса заболеваний. При этом отсутствует специфическая клиническая симптоматика, как при гиповитаминозах. Причины недостаточной витаминной обеспеченности:
1. Снижение затрат энергии в современных условиях, следовательно, необходимость снижение
потребления пищи.
88.
2. Повышение потребления рафинированных продуктов, калорийных, но бедных витаминами.
3. Использование консервированных продуктов длительного хранения. Выход:
1. Витаминизация пищи.
2. Поливитамины с не менее 8-9 компонентами.
Рацион современного человека, достаточный по калорийности, не может удовлетворить потребность организма в витаминах и микроэлементах.
Лекция № 29. Биохимия печени.
1. РОЛЬ ПЕЧЕНИ В ПИГМЕНТНОМ ОБМЕНЕ. БИОСИНТЕЗ И РАСПАД ГЕМА.
2. ПАТОЛОГИЯ ПИГМЕНТНОГО ОБМЕНА. ВИДЫ ЖЕЛТУХ.
Основным источником пигментов для организма являются гемсодержащие белки. Эти сложные белки объединяет их небелковая часть, которая представлена гемом.
ТЕТРАМЕТИЛДИВИНИЛДИПРОПИОНОВОКИСЛЫЙ ПОРФИН. Основную массу всех гемпротеинов организма человека составляет гемоглобин, находящийся в эритроцитах крови и клетках костного мозга (82%). 17% тема содержится в миоглобине скелетных мышц и миокарда. На долю клеточных гемпротоинов (ферменты, ПЕРОКСИДАЗЫ, ЦИТОХРОМЫ) приходится 1%.
БИОСИНТЕЗ ГЕМА.
Исходным материалом в синтезе является глицин и активная форма янтарной кислоты и образующийся из них сигма -АМИНОЛЕВУМИНОВАЯ кислота (АЛК). В дальнейшем из двух молекул этой кислоты образуется МОНОПИРРОЛ. Далее при конденсации четырёх молекул монопиррола образуется ТЕТРАПИРРОЛ, дальнейшее превращение которого в гем предусматривает ДЕКАРБОКСИЛИРОВАНИЕ, окисление с последующим включением атома железа. Печень и костный мозг с ядросодержащими эритроцитами занимают центральное место в биосинтезе. В меньшей степени биосинтез возможен в почках и слизистой кишечника.

РАСПАД ГЕМА.
За сутки в организме взрослого человека в среднем с массой 70кг распадается около 9гр гемпротеинов, главным образом за счёт распада эритроцитов, в которых содержится гемоглобин. Средняя продолжительность жизни эритроцитов составляет 3,5-4 месяца. Разрушение эритроцитов происходит в кровяном русле или селезёнке, что ведёт к высвобождению гемоглобина, который связывается с альфа2 -ГЛОБУЛИНАМИ плазмы и в виде комплекса ГЕМОГЛОБИН-ГАПТОГЛОБИН попадает в клетки РЭС, главным образом селезёнки, печени и соединительной ткани. Гаптоглобин, отщепляясь, переходит в кровь, а гемоглобин, окисляясь, подвергается распаду с образованием желчных кислот БИЛИВЕРДИНА и БИЛЛИРУБИНА (очень токсичные вещества). Освобождающийся из гемоглобина гем повторно не используется. Железо утилизируется. Распад гемоглобина начинается с разрыва одного из метильных мостиков с образованием ВЕРДОГЛОБИНА. Это первая стадия распада, катализируемая ферментом ГЕМОКСИТЕНАЗОЙ, требующей присутствия кислорода и НАДФ*Н2.
В дальнейшем от молекулы ВЕРДОГЛОБИНА отщепляется ГЛОБИН и железо с образованием БИЛЛИВЕРДИНА, который в дальнейшем превращается при восстановлении в БИЛЛИРУБИН (коричневого цвета). Он тоже очень токсичен, поэтому из клеток РЕС он удаляется. В крови он соединяется с белком АЛЬБУМИНОМ, образуя комплексное соединение БИЛЛИРУБИН-АЛЬБУМИН. Его принято называть неконъюгированным биллирубином (НБ). Ранее его называли непрямым, поскольку он не мог быть открыт прямой реакцией с реактивом ЭРЛИХА, а открывается только при осаждении белка. Он имеет свойства: токсичен, гидрофобен. не способен фильтроваться почками, не даёт прямой реакции с реактивом ЭРЛИХА. Поступая в печень, НБ обезвреживается. Выполнив транспортную роль, с током крови уходит альбумин, а в клетках печени биллирубин будет конъюгироваться с глюкуроновой кислотой (УДФГК), при этом образуется МОНОДИБИЛЛИРУБИНГЛЮКУРОНИД. Глюкуроновая кислота присоединяется к СООН-группе остатков пропионовой кислоты. ГЛЮКУРОНИДЫ это уже обезвреженные формы биллирубина. Их называют КОНЪЮГИРОВАННЫМ БИЛЛИРУБИНОМ (КБ). Ранее его называли прямым биллирубином, т.к. он открывается прямой реакцией с ДИАЗО -реактивом ЭРЛИХА. Он имеет свойства: нетоксичен, гидрофилен, способен фильтроваться почками, дает прямую реакцию с реактивом ЭРЛИХА. КБ выделяется из печени в составе желчи в кишечник, где под влиянием ферментов слизистой оболочки кишечника и кишечной микрофлоры гидролитически распадается. Глюкуроновая кислота всасывается в кровь и через систему портальной вены поступает в печень, где снова принимает участие в интоксикации веществ. БИЛЛИРУБИН восстанавливается по некоторым двойным связям, превращаясь в МЕЗОБИЛЛИНОГЕН. Он частично в тонком отделе кишечника может всасываться в кровь и через портальную вену поступать в печень, где частично распадается с образованием моно-, ди-, трипирролов, которые выделяются почками в составе мочи. Незначительная часть МЕЗОБИЛИНОГЕНА, минуя печень, поступает в почки и выделяется в виде УРОБИЛИНОГЕНА. При суточном диурезе в норме 1,2 - 1,5л с мочой взрослого человека выделяется 1 - 4мг уробилиногена, который на свету превращается в уробилин. Основная часть мезобилиногена, продвигаясь с пищевым комком в толстый отдел кишечника под влиянием ферментов кишечной микрофлоры восстанавливаясь, превращается в СТЕРКОБИЛИНОГЕН - основной пигмент кала, который, выделяясь из организма, на свету превращается в стеркобилин. Было установлено, что за сутки с калом взрослого человека выделяется 240 - 300мг стеркобилина. Небольшая часть стеркобилиногена в толстом отделах кишечника в области геморроидальных вен, всасываясь в кровь, минуя печень, поступает в почки, где фильтруется и выделяется в составе мочи.
Т.о. основными компонентами доступных для исследования биологических сред являются:
1. Для крови: НБ - 75%, КБ - 25%. Суммарно этот показатель обозначается, как общий билирубин КРОВИ, который в норме для взрослого человека составляет 8 -20ммоль/л.
2. Для желчи - КБ.
3. Для мочи: УРОБИЛИНОГЕН (1 -4мг/сутки), СТЕРКОБИЛИН.
4. Для кала: СТЕРКОБИЛИНОГЕН (240 - 300мг/сутки).
ПАТОЛОГИЯ ПИГМЕНТНОГО ОБМЕНА.
Может наблюдаться при усиленном распаде эритроцитов, при нарушении функции печени и ЖВП. В результате этих нарушений у больных кожа и видимые слизистые оболочки окрашиваются в желтый цвет. Желтушность становится заметной если уровень общего билирубина в крови повышается в 2 -3 раза. Для проведения дифференциальной диагностики желтух необходимо исследовать кровь, мочу и кал на содержание в них желчных пигментов. Различают:
1. НАДПЕЧЕНОЧНАЯ ЖЕЛТУХА (ГЕМОЛИТИЧЕСКАЯ).
Идёт гемолиз эритроцитов по причине их токсического повреждения, переливания несовместимых групп крови, несовместимости групп крови матери и плода по резус-фактору, при дефиците ферментных систем эритроцитов, при гемолитической болезни новорождённых. В крови у таких больных наблюдается: ГИПЕРБИЛИРУБИНЕМИЯ за счёт НБ, количество эритроцитов и гемоглобина ниже нормы. В крови повышается активность АСАТ. В моче количество уробилина выше нормы, билирубин отсутствует. Моча окрашивается в интенсивно оранжевый цвет. Кал интенсивно окрашен. В нём повышается содержание стеркобилина.
2. ПЕЧЕНОЧНАЯ ЖЕЛТУХА (токсические и вирусные и другие гепатиты).
Причиной развития является воспалительное заболевание печени. При этом повреждаются клетки печени, что ведёт к понижению активности ГЛЮКУРОНИЛТРАНСФЕРАЗЫ и, как следствие, нарушается образование КБ. Токсическое влияние на мембраны ведёт к повышению их проницаемости и выходу в кровь НБ и КБ. Так у больных развивается смешанная ГИПЕРБИЛИРУБИНЕМИЯ. Значит, повышается активность ферментов АЛАТ, АСАТ, ГГТ, ЛДГ-4, ЛДГ-5. В моче в большом количестве КБ. Моча окрашивается в коричневый цвет. В кале количество стеркобилина понижается.
3. ПОДПЕЧЕНОЧНАЯ ЖЕЛТУХА (механическая).
Развивается по причине нарушения оттока желчи в тонкий кишечник из-за болезней печени, ЖВП, либо давлении опухолью извне. При глистных инвазиях, когда происходит закупорка общего желчного протока. В результате развивается застой желчи в желчном пузыре, что ведёт к повышению проницаемости желчных капилляров и выходу КБ. В крови повышается активность ГГТ, щелочной фосфатазы. В моче обнаруживается билирубин. Количество стеркобилина в кале значительно понижается. Кал приобретает серовато-грязный цвет, т.е. становится АХОЛИЧНЫМ.
4. ФИЗИОЛОГИЧЕСКАЯ ЖЕЛТУХА НОВОРОЖДЁНЫХ.
Развивается на 3-4 сутки после рождения и держится 7-8 дней. Встречается у 80% новорождённых. Она связана с тем, что в крови содержится много эритроцитов, скорость распада которых после рождения велика, а детоксикация развита слабо по причине низкой активности генов, ответственных за синтез ГЛЮКУРОНИЛТРАНСФЕРАЗЫ.
5. ЖЕЛТУХА НЕДОНОШЕННЫХ.
Выражена сильнее и держится дольше до 4 -5 недель. Билирубин оказывает большое токсическое влияние на функции мозга. Понизить интоксикацию можно переливанием крови, введением ФЕНОБАРБИТАЛА и проводимой светотерапией, которая повышает конъюгацию билирубина.
6. НАСЛЕДСТВЕНЫЕ ЖЕЛТУХИ.
Связаны с генетическим дефектом ГЛЮКУРОНИЛТРАНСФЕРАЗЫ. В крови уровень НБ резко повышается. В отличие от гемолитической желтухи количество эритроцитов и уровень гемоглобина в норме. В желчи КБ нет.
Лекция № 30. Биохимия крови и почек.
1. БИОХИМИЯ КРОВИ.
2. БИОХИМИЯ ПОЧЕК.
ТИПЫ ИЗМЕНЕНИЯ БИОХИМИЧЕСКОГО СОСТАВА КРОВИ.
1. Абсолютные и относительные.
Абсолютные изменения обусловлены нарушением синтеза, распада, выделения того или иного
соединения. Относительные обусловлены изменением ОЦК. Когда ОЦК повышается (за счёт воды),
концентрация растворённых в ней соединений понижается. Если же ОЦК понижается
(обезвоживание), то наблюдается сгущение крови и повышается концентрация веществ.
2. Качественные и количественные.
Качественные изменения: появление патологических компонентов или отсутствие компонентов (АФИБРИНОГЕНЕМИЯ - отсутствие фибриногена). Количественные изменения - повышение или понижение показателя. Название образуется из приставки «ГИПО» или «ГИПЕР», названия этого компонента и концовки «ЕМИЯ». Отсутствие компонента «А» или «АП».
БЕЛКОВЫЙ СОСТАВ КРОВИ. Функции белков крови:
1. поддерживают онкотическое давление (альбумины)
2. определяют вязкость плазмы крови (альбумины)
3. определяют устойчивость форменных элементов в кровотоке (предупреждают склеивание клеток крови между собой)
4. участвуют в поддержании кислотно-щелочного равновесия, образуя белковую буферную систему
5. транспортируют метаболиты, микроэлементы, ксенобиотики (альбумины)
6. участвуют в поддержании гомеостаза, являясь компонентом свёртывающей системы
7. участвуют в реакциях иммунитета (система комплемента, гамма - глобулины)
8. являются резервом аминокислот.
ОБЩИЙ БЕЛОК.
В норме составляет 65 -85г/л. Общий белок - это совокупность всех белковых веществ крови. ГИПОПРОТЕИНЕМИЯ. Причины:
1.дефицит аминокислот в организме - нарушение поступления, низко белковое питание, нарушение переваривания и всасывания
2.усиление распада белков - голодание, повышение потребностей в энергии и пластическом материале (беременность, травмы)
3. выведение белков из кровеносного русла - перераспределение (из кровеносного русла белки уходят в ткани - ЭКССУДАЦИЯ, ТРАНССУДАЦИЯ), выделение из организма во внешнюю среду (нарушение фильтрации почек, кровотечение)
4. нарушение белоксинтезирующей функции печени.
Абсолютная ГИПОПРОТЕИНЕМИЯ развивается за счёт ГИПОАЛЬБУМИНЕМИИ. При относительной соотношение между фракциями не меняется.
Абсолютная ГИПЕРПРОТЕИ'НЕМИЯ возникает при остром воспалительном процессе за счёт повышения уровня антител и белковой фазы острого воспаления, появление ПАРАПРОТЕИНОВ. Абсолютная ГИПЕРПРОТЕИНЕМИЯ реализуется за счёт фракции глобулинов. Относительная ГИПЕРПРОТЕИНЕМИЯ не сопровождается изменениями между фракциями.
АЛЬБУМИНЫ в норме составляют 35 - 50г/л. ГИПОАЛЬБУМИНЕМИЯ причины аналогичны гипопротеинемии. При понижении альбуминов ниже 30 г/л возникают отёки. ГИПЕРАЛЬБУМИНЕМИЯ возникают из-за гемаконцентрации, ядрогенная при введении растворов альбуминов в кровь больного. Истинной не встречается.
ГЛОБУЛИНЫ в норме составляют 20 - 30г/л.
Альфа-1 -ГЛОБУЛИНЫ:
Альфа -АНТИТРИПСИН обладает антипротеиназной активностью как к собственным ферментам организма (трипсин, пепсин и т.д.), так и к ферментам микрофлоры. Оказывает противовоспалительное действие. Повышается в острой фазе воспаления, как защитный процесс, поэтому он называется белком острой фазы. Понижается при нарушении белоксинтезирующей функции печени, генетический дефект синтеза.
Альфа -СЕРОМУКОЙДЫ - белки клеточных мембран. Поступают в кровь за счёт обновления или распада клеток. Обнаруживаются в печени в ответ на воспаление, относятся к маркёрам острой фазы воспаления.
Альфа -ФЕТОПРОТЕИН фетальный белок. В норме в большом количестве во внутриутробном плоде. Используется как маркер внутриутробного развития. В организме плода выполняет важные функции: заменяет альбумины, участвует в органогенезе, защищает ткани плода от избытка эстрогена беременной женщины. У взрослых содержится в очень малом количестве - не более 15мг/л. Повышается его содержание при опухолевом росте тканей, развивающихся из зачатка желточного мешка (является маркером рака печени); при беременности используется в акушерстве для оценки состояния ФЕТОПЛАЦЕНТАРНОГО комплекса (перенатальная диагностика).
Альфа-2 -ГЛОБУЛИНЫ:
Альфа -МАКРОГЛОБУЛИНЫ по функции аналогичны антитрипсину. Защищает функциональные белки от протеолитических ферментов. Обладают противомикробной активностью. Повышается содержание в острую фазу воспаления, при потере альбуминов с мочой.
ГАПТОГЛОБИН - связывает и транспортирует свободный гемоглобин в клетки РЭС. Является антиоксидантом, т.к. связывает гемоглобин, который в свободном виде - сильнейший яд, активирующий свободно-радикальные процессы.
ЦЕРУЛЛОПЛАЗМИН (МЕДЬСОДЕРЖАЩЯЯ ОКСИДАЗА) выполняет ряд функций:
1. транспортирует ионы меди, связывает и удерживает их в кровеносном русле
2. обладает ферментативной активностью, катализируя окисление Fe(2+) ® Fe(3+), что
обеспечивает его транспорт трансферрином
3. обладает противовоспалительным действием
4. является антиоксидантом, обезвреживает активные формы кислорода и ПОЛ.
Содержание повышается: в острую фазу воспаления, при циррозе печени, заболеваниях печени воспалительного характера, нарушении белоксинтезирующей функции печени. Болезнь ВИЛЬСОНА - КОНОВАЛОВА: церуллоплазмин не удерживается в крови, а выходит в ткани и с мочой, а также откладывается в прозрачных средах глаза. Бета -ГЛОБУЛИНЫ.
ТРАНСФЕРРИН - белок, транспортирующий ионы железа. Максимально транспортирует 2 иона железа. Повышается при дефиците железа в организме. Понижается его содержание при нарушении синтеза в печени, при остром воспалении (негативный маркер острой фазы воспаления). У пациентов с врожденной ГИПО- и АТРАНСФЕРРИНЕМИЕЙ не удается вылечить анемию.
ГЕМОПЕКСИН - аналогичен гаптоглобину, но транспортирует свободный гемоглобин в клетки РЭС. Повышается в острую фазу воспаления. Понижается при гемолизе.
ФИБРИНОГЕН (в норме 2 - 4г/л) - компонент свёртывающей системы крови. При формировании сгустка превращается в фибрин. Фибриноген содержится в плазме крови, а в сыворотке крови его нет. Повышается (ГИПЕРФИБРИНОГЕНЕМИЯ) в острую фазу воспаления с целью отграничения здоровой ткани от патологической, при тромботических заболеваниях (ГИПЕРКОАГУЛЯЦИЯ). Понижается (ГИПОФИБРИНОГЕНЕМИЯ) при нарушении его синтеза в печени, врожденных дефектах образования.
С-реактивный белок назван так по способности реагировать с С-полисахаридом пневмококка и многих других микроорганизмов и аномальных клеток организма. Эта реакция необходима для активации фагоцитоза, следовательно, обладает противовоспалительным действием, способствует фагоцитозу, обеспечивает действие клеток иммунной системы. В норме содержится в количестве 6 мг/л. Повышается при бактериальной инфекции и неинфекционном воспалении. Является маркером острой фазы воспаления. Концентрация его пропорциональна массе микробных тел в организме или количеству антигенов.
Гамма -ГЛОБУЛИНЫ (ИММУНОГЛОБУЛИНЫ и АНТИТЕЛА).
Повышение титра иммуноглобулинов:
IgM - острый инфекционный процесс;
IgG - хронический воспалительный процесс и после острого заболевания;
IgA - секреторный иммуноглобулин поверхности слизистых оболочек;
IgE - антитела аллергии;
IgD. Функция неизвестна.
Повышение (ГИПЕРГАММАГЛОБУЛИНЕМИЯ) при иммуновоспалительном процессе.
Понижение (ГИПОГАММАГЛОБУЛИНЕМИЯ) при подавлении гуморального звена иммунитета
(лучевая болезнь, иммунодефицит, истощение организма). Качественные изменения заключаются в появлении ПАРАПРОТЕИНОВ. Это изменённые антитела, продукты аномального синтеза иммуноглобулинов патологически изменёнными клетками иммунной системы. Могут занимать любое положение на электрофораграмме. При понижении температуры переходит в нерастворимое состояние, обуславливая холодовую аллергию (КРИОПАРАПРОТЕИНЫ). При повышении температуры тела более 37грд. Переходят в гель (ПИРОПАРАПРОТЕИНЫ). Реакция обратима, при восстановлении температуры до нормы этот белок вновь растворяется. Содержание его повышается при опухоли лимфатической ткани. КРИОПАРАПРОТЕИНЫ повышаются с возрастом.
НЕБЕЛКОВЫЕ АЗОТСОДЕРЖАЩИЕ ВЕЩЕСТВА.
Остаточный азот - совокупное содержание азота всех небелковых веществ крови. В норме 14 -28ммоль/л. Компоненты остаточного азота:
1. Метаболиты: аминокислоты (25%), креатин (5%), полипептиды и нуклеотиды (3,5%)
2. Конечные азотистые продукты: мочевина(50%), мочевая кислота (4%), креатинин (2,5%), индикан и аммиак.
ГИПЕРАЗОТЕМИЯ: 1. Продукционная АЗОТЕМИЯ - активный распад белков. 2.РЕТЕНЦИОННАЯ АЗОТЕМИЯ - задержка азотистых шлаков в организме за счёт нарушения функции почек. Например, повышение мочевины. При интенсивном распаде нуклеиновых кислот, подагре повышается мочевая кислота. При патологии мышц повышается креатин.
УГЛЕВОДНЫЙ ОБМЕН.
Глюкоза в цельной капиллярной крови натощак - 3,3 - 5,5ммоль/л
ГИПЕРГЛИКЕМИЯ: избыток контринсулярных гормонов, дефицит инсулина (ИЗСД), нарушение функции рецепторов (ИНСД), стресс (адреналин повышает уровень глюкозы), употребление избытка углеводов.
ГИПОГЛИКЕМИЯ: передозировка инсулина, недостаток контринсулярных гормонов в организме, голодание.
Кетоновые тела (не более 0,1 г/л) - ацетон, ацетоуксусная кислота, бета -гидроксимасляная кислота. При дефиците углеводов в клетке жиры не могут полностью окисляться, и избыток ацетил-КоА компенсируется образованием кетоновых тел. Уровень кетоновых тел повышается при сахарном диабете и голодании. Опасно в отношении КЕТОАЦИДОЗА.
ЛИПИДНЫЙ ОБМЕН.
ХОЛЕСТЕРИН (3 - 5,2ммоль/л) в плазме находится в составе ЛПНП, ЛПОНП, и ЛПВП. Вероятность развития атеросклероза связана с коэффициентом атерогенности.
К *ЛП=- Хс*ЛПНП +
Хс*ЛПОНП
Хс ВП
Идеальное значение К=1, но может быть только у новорождённых. У взрослых К не более 3. ГИПЕРХОЛЕСТЕРИНЕМИЯ: атеросклероз (избыток ЛПНП, ЛПОНП), сахарный диабет (избыток ацетил -КоА), подпечёночная желтуха, гипофункция щитовидной железы. ГИПОХОЛЕСТЕРИНЕМИЯ: голодание, истощающие заболевания, наследственные нарушения синтеза холестерина, нарушение функции печени, гиперфункция щитовидной железы.
БИЛИРУБИН (в норме 8-20ммоль/л). КБ 2-8ммоль/л. Чаще встречается ГИПЕРБИЛИРУБИНЕМИЯ.
Натрий это основной внеклеточный ион. На его уровень в крови влияют МИНЕРАЛОКОРТИКОИДЫ. Повышение его концентрации при сгущении крови, избыток хлорида натрия в пище. Понижается при длительной рвоте, длительном поносе, повышении концентрации воды в крови. Калий - это главный внутриклеточный ион. Повышается при избытке в пище калий содержащих продуктов (бананы), нарушении функции почек Понижается при задержке натрия в организме (при гиперсекреции альдостерона), недостаток калия в продуктах, ГЕМОДЕЛЛЮЦИЯ. Понижение уровня калия ведёт к нарушению сердечного ритма.
Кальций (2,2 -2,6ммоль/л). Повышается при массивном распаде костной ткани, ГИПЕРПАРАТИРЕОЗ, ГИПЕРВИТАМИНОЗ D, понижение уровня кальцитонина. Понижается при ГИПОПАРАТИРЕОЗЕ, ГИПОВИТАМИНОЗЕ D, гиперсекреции кальцитонина. Фосфор (1 - 2ммоль/л) входит в состав буферных систем крови, следовательно, его уровень влияет на кислотно-щелочное равновесие. Повышается при ГИПОПАРАТИРЕОЗЕ, ГИПОВИТАМИНОЗЕ D, заболевании костей. Понижается при ГИПЕРПАРАТИРЕОЗЕ, рахите, нарушении всасывания фосфатов в ЖКТ.
Показатели КЩС (кислотно-щелочного состояния) крови (рН =7,36 - 7,44)
рН изменяется только при декомпенсированных изменениях КЩС: ДЕКОМПЕНСИРОВАННЫЙ АЛКАЛОЗ (рН > 7,44), ДЕКОМПЕНСИРОВАННЫЙ АЦИДОЗ (рН < 7,36).
ВВ (buffer basis) - совокупное содержание оснований всех буферных систем крови. В норме ВВ = 40 -60ммоль/л. КОМПЕНСИРОВАННЫЙ АЦИДОЗ - ВВ < 40ммоль/л.
КОМПЕНСИРОВАННЫЙ АЛКАЛОЗ - ВВ > 60ммоль/л.
ФЕРМЕНТЫ СЫВОРОТКИ КРОВИ.
ПЛАЗМОСПЕЦИФИЧЕСКИЕ - целенаправленно выделяются в кровь для выполнения определённых функций. Активность в крови больше, чем в тканях. Например, ферменты свёртывания крови, ренин (вырабатывается в почках), холинэстераза (в печени). Повышение или понижение имеет диагностическое значение.
ПЛАЗМОНЕСПЕЦИФИЧЕСКИЕ не требуются для выполнения функций крови. Поступают в плазму из тканей в результате нормальной проницаемости мембран и обновления клеток. Например, АЛАТ, АСАТ, ЛДГ и др. Повышение не менее чем на 70% по сравнению с верхней границей нормы имеет диагностическое значение.
Причины повышения ПЛАЗМОНЕСПЕЦИФИЧЕСКИХ ферментов: повышение проницаемости клеточных мембран, цитолиз, некроз, нарушение выделения ферментов из крови, мифация ферментов из секрета в кровь (нарушение оттока этих секретов), усиление синтеза (при рахите повышается уровень ЩФ -щелочной фосфатазы).
АЛАТ- (0,1 - 0,8ммоль/л). Наибольшее его количество в печени, меньше - в скелетных мышцах, миокарде и др. Повышение активности наблюдается при заболеваниях печени, мышц, миокарда. Это цитоплазменый фермент цотолиза. Активность его повышается в ранние стадии заболевания. АСАТ (0,1 - 0,45ммоль/л). Наибольшее содержание в мышцах, в печени. Повышение уровня активности АСАТ свидетельствует о глубоком поражении печени. Повышение активности АСАТ - при заболеваниях мышц, генетических заболеваниях, травмах, воспалениях, а также при заболеваниях миокарда и печени. При заболеваниях печени повышение АЛАТ равно повышению АСАТ и означает глубокое поражение. ЛДГ (не более 4ммоль/л) является тетрамером: состоит из Н (сердце) и М (мышца) единиц. Представлена пятью изомерами: ЛДГ-1 (миокард), ЛДГ-2 (миокард, эритроциты, почки), ЛДГ-3 (легкие, ПЖЖ), ЛДГ-4 (скелетная ткань), ЛДГ-5 (скелетная мускулатура, печень). КФК (КРЕАТИНФОСФОКИНАЗА) - 0,16 - 0,3ммоль/л. Состоит из 2-х единиц: В (мозг), М (мышцы).КФК-1 (ВВ, 0%, ЦНС) повышается при глубоком тяжёлом поражении (опухоль, травма, ушиб мозга). КФК-2 (MB, 3%, миокард) повышается при инфаркте миокарда, травме сердца. КФК-3 (ММ, 97%, мышечная ткань) повышается при поражении миокарда, синдром длительного давления.
ЩФ (ЩЕЛОЧНАЯ ФОСФАТАЗА) - 0,6 - 1,3ммоль/л. Источники: костная ткань (образуется остеобластами), билиарная система (эпителий желчных протоков). Повышается при: заболеваниях костной ткани, метастазах опухолей в костную ткань, рахите, остеопорозах, под печеночной желтухе.
Альфа -АМИЛАЗА синтезируется в ПЖЖ и слюнных железах. В крови повышается при панкреатитах, реже при воспалении слюнных желез. Панкреатическая амилаза фильтруется в мочу.
БИОХИМИЯ ПОЧЕК.
ФУНКЦИИ ПОЧЕК:
1.Экскреторная функция - это выделение мочевины, мочевой кислоты, креатина, лекарств, токсинов, избытка воды, микроэлементов, электролитов. Состоит из трёх фаз:
A) КЛУБОЧКОВАЯ УЛЬТРАФИЛЬТРАЦИЯ. В клубочках за счёт разницы гидростатического давления образуется первичная моча, состав которой по содержанию низкомолекулярных веществ не отличается от плазмы крови. В малых количествах могут содержаться альбумины.
B) КАНАЛЬЦЕВАЯ РЕАБСОРБЦИЯ. Обратное всасывание воды, ионов натрия, магния, хлора, фосфора, глюкозы, белков. Т.е. те вещества, в которых нуждается организм. В результате моча становится более концентрированной. Способность концентрировать мочу - важный показатель функции почек. Он оценивается по плотности мочи. Практически обратно не всасывается КРЕАТИНИН. В небольшом количестве всасывается мочевина, мочевая кислота, т.е. реабсорбция носит избирательный характер.
C) КАНАЛЬЦЕВАЯ СЕКРЕЦИЯ ионов калия, аммония, водорода. При повышении концентрации веществ секретируется вода. Образуется вторичная моча.
Вещества, находящиеся в моче делятся на:
в норме не фильтруемые грубодисперсные высокомолекулярные вещества, которые не могут преодолеть почечный барьер. Их появление говорит о нарушении фильтрации.В норме фильтруются соединения, они присутствуют в первичной моче, но не все из них присутствуют во вторичной моче. Они делятся:
- пороговые из первичной мочи реабсорбируются (аминокислоты, глюкоза). Во вторичной моче в норме содержатся. Имеют порог реабсорбции - верхний предел концентрации вещества в крови, преодоление которого влечёт не эффективное обратное всасывание. Для глюкозы – 10 ммоль/л. Появление пороговых веществ в крови выше нормы влечёт их появление в моче.
- без пороговые соединения выделяются во вторичную мочу независимо от функции почек (мочевина, креатинин). Они обратно не всасываются.
2.Регуляторная и гомеостатическая.
A) регуляция артериального давления посредством ренина,
B) регуляция объёма внутриклеточной жидкости (альдостерон, АДГ),
C) регуляция осмотического давления (вазопрессин),
D) регуляция КЩС.
АЦИДОГЕНЕЗ - активное выведение кислот из организма. Происходит в эпителии почечных канальцев. Он обеспечивает выведение избытка ионов водорода, сбережение ионов натрия и гидрокарбонат анионов, благодаря чему обеспечивается буферная ёмкость крови.
АММОНИОГЕНЕЗ происходит в эпителии почечных канальцев. В итоге выводится аммиак, связываются протоны в моче и понижается её кислотность, выводятся хлориды.
3.Секреторная функция:
A) образование ЭРИТРОПОЭТИНОВ,
B) образование РЕНИНА,
C) образование КАЛЫДИТРИОЛА.
4.Антитоксическая функция:
A) АММОНИОГЕНЕЗ,
B) реакции конъюгации с глюкуроновой, серной и уксусной кислотами,
C) реакции окисления некоторых токсических веществ.
ФИЗИЧЕСКИЕ СВОЙСТВА МОЧИ. Количество мочи - 1,2 - 1,5л/сутки.
ПОЛИУРИЯ - повышение количества мочи:
1.усиление фильтрации ( под действие адреналина повышается фильтрационное давление в капиллярах почек),
2.понижение реабсорбции воды и натрия (недостаток альдостерона и АДГ - не сахарный диабет),
3.повышение содержания в моче осмотически активных веществ (глюкоза, мочевина, белок)
4.повышение онкотического давления при понижении концентрации белков в плазме
5.понижение активности натрий сберегающий процессов (АЦЙДО и АММОНИОГЕНЕЗ)
6.угнетение систем реабсорбции при повреждении почечных канальцев.
ОЛИГОУРИЯ - понижение количества мочи:
1.снижение фильтрации (понижение АД и давления в почечных капиллярах)
2.повышение обратного всасывания воды и натрия (избыток альдостерона и АДГ)
3.понижение осмотического и онкотического давления крови
4.угнетение всех фаз образования мочи (резкое понижение количества нефронов). АНУРИЯ - полное отсутствие мочи при выраженной почечной недостаточности.
Цвет мочи в норме от светло до темно-жёлтого (соломенно-желтый). Бесцветная моча при ПОЛИУРИИ. Коричневый (зеленовато-бурый) цвет появляется за счёт желчных пигментов при под печеночной и печеночной желтухе, из-за появления КБ. Розовый цвет - ЭРИТРОЦИТУРИЯ при патологии почечного фильтра. Ярко-красный цвет - наличие в моче свежей крови (травмы МВП). ГЕМАТУРИЯ может быть почечной и вне почечной. Моча может быть подкрашена пищевыми веществами или медикаментами, содержащими красители. Запах в норме специфический. Резко аммиачный запах при повышении распада белков в организме. Фруктовый запах (ацетон) говорит о наличии кетоновых тел (сахарный диабет, голодание). Гнилостный запах - процессы распада в мочевом пузыре (гангрена). Каловый запах -наличие ВЕЗИКАЛЬНО-РЕКТАЛЬНЫХ свищей. Реакция среды в норме слабокислая (рН =5,0 - 7,0). Повышение рН более 7,0 говорит об угнетении функции почек (АЛКАЛОЗ). Понижение рН менее 5,0 - АЦИДОЗ за счёт удаления избытка протонов и за счёт выделения кетоновых тел. При употреблении значительного количества белковой пищи происходит закисление, а растительной - защелачивание мочи. Суточные колебания плотности в норме 1,005 - 1,030г/мл. Одинаково монотонная плотность - ИЗОСТЕНУРИЯ. Нарушение концентрационной функции почек: ГИПОСТЕНУРИЯ (понижение плотности) - преобладание процессов фильтрации над ребсорбцией. Возникает при несахарном диабете и заболеваниях почек. ГИПЕРСТЕНУРИЯ (повышение плотности) - при появлении веществ в норме отсутствующих в моче (глюкоза, кровь, белки, слизь). Прозрачность мочи в норме полная. Моча мутная из-за присутствия нерастворимых солей (УРАТОВ, ОКСАЛАТОВ), слизи, гноя, белка.
ХИМИЧЕСКИЙ СОСТАВ МОЧИ.
Общий азот - это совокупность азота всех азотсодержащих веществ в моче. В норме 10 - 18г. ГИПЕРАЗОТУРИЯ - распад белков в организме, употребление большого количества мясной пищи. ГИПОАЗОТУРИЯ - нарушение функции почек. Компоненты общего азота:
1.Мочевина (20 - 35г/сутки). Повышается при повышенном распаде белков при нормальной функции печени, высокобелковое питание. Понижается при нарушении синтеза в печени, нарушении функции почек.
2.Мочевая кислота (0,3 - 1,2г/сутки) является продуктом катаболизма пуринов. ГИПЕРУРИКУРИЯ наблюдается при распаде нуклеопротеинов, при употреблении большого количества белков пищи, при некоторых видах подагры. ГИПОУРИКУРИЯ: определённые формы подагры с нарушением выделения мочевой кислоты, нарушение фильтрации мочевой кислоты почками.
3. Креатинин (0,8 - 2,3г/сутки). Повышается при усиленном распаде компонентов мышечной ткани (травмы мышц), увеличение употребления мясной пищи. Понижается при угнетении фильтрации почками.
4. Белок (не более ЗОмг/л). Качественными реакциями не обнаруживается. ПРОТЕИНУРИЯ наблюдается при гематурии, нарушении функции почек.
ПАТОЛОГИЧЕСКИЕ КОМПОНЕНТЫ. В норме в моче отсутствуют.
Желчные пигменты, билирубин - печёночная и под печеночная желтухи. Кетоновые тела - сахарный диабет, голодание. Глюкоза (ГЛЮКОЗУРИЯ) - сахарный диабет, почечная недостаточность. Кровь (ГЕМАТУРИЯ) - повреждение МВП, почечная недостаточность. Индол в отсутствии индикана - угнетение детоксикационной функции печени. Индикан в отсутствии индола - повышение процессов гниения белков в кишечнике при нормальной функции печени.
Лекция №31. Биохимия нервной ткани.
1. ХИМИЧЕСКИЙ СОСТАВ НЕРВНОЙ ТКАНИ.
2. ОСОБЕННОСТИ ОБМЕНА ВЕЩЕСТВ В НЕРВНОЙ ТКАНИ.
3. ХИМИЧЕСКАЯ ПЕРЕДАЧА НЕРВНОГО ВОЗБУЖДЕНИЯ.
ХИМИЧЕСКИЙ СОСТАВ НЕРВНОЙ ТКАНИ. Функции нервной системы:
1. координация и регуляция обмена веществ,
2. обеспечение связи организма с внешней средой.
Химический состав нервной ткани сложен и неоднороден, как в целом и сама нервная ткань. Отличия в химическом составе носят в основном количественный характер. В сером веществе 77 -81% воды, в белом-70%. Содержание белков в нервной ткани меньше, чем в некоторых других тканях (печень, мышцы). Их больше в сером веществе и меньше в периферических нервах. В нервной ткани содержится больше сложных белков: ЛИПОПРОТЕИНЫ (миелиновые оболочки), ФОСФОПРОТЕИНЫ, НУКЛЕОПРОТЕИНЫ (ДНП, РНП), ГЛИКОПРОТЕИНЫ (нейрокератин), En.
Наибольший интерес представляют нейроспецифические белки:
1. белок S-100 (растворим в 100% растворе (NH4)2SO4). Он повышается в ткани мозга в эксперименте при обучении и эмоциональном воздействии. Считают, что этот белок отвечает за формирование зависимостей (алкогольной, наркотической). ПРОПРОТЕИН - антитело к белку S-100, понижает его содержание в ткани мозга.
2. Белок 14-3-2 играет важную роль в формировании памяти.
3. НЕЙРОПЕПТИДЫ - играют роль нейромедиаторов и гормонов. Пептиды памяти, боли, сна. Не белковые азотистые соединения те же самые, что и в других тканях, но отличаются по
количественному составу. В нервной ткани много свободных аминокислот, г.о. дикарбоновых (ГЛУ, ГЛН, ACП, АСН), ГАМК, ароматические аминокислоты, ЦАМФ и ЦГМФ. Углеводов незначительное количество:
1. резервные углеводы - гликоген (0,1 %)
2. глюкоза (1 -4мкмоль/л)
3. гексозофосфаты
4. триозофосфаты
5. ПВК
6. молочная кислота.
ЛИПИДОВ в сером веществе 25%, в белом веществе 50%.
1. ФОСФОЛИПИДЫ (до 50%) - ПЛАЗМОГЕН АЦЕТАЛЬФОСФАТИДЫ.
2. ГЛИКОЛИПИДЫ - ЦЕРЕБРОЗИДЫ, ГАНГЛИОЗИДЫ.
3. ВЖК - в основном непредельные, содержащие по 4 - 5 двойных связей.
4. Холестерин (25%) в свободном виде. Мозг даже называют депо холестерина.
5. Нейтральные жиры - в незначительном количестве в головном, но в большом количестве в периферических нервах.
Минеральные вещества представлены катионами калия, натрия, кальция, магния, железа, меди, цинка, в качестве анионов выступают анионы белков и фосфаты.
ОСОБЕННОСТИ ОБМЕНА ВЕЩЕСТВ В НЕРВНОЙ ТКАНИ. Особенности энергетического обмена.
1. В ткани головного мозга очень высока интенсивность дыхания. Мозг потребляет кислород больше, чем постоянно функционирующий миокард, на 20% больше покоящиеся мышцы. 20 - 25% всего кислорода приходится на долю головного мозга, у детей грудного возраста -50%. За 10 секунд мозг поглощает весь кислород, находящийся в ткани. Из этого следует особая важность адекватного кровоснабжения нервной ткани. Прекращение кровоснабжения ГМ 6 -8 секунд приводит к потере сознания.
2. Основным субстратом окисления является глюкоза. ДЫХ. КОЭФ.=V(СО2)/V(О2)=1,0
Мозг это единственный орган, использующий в качестве источника энергии исключительно глюкозу.
3. До 70% АТФ используется для поддержания ионных градиентов (удаление натрия из клетки).
ОСОБЕННОСТИ УГЛЕВОДНОГО ОБМЕНА.
Исходный субстрат окисления - глюкоза. 85% окисляется аэробно. Функция головного мозга зависит от концентрации глюкозы в крови. ГИПОГЛИКЕМИЯ ведёт к судорогам, смерти. 0,1% гликогена обновляется в ткани мозга за 4 часа. Распад идет двумя путями: ФОСФОРОЛИТИЧЕСКИМ и ГИДРОЛИТИЧЕСКИМ.
При нарушении обмена углеводов нарушается функция головного мозга. Эффект снотворных веществ связан с торможением окисления углеводов. Недостаток витамина BI ведёт к нарушению углеводного обмена и полиневритам.
ОСОБЕННОСТИ ОБМЕНА БЕЛКОВ И АМИНОКИСЛОТ.
При возбуждении нервной ткани нарушается распад белков и аминокислот и повышается содержание аммиака в клетках. Во время торможения и сна количество аммиака снижается. Аммиак токсичен для ткани головного мозга и обезвреживается ГЛУ с образованием амидов (ГЛН)

ГПН проникает через мембраны и выходит из клетки.
РОЛЬ ГЛУТАМИНОВОЙ КИСЛОТЫ В ОБМЕНЕ ВЕЩЕСТВ.
1. ГЛУ связывает аммиак
2. ТРАНСАМИНИРОВАНИЕ, следовательно, образование заменимых аминокислот
3. ДЕКАРБОКСИЛИРОВАНИЕ

4 ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ
5. Является нейромедиатором возбуждающего действия
6. Стабилизирует содержание калия в клетке.
До 10% глюкозы превращается в нервной ткани в ГЛУ. ГЛУ применяется в качестве лечебного средства при ЧМТ.
ОСОБЕННОСТИ ЛИПИДНОГО ОБМЕНА.
Нейтральные жиры не используются как энергетический материал в нервной ткани. ФОСФО и ГЛИКОЛИПИДЫ играют в основном структурную роль, как компоненты мембран.
ХИМИЧЕСКАЯ ПЕРЕДАЧА НЕРВНОГО ВОЗБУЖДЕНИЯ. Химическими передатчиками являются нейромедиаторы:
1. АЦЕТИЛХОЛИН
2. БИОГЕННЫЕ АМИНЫ
3. АМИНОКИСЛОТЫ (ГЛУ, ГЛИ)
4. НЕЙРОПЕПТИДЫ.
В передаче нервного возбуждения участвуют:
1. Натриевый насос (АТФ -аза)
2. Натриевые каналы
3. Калиевые каналы.
Этапы передачи нервного возбуждения.
1. Нервный импульс
2. Освобождение медиатора
3. Диффузия медиатора через синаптическую щель
4. Присоединение медиатора к рецептору
5. Изменение конфигурации рецептора
6. Открытие калий -натриевых каналов
7. Инактивация медиатора
8. Удаление натрия из клетки с помощью АТФ-азы.
В покое натрий удаляется из клетки, и мембрана становится проницаемой для калия. Калий выходит из клетки и внутри клетки наблюдается положительный потенциал - ПП (70мВ) При возбуждении натрий -калиевые каналы открываются, натрий заходит в клетку, калий выходит из клетки. Но т.к. концентрация натрия снаружи больше, его в клетку заходит больше. Это приводит к понижению отрицательного заряда внутри клетки и мембрана деполяризуется. Это и есть начало передачи импульса по мембране. ОБРАЗОВАНИЕ НЕЙРОМЕДИАТОРОВ. В ХОЛИНЕРГИЧЕСКИХ синапсах основной медиатор - АЦЕТИЛХОЛИН. Образуется из холина.
![]()
Ацетилхолин разрушается с помощью ХОЛИНЭСТЕРАЗЫ.
В АДРЕНЕРГИЧЕСКИХ синапсах медиаторы образуются из ТИР.


В СЕРОТОНИНЕРГИЧЕСКИХ синапсах медиатор образуется из ТРИ.

Они разрушаются МОНОАМИООКСИДАЗОЙ (МАО).
