Лекция № 1.
Биохимия, её задачи. Структурная организация белков.
1 .Предмет биохимии.
2.Задачи биохимии.
3.Значение биохимии для медицины.
4.Белки,их биологическая роль.
5.Структурная организация белков.
Биохимия относится к фундаментальным дисциплинам медицины и биологии. В результате научного познания мира выделился ряд фундаментальных дисциплин: философия, физика, химия, биология и д.р. Биохимия выделилась с одной стороны в результате разделения наук. Ей не доставало точности, т.к. длительно она была описательной наукой. Середина 20 в. ознаменовалась глобальными открытиями в физике. В это же время интеграция биологии с точными науками способствовала её бурному развитию. Биохимия возникла как наука, благодаря привлечению в биологию точных знаний, в частности химии.
Биохимия—наука о структуре веществ, входящих в состав живого организма, их превращениях и физико-химических процессах, лежащих в основе жизнедеятельности.
Выделяют три составных компонента общей биохимии:
1.Статическая биохимия (изучает структуру веществ ) - биоорганическая химия.
2.Динамическая биохимия (изучает превращение веществ в организме).
3.Функциональная биохимия (изучает процессы, лежащие в основе функций органов и тканей). Кроме общей (базисной) биохимии выделяют ещё ряд разделов биохимии, в зависимости от направления проводящихся исследований:
1.Биохимия растений.
2.Биохимия микроорганизмов.
3.Биохимия животных.
4.Медицинская биохимия.
5.Ветеринарская биохимия.
6.Техническая биохимия.
7.Биохимия генетики.
8.Молекулярная биохимия.
Задачи биохимии.
1.Изучение процессов БИОКАТАЛИЗА.
2.Изучение механизмов наследственности на молекулярном уровне.
3.Изучение строения и обмена нуклеиновых кислот.
4.Изучение строения и обмена белков.
5.Изучение превращения углеводов.
6.Изучение обмена жиров.
7.Изучение биологической роли сигнальных молекул (ГОРМОНЫ, НЕЙРОМЕДИАТОРЫ).
8.Изучение роли витаминов в обмене веществ.
9.Изучение роли минеральных веществ.
Значение биохимии для медицины.
Основные вопросы медицины: патогенез, диагностика, лечение и профилактика заболеваний.
1.Значение биохимии для понимания механизма заболевания.
ПРИМЕР. В норме, ГЕМОГЛОБИН-А располагается в эритроцитах равномерно, занимая весь объём клетки. При смене 1 АК ГЛУТАМИНА на ВАЛИН образуется ГЕМОГЛОБИН-S, плохо растворимый и выпадающий в эритроцитах в осадок. Сущность этого заболевания раскрыл Л. ПОЛЛИНГ. Только биохимические исследования позволяют диагностировать это заболевание и раскрыть механизм развития вследствие недостатка гормона инсулина. Сердечно-сосудистые заболевания (атеросклероз). Раньше считали, что важную роль в патогенезе принадлежит накоплению ЛИПОПРОТЕИНОВ низкой плотности и нарушение соотношения между ЛИПОПРОТЕИНАМИ низкой плотности и ЛИПОПРОТЕИНАМИ высокой плотности. В настоящее время предполагают, что важным является чувствительность рецепторов клеток к ЛИПОПРОТЕИНАМ низкой плотности.
2.Значение биохимии для диагностики заболеваний.
Широкое использование биохимических исследований биологических жидкостей.
A. Количество субстратов.
Б. Исследование активности ферментов.
B. Исследование уровня гормонов. Методы РИА, ИФА, ИХЛА, ДНК-зонды.
Важным моментом в настоящее время является выявление ПРЕДЗАБОЛЕВАНИЙ.
3. Значение биохимии для лечения. Выявление нарушенных звеньев метаболизма и создание соответствующих лекарственных препаратов, широкое использование природных препаратов.
4.Значение биохимии для профилактики заболеваний.
ПРИМЕР. Недостаток витамина С —цинга—для профилактики использование витамина С (профилактика простудных заболеваний).
Недостаток витамина D— рахит— использование витамина D.
БЕЛКИ, ИХ БИОЛОГИЧЕСКАЯ РОЛЬ.
Белки - это высокомолекулярные азотсодержащие органические вещества, состоящие из АК. соединённых ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь, и имеющие сложную структурную организацию.
Характерные признаки белков, отличающие их от других соединений:
1 .Белки - АЗОТСОДЕРЖАЩИЕ вещества (до 16 %).
2.Структурной единицей белков являются альфа АК L-РЯДА.
![]()
3-.АК связываются ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь.
4.Большая молекулярная масса белков (от 20000 до нескольких миллионов дальтон).
5.Сложная структурная организация.
ФУНКЦИИ БЕЛКОВ.
1.Каталитическая. Многие белки являются ферментами
2.Регуляторная. Некоторые гормоны являются белками
3.Структурная. Во все структуры живой клетки входят белки.
4.Рецепторная. Белки являются обязательным компонентом рецепторов, способны узнавать другие молекулы.
5.Транпортная. Транспорт жиров, лекарственных веществ и д.р.
6.Опорная. Коллаген, белки костной ткани.
7.Энергетическая. Окисление 1 грамма белка сопровождается выделением 17 КДЖ энергии. В сутки 15% энергии образуется за счёт распада Б.
8.Сократительная. Актин, миозин мышц.
9.Генно-регуляторная (ГИСТОНЫ).
10.Иммунологическая. Антитела являются белками.
11 .Гемостатическая. Фибриноген.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ. Свойства белков обусловлены их структурой.
ПЕРВИЧНАЯ СТРУКТУРА - последовательное соединение АК в ПОЛИПЕПТИДНОЙ цепи с помощью ПЕПТИДНЫХ связей.
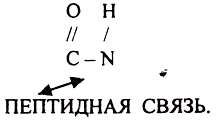
Свойства ПОЛИПЕПТИДНОЙ цепи зависят от составляющих её АК.
Порядок АК в цепи устанавливается с помощью СЕКВЕНИРОВАНИЯ - процедура выявления последовательности АК. Впервые было проведено в 1958 г. Ф. СЕНДЖЕРОМ на инсулине.
ВТОРИЧНАЯ СТРУКТУРА - способ укладки в пространстве ПОЛИПЕПТИДНОЙ цепи. Образуется за счет водородных связей между 1 и 4 АК.
![]()
Выделяют 3 вида вторичной структуры:
1 .Альфа спираль ( Л.ПОЛЛИНГ) - виток составляет от 3 до 6 АК. Терминатором спирали является АК-ПРОЛИН.
2.Бетта складчатый слой.
3.Петли ПОЛИПЕПТИДНОЙ цепи (соединительные петли).
ТРЕТИЧНАЯ СТРУКТУРА - укладка вторичной структуры более компактно, в виде ГЛОБУЛЫ или ФИБРИЛЛЫ. Осуществляется за счёт водородных, ионных, ДИСУЛЬФИДНЫХ и гидрофобных связей.
Домены - это фрагменты ПОЛИПЕПТИДНОЙ цепи, сходные по свойствам с самостоятельными глобулярными белками. Домен автономен. Домены возникают в результате слияния нескольких генов отдельных белков.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА - объединение нескольких доменов. П. Гемоглобин-4 СУБЪЕДИНИЦЫ.
ЛЕКЦИЯ № 2.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. КЛАССИФИКАЦИЯ БЕЛКОВ.
1.Физико-химические свойства белков. Их использование для разделения белков.
2.Принципы классификации белков.
3.Характеристика простых белков.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ.
1.Молекулярная масса белков определяет многие свойства белков: седиментация, диффузия, плотность белковых растворов, коллоидные свойства белков и др. характеристики.
Молекулярная масса: инсулин (5700)
МИОГЛОБИН (17000)
ПЕПСИН (35000)
ГЕМОГЛОБИН (65000).
Молекулярную массу белка можно определить по скорости седиментации (осаждения) при УЛЬТРАЦЕНТРИФУГИРОВАНИИ, т.е. при ускорении 100000-500000 дальтон. На основании этого определяют коэффициент седиментации, который обозначают S ( в честь СВЕДБЕРГА). Он предложил за единицу коэффициента седиментации величину 10-13 степени. S большинства белков колеблется в пределах 1-2 СВЕДБЕРГОВ. Др. методом определения молекулярной массы является метод ГЕЛЬФИЛЬТРАЦИИ (молекулярное просеивание). Используется искусственно созданные гранулы, имеющие поры (гранулы СЕФАДЕКСА). Внутрь гранулы могут проникать только соединения определённого размера: молекулы небольшого размера входят в гранулы, а большие быстрее вымываются. Молекулярная масса рассчитывается ориентировочно. Буфер не задерживается, а белок движется тем медленнее, чем меньше молекулярная масса.
2.Способность белков связываться с ЛИГАНДАМИ,
Белки способны связываться с определенными веществами. Белки специфично узнают свои ЛИГАНДЫ, что обусловлено комплиментарным строением определённого участка белка и ЛИГАНДЫ.
Fe2+ O2. ИЗБИРАТЕЛЬНОСТЬ обеспечивается белковой частью гемоглобина. Центр связывания ЛИГАНДА называется активным центром. Это свойство лежит в основе др. метод разделения белков - АФФИНАЯ ХРОМОТОГРАФИЯ (разделение по сродству).
3.Электрохимические свойства белков.
А. АМФОТЕРНОСТЬ.
Белки - АМФОТЕРНЫЕ ЭЛЕКТРОЛИТЫ.

АМФОТЕРНОСТЬ обусловлена:
1. Концевыми СООН и NH2 группами.
2.Боковыми группами:
ГЛУ, АСП -дополнительные кислотные СВОЙВТВА. АРГ, ЛИЗ, ГИС - основные свойства.
Т.к. белковые молекулы имеют много ИОНОГЕННЫХ групп, следовательно, они ПОЛИЭЛЕКТРОЛИТЫ. БЕЛКИ являются АМФОЛИТАМИ.
Б. Буферные свойства - способность поддерживать РН среды. Наиболее мощным буфером крови является ГЕМОГЛОБИНОВЫЙ буфер, т.к. в большом количестве содержит ГИСТИДИН.
B. Белки содержат заряд, который зависит от соотношения кислотных и основных групп, а оно в свою очередь зависит от их диссоциации, определяющейся РН среды.
Изоэлектрическое состояние - это состояние молекулы белка, при котором её заряд равен 0. Значение РН, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой.
PI кислые белки<7 (белки протоплазмы)
РI основные белки >7 (ядерные белки).
В изоэлектрическом состоянии белок менее устойчив. Это свойство белков используется при их ФРАКЦИВАНИИ:
1.ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ.
Для неё используется ИОНООБМЕННИКИ, которые изготавливаются из чистой целлюлозы: ДЭАЭ - целлюлоза (содержит катионные группы); КМ - целлюлоза (содержит анионные группы). На ДЭАЭ разделяют отрицательно заряженные белки, на КМ - положительно заряженные. Чем больше в белке СООН групп, тем прочнее он связывается с ДЭАЭ целлюлозой.
2.Разделение белков на основании величины заряда - электрофорез белков. С помощью электрофореза в сыворотке крови выделяют как минимум 5 фракций: АЛЬБУМИНЫ, альфа, альфа-2, гамма, бета - глобулины.
4.Коллоидные свойства белков.
Белковые растворы весьма устойчивы , их иногда относят к истинным растворам , высокая молекулярная масса придаёт белковым растворам коллоидные свойства.
A. Оптические свойства:
- ОПАЛЕСЦЕНЦИЯ - дифракция световых лучей при прохождении через раствор и, следовательно, наблюдение его некоторого потемнения при взгляде под прямым углом к источнику света.
- Рассеивание света ( конус ТИНДАЛЯ).
Оптические свойства используются в световой микроскопии, нефелометрии, ТУРБОДИМЕТРИИ.
При нефелометрии измеряется интенсивность отраженного света. При ТУРБОДИМЕТРИИ измеряется интенсивность проходящего света.
Б. Высокая вязкость растворов белка.
B. Малая скорость диффузии.
Г. Неспособность белков проникать через полупроницаемые мембраны. Давление, обусловленное белками, называется ОНКОТИЧЕСКИМ. Диализ - очистка белковых растворов
от низкомолекулярных веществ. В клинике используется ГЕМОДИАЛИЗ - очистка крови от азотистых компонентов.
Д. Способность белковых растворов переходить из состояния золя в гель. Гель хорошо образует миозин и др. фибриллярные белки.
5. Гидратация белков - способность белков связывать воду. Она осуществляется за счёт:
-полярных групп;
-ПЕПТИДНЫХ связей.
100 г. белка связывает 30-35 г. воды. Способность связывать воду изменяется с возрастом. Вода может проникать в молекулы и связываться с внутренними структурами белка, и образованием раствора воды в белке. Вода может связываться и с наружными структурами белка с образованием ГИДРАТНОЙ оболочки.
6. Растворимость белков в воде (устойчивость белков в водном растворе). Многие белки хорошо растворимы в воде, что определяется количеством полярных групп. Растворимость глобулярных молекул лучше, чем фибриллярных белков. Факторы, определяющие стабильность белковых растворов:
- наличие зарядов в белковой молекуле. Одноименные заряды способствуют растворимости белка, т.к. препятствуют соединению молекул и выпадению в осадок.
- Наличие ГИДРАТНОЙ оболочки, препятствующей объединению белковых молекул. Для осаждения белка, его необходимо лишить этих двух факторов устойчивости. Методом осаждения белка является вливание - осаждение белка с помощью нейтральных солей - (NH4)2-S04.
В полунасыщенном растворе (NH4)2-SO4 осаждаются глобулины, а в насыщенном - альбумины.
После удаления осаждающего фактора, белки переходят в растворённое состояние.
7.ЛАБИЛЬНОСТЬ пространственной структуры белка. Под действием внешних факторов может происходить нарушение высших уровней организации белковой молекулы (вторичной, третичной, четвертичной структур) при сохранении первичной структуры. При этом белок теряет свои НАТИВНЫЕ, физико-химические и биологические свойства. Это явление называется денатурацией. Денатурацию вызывают химические факторы ( повышение температуры, давления, механическое воздействие, УЗ, ионизирующее излучение), химические факторы ( кислоты, щелочи, органические растворители -спирт, фенол; соли тяжёлых металлов).n В некоторых случаях возможна РЕНАТУРАЦИЯ, когда денатурирующий фактор действовал кратковременно и нанёс лёгкое разрушение молекуле. В последние годы установлено, что в организме есть белковые системы предупреждающие денатурацию. Они тоже белковой природы - ШАПЕРОНЫ - класс белков, защищающий в условиях клетки др. белки от денатурации. Они облегчают формирование пространственной конфигурации белков. К ним относятся белки теплового шока или белки стресса.
КЛАССИФИКАЦИЯ БЕЛКОВ.
1 .По функции выделяют:
1. Транспортные белки (гемоглобин О2, альбумин жирные кислоты).
2. Каталитические (ферменты),
3. Регуляторные (гормоны).
4. Структурные (белки соединительной ткани, мембранные белки).
5. Защитные (антитела).
6. Сократительные (актин, миозин).
7. Рецепторные участвуют в образовании рецепторов.
2. По форме выделяют:
1. Глобулярные.
2. Фибриллярные белки.
3. По структуре белки делятся:
1.Простые (ПРОТЕИНЫ) состоят только из АК (ГИСТОНЫ, ПРОТАМИНЫ, АЛЬБУМИНЫ, ГЛОБУЛИНЫ, ГЛЮТЕМИНЫ, ПРОЛОНГИНЫ, ПРОТЕИНОИДЫ).
2.Сложные (ПРОТЕИДЫ) состоят из белков и небелковой части. Белковая часть -АПОПРОТЕИНЫ+ ПРОСТЕТИЧЕСКАЯ группа = ХОЛОПРОТЕИНЫ. Это НУКЛЕОПРОТЕИНЫ, ЛИПОПРОТЕИНЫ, ГЛИКОПРОТЕИНЫ, ХРОМОПРОТЕИНЫ, ФОСФОПРОТЕИНЫ, МЕТАЛЛОПРОТЕИНЫ.
Лекция № 3.
ФЕРМЕНТЫ (F).
1. Понятие о F.
2.Строение F.
3.Коферменты (KO-F).
ПОНЯТИЕ О ФЕРМЕНТАХ.
Ферменты - это биологические катализаторы (КАТ) белковой природы. Роль ферментов в организме огромна. В каждой клетке организма находится до 10000 молекул ферментов, которые катализируют более 2000 различных химических реакций. Ферменты начинают своё каталитическое действие в ЖКТ, продолжают его в тканях, на этапе выведения и образования конечных продуктов. Все реакции в организме ферментативные. Энзимология (ферменты - энзимы) - раздел науки, изучающий ферменты.
ОБЩИЕ ЧЕРТЫ ФЕРМЕНТОВ И НЕБИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ.
1. Повышают скорость реакции.
2. В реакциях они не расходуются.
3. Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом.
ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ ФЕРМЕНТОВ.
1 .Ферменты обладают более высокой эффективностью действия (повышают скорость реакции в большее число раз, чем неорганические КАТ).
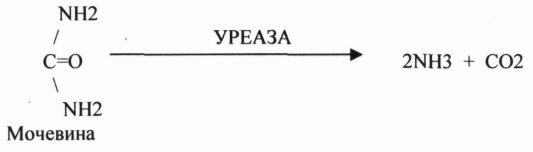
УРЕАЗА (гидролиз мочевины) повышает скорость реакции в 10 раз.
2.Ферменты чувствительны к температуре (ТЕРМОЛАБИЛЬНЫ)
3.Ферменты чувствительны к значениям РН среды.
4.Ферменты, в отличие от неорганических КАТ, обладают высокой специфичностью действия.
5.Ферменты - это катализаторы с регулируемой активностью.
Ферменты, являясь белками, повторяют все особенности структуры и состава белков (состоят из АК, имеют 4 уровня структурной организации), физико-химические свойства белков. Ферменты, как и все функциональные белки, могут быть простыми и сложными.
Простые ферменты представлены только белковой частью (состоят из АК) - ПЕПСИН, ТРИПСИН, ФОСФАТАЗЫ. В структурном отношении имеют 3 уровня организации (ГЛОБУЛА).
Сложные ферменты представлены:
1 .Белковой частью (состоит из АК) - АПОФЕРМЕНТ;
2.Небелковой частью - КОФАКТОР.
Выделяют 2 основных КОФАКТОРА:
А. Ионы металлов (К, Na, Ca, Mg, Mn) большинство всех ферментов являются МЕТАЛЛОФЕРМЕНТАМИ. В продуктах питания должны обязательно содержаться микроэлементы.
В. КОФЕРМЕНТЫ - низкомолекулярные органические вещества не белковой природы.
Для многих ферментов его АПОФЕРМЕНТ вместе с КОФАКТОРОМ образуют каталитически активную молекулу, которая называется ХОЛОФЕРМЕНТОМ.
АПОФЕРМЕНТ+КОФАКТОР=ХОЛОФЕРМЕНТ.
СТРОЕНИЕ ФЕРМЕНТОВ.
В пространственной структуре фермента можно выделить отдельные участки, которые выполняют те или иные функции (активный центр, контактный участок, каталитический участок, аллостерический центр).
Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. АЦ обычно располагается в гидрофобном углублении ( недоступном для молекул воды), изолируя субстрат от воды. В образовании АЦ, участвуют боковые группы АК (12-20 АК), причём эти АК могут находиться на разных участках полипептидной цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы боковых цепей АК:
- NH2 (АРГ, ЛИЗ)
- СООН (АСП, ГЛУ)
- SH (ЦИС)
- ОН (СЕР, ТРЕ)
- ИМИДАЗОЛ (ГИС)
- ГУАНИДИНО группа Фенольное кольцо (ТИР)
Остальные АК поддерживают пространственную конфигурацию активного центра фермента
и обеспечивают его реакционную способность.
Контактный ( субстрат связывающий ) участок - это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту.
Каталитический участок - место, где проходит сама каталитическая реакция.
АЛЛОСТЕРИЧЕСКИЙ (регуляторный) центр - участок в молекуле фермента, расположенный в др. месте, в отличие от активного центра. К АЛЛОСТЕРИЧЕСКОМУ центру могут присоединяться различные вещества, которые отличаются по структуре от молекул субстрата. Эти вещества называются АЛЛОСТЕРИЧЕСКИЕ ЭФФЕКТОРЫ. Они могут влиять на конформацию активного центра фермента, изменяя её, т.е. могут или повышать скорость реакции, или тормозить её. В роли АЛЛОСТЕРИЧЕСКИХ ЭФФЕКТОРОВ чаще всего выступают гормоны, лекарственные вещества и др. химические соединения.
КОФЕРМЕНТЫ (Ko-F).
КОФЕРМЕНТЫ являются или акцепторами, или донорами различных атомов, или даже атомных групп. Они чаще всего содержат в своём составе различные витамины, следовательно, их делят на две группы:
1.Витаминные.
2.Невитаминные.
Витаминные КОФЕРМЕНТЫ:
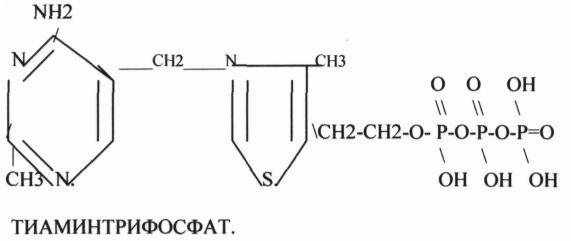
1.ТИАМИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин В1 (ТИАМИН).
A. ТИАМИНМОНОФОСФАТ - ТМФ
Б. ТИАМИНДИФОСФАТ или ТИАМИНПИРОФОСФАТ - ТДФ или ТПФ
B. ТИАМИНТРИФОСФАТ - ТТФ
ТПФ связана с ферментами ДЕКАРБОКСИЛАЗАМИ альфа КЕТОКИСЛОТ (ПВК, альфа КГК)
2.ФЛАВИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин В2.
1 . ФЛАВИНМОНОНУКЛЕОТИД - ФМН
2. ФЛАВИИАДЕНИНДИНУКЛЕОТИД - ФАД
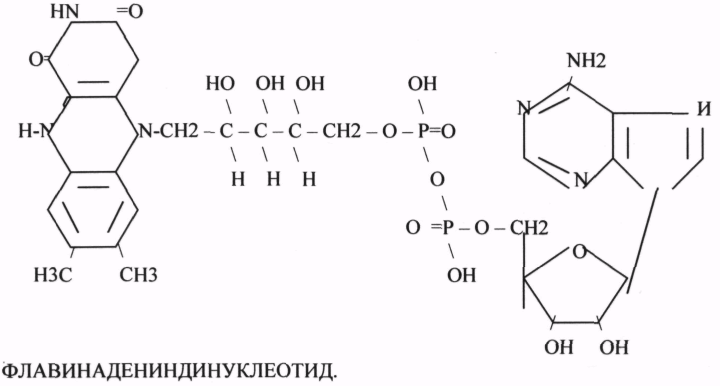
ФМН и ФАД связанны с ферментами ДЕГИДРОГЕНАЗАМИ. Участвуют в реакциях ДЕГИДРИРОВАНИЯ, т.е. отнятия Н — ОВР.
3. ПАНТОТЕИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин ВЗ (ПАНТОТЕИНОВАЯ К-ТА). KO-F A (HSK.O-A - HS КОЭНЗИМ А). КОФЕРМЕНТ АЦИЛИРОВАНИЯ.
4. НИКОТИНАМИДНЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин РР
(НИАЦИН):
1.НАД (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД). НАД * Н2.
2.НАДФ (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ). НАДФ*Н2.
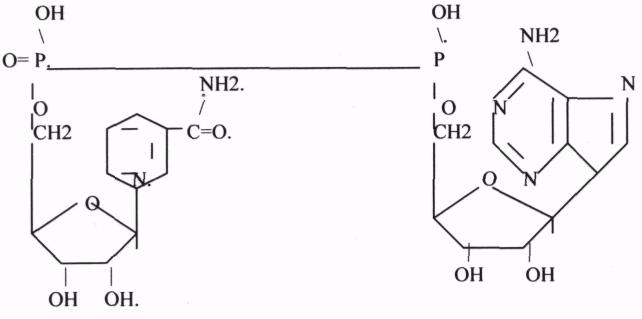
НАД и НАДФ также связаны с ферментами ДЕГИДРОГЕНАЗАМИ, которые в окислительно-восстановительных реакциях (реакции ДЕГИДРИРОВАНИЯ) - анаэробные ДГ.
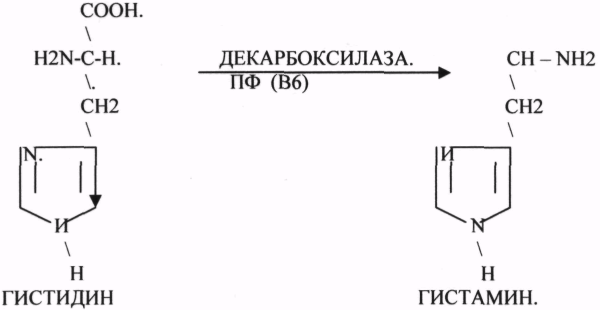
5.ПИРИДОКСИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин В6.
1. ПАФ - ПИРИДОКСАМИНОФОСФАТ.
2. ПФ - ПИРИДОКСАЛЬФОСФАТ.
Участвует в реакциях превращения АК:
1.Реакции ПЕРЕАМИНИРОВАНИЯ (ТРАНСАМИНИРОВАНИЕ). Связан с ферментами АМИНОТРАНСФЕРАЗАМИ.
2.РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ АК.
НЕВИТАМИНЫЕ КОФРМЕНТЫ:
Не содержат в своём составе витаминов, но участвуют в каталитических превращениях.
1 .НУКЛЕОТИДЫ: АТФ, ЦТФ (синтез ФОСФОЛИПИДОВ); УДФ, УТФ, ГТФ (синтез
ГЛИКОГЕНА).
2.ПРОИЗВОДНЫЕ ПОРФИРИНА: ГЕМ, ЦИТОХРОМЫ, КАТАЛАЗА.
3.ПЕПТИДЫ:
ГЛУТАТИОН - ТРИПЕПТИД, содержащий ГЛУ-ЦИС-ГЛИ. Он связан с ферментами ОКСИДОРЕДУКТАЗАМИ. Участвует в окислительно-восстановительных реакциях.
4.ИОНЫ РАЗЛИЧНЫХ МЕТАЛЛОВ.
Лекция № 4.
ФЕРМЕНТЫ (продолжение).
1.СВОЙСТВА ФЕРМЕНТОВ.
2.МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ.
З.МОЛЕКУЛЯРНЫЕ ЭФФЕКТЫ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ.
СВОЙСТВА ФЕРМЕНТОВ:
1 .Высокая каталитическая активность. УРЕАЗА повышает скорость реакции в 10 раз.
2.Ферменты, являясь белками, проявляют ТЕРМОЛАБИЛЬНЫЕ свойства - чувствительность к изменению температуры.
При повышении температуры на каждые 10 градусов, скорость ферментативных реакций повышает в 1,5-2 раза (правило ВАНТ - ГОФФА). Это правило применимо для ферментов в очень узком интервале температуры, т.к. уже при 50-60 градусах наблюдается денатурация, а при 100 гр. - полная денатурация с потерей активности. При 1-3 гр. активность фермента также понижается, но при понижении температуры структура его сохраняется, поэтому при последующем повышении Т. активность восстанавливается. Это свойство используется в клинической практике при проведении оперативных вмешательств. Температура, при которой фермент проявляет максимальную активность, называется ОПТИМАЛЬНОЙ.

3. Ферменты чувствительны к изменениям РН среды. Для большинства ферментов оптимальные значения РН лежат в нейтральной среде (для КАТАЛАЗЫ РН=7).
Есть ферменты, для которых оптимальные значения РН лежат в кислой среде (пепсин РН=1,5-2,5). Некоторые ферменты проявляют активность в щелочной среде (АРГИНАЗА РН=10-11). Изменения pН приводит к изменению степени ионизации кислых и основных групп в активном центре фермента, т.к. эти группы участвуют в связывании субстрата и его превращении. Изменение pН приводит к конформационной перестройке не только активного центра фермента, но и всей молекулы фермента. Это может сопровождаться нарушением третичной структуры фермента. При оптимальном значении pН функциональные группы активного центра находятся в наиболее реакционно-способном состоянии, и это обеспечивает образование фермент-субстратного комплекса.
4. Специфичность действия ферментов. В основе специфичности действия ферментов лежит КОНФОРМАЦИОННОЕ соответствие его активного центра молекуле субстрата. Различают следующие виды специфичности:
А). Абсолютная специфичность. Ей обладают ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты.
УРЕАЗА ГИДРОЛИЗУЕТ МОЧЕВИНУ.
АРГИНАЗА ОТЩЕПЛЯЕТ АРГ.
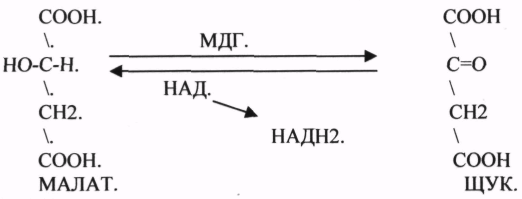
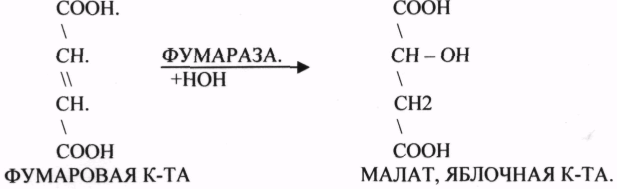
ФУМАРАЗА - ГИДРАТАЦИЯ ФУМАРОВОЙ КИСЛОТЫ.
В). СТЕРИОСПЕЦИФИЧНОСТЬ. Ей обладают ферменты, действующие на пространственные или стереоизомеры. ЦИС и ТРАНС изомеры; оптические изомеры (ЭНАНТИОМЕРЫ).
С). Групповая специфичность. Ей обладают ферменты, которые катализируют однотипные реакции сходных по строению субстратов, т.е. эти субстраты могут содержать в своём составе одинаковые группы атомов.
Пример: ЛИПАЗА - участвует в расщеплении ЛИПИДОВ, содержащих в своём
составе СЛОЖНОЭФИРНУЮ связь.
![]()
ПЕПТИДАЗЫ действуют на субстраты, содержащие ПЕПТИДНЫЕ связи.
Их действию подвергаются ПЕПТИДЫ Б.
![]()
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ.
С термодинамической точки зрения, действие любого фермента направлено на понижение энергии активации. Энергия активации - это то дополнительное количество энергии, которое нужно сообщить молекуле, чтобы перевести её из неактивного состояния в состояние активности. Чем ниже энергия активации, тем выше скорость реакции. Теория действия ферментов была предложена БЕЙЛИСОМ и ВАНБУРГОМ. Эта теория получила название АДСОРБЦИОНОЙ. Согласно ей, фермент представляет собой "губку", которая адсорбирует на своей поверхности молекулы реагирующих веществ. Она как бы стабилизирует их, способствует взаимодействию. Эта гипотеза не могла объяснить специфичность действия ферментов. 70 лет назад была предложена др. теория МИХАЭЛИСОМ и МЕНТЕНОМ. Они выдвинули понятие о F-S комплексе. Фермент взаимодействует с субстратом, образуя нестойкий промежуточный F-S комплекс, который затем распадается с образованием продуктов реакции (Р) и освобождением фермента. В этом процессе выделяют несколько стадий:
1.Диффузия S к F и их СТЕРИЧЕСКОЕ взаимодействие с образованием F-S комплекса. Эта стадия не продолжительна. Её скорость зависит от концентрации субстрата и скорости диффузии его к активному центру фермента. На этой стадии практически не происходит понижения энергии активации.
![]()
2.Преобразование F-S комплекса в один, или несколько, активированных комплексов.
![]()
Они называются переходными. Эта стадия является наиболее продолжительной по времени. При этом происходит разрыв связей в молекуле субстрата, образование новых связей, т.е. образуются Р реакции. Е активации
3.Освобождение продуктов реакции от фермента и поступление их в окружающую среду.
![]()
МОЛЕКУЛЯРНЫЕ ЭФФЕКТЫ ФЕРМЕНТАТИВНОГО ДЕЙСТВИЯ.
1. Эффект концентрации. Чтобы произошло взаимодействие между молекулами реагирующих веществ, они должны обязательно столкнуться. В обычных условиях без участия фермента столкновение этих молекул является медленным, что замедляет реакцию. Поэтому основная роль ферментов заключается в притяжении молекул реагирующих веществ на свою поверхность и концентрация этих молекул в области активного центра фермента.
2. Эффект сближения и ориентации. Это характерное свойство ферментов, которое позволяет ускорить превращение субстрата и повышение скорости реакции в 1000 и 10000 раз. Контактные участки активного центра фермента связывают специфически молекулы субстрата, сближают их и обеспечивают взаимную ориентацию так, чтобы это было выгодно для действия каталитических групп фермента. Такое упорядоченное расположение S приводит к снижению энергии активации.
3. Эффект натяжения ("дыбы"). До присоединения субстрата к активному центру фермента, его молекула как бы в расслабленном состоянии. После связывания молекула субстрата растягивается и принимает напряжённую деформированную конфигурацию. При этом увеличивается длина межатомных связей, следовательно, понижается Е активации.
4. Кислотно-основной катализ. В активном центре фермента содержатся группы кислотного и основного типа. Группы кислотного типа отщепляют Н+ и имеют отрицательный заряд. Группы основного типа присоединяют Н+ и имеют положительный заряд. Кроме основных групп, положительный заряд несут ионы металлов. После связывания субстрата с активным центром фермента, молекулы субстрата перестраиваются, т.к. они подвергаются действию каталитических групп активного центра: одни группы присоединяют Н+, др. его отщепляют. Это приводит к ускорению образования продукта реакции, т.е. способствует понижению энергии активации.
5.Ковалентный катализ (ФОСФОТАЗЫ). Наблюдается у ферментов, которые образуют ковалентные связи между каталитическими группами активного центра и субстрата. В результате формируется промежуточный F-S комплекс, который неустойчив, легко распадается, продукты реакции быстро освобождаются.
6.Эффект индуцированного соответствия.
Он объясняет специфичность действия ферментов. По этому поводу имеется 2 точки зрения:
А). Гипотеза ФИШЕРА. Согласно ей имеется строгое СТЕРИЧЕСКОЕ соответствие субстрата и активного центра фермента. По ФИШЕРУ, фермент - это жёсткая структура, а субстрат является как бы слепком его активного центра. Если субстрат подходит к активному центру фермента как ключ к замку, то реакция возможна. Но эта теория не могла объяснить групповую специфичность фермента.
В). Теория индуцированного соответствия КОШЛЕНДА дополнила теорию ФИШЕРА. Согласно ей молекула фермента - это не жёсткая, а гибкая структура. После связывания фермента с субстратом, изменяется КОНФОРМАЦИЯ активного центра фермента и всей молекулы субстрата. Они находятся в состоянии индуцированного соответствия. Это происходит в момент взаимодействия. Гипотеза КОТЛЕНДА получила название "рука-перчатка".
Лекция № 5.
ФЕРМЕНТЫ (продолжение).
1.Ингибиторы ферментативной активности.
2.Виды ИНГИБИРОВАНИЯ.
3.Активаторы ферментов.
4.Понятие об ИЗОФЕРМЕНТАХ.
ИНГИБИТОРЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ.
Ферменты - это катализаторы с регулируемой активностью. Ею можно управлять с помощью различных веществ. Действие фермента можно подавить или частично, или полностью, т.е. ИНГИБИРОВАТЬ определёнными химическими веществами, находящимися в организме или поступающими извне. Эти вещества называются ИНГИБИТОРАМИ.
По характеру действия ингибиторы делятся на 2 большие группы:
1.Обратимые - это соединения, которые НЕКОВАЛЕНТНО взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации.
2.Необратимые - это соединения, которые могут специфически связывать определенные функциональные группы активного центра фермента. Они образуют с ним прочные КОВАЛЕНТНЫЕ связи, поэтому такой комплекс трудно разрушить.
ВИДЫ ИНГИБИРОВАНИЯ
По механизму действия выделяют следующие виды ИНГИБИРОВАНИЯ:
1. КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное связыванием с активным центром фермента ингибитора, который по своей структуре близок к структуре субстрата. При этом и субстрат, и ингибитор могут взаимодействовать с ферментом, но они будут конкурировать за активный центр фермента, и связываться будет вещество, которого больше.
![]()
ПРИМЕР: СУКЦИНАТДЕГИДРОГЕНАЗНАЯ реакция.
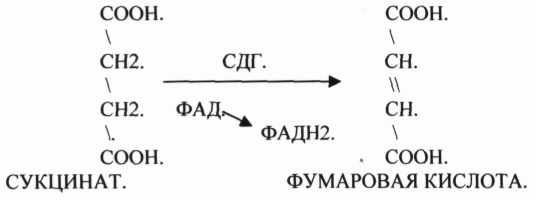
Конкурентным ингибитором данной реакции является МАЛОНОВАЯ кислота, поэтому с активным центром фермента связывается и та, и другая кислота, в зависимости от их соотношения в растворе. Чтобы снять частично или полностью действие конкурентного ингибитора, нужно повысить концентрацию субстрата. При этом весь фермент будет находиться в форме фермент-субстратного комплекса, а доля комплекса фермент-ингибитор будет резко понижаться, поэтому скорость ферментативной реакции может быть максимальной даже в присутствии ингибитора. Многие лекарственные препараты действуют по типу конкурентного ингибитора. При этом они тормозят активность ряда ферментов, необходимых для функционирования бактериальных клеток. Примером является применение СУЛЬФАНИЛА (СА). При различных инфекционных заболеваниях, которые вызываются бактериями, применяются СА препараты. Эти препараты имеют структурное сходство с ПАРААМИНОБЕНЗОЙНОЙ кислотой, которая используется бактериями для синтеза ФОЛИЕВОЙ кислоты, необходимой для роста и размножения бактерий.
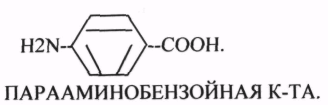

Введение СА приводит к ИНГИБИРОВАНИЮ фермента бактерий, которые синтезируют ФОЛИЕВУЮ кислоту. Нарушение синтеза этой кислоты проводит к нарушению роста микроорганизмов и их гибели.
По принципу конкурентных ингибиторов действует целая группа различных препаратов -это АНТИХОЛИНЭСТЕРАЗЫ. Они являются конкурентными ингибиторами фермента
ХОЛИНЭСТЕРАЗЫ, катализирующего ГИДРОЛИЗ АЦЕТИЛХОЛИНА. АЦЕТИЛХОЛИН обеспечивает проведение нервного импульса. АНТИХОЛИНЭСТЕРАЗЫ конкурируют с АЦЕТИЛХОЛИНОМ за активный центр фермента ХОЛИНЭСТЕРАЗЫ. В результате этого распад АЦЕТИЛХОЛИНА тормозится, он накапливается в организме, вызывая нарушение проведения нервного импульса.
2.НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное влиянием ингибитора на каталитическое превращение субстрата. При этом ингибитор не влияет на связывание фермента с субстратом. Неконкурентный ингибитор может связываться либо с каталитическими группами активного центра фермента, либо вне активного центра фермента, но при этом он изменяет КОНФОРМАЦИЮ фермента и затрагивает каталитический участок его активного центра. При неконкурентном ИНГИБИРОВАНИИ, возможно образование тройного комплекса.
![]()
В качестве неконкурентного ингибитора выступают ЦИАНИДЫ. Они прочно связываются с ионами железа, которые входят в состав каталитического ГЕМИНОВОГО фермента -ЦИТОХРОМОКСИДАЗЫ. Этот фермент является одним из компонентов дыхательной цепи. Блокирование дыхательной цепи выключает её из работы, что приводит к мгновенной гибели организме. Примером неконкурентного ингибитора являются соли тяжёлых металлов. Они блокируют -SH группы, которые входят в каталитический участок фермента. При этом образуется F-I комплекс. Он способен присоединять субстрат, но дальнейшего превращения субстрата не происходит, т.к. каталитические группы фермента заблокированы. Реакция непродуктивна. Снять действие неконкурентного ингибитора очень сложно, т.к. ионы металлов очень прочно связываются с активным центром фермента. Действие этого ингибитора можно снять только с помощью специальных веществ - РЕАКТИВАТОРОВ.
3.СУБСТРАТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное избытком субстрата. При этом образуется F-S комплекс, но он не подвергается каталитическим превращениям, т.к. делает молекулу фермента неактивной. Действие субстратного ингибитора снимается путём уменьшения концентрации субстрата.
4.АЛЛОСТЕРИЧЕСКОЕ ИНГИБИРОВАНИЕ характерно для ферментов, имеющих четвертичную структуру, молекула которых состоит из нескольких единиц (ПРОТОМЕРОВ). АЛЛОСТЕРИЧЕСКИЕ ферменты могут иметь 2 и более единиц. При этом одна имеет каталитический центр и называется каталитической, а другая - АЛЛОСТЕРИЧЕСКИЙ центр и называется регуляторной. В отсутствии АЛЛОСТЕРИЧЕСКОГО ИНГИБИТОРА субстрат присоединяется к каталитическому центру, и идёт обычная каталитическая реакция. При появлении АЛЛОСТЕРИЧЕСКОГО ИНГИБИТОРА, он присоединяется к регуляторной единице, т.е. к АЛЛОСТЕРИЧЕСКОМУ центру, и изменяет КОНФОРМАЦИЮ центра фермента, в результате этого активность фермента снижается.
АКТИВАТОРЫ ФЕРМЕНТОВ.
Это вещества, повышающие скорость ферментативной реакции. Выделяют несколько групп активаторов:
1. Соляная кислота - активатор пепсина. Желчные кислоты - активаторы ЛИПАЗЫ.
2. Ионы различных металлов
Некоторые ферменты для проявления ферментативной активности требуют присутствия ионов нескольких металлов. Ионы металлов в разных случаях могут быть или донорами, или акцепторами электронов. Некоторые ионы металлов способны присоединять субстрат к активному центру фермента, т.е. способствуют образованию F-S комплекса.
3. Активация некоторых ферментов осуществляется путём частичного ПРОТЕОЛИЗА. Эти ферменты действуют в основном в ЖКТ. Они вырабатываются в неактивной форме, а именно, в форме ПРОФЕРМЕНТА. Активация таких ферментов происходит путём разрыва одной или нескольких ПЕПТИДНЫХ связей.
![]()
Из оставшейся части, после отнятия ГЕКСАПЕПТИДА, формируется новый фермент, отличающийся по ПРОСТРАНСТВЕННОЙ КОНФИГУРАЦИИ от неактивного ТРИПСИНОГЕНА, а также формой активного центра ТРИПСИНА.
4. АЛЛОСТЕРИЧЕСКАЯ АКТИВАЦИЯ ферментов характерна для АЛЛОСТЕРИЧЕСКИХ ферментов. Активатор присоединяется к АЛЛОСТЕРИЧЕСКОМУ центру и влияет на КОНФОРМАЦИЮ активного центра фермента, делает её КОМПЛЕМЕНТАРНОЙ молекуле субстрата.
ПОНЯТИЕ ОБ ИЗОФЕРМЕНТАХ.
ИЗОФЕРМЕНТЫ - это семейство или группа ферментов, катализирующих одну реакцию, но различающихся по некоторым физико-химическим свойствам:
по АК составу;
по последовательности АК;
по молекулярной массе;
по электрофоретической подвижности;
по способам регуляции.
ИЗОФЕРМЕНТЫ называют ещё молекулярными формами фермента, причём физико-химические различия в их формах возникли, вследствие генетического различия в первичной структуре белка. Множественные формы ферментов - это модификации одного фермента, у которого различия в физико-химических свойствах возникли не вследствие генетических причин, а вследствие каких-то внешних воздействий.
ЛДГ (ЛАКТАТДЕГИДРОГЕНАЗА) имеет 5 ИЗОФОРМ, каждая из которых является ТЕТРОМЕРОМ - состоит из 4 СУБЪЕДИНИЦ Н и М типов.
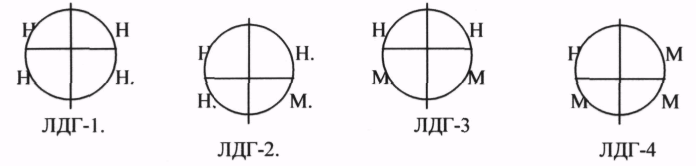
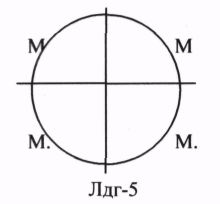
ИЗОФЕРМЕНТЫ отличаются строгой органной специфичностью. В миокарде, почках наиболее активна ЛДГ-1, ЛДГ-2. Для печени и мышц наиболее активны ЛДГ-4, ЛДГ-5. Определение активности ИЗОФЕРМЕНТОВ имеет диагностическое значение. При патологии печени в сыворотке крови резко возрастает активность ЛДГ-4, ЛДГ-5.
Лекция № 6.
ФЕРМЕНТЫ (продолжение).
1. КЛАСИФИКАЦИЯ ФЕРМЕНТОВ.
2. НОМЕНКЛАТУРА ФЕРМЕНТОВ.
3. ФЕРМЕНТЫ В МЕДИЦИНЕ.
КЛАССИФИКАЦИЯ ФЕРМЕНТОВ.
Всего насчитывается 1800 ферментов, из них в чистом виде выделено 150. В 1961 г. в Москве состоялась международная комиссия по классификации и номенклатуре ферментов.
Согласно её работе, все ферменты были разделены на 6 классов, каждый из которых указывает тип каталитической реакции.
1. ОКСИДОРЕДУКТАЗЫ.
2. ТРАНСФЕРАЗЫ.
3. ГИДРОЛАЗЫ.
4. ЛИАЗЫ.
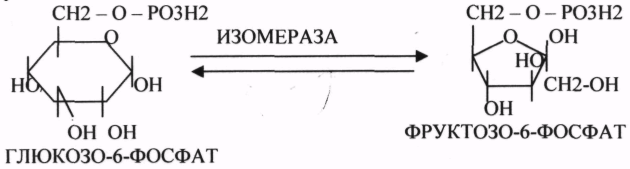
5. ИЗОМЕРАЗЫ.
6. ЛИГАЗЫ.
Каждый класс делится на подклассы. Они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на ПОДПОДКЛАССЫ, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента. ПОДПОДКЛАСС может указывать на химическую природу акцептора.
1 .Оксидоредуктазы.
Ферменты этого класса участвуют в ОВР (окислительно-восстановительные реакции), т.е. в реакциях транспорта электронов и протонов. Это наиболее многочисленный класс ферментов: насчитывается более 400 ОКСИДОРЕДУКТАЗ. Здесь выделяют 17 подклассов.
1.АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ.
Они участвуют в реакциях ДЕГИДРИРОВАНИЯ, при этом они отнимают атомы Н2 от окисленного субстрата и транспортируют их на О2.

Некоторые АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ называют ОКСИДАЗАМИ. Например, ОКСИДАЗЫ АК.
![]()
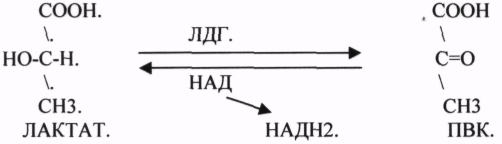
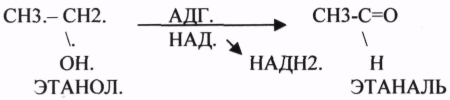
2.АНАЭРОБНЫЕ ДГ.
Эти ферменты также участвуют в реакциях ДЕГИДРИРОВАНИЯ, т.е. отнятия Н2 от окисляемого субстрата и транспортировка его на любой др. субстрат, кроме О2.
3.ПЕРОКСИДАЗЫ.
Это группа ферментов, которые отнимают Н2 от окисляемого субстрата и транспортируют его на ПЕРОКСИД.

КАТАЛАЗА катализирует разложение Н2О2 до Н2О и молекулярного О2
![]()
4.ЦИТОХРОМЫ.
Они содержат в своем составе ГЕМ, а следовательно ионы железа, степень окисления которого может изменяться. ЦИТОХРОМЫ участвуют в транспорте только электронов.
2.ТРАНСФЕРАЗЫ.
Ферменты этого класса участвуют в транспорте атомных групп от одного субстрата к другому. Субстрат, от которого группа отнимается, является донором, а субстрат, который её принимает, является акцептором. В зависимости от переносимых групп, ТРАНСФЕРАЗЫ делятся на несколько подклассов:
1.АМИНОТРАНСФЕРАЗЫ. Они участвуют в реакциях ПЕРЕАМИНИРОВАНИЯ.

АСАТ - АСПАРАГИНОВАЯ АМИНОТРАНСФЕРАЗА.
2.МЕТИЛТРАНСФЕРАЗЫ (СНЗ группы).
3.ФОСФОТРАНСФЕРАЗЫ (ФОСФАТНЫЕ группировки).
4.АЦИЛТРАНСФЕРАЗЫ (кислотные остатки).
3.Гидролазы.
Ферменты этого класса участвуют в реакциях разрыва связей в молекулах субстратов при участии воды. При этом элементы воды присоединяются к свободным единичным валентностям, образовавшимся после разрыва связей. Т.о. сложные органические соединения распадаются на простые - каталитические реакции гидролиза. В зависимости от разрушаемых связей, различают следующие подгруппы ГИДРОЛАЗ.
1.ЭСТЕР АЗЫ действуют на СЛОЖНО-ЭФИРНЫЕ связи. К ним относятся ЛИПАЗЫ, ФОСФОЛИПАЗЫ, ХОЛЕСТЕРАЗЫ.

2.ГЛИКОЗИДАЗЫ - действует на ГЛИКОЗИДНУЮ связь, находящуюся в сложных углеводах. К ним относятся АМИЛАЗА, САХАРАЗА, МАЛЬТАЗА, ГЛИКОЗИДАЗЫ, ЛАКТАЗА.

3.ПЕПТИДАЗЫ участвуют в разрыве ПЕПТИДНЫХ связей в белках. К ним относятся ПЕПСИН, ХИМОТРИПСИН, АМИНОПЕПТИДАЗА, КАРБОКСИПЕПТИДАЗА и т.д.
4.Лиазы.
Ферменты, отщепляющие определенную группу от S не гидролитическим путем, без участия воды или присоединяющие воду по месту разрыва двойной связи.
1 .ДЕКАРБОКСИЛАЗЫ участвуют в реакциях ДЕКАРБОКСИЛИРОВАНИЯ.
2.Ферменты, участвующие в разрыве связей между атомами углеводов не ГИДРОЛИТИЧЕСКИМ путём без участия воды. К ним относится АЛЬДОЛАЗА.
3.Ферменты, участвующие в реакциях ГИДРАТАЦИИ и ДЕГИДРАТАЦИИ.
5. Изомеразы.
Ферменты этого класса участвуют в ИЗОМЕРИЧЕСКИХ превращениях. При этом один структурный изомер может превращаться в другой, за счёт внутримолекулярной перегруппировки атомов.