
- •Государственное бюджетное образовательное учреждение
- •1. Тематические разделы дисциплины «химия общая и неорганическая»
- •1. 1. Растворы. Способы выражения концентрации растворов
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.2. Введение в титриметрический анализ. Метод нейтрализации
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.3. Оксидиметрия. Перманганатометрия.
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.4. Элементы химической термодинамики
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.5. Энергетика химических процессов
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.6. Коллигативные свойства растворов. Осмос
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.7. Водородный показатель среды растворов – ph
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.8. Буферные системы
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.9 Строение атома
- •Ядро атома
- •Изотопы
- •Современные представления о строении атома
- •Электронные семейства элементов
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания
- •2) Могут
- •Контрольные задания
- •Литература
- •1.10. Химическая связь
- •1. Ионная связь
- •2. Ковалентная связь
- •3. Координационная связь – (донорно-акцепторная) может рассматриваться, как результат наложения ионных и ковалентных связей
- •4. Металлическая связь
- •5. Водородная связь – одна из разновидностей межмолекулярного взаимодействия
- •6. Межмолекулярное взаимодействие
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания
- •Контрольные задания
- •Литература
- •1.11. Комплексные соединения
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания
- •Контрольные задания
- •Литература
- •2. Инструкция по охране труда и пожарной безопасности для студентов при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •2.5. Требования безопасности по окончании работы
- •Заключение
- •Глоссарий
- •Ответы на тестовые задания
- •Приложения
- •1. Основные физико-химические константы
- •2. Важнейшие единицы си и их соотношение с единицами других систем
- •3. Приставки для дольных и кратных единиц си
Тестовые задания для самоконтроля
Выберите один правильный ответ
01. ВЫБЕРИТЕ ПРАВИЛЬНОЕ ПОЛОЖЕНИЕ ГЛАЗ ПРИ ОПРЕДЕЛЕНИИ ОБЪЕМА РАСТВОРА В БЮРЕТКЕ
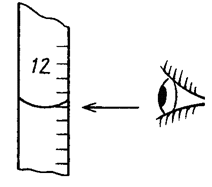


1)
2)
![]() 3)
3)![]()
02. РАСЧЕТЫ РЕЗУЛЬТАТОВ ОПРЕДЕЛЕНИЙ В ТИТРИМЕТРИИ ОСНОВАНЫ НА ЗАКОНЕ
1) кратных отношений
2) действующих масс
3) Авогадро
4) эквивалентов
03. ВЕЛИЧИНА рН В ТОЧКЕ ЭКВИВАЛЕНТНОСТИ БОЛЬШЕ 7 ПРИ ТИТРОВАНИИ:
1) сильной кислоты сильным основанием
2) слабой кислоты сильным основанием
3) сильного основания сильной кислотой
4) слабого основания сильной кислотой
04. ОБЪЕМ (МЛ) ДЕЦИМОЛЯРНОГО РАСТВОРА NаOH, НЕОБХОДИМЫЙ ДЛЯ ДОСТИЖЕНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ ПРИ ТИТРОВАНИИ 8,0 МЛ РАСТВОРА H2SO4 С МОЛЯРНОЙ КОНЦЕНТРАЦИЕЙ ЭКВИВАЛЕНТА 0,1 МОЛЬ·ДМ-3 РАВЕН:
1) 4,0 мл
2) 16,0 мл
3) 8,0 мл
4) 0,8 мл
05. КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ -
1) слабые неорганические кислоты или основания, окраска которых изменяется при изменении рН среды
2) слабые органические кислоты или основания, окраска которых изменяется при изменении рН среды
3) сильные органические кислоты или основания, окраска которых изменяется при изменении рН среды
4) сильные неорганические кислоты или основания, окраска которых изменяется при изменении рН среды
06. ПРИ ТИТРОВАНИИ РАСТВОРА ЩАВЕЛЕВОЙ КИСЛОТЫ (Н2С2О4) ИЗРАСХОДОВАНО 20 МЛ РАСТВОРА NAOH С МОЛЯРНОЙ КОНЦЕНТРАЦИЕЙ 0,1 МОЛЬ·ДМ-3. МАССА КИСЛОТЫ (МГ) В РАСТВОРЕ РАВНА:
1) 135
2) 270
3) 45
4) 90
07. ЕСЛИ В МЕТОДЕ НЕЙТРАЛИЗАЦИИ В КАЧЕСТВЕ ТИТРАНТА ИСПОЛЬЗУЮТ ЩЕЛОЧЬ, ТО ТАКОЕ ОПРЕДЕЛЕНИЕ ОТНОСИТСЯ К:
1) ацидиметрии
2) алкалиметрии
3) окислительно-восстановительному титрованию
4) комплексонометрии
08. ВЕЩЕСТВА, КОТОРЫЕ ИСПОЛЬЗУЮТ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ ДЛЯ ФИКСИРОВАНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ, НАЗЫВАЮТСЯ:
1) эталонами
2) индикаторами
3) катализаторами
4) ингибиторами
09. ПРИ ТИТРОВАНИИ 20 МЛ РАСТВОРА УКСУСНОЙ КИСЛОТЫ ЗАТРАЧЕНО 16 МЛ РАСТВОРА КОН С МОЛЯРНОЙ КОНЦЕНТРАЦИЕЙ 0,15 МОЛЬ·ДМ-3. МАССА СН3СООН В 200 МЛ ЭТОГО РАСТВОРА РАВНА:
1) 1,44 г
2) 5,6 г
3) 7,2 г
4) 4,32 г
10. НА ТИТРОВАНИЕ V(NA2B4O7.10H2O) МЛ РАСТВОРА ТЕТРАБОРАТА НАТРИЯ С КОНЦЕНТРАЦИЕЙ С(½NA2B4O7.10H2O) ИЗРАСХОДОВАНО V(HCl) МЛ РАСТВОРА HCl. ТИТР СТАНДАРТНОГО РАСТВОРА HCl T(HCl) РАССЧИТЫВАЮТ ПО ФОРМУЛЕ
-
1)

2)

3)

4)
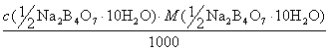
Контрольные задания
11. Определить молярную концентрацию натрия гидроксида в растворе, если массовая доля его в растворе составляет 26%. (ρ = 1,3 г/см3).
12. Рассчитать массовую долю (%) серной кислоты в растворе (ρ = 1,12 г/см3) с молярной концентрацией эквивалента серной кислоты С(½Н2SO4) = 0,5 моль/дм3.
13. При ожогах щелочами пораженный участок кожи в течение 5-10 минут промывают водой, а затем нейтрализуют раствором уксусной кислоты с массовой долей 1%. Какая масса уксусной эссенции с массовой долей кислоты 60% необходима для приготовления 1%-ного раствора массой 600 г?
14. В медицине применяется 5%-ный спиртовой раствор йода для обработки ран, ссадин, операционного поля. Какой объем 5%-ного спиртового раствора йода можно приготовить из 10 г кристаллического йода? Плотность раствора 0,950 г/мл.
15. При укусах муравьев, при соприкосновении с крапивой на коже возникает чувство жжения за счет действия муравьиной кислоты. Какая масса муравьиной кислоты может быть нейтрализована с помощью 10 мл 2%-ного раствора NaHCO3, плотность которого равна 1,013 г/мл?
