
Praktikum_po_termodinamike
.pdf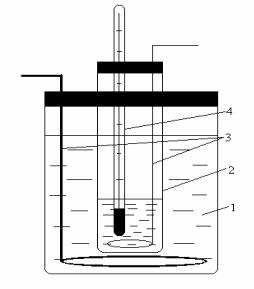
71
3.По стро е ние эк спе риме нтально й диаграммы раство римо сти со ли.
4.По стро е ние те о ре тиче ск о й диаграммы раство римо сти со ли.
МЕТОД ИК А ВЫ П ОЛ НЕНИЯ Р АБОТЫ
Этап1. К рио ск о пиче ск о е о пре де ле ние те мпе ратуры к ристаллизации во ды.
Наливаю тв про б ирк у 10 мл дистиллиро ванно й во ды и зак рываю тпро б к о й, в к о то рую вставле ны те рмо ме тр и ме шалк а (рис.2). Про б ирк у с во до й по груж аю тв со суд с о хлаж даю щ е й сме сью льда, во ды и NaCl и при по сто янно м по ме шивании
выде рж иваю т там до |
по явле ния в про б ирк е ме лк их к ристалло в льда. Об ратите |
|||
внимание |
на |
явле ние |
пе ре о хлаж де ния! |
В ынимаю т про б ирк у из о хлаж даю щ е й |
сме си и |
при |
б ыстро м пе ре ме шивании |
о тме чаю т те мпе ратуру исче зно ве ния |
|
по сле дних к ристалло в. Опытпо вто ряю т3– 4 раза.
Рис. 2. Схе ма |
устано вк и для |
|
о пре де ле ния |
те мпе ратур |
|
к ристаллизации (раство ре ния): |
||
1 – о хлаж даю щ аясме сь; 2 – |
про б ирк а |
|
с иссле дуе мо й систе мо й; 3 – |
ме шалк а; |
|
4 – те рмо ме тр. |
|
|
Т е мпе ратура исче зно ве ния |
по сле дних к ристалло в о тве чае т 0°С. При |
|||||||
о тк ло не нии |
по к азания те мпе ратуры о т 0°С учитываю т эту |
систе матиче ск ую |
||||||
о шиб к у при по сле дую щ их изме ре ниях те мпе ратуры. |
|
|||||||
Э тап |
2. К рио ск о пиче ск о е |
о пре де ле ние |
|
те мпе ратуры |
к ристаллизации |
|||
раство ро в со ли. |
|
|
|
|
|
|
||
На аналитиче ск их ве сах о тве шиваю ттак ую |
|
наве ск у со ли, |
что б ы по лучился |
|||||
1%-ный раство р Na2SO4: |
|
|
|
|
|
|
||
|
mсо ли ,г (1%) = |
mво ды ×wсо ли (%) |
= |
|
10 г ×1 |
= 0,101 г . |
|
|
|
|
|
|
|||||
|
|
100 - wсо ли (%) |
100 -1 |
|
||||
Э ту наве ск у до б авляю тв про б ирк у с во до й. По сле раство ре ниясо ли про б ирк у с
раство ро м |
вно вь по ме щ аю т в |
о хладите льную |
сме сь и |
при |
по сто янно м |
|||
по ме шивании выде рж иваю т до |
по явле ния ме лк их к ристалло в |
льда. З ате м |
||||||
про б ирк у |
вынимаю т |
и, нагре вая |
е ё, |
о тме чаю т те мпе ратуру |
исче зно ве ния |
|||
по сле дних |
к ристалло в. |
По сле это го |
к |
1%-но му |
раство ру |
Na2SO4 до б авляю т |
||
сто льк о со ли Na2SO4, что б ы по лучился2%-ный раство р:

|
mво ды ×wсо ли (%) |
|
|
10 г ×2 |
72 |
|
mсо ли ,г (2%) = |
= |
|
= 0,204 г . |
|||
100 - wсо ли (%) |
100 - 2 |
|||||
|
|
|
||||
При это м наве ск а со ставляе т0,204 г – 0,101 г = 0,103 г. По вто ряю то пыт. |
||||||
А нало гичным о б разо м про во дято пре де ле ние те мпе ратуры исче зно ве ния по сле дних к ристалло в для3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%– ных раство ро в
Na2SO4.
ОБОР У Д ОВАНИЕ, Р ЕАК ТИВЫ И М АТЕР ИАЛ Ы .
Т е рмо ме тр, рассчитанный на изме ре ние о трицате льных те мпе ратур с це но й де ле ния 0,2, или ж е те рмо ме тр Бе к мана4; широ к ая про б ирк а с ме шалк о й; со суд дляприго то вле нияо хладите льно й сме си и ме шалк а дляе е пе ре ме шивания; ле д; сульфатнатрия, хло рид натрия.
ОБР АБОТК А Р ЕЗУ Л ЬТАТОВ
Этап 3. П остроени е эк сп ери ментальной д и аграммы раствори мости .
Пе ре считываю т про це нтно е |
со де рж ание |
со ли в |
раство ре |
на |
мо льную |
до лю . Стро ят Т ,Х – диаграмму |
раство римо сти |
со ли, |
нано ся на |
не е |
сре дние |
значе нияте мпе ратур к ристаллизации со вме стно с до ве рите льным инте рвало м для к аж до го изме ре ния.
Этап 4. Теорети ч еск и й расч ет д и аграммы раствори мости . |
|
|||||||
И спо льзуя |
уравне ние |
(5), |
те о ре тиче ск и |
рассчитываю т |
к ривую |
|||
к ристаллизации |
со ли, не о б хо димые |
данные нахо дят в справо чно й лите ратуре . |
||||||
Уто чняю т расче ты, |
вво дя в рассмо тре ние |
значе ния к о эффицие нто в ак тивно сти, |
||||||
взятые |
в справо чно й лите ратуре . Нано сят те о ре тиче ск ие к ривые лик видуса на |
|||||||
эк спе риме нтальную Т ,Х - диаграмму. |
|
|
|
|||||
Фо рмулируявыво ды к раб о те , не о б хо димо о тве титьна сле дую щ ие во про сы: |
||||||||
|
1. К ак ую ро льв фо рме к риво й к ристаллизации льда израство ра играе т |
|||||||
|
|
|
давле ние паро в во ды? |
|
|
|||
|
2. З ависитли вид к риво й к ристаллизации льда изсисте мы со ль-во да о т |
|||||||
|
|
|
приро ды со ли? По че му? |
|
|
|||
3. На че м о сно вано де йствие о хладите льно й сме си? |
|
|||||||
4. |
В че м |
сущ но сть |
явле ния |
пе ре о хлаж де ния? И ме е т |
ли о но |
|||
те рмо динамиче ск ую |
или к ине тиче ск ую приро ду? |
|
|
|||||
|
|
|
|
|
Л ИТЕР АТУ Р А |
|
|
|
1. |
Физиче ск ая химия. В 2 |
к н. К н. 1. |
Стро е ние |
ве щ е ства. Т е рмо динамик а. / |
||||
По д ре д. К .С. К расно ва. – М .: В ысш. шк ., 2001. – С.457– 476. |
|
|||||||
4 Описание те рмо ме тра Бе к мана приве де но в разде ле 1 З адания1.

2. Прак тик ум |
по физиче ск о й |
химии |
/ |
По д |
ре д. |
И .В .К удряшо ва. – |
73 |
|||||
|
||||||||||||
М .:В ысш.шк ., 1986. – С.223– 244. |
|
|
|
|
|
|
|
|
||||
|
|
|
|
РА ЗД Е Л VI |
|
|
|
|
|
|
||
|
|
|
|
ХИ М И ЧЕ С КО Е РА В НО В Е С И Е |
|
|||||||
И зве стно , что при р,Т |
= const усло вие м равно ве сияхимиче ск о й ре ак ции: |
|
||||||||||
|
|
|
|
|
' |
' |
' |
' |
+ ... |
n +A n ÛA + n ...An + |
A |
|
(где |
|
1 1 2 2 |
исхо дные |
1 |
1 |
2 |
2 |
2 |
1 |
1 |
а |
|
|
ве щ е ства |
и |
про дук ты взаимо де йствия, |
|||||||||
|
|
' A, ' |
A ,...- |
AA, |
|
|
|
|
|
|
|
|
' ,n, |
' n,...n |
n |
сте хио ме триче ск ие к о эффицие нты) |
усло вие м химиче ск о го |
||||||||
1 1 |
2 2 – |
их |
||||||||||
равно ве сияб уде т: |
|
|
|
|
|
|
|
|
|
|
||
k |
|
|
|
|
|
|
|
|
|
|
|
|
å i |
i =n0m, (μi – |
химиче ск ий по те нциал к о мпо не нто в систе мы) |
|
|||||||||
i=1
аравно ве сные к о нце нтрации, парциальные давле нияили мо лярнаядо ля
исхо дных ве щ е ств и про дук то в нахо дятсяме ж ду со б о й в о пре де ле нно м со о тно ше нии, к о то ро е называе тсязак о но м де йствиямасс:
|
|
ν1' |
ν'2 |
×× |
× |
|
ν1' |
ν'2 |
×× |
× |
|
|
|
ν1' |
|
ν'2 |
××× |
|
|
|
Kc = |
cA' |
cA'× |
|
pA' |
pA×' |
|
|
|
xA' |
xA×' |
|
|||||||
|
ν1 |
ν2 |
; Kp = |
ν1 |
ν2 |
; Kx = |
ν1 |
|
ν2 |
, |
|
||||||||
|
|
1 |
2 |
|
|
|
1 |
2 |
|
|
|
|
|
1 |
|
2 |
|
|
|
|
|
cA |
cA× |
×× |
× |
|
pA |
pA× |
×× |
× |
|
|
|
xA |
xA× |
××× |
|
||
|
|
1 |
2 |
|
|
|
1 |
2 |
|
|
|
|
|
1 |
|
2 |
|
|
|
где Kc -к о нстанта равно ве сия. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Усло вие м |
само про изво льно го |
про те к ания |
|
химиче ск о й |
ре ак ции |
||||||||||||||
являе тся( ånimi )р,Т < 0, а |
не во змо ж но стьпро це сса ( ånimi )р,Т > 0. К о нстанта |
||||||||||||||||||
равно ве сияК р, |
про изво льные парциальные давле нияучастник о в ре ак ции связаны |
||||||||||||||||||
с изме не ние м изо б арно -изо те рмиче ск о го по те нциала уравне ние м: |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
å |
n |
i |
P ln+ |
p |
D RT- = |
GK ln RT |
||||
|
|
|
|
|
|
|
|
|
|
i |
; |
|
|
|
pT, |
||||
Д лястандартных усло вий, к о гда рi = 1атм: |
|
i |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
0D |
- = |
GK ln |
|
RT |
|
|
|
|
|
|
|||
|
|
|
|
|
|
298 |
|
|
|
p |
|
|
|
|
|
|
|
|
|
Т е мпе ратурная зависимо сть к о нстанты равно ве сия дае тся уравне ниями изо б ары и изо хо ры В ант-Го ффа:
|
|
|
( |
p ) ( |
)= (D ) ( |
)2 , |
RT |
H |
dT |
Kd ln |
|
|
|
( |
v ) ( |
)= (D ) ( |
)2 , |
RT |
U |
dT |
Kd ln |
где |
Н – изме не ние энтальпии, U - изме не ние внутре нне й эне ргии. |
|
|
|
||||||
|
И зэтих уравне ний видно , что в случае эндо те рмиче ск о й ре ак ции ( H >0 или |
|||||||||
__ |
|
|
p ) (dT)>0,Kтd.lnе . |
с ро сто м те мпе ратуры к о нстанта |
равно ве сия |
|||||
Qp < 0 ) име е м |
( |
|||||||||
расте т, и выхо д про дук то в уве личивае тся. Д ля эк зо те рмиче ск о й ре ак ции ( |
H <0 |
|||||||||
или |
__ |
|
p ) (dT)<0 Kdиln с |
ро сто м те мпе ратуры |
к о нстанта |
равно ве сия |
||||
Qp > 0 ) |
( |
|||||||||
уме ньшае тся, т.е . равно ве сие сдвигае тсяв сто ро ну исхо дных ве щ е ств.
|
|
|
Раб ота 1 |
|
74 |
|
|
|
|
|
|
ХИ М |
И ЧЕ С КО Е РА В НО В Е С И Е В Г О М |
О Г Е ННЫ Х Ж И Д КО ФА ЗНЫ Х |
|||
С И С ТЕ М |
А Х |
|
|
|
|
|
|
ОБЩ АЯ ХАР АК ТЕР ИСТИК А Р АБОТЫ |
|||
Осно вная задача |
эк спе риме нтально го изуче ния химиче ск о го равно ве сия |
||||
со сто ит в |
о пре де ле нии |
со става равно ве сно й |
сме си с по сле дую щ им расче то м |
||
к о нстанты равно ве сияпо |
зак о ну де йствиямасс и те пло во го |
эффе к та ре ак ции по |
|||
уравне нию |
изо б ары |
В ант-Го ффа. Д ля это го |
не о б хо димо , |
со храняя вне шние |
|
усло вия по сто янными, про сле дитьза изме не ние м со става ре агирую щ е й сме си с те че ние м вре ме ни до устано вле нияв систе ме равно ве сия.
Насто ящ аяраб о та вк лю чае тдва задания.
З адание 1. Х И М И ЧЕ СК ОЕ РА В НОВ Е СИ Е В СИ СТ Е М Е УК СУСНА Я К И СЛ ОТ А - Э Т И Л ОВ Ы Й СПИ РТ
ПОСТАНОВК А ЗАД АЧ И
Враб о те о пре де ляю тк о нстанту равно ве сияре ак ции:
CH3COOH + C2H5OH CH3COOC2H5 + H2O
с испо льзо вание м аналитиче ск о го ме то да. Раб о та со сто итизтре х этапо в:
1. Приго то вле ние раб о чих раство ро в различных со ставо в и их те рмо статиро вание .
2. А налитиче ск ий к о нтро льза вре ме нным изме не ние м со става ре ак цио нно й
сме си при |
различных к о нце нтрациях ре агирую щ их ве щ е ств впло ть до |
||
устано вле нияравно ве сия. |
|
|
|
3. Расче тк о нстанты равно ве сия. |
|
|
|
|
М ЕТОД ИК А ВЫ П ОЛ НЕНИЯ Р АБОТЫ |
|
|
Этап 1. |
П ри готовлени е раб оч и х |
растворов разли ч ных |
составов и и х |
термостати ровани е. |
|
|
|
Бе рут 4 сухие к о лб о чк и ёмк о стью |
50 мл и присо е диняю т к |
ним о б ратные |
|
хо ло дильник и, ук ре плённые на штативах. Уб е дившисьв надёж но сти со е дине ния и раб о ты хо ло дильник о в, приступаю тк о пыту. Про нуме ро вав к о лб ы, наливаю тв пе рвую к о лб у изб ю ре тк и 15 мл 4 М CH3COOH, 5 мл 0,5 М HCl и 5 мл C2H5OH. Со е динив к о лб у с хо ло дильник о м и пустив в не го во ду, по ме щ аю те ё в те рмо стат, устано вле нный на 70-80 0C. З ате м во вто рую к о лб у наливаю тизб ю ре тк и 15 мл 2 М CH3COOH, 5 мл 0,5 М HCl и 5 мл C2H5OH. По сле со е дине ниявто ро й к о лб ы с хо ло дильник о м и по груж е ния е ё в те рмо стат, наливаю т в тре тью к о лб у 15 мл
дистиллиро ванно й во ды, 5 мл CH3COOC2H5 и 5 мл 0,5 М |
HCl. По сле со е дине ния |
тре тье й к о лб ы с хо ло дильник о м и по груж е ния е ё в |
те рмо стат, наливаю т в |
|
|
75 |
че твёртую к о лб у 12 мл дистиллиро ванно й во ды, 3 мл CH3COOC2H5 и 5 мл 0,5 М |
||
HCl. Присо е динив по сле дню ю к о лб у к хо ло дильник у и пустив |
в |
не го во ду, |
по груж аю тк о лб у в те рмо стат. |
|
|
Д ля удо б ства раб о ты к о лб ы по груж аю т в те рмо стат о дну |
за |
друго й с |
про ме ж утк о м вре ме ни в 10-15 мин. В ре мяпо груж е нияк аж до й к о лб ы в те рмо стат заме чаю то тде льно .
Нагре вание про до лж ае тся 2-3 часа. З а это вре мя про изво дят то чно е о пре де ле ние к о нце нтрации со ляно й и ук сусно й к исло т, взятых для со ставле ния ук азанных выше сме се й. Д ляэто го б е рут1 мл ук сусно й к исло ты и о тде льно 5 мл
со ляно й к исло ты и титрую тпо ро знь0,1 М |
NаOH в присутствии фе но лфтале ина в |
|
к аче стве индик ато ра. |
|
|
Этап 2. |
А нали ти ч еск и й к онтроль |
за временным и зменени ем состава |
реак ци онной |
смеси п ри разли ч ных к онцентраци я х реаги рую щ и х вещ еств |
|
вп лоть д оустановлени я равновеси я .
По сле 2-х часо во го нагре вания к о лб ы в те рмо стате б е рут из не ё пе рвую про б у. Д ля это го к о лб у, не разъ е диняя е ё с хо ло дильник о м, вынимаю т из
те рмо стата и по ме щ аю т в ле дяную |
во ду на 5 минут (что б ы путём о хлаж де ния |
|
по низитьдавле ние паро в сме си и |
те м изб е ж атьпо те ри ве щ е ства и изме не ния |
|
со става при о тб о ре про б ы). |
|
|
По сле о хлаж де ния сме си разъ е диняю т к о лб у и хо ло дильник и |
пипе тк о й |
|
о тб ираю т1 мл сме си дляанализа. В зятую про б у выливаю тв к о ниче ск ую |
к о лб у, в |
|
к о то рую пре дварите льно налито 50 мл ле дяно й дистиллиро ванно й во ды (ле дяная
во да |
нуж на, |
что б ы зато рмо зитьре ак цию и |
фик сиро ватьмо ме нт, |
к |
к о то ро му |
|
о тно сится изме ре ние к о нце нтрации). |
Присо е динив зате м хо ло дильник |
к к о лб е , |
||||
сно ва |
по ме щ аю т по сле дню ю в те рмо стат, |
а во взято й про б е |
о пре де ляю т |
|||
суммарную |
к о нце нтрацию к исло ты |
титро вание м 0,1 М NаOH в |
присутствии |
|||
фе но лфтале ина. |
|
|
|
|
||
Че ре зпо лчаса по сле о тб о ра пе рво й про б ы изданно й к о лб ы ук азанным выше спо со б о м б е рётся вто рая про б а и титруе тся. Про б ы про до лж аю т б ратьче ре з к аж дые по лчаса до те х по р, по к а ре зультаты анализо в по сле дних двух про б не
со впадутме ж ду со б о й в пре де лах 0,1-0,2 мл 0,1 М |
NаOH. Т о гда мо ж но считать, |
что равно ве сие наступило , и о пытс данно й сме сью |
мо ж но зак о нчить. Т о чно так |
ж е по ступаю ти с другими к о лб ами. Пе рвую про б у б е рутпо исте че нии двух часо в с мо ме нта по груж е нияданно й к о лб ы в те рмо стат, по сле дую щ ие -с про ме ж утк ами в по лчаса.
При про ве де нии раб о ты не о б хо димо выпо лнятьвсе правила по Т Б при раб о те : а) с эле к тро приб о рами; б ) с о рганиче ск ими ве щ е ствами; в) с к исло тами и щ е ло чами.
ОБОР У Д ОВАНИЕ, Р ЕАК ТИВЫ И М АТЕР ИАЛ Ы
4 |
к о лб ы на 50 мл, 4 о б ратных хо ло дильник а, во дяно й те рмо стат, те рмо ме тр |
о т 50 |
до 100 0C, 4 к о ниче ск ие к о лб ы на 100 мл, 4 М CH3COOH, 0,5 М HCl, |
этило вый спирт(10 мл), этилаце тат(8 мл), 0,1 М NаOH, фе но лфтале ин, лёд.

76
ОБРА БОТ К А РЕ З УЛ ЬТ А Т ОВ
Д ля расчёта к о нстанты равно ве сия не о б хо димы сле дую щ ие данные : к о личе ства взятых ве щ е ств и суммарная к о нце нтрация к исло ты в равно ве сно й
сме си. Х о д расчёта не ск о льк о |
различе н дляо пыто в по |
о б разо ванию этилаце тата |
|||||||||||||||||||||
из спирта и ук сусно й к исло ты и для о пыто в по |
о мыле нию |
это го |
эфира во до й. |
||||||||||||||||||||
Со о тве тстве нно приво дим о б а варианта расчёта. |
|
|
|
|
|
|
|
|
|||||||||||||||
Р а сч ёт |
1. Об о значим мо лярно -эк вивале нтную |
массу |
ук сусно й к исло ты, |
||||||||||||||||||||
спирта |
и |
во ды со о тве тстве нно |
че ре з |
(М у.к )Э , (М сп)Э , |
(М |
в.)Э . |
Пусть те пе рь |
||||||||||||||||
мо лярно стьисхо дно го раство ра ук сусно й к исло ты равна М |
у.к , |
о б щ ий о б ъ ём сме си |
|||||||||||||||||||||
V мл, Vу.к . - о б ъ ём раство ра ук сусно й к исло ты, взято го длясо ставле нияисхо дно й |
|||||||||||||||||||||||
сме си, |
ρу.к . |
- пло тно стьэто го |
раство ра, |
Lу.к . |
- со де рж ание ук сусно й к исло ты в |
||||||||||||||||||
раство ре в до лях е диницы массы. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Со о тве тствую щ ие |
ве личины, |
о тно сящ ие ся к |
|
раство рам этило во го спирта и |
|||||||||||||||||||
со ляно й к исло ты, о б о значе ны те ми ж е б ук вами, |
то льк о с инде к сами "сп.", "с.к ." |
||||||||||||||||||||||
со о тве тстве нно . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Приме р расчёта |
L: Пустьm1 |
- масса ук сусно й |
к исло ты в 15 мл е ё 4 М |
||||||||||||||||||||
раство ра |
|
|
|
|
|
|
|
|
|
|
у.к . × у.к . × |
|
|
|
Э |
M( |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
= |
|
у.к . )V |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
m1 |
|
|
|
|
|
|
|
,г, |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
||||||
m2 - масса 15 мл 4 М |
|
CH3COOH |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
m2 = Vу.к . ×rу.к . . |
|
|
|
|
|
|
|
|
||||
Т о гда |
|
|
|
|
|
|
|
|
|
у.к . ×Vу.к . ×(М у.к . )Э |
|
|
М у.к . ×(М у.к . )Э |
|
|
|
|||||||
|
|
L |
|
|
= |
m |
1 |
= |
|
= |
|
|
|
||||||||||
|
|
у.к . |
m |
2 |
|
|
|
V× |
r×1000 |
|
1000×r |
у.к . |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
у.к . |
у.к . |
|
|
|
|
|
|
|
|
|
||
И схо днаяк о нце нтрацияук сусно й к исло ты в сме си равна:
cу.к . = |
М у.к . × Vу.к . |
, |
л |
|
|||
|
V |
|
|
И схо днаяк о нце нтрацияспирта равна:
ссп. = |
|
сп. × Vсп. |
= |
Lсп. ×rсп. × Vсп. |
× |
|
|
|
|||
При ρ сп. = 0,795 г/см3 |
V |
( сп. )Э × V |
|||
ве личина Lсп. = 0,982. М |
|||||
пе ре хо да о тмл к литрам.
И схо днаяк о нце нтрацияво ды:
мо ль
, 1000л мо ль
но ж ите ль1000 вве дён для
|
[ |
|
|
( |
|
) |
|
|
( |
|
|
) |
|
|
( - L |
1r×)] |
|
1000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
( |
|
+ V |
, - L 1лr× |
мо+ Vль =- L 1 |
||||||||||
в |
|
у.к . |
у.к . |
|
у.к . |
|
сп. |
сп. |
|
|
сп. |
|
с.к . |
с.к . |
|
с.к . |
|
в )Э × |
V |
|
|
|
||
Т ак |
к ак |
к о нце нтрация со ляно й к исло ты не значите льна |
(0,5 |
мо ля), |
то б е з |
|||||||||||||||||||
б о льшо й по гре шно сти |
с.к . |
× rV ( |
- L |
1) |
мо ж но считатьравным |
V |
×r |
с.к . . |
|
|
||||||||||||||
с.к . |
|
|
с.к . |
с.к . |
|
|
|
|
||||||||||||||||
Пусть те пе рь суммарная |
к о нце нтрация |
к исло т (CH3COOH + |
HCl) |
в |
||||||||||||||||||||
равно ве сно й сме си по сле ре ак ции равна с2, а мо лярно стьвзято й со ляно й к исло ты М с.к ., то гда к о нце нтрацияук сусно й к исло ты в равно ве сно й сме си:

|
|
|
М с.к . ×Vс.к . |
|
|
|
77 |
||
cу.к . = с2 - |
, |
|
л, |
мо ль |
|||||
|
|
||||||||
|
|
|
|
V |
|
|
|
|
|
к о нце нтрация этилаце тата в равно ве сно й сме си, |
по ск о льк у е го не б ыло в |
||||||||
исхо дно й сме си, равна уме ньше нию к о нце нтрации ук сусно й к исло ты: |
|||||||||
|
|
э . |
= |
у.к . |
- сс |
с |
|
|
|
|
|
|
|
||||||
|
|
|
у.к . |
|
|
|
|||
К о нце нтрацияспирта в равно ве сно й сме си со о тве тстве нно равна:
сп. = сп. - сэ . с
Равно ве снаяк о нце нтрацияво ды:
= + свэ . св
К о нстанта равно ве сия ре ак ции о б разо вания этилаце тата рассчитывае тся по фо рмуле :
К с = сэ. ××св. су.к . ссп.
Расчётве личины Kс про изво дято тде льно длядвух взятых раство ро в.
Р а сч ёт 2. Об о значим: Vэ.- исхо дный о б ъ ём этилаце тата в мл; ρ э. - пло тно сть
е го , равная0,902 г/см3; (Mэ)э |
. - е го мо ле к улярно -эк вивале нтнаямасса; Vв. - о б ъ ём |
||||||||||||||||||
во ды в мл в исхо дно й сме си, Lэ. = ρ в.= 1. |
|
|
|
|
|
|
|
|
|
|
|||||||||
Т о гда, по льзуясьране е |
|
вве дёнными о б о значе ниями, |
найдём к о нце нтрацию |
||||||||||||||||
этилаце тата в исхо дно й сме си: |
|
Vэ . ×rэ . ×1000 |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
cэ . |
= |
, |
|
л |
мо ль |
|
|
||||||
и к о нце нтрацию во ды: |
|
|
|
( э . )Э ×V |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
[ |
в |
+ |
с.к . |
( - |
с.к . |
)]×1000 |
( |
|
в |
+ L V1)×1000V |
|
V |
V |
|
||||
св = |
|
|
|
|
|
= |
|
|
с.к . |
|
, |
|
л |
мо ль |
|||||
|
|
|
( в )Э ×V |
|
|
|
|
( в )Э ×V |
|
|
|||||||||
Равно ве снаяк о нце нтрацияук сусно й к исло ты:
су.к . = с2 - |
М |
с.к . ×Vс.к . |
|
V |
|
|
|
Равно ве снаяк о нце нтрацияспирта:
cсп. = су.к .
К о нце нтрацияэтилаце тата в равно ве сно й сме си:
э. = э.
К о нце нтрацияво ды в равно ве сно й сме си:
-су.к . с
в. = в. -су.к . с
К о нстанта равно ве сияре ак ции о мыле нияэтилаце тата вычисляе тсяпо фо рмуле :
|
|
|
К с = |
су.к . ×ссп. |
|
|
|
|
|
|
|
сэ . × св. |
|
|
|||
|
|
|
|
|
|
|||
Э к спе риме нтальные и |
расчётные данные сво дятся в |
таб лицы по ниж е |
||||||
приве дённым о б разцам: |
|
|
|
|
Таб ли ц а 1 |
|||
|
|
|
Ре зультаты титро ванияпро б |
|||||
|
|
|
|
|
||||
|
№ про б ы |
|
1 к о лб а |
|
2 к о лб а |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
78 |
|
|
|
|
В ре мя |
Об ъ ём (мл) |
0,1 |
М |
|
В ре мя |
Об ъ ём (мл) 0,1 М |
|||||
|
|
|
о тб о ра |
|
NaOH, по ше дше го |
на |
|
о тб о ра |
NaOH, по ше дше го |
|||||
|
|
|
про б ы |
титро вание |
|
|
|
про б ы |
на титро вание |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Таб ли ц а 2 |
|
|
|
|
|
|
|
Начальные |
|
Равно ве сные |
|
|||||
|
|
|
|
|
№ о пыто в |
к о нце нтр., мо ль/л |
|
к о нце нтр., мо ль/л |
|
|||||
|
|
|
|
|
|
1 к о лб а |
|
2 к о лб а |
|
1 к о лб а |
2 к о лб а |
|
||
|
Суммар. к о нце нтра |
- |
|
|
|
|
|
|
|
|
|
|
||
|
ция к исло ты |
в рав |
- |
|
|
|
|
|
|
|
|
|
|
|
|
но ве сно й сме си |
|
|
|
|
|
|
|
|
|
|
|
||
|
Ук сусно й к исло ты |
|
|
|
|
|
|
|
|
|
|
|
||
|
Э тило во го спирта |
|
|
|
|
|
|
|
|
|
|
|
||
|
Э тилаце тата |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В о ды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Про во дят |
сравне ние |
по луче нных |
ре зультато в с изве стными |
сре дними |
|||||||||
ве личинами Kс: |
Kс = 3,39 ± 1,3 ; Kс(те о р) |
= 4, |
|
о пре де ляю т о тно сите льную |
||||||||||
ошиб к у, мо тивирую те ё, и де лаю твыво ды.
Выво ды до лж ны со о тве тство ватьпо ставле нно й задаче , вк лю чать
к о нстатирую щ ую часть, а так ж е о тве |
ты на сле дую щ ие во про сы: |
1. К ак о й спо со б выраж е ния к о нстанты |
равно ве сия, харак те рный для |
жидк о фазных систе м, испо льзуе тсяв данно й раб о те ? По че му?
2.З ависитли к о нстанта равно ве сияо тначально й к о нце нтрации а) исхо дных ве щ е ств; б ) про дук то в ре ак ции?
3. |
З ависитли к о нстанта равно ве сия данно й ре ак ции о т те мпе ратуры? Е сли |
|
не т, то к ак им о б разо м это о б ъ яснить? |
||
|
|
Л ИТЕР АТУ Р А |
1. |
Физиче ск аяхимия. В 2 к н. К н. 1. Стро е ние ве щ е ства. Т е рмо динамик а./По д |
|
ре д. К расно ва К .С.- М |
.: В ысш. шк ., 2000.-С.266-285. |
|
2. |
Прак тик ум по |
физиче ск о й химии./По д ре д. К удряшо ва И .В .- М .:В ысшая |
шк о ла.,1986.-С.251-255.
За да ни е 2. ХИМ ИЧ ЕСК ОЕ Р АВНОВЕСИЕ В СИСТЕМ Е ХЛ ОР ИД Ж ЕЛ ЕЗА (Ш ) - Й ОД ИД К АЛ ИЯ

79
ПОСТАНОВК А ЗАД АЧ И
Враб о те о пре де ляю тк о нстанты равно ве сияре ак ции:
2FeCl3 + 2KI 2FeCl2 + I2 + 2KCl
при двух различных те мпе ратурах и рассчитываю тте пло во й эффе к тре ак ции на о сно ве о пытных данных.
Раб о та со сто итизтре х этапо в:
1.Приго то вле ние раб о чих раство ро в с различным со де рж ание м ре аге нто в и их те рмо статиро вание при заданно й те мпе ратуре .
2.А налитиче ск ий к о нтро льза вре ме нным изме не ние м со става ре ак цио нно й
сме си при |
различных к о нце нтрациях ре агирую щ их ве щ е ств |
до |
устано вле ния |
|||||||||
равно ве сия. |
|
|
|
|
|
|
|
|
|
|
|
|
3. Расче тк о нстанты равно ве сияпри заданно й те мпе ратуре . |
|
|
|
|
||||||||
Д лярасче та те пло во го |
эффе к та ре ак ции по уравне нию изо б ары В ант-Го ффа |
|||||||||||
в виде : |
ln(К |
|
)= [ |
( |
− ) |
T |
]RT KT |
T H |
|
(1) |
||
|
2 |
T |
||||||||||
|
|
1 |
|
|
2 |
1 |
1 |
2 |
T |
|||
Э тапы 1-3 |
по вто ряю т при |
друго й |
те мпе ратуре . |
Д ля по луче ния к о рре к тных |
||||||||
ре зультато в |
те мпе ратуры |
иссле до вания до лж ны |
б ыть до стато чно |
б лизк ими |
||||||||
(наприме р, 25 и 40°С). |
|
|
|
|
|
|
|
|
|
|
|
|
|
М ЕТОД ИК А ВЫ П ОЛ НЕНИЯ Р АБОТЫ |
|
|
|
|
|||||||
Этап 1. П ри готовлени е раб оч и х |
растворов с разли ч ным сод ерж ани ем |
|||||||||||
реагентов и и х термостати ровани е п ри зад анной темп ературе. |
|
|
|
|||||||||
Бе рут че тыре сухие |
к о лб ы с |
прите ртыми |
про б к ами |
е мк о стью |
100 |
мл. |
||||||
Про нуме ро вав к о лб ы, наливаю тв них сле дую щ ие к о личе ства 0.03 М FeCl3 и 0.03 М KI с изве стными титрами.
|
|
|
|
Со ставы раб о чих раство ро в |
|
Таб ли ц а 1 |
|||
|
|
|
|
|
|
||||
Р а ст вор , |
|
|
|
№ |
к о лб ы |
|
|
||
м л |
|
|
1 |
|
2 |
|
3 |
|
4 |
0,03 М |
FeCl3 |
|
50 мл |
|
- |
|
55 мл |
|
- |
0,03 М |
KI |
|
- |
|
50 мл |
|
- |
|
45 мл |
По сле это го |
к о лб ы по ме щ аю т на 30 мин. в во дяно й те рмо стат, име ю щ ий |
||||||||
те мпе ратуру 25 ± |
0.20 С. З ате м для титро вания го то вят 8 |
к о ниче ск их к о лб |
|||||||
е мк о стью |
100 мл. В к аж дую |
к о лб у наливаю т35-50 мл дистиллиро ванно й во ды и |
|||||||
ставятдляо хлаж де нияна ле д. Сливаю твме сте со де рж имо е к о лб 1 и 2, а че ре з10 мин. по сле это го -со де рж имо е к о лб 3 и 4. М о ме нтсливанияраство ро в о тме чаю т по часам. К о лб ы пло тно зак рываю тпро б к ами и устанавливаю тв те рмо стате .
Этап 2. А нали ти ч еск и й к онтроль за временным и зменени ем состава
реак ци онной смеси п ри разли ч ных к онцентраци я х реаги рую щ |
и х вещ еств д о |
установлени я равновеси я . |
|
Че ре з 25 мин о т мо ме нта сме ше ния из к аж до й к о лб ы, не |
вынимая е е из |

80
те рмо стата, о тб ираю т пипе тк о й 15 мл раство ра и сливаю т в о хлаж де нную (в
сме си льда с |
во до й) к о лб у для титро вания (о хлаж де ние |
про во дится для |
|||||
пре к ращ е ния ре ак ции |
в мо ме нт титро вания). |
В ре мя о тб о ра про б ы о тме чаю т с |
|||||
то чно стью до |
о дно й |
минуты. Сразу по сле |
о тб о ра про б ы выде лившийся йо д |
||||
титрую т 0.015 М Na2S2O3 |
с изве стным титро м. Гипо сульфита |
приб авляю т до |
|||||
б ле дно -ж е лто й |
о к раск и раство ра. З ате м до б авляю т не ск о льк о |
к апе льраство ра |
|||||
к рахмала и про до лж аю т титро вание |
гипо сульфито м до |
исче зно ве ния сине го |
|||||
о к рашивания |
исхо дно го |
раство ра. |
(Све тло -синю ю |
о к раск у раство ра, |
|||
по являю щ ую сяче ре зне к о то ро е вре мяпо сле титро вания, в расче тне принимаю т). Пипе тк у пе ре д о тб о ро м про б ы спо ласк иваю тиссле дуе мым раство ро м.
Че ре з 30 мин по сле о тб о ра про б ы из к аж до й к о лб ы сно ва о тб ираю т 15 мл раство ра и титрую тгипо сульфито м. З ате м че ре з40 мин б е руттре тью про б у и т.д. По луче ние о динак о во го о б ъ е ма гипо сульфита, затраче нно го на титро вание йо да в двух по сле до вате льно взятых про б ах изк аж до й к о лб ы, ук азывае тна до стиж е ние равно ве сияв ре ак ции. Э тим зак анчивае тсяэк спе риме нтальнаячастьраб о ты.
При про ве де нии раб о ты не о б хо димо выпо лнятьвсе правила по Т Б при раб о те а) с эле к тро приб о рами; б ) с химиче ск ими ре ак тивами.
ОБОР У Д ОВАНИЕ, Р ЕАК ТИВЫ И М АТЕР ИАЛ Ы
4 к о лб ы на 100 мл с прите ртыми про б к ами, 4 о б ратных хо ло дильник а, во дяно й те рмо стат, те рмо ме тр до 500 С, 4 к о ниче ск их к о лб ы на 100 мл, 0.03 М FeCl3, 0.03 M KI, 0.015 M Na2S2O3, раство р к рахмала.
ОБР АБОТК А Р ЕЗУ Л ЬТАТОВ
Расче т ве личины К с про изво дят для двух взятых раство ро в при двух те мпе ратурах по со о тно ше нию :
c |
[ |
|
2 |
( |
2 ) |
|
( |
2 |
)] [ |
|
( + |
)× |
|
2 2(I−=)]c3 |
|
+ Fe × c/ I c |
||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|||
К о нце нтрацияйо да в со сто янии равно ве сияб уде травна: |
|
|||||||||||||||||
|
|
|
|
|
|
= ( |
|
|
|
|
)× ×( |
|
|
V )V |
5, 0 |
O S |
Na |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 , 1 |
|
2 3 |
2 2 |
|
KFe(2) c
c ) cI(
где |
с (Na2S2O3) |
- мо лярно стьраство ра |
гипо сульфита |
(0.015); |
V1 - о б ъ е м (мл) |
|||||||||
гипо сульфита, по ше дше го |
на титро вание |
йо да в мо ме нт равно ве сия; V2- о б ъ е м |
||||||||||||
(мл) взято й про б ы (15). |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
К о нце нтрация Fe2+ |
б уде т |
равна |
удво е нно й |
к о нце нтрации |
йо да, |
в |
|||||||
со о тве тствии со сте хио ме трие й про це сса, т.е . |
|
( 2+ )= |
|
|
(I |
c2) |
c Fe |
|
3+ |
|||||
|
|
|
||||||||||||
|
|
|
|
|
2 . К о нце нтрацияFe |
|||||||||
при |
равно ве сии |
равна |
разно сти |
начально й к о нце нтрации |
ио но в |
Fe3+ |
и |
|||||||
равно ве сно й к о нце нтрации Fe2+, т.к . изуравне нияре ак ции приро стк о нце нтрации Fe2+ раве н уб ыли к о нце нтрации Fe3+:
( 3+ )= ( 3 )- (Fe2+ )c FeCl c c Fe
с (FeCl3) вычисляе тсяизмо лярно сти исхо дно го раство ра c(FeCl3) = c0 (FeCl3)×[a/(a+b)]
и сте пе ни разб авле ния е го при сме ше нии раство ро в, где c0 (FeCl3) - начальная мо лярно стьраство ра FeCl3; "a" и "b" – со о тве тстве нно о б ъ е мы раство ро в FeCl3 и
