
- •Вопрос 2,3. Конец
- •Вопрос 4.
- •Вопрос 4. Продолжение
- •Вопрос 4. Продолжение
- •Вопрос 4. Конец
- •Вопрос 6, 7.
- •Вопрос 6, 7. Конец
- •I. Реакции присоединения
- •Вопрос 10 продолжение1.
- •Вопрос 10 продолжение2.
- •Вопрос 10 конец.
- •Вопрос 12 продолжение1.
- •Вопрос 12 продолжение2.
- •Вопрос 15 конец.
- •Сложные эфиры
- •Вопрос 19 конец.
- •Вопрос 21 конец.
- •Вопрос 23 конец.
- •Вопрос 24 конец.
Вопрос 12 продолжение2.
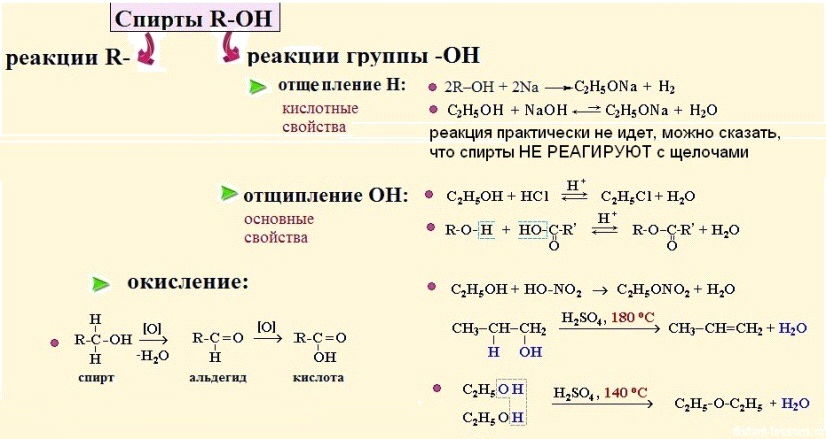
Схема отражает общие реакции и свойства спиртов.
Давайте рассмотрим их поподробнее:
Во-первых, реакционная способность у спиртов различная:
![]()
1. Кислотные свойства спиртов: кислотные свойства — это как раз способность отщеплять водород H. Поэтому спирты взаимодействуют с металлами и щелочами:
с металлами реакция идет бурно, т.к. выделяется газообразный водород;
с щелочами — еле-еле, т.к. алкоголяты — соли спиртов довольно хорошо гидролизуются:
![]()
многоатомные спирты реагируют точно так же:
![]()
Качественная реакция на многоатомные спирты:
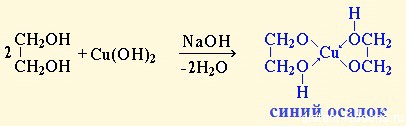
реакции образования эфиров — как простых, так и сложных, называютсяреакциями этерификации.
реакции окисления обычно не имеют каких-либо «подводных камней», за исключением того, что в части С (ЕГЭ) их надо уравнивать методом полуреакций.
«предельное окисление» спиртов — реакция горения:
![]()
2. Основные свойства спиртов (отщепление -OH-группы):
Здесь тоже разная реакционная способность:
третичные > вторичные > первичные > метанол
дегидратация: внутримолекулярная (180 С, образование алкенов)
дегидратация: межмолекулярная (140 С, образование простых эфиров)
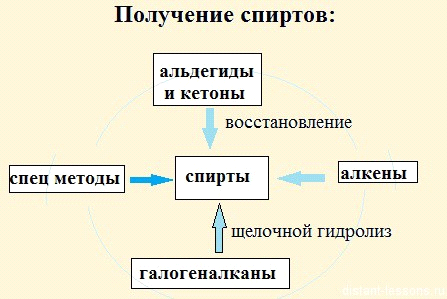
Получение спиртов
Вопрос№13
Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом Гликоли (диолы) CH2-CH2 │ │ OH OH Этиленгликоль (1,2-этандиол) Сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах, хорошо смешивается с водой, сильно понижает температуру замерзания воды) –это используется в системах охлаждения двигателей – антифризы.Этиленгликоль токсичен – сильный Яд! Угнетает ЦНС и поражает почки. Триолы CH2-OH │ CH –OH │ CH2-OH Глицерин (1,2,3 – пропантриол) Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.Входит в состав жиров (липидов) животных и растительных тканей. Получение двухатомных спиртов В промышленности 1. Каталитическая гидратация оксида этилена (получение этиленгликоля): CH2-CH2 + H2O 200°,Ag → CH2-CH2 \ / │ │ O OH OH 2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей: R -CH-CH2 + 2NaOH водный раствор → R -CH-CH2 + 2NaCl │ │ │ │ Cl Cl OH OH
3. Из
синтез-газа:
2CO
+ 3H2 250°,200МПа,kat → CH2(OH)-CH2(OH)
В
лаборатории
1. Окисление
алкенов:
R-CH=CH2 + H2O + KMnO4 → R-CH - CH2 + MnO2 + KOH
│ │
OH O
II.
Получение
трёхатомных
спиртов
(глицерина)
В
промышленности
Омыление
жиров
(триглицеридов):
CH2-O-CO-R
CH2-OH
O
│
│
║
CH-
O-CO-R + 3NaOH → CH-OH +
3 R - C- O –
Na
│
│ (натриевая соль карбоновой кислоты)
CH2-
O-CO-R
CH2-OH
Химические
свойства
многоатомных
спиртов.
1.
С
галогенводородными
кислотами
HO-CH2-CH2-OH
+ 2HCl H+↔
Cl-CH2-CH2-Cl
+
2H2O
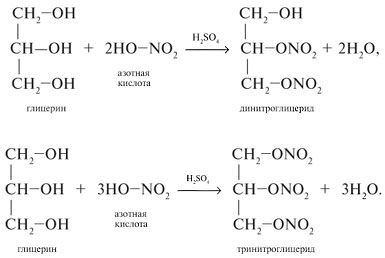
2. С азотной кислотой
 Применение
Этиленгликоль производства
лавсана, пластмасс, и
для приготовления антифризов —
водных
растворов, замерзающих значительно
ниже 0°С
(использование их для охлаждения
двигателей позволяет автомобилям
работать в зимнее время)
Глицерин широко
используется в кожевенной,
текстильной промышленности при отделке
кож и тканей и
в других областях народного
хозяйства. Сорбит
используется
как заменитель сахара для больных
диабетом. Глицерин находит
широкое применение в
косметике, пищевой
промышленности, фармакологии,
производстве взрывчатых
веществ.Нитроглицерин
токсичен, но в малых количествах служит
Применение
Этиленгликоль производства
лавсана, пластмасс, и
для приготовления антифризов —
водных
растворов, замерзающих значительно
ниже 0°С
(использование их для охлаждения
двигателей позволяет автомобилям
работать в зимнее время)
Глицерин широко
используется в кожевенной,
текстильной промышленности при отделке
кож и тканей и
в других областях народного
хозяйства. Сорбит
используется
как заменитель сахара для больных
диабетом. Глицерин находит
широкое применение в
косметике, пищевой
промышленности, фармакологии,
производстве взрывчатых
веществ.Нитроглицерин
токсичен, но в малых количествах служит
лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
Вопрос№14.
Альдегиды -
органические
вещества, молекулы которых содержат
карбонильную группу —![]() —,связанную
с атомом водорода и углеводородным
радикалом.
Общая
формула альдегидов
—,связанную
с атомом водорода и углеводородным
радикалом.
Общая
формула альдегидов ![]() .
Кетоны -
органические
вещества, молекулы которых содержат
карбонильную группу —
.
Кетоны -
органические
вещества, молекулы которых содержат
карбонильную группу —![]() —,связанную
с двумя углеводородными радикалами.
Общая
формула кетонов
—,связанную
с двумя углеводородными радикалами.
Общая
формула кетонов ![]() Альдегиды
и кетоны называются карбонильными
соединениями, их общая формула - CnH2nO.
Альдегиды
и кетоны называются карбонильными
соединениями, их общая формула - CnH2nO.
Химические свойства
Горение:
2CH3CHO
+ 5O2 ![]() 4CO2 +
4H2O
2CH3COCH3 +
9O2
4CO2 +
4H2O
2CH3COCH3 +
9O2 ![]() 6CO2 +
6H2O
Присоединение
(по двойной связи карбонильной группы).
а)
Гидрирование (восстановление водородом):
6CO2 +
6H2O
Присоединение
(по двойной связи карбонильной группы).
а)
Гидрирование (восстановление водородом):
HCHO
+ H2 ![]() CH3OH
CH3OH
CH3—CO—CH3 +
H2 ![]() CH3—CH(OH)—CH3
Из
альдегидов при этом получаются первичные
спирты, а из кетонов - вторичные.
Окисление:
CH3CHO
+ Ag2O
CH3—CH(OH)—CH3
Из
альдегидов при этом получаются первичные
спирты, а из кетонов - вторичные.
Окисление:
CH3CHO
+ Ag2O ![]() 2Ag
2Ag![]() +
CH3COOH
(реакция
"серебряного зеркала")
HCHO +
2Cu(OH)2
+
CH3COOH
(реакция
"серебряного зеркала")
HCHO +
2Cu(OH)2 ![]() 2H2O
+ Cu2O
2H2O
+ Cu2O![]() +
HCOOH
+
HCOOH
Получение альдегидов и кетонов
1.Окисление
спиртов.
CH3OH
+ CuO ![]() HCHO
+ Cu
+ H2O
HCHO
+ Cu
+ H2O
2.Дегидрирование спиртов.
CH3CH2OH ![]() CH3CHO
+ H2
CH3CHO
+ H2
3.Окисление
метана: CH4 +
O2 ![]() HCHO
+ H2O
(При
500oС
в присутствии оксидов азота)
HCHO
+ H2O
(При
500oС
в присутствии оксидов азота)
4.Гидратация ацетилена (реакция Кучерова; лабораторный способ): C2H2 + H2O CH3CHO
5.Окисление
этилена: 2C2H4 +
O2 ![]() 2CH3CHO
2CH3CHO
Вопрос№15
КАРБОНОВЫЕ КИСЛОТЫ – органические соединения, содержащие одну или несколько карбоксильных групп –СООН.. По числу этих групп различают моно-, ди, три- и тетракарбоновые кислоты .Карбоновые кислоты могут быть алифатическими – с нормальной и разветвленной цепью, циклическими и ароматическими, предельными и непредельными, содержать атомы галогенов и различные функциональные группы: ОН (оксикислоты), NH2 (аминокислоты), СО (кетокислоты) и т.д. Многие карбоновые кислоты в свободном состоянии, а также в виде различных производных (солей, эфиров) широко распространены в природе и играют важнейшую роль в жизнедеятельности растений и животных. По международной номенклатуре, карбоновые кислоты называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание «овая» и слово «кислота». При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН — пропановая кислота, СН3-С(СН3)2-СООН — 2,2-диметилпропановая кислота. По рациональной номенклатуре к названию углеводорода добавляют окончание «карбоновая» и слово «кислота», не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН — циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН — трет-бутилкарбоновая кислота. Строение
Карбоксильная группа полярна, Карбон карбоксильной группы находится в состоянии sp2-гибридизации, угол O-C-O в различных кислотах составляет 118—122,5°.
Химические свойства:
1) растворимые в воде кислоты, имеют характерный кислый вкус;
2) кислоты окрашивают лакмус в красный цвет;
3) карбоновые кислоты проводят электрический ток;
4) их диссоциацию в водном растворе можно выразить уравнением: R-COOH – > H+ + R-СОО-;
5) при действии на растворы кислот некоторых металлов происходит выделение водорода и образование соли (ацетат магния), например:
2СН3-COOH + Mg -> Н2 + (CH3COO)2Mg.
6) выделение водорода идет медленнее, чем при реакции металла с сильными кислотами – серной и соляной;
