
- •Вопрос 2,3. Конец
- •Вопрос 4.
- •Вопрос 4. Продолжение
- •Вопрос 4. Продолжение
- •Вопрос 4. Конец
- •Вопрос 6, 7.
- •Вопрос 6, 7. Конец
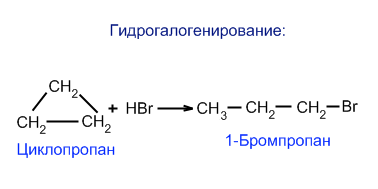
- •I. Реакции присоединения
- •Вопрос 10 продолжение1.
- •Вопрос 10 продолжение2.
- •Вопрос 10 конец.
- •Вопрос 12 продолжение1.
- •Вопрос 12 продолжение2.
- •Вопрос 15 конец.
- •Сложные эфиры
- •Вопрос 19 конец.
- •Вопрос 21 конец.
- •Вопрос 23 конец.
- •Вопрос 24 конец.
Вопрос 4. Продолжение
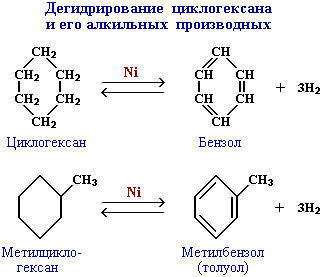
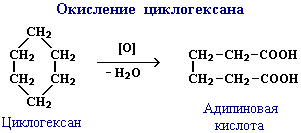
получение циклоалканов:
1. При переработке нефти выделяют главным образом циклоалканы С5 - С7.
2. Действие активных металлов на дигалогензамещенные алканы (реакция Вюрца) приводит к образованию различных циклоалканов:
![]()
(вместо металлического натрия используется также порошкообразный цинк).
Строение образующегося циклоалкана определяется структурой исходного дигалогеналкана. Этим путем можно получать циклоалканы заданного строения. Например, для синтеза 1,3-диметилциклопентана следует использовать 1,5-дигалоген-2,4-диметилпентан:
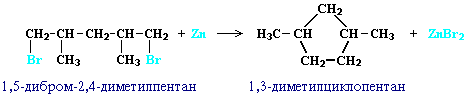
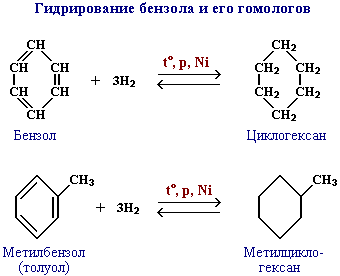
Существуют и другие методы получения циклоалканов. Так, например, циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки.
Вопрос 4. Конец
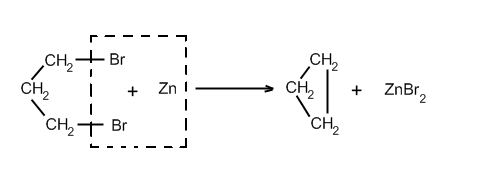
Дегалогенирование дигалогенопроизводных. Трех- и четырехчленные циклы получают децствием цинка на соответствующие дигалогенопроизводные:
Либо можно получить пиролизом солей дикарбоновых кислот. Циклопентан и циклогексан образуются при пиролизе (нагревании без доступа воздуха) кальциевых солей соответственно гександикарбоновой и гептандикарбоновой кислот и воставлении образующихся кетонов.
Вопрос 6, 7.
Алкены
Углеводороды ряда этилена по международной номенклатуре называют алкенами.
C2H4
Изомерия и номенклатура.
Формулы углеводородов ряда этилена можно вывести из соответствующих формул предельных углеводородов. Названия углеводородов ряда этилена образуют путем изменения суффикса -ан соответствующего предельного углеводорода на -ен или -илен.
Гомологический ряд этилена
C2H4 - Этилен (Этен)
C3H6 - Пропилен (Пропен)
C4H8 - Бутен
C5H10 - Пентен
C6H12 - Гексен
C7H14 - Гептен
C8H16 - Октен
C9H18 - Нонен
C10H20 - Децен
Получение
Этилен в лаборатории получают при нагревании смеси этилового спирта с концентрированной серной кислотой.
Углеводороды ряда этилена можно получить также дегидрированием предельных углеводородов.
На производстве этилен получают из природного газа и при процессах пиролиза нефти.
Углеводороды ряда этилена можно получить при взаимодействии дигалогенопроизводных предельных углеводородов с металлами.
При действии спиртовых растворов щелочей на галогенопроизводные отщепляется галогеноводород и образуется углеводород с двойной связью.
Физические свойства
Этилен — бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде. Пропилен и бутены (бутелены) при нормальных условиях также газообразны, от пентена C5H10до
Вопрос
Вопрос 6, 7. Конец
октадецена C18H36 включительно углеводороды находятся в жидком состоянии, а начиная с нонадецена C19H38 - в твердом.
Химические свойства
Химические свойства этилена и его гомологов в основном определяются наличием в их молекулах двойной связи. Для них характерны реакции присоединения, окисления и полимеризации.
Реакции присоединения.
Этилен и его гомологи взаимодействуют с галогенами. Так, например, они обесцвечивают бромную воду: H2C = CH2 + Br2 -> Ch2Br - CH2Br
Аналогично происходит присоединение водорода (гидрирование этилена и его гомологов)
В присутствии серной или ортофосфорной кислоты и других катализаторов этилен присоединяет воду (реакция гидратации). Этой реакцией пользуются для получения этилового спирта в промышленности.
Этилен и его гомологи присоединяют также галогеноводороды. Пропилен и последующие углеводороды ряда этилена реагируют с галогеноводородами согласно правилу В.В.Марковникова.
Водород присоединяется к наиболее, а атом галогена - к наименее гидрированному атому углерода: (пропилен) CH2 = CH - CH3 + HBr → CH3 - CHBr - CH3 (2 - бромпропан)
Реакции окисления.
Этилен и его гомологи способны гореть на воздухе. С воздухом этилен и его газообразные гомологи образуют взрывчатые смеси.
Этилен и его гомологи легко окисляются, например кислородом перманганатакалия; при этом раствор последнего обесцвечивается.
Большое промышленное значение имеет частичное окисление этилена кислородом воздуха.
Реакции полимеризации. При повышенной температуре, давлении и в присутствии катализаторов молекулы этилена соединяются друг с другом вследствие развала двойной связи. Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации.
Получение.
Этилен и его соединения используются для получения горючего с высоким октановым числом, пластмасс, взрывчатых веществ, антифризов, растворителей, для ускорения созревания фруктов, для получения ацетальдегида, синтетического каучука.
Вопрос №8, 9.
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Изомерия
Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и межклассовая изомерия с алкадиенами.
Получение
1) В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
2CH4 ––1500°C® HCєCH + 3H2
2) Алкины можно получить из дигалогенопроизводных парафинов отщеплением галогеноводорода при действии спиртового раствора щелочи. Атомы галогена при этом могут быть расположены как у соседних атомов углерода, так и у одного углеродного атома.
|
Вопрос 8,9 продолжение. СH3–CH–CH2 + 2 KOH ––этанол® CH3–CєCH + 2KBr + 2H2O I I Br Br |
|
Br I CH3–C–CH2–CH3 + 2KOH ––этанол® CH3–CєC–CH3(бутин-2) + 2KBr + 2H2O I Br |
3) Ацетилен получают также из ацетиленида (карбида) кальция при разложении его водой.
CaC2 + 2H2O ® Ca(OH)2 + HCєCH
Физические свойства
По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами. Физические свойства некоторых алкинов сведены в таблице.
Химические свойства
