- •Вопрос 2,3. Конец
- •Вопрос 4.
- •Вопрос 4. Продолжение
- •Вопрос 4. Продолжение
- •Вопрос 4. Конец
- •Вопрос 6, 7.
- •Вопрос 6, 7. Конец
- •I. Реакции присоединения
- •Вопрос 10 продолжение1.
- •Вопрос 10 продолжение2.
- •Вопрос 10 конец.
- •Вопрос 12 продолжение1.
- •Вопрос 12 продолжение2.
- •Вопрос 15 конец.
- •Сложные эфиры
- •Вопрос 19 конец.
- •Вопрос 21 конец.
- •Вопрос 23 конец.
- •Вопрос 24 конец.
Вопрос №1.
Теория химического строения - учение о строении молекулы, описывающее все те её характеристики, которые в своей совокупности определяют химическое поведение (реакционную способность) данной молекулы. Сюда относятся: природа атомов, образующих молекулу, их валентное состояние, порядок и характер химической связи между ними, пространственное их расположение, характерное распределение электронной плотности, характер электронной поляризуемости электронного облака молекулы и т.д. Основные положения теории химического строения, являющейся фундаментом химии, были развиты русским химиком Бутлеровым А.М.
Атомы в молекулах соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением.
Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
Свойства веществ зависят не только от их состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
Атомы в молекулах оказывают влияние друг на друга и это влияние приводит к химическим изменениям поведения атома.
Определить состав и строение химического вещества можно по продуктам химических превращений.
Теория химического строения А.М. Бутлерова претерпела эволюцию, важнейшие направления которой:
Появление электронных теорий в органической химии, позволявших сформулировать зависимость химического поведения органических веществ от электронного строения.
Стереохимические представления, определившие связь химических свойств веществ с пространственным строением.
Особенности органических соединений, их многообразие определяются, прежде всего, электронным строением атома углерода, который в органических соединениях проявляет валентность равную четырем и может находиться в sp3-, sp2- и sp-гибридном состоянии. Поэтому связь между атомами может осуществляться одной, двумя и тремя электронными парами, т.е. быть одинарной (σ - связь), двойной (1σ - связь и 1π - связь), тройной (1σ - связь и 2 π - связи). Исключительное свойство углерода – способность образовывать цепи атомов различной длины и циклические структуры.
Из второго положения теории строения вытекает наличие у органических веществ гомологии и изомерии. Гомологическим рядом называют совокупность органических соединений, обладающих сходным строением и свойствами и отличающихся друг от друга по составу на одну или несколько групп –СН2–. Представителей одного гомологического ряда называют гомологами.
Изомеры – вещества, которые имеют одинаковый количественный и качественный состав, но различаются строением молекул, а, следовательно, и свойствами. Различают структурную и пространственную (стерео-) изомерию. К первому типу относится
изомерия углеродного скелета (например, н-бутан и изобутан);
изомерия положения кратной связи в молекуле (например, 2-метил-1-бутен и 2-метил-2-бутен);
изомерия положения функциональной группы (например, 1-хлорпропан и 2-хлорпропан);
межклассовая изомерия или метамерия (например, бутин-1 и бутадиен-1,3) и т.д.
В пространственных изомерах порядок связи атомов в молекулах совпадает, а их расположение в пространстве различается, что вызывает различие в свойствах. К пространственной относится геометрическая изомерия. Она возможна, например, у алкенов.

Вопрос №2,3
Гомологи – это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп CH2. Например, мысленно к молекуле метана CH4 добавить группу CH2 (группу CH2 называют гомологической разностью), то получиться следующий углеводород – этан C2H6 и т.д. Формулы углеводородов ряда метана даны в таблице 1.
Предельные углеводороды составляют гомологический ряд метана.
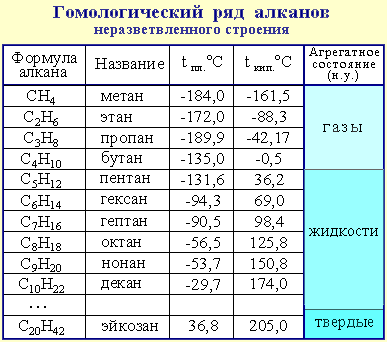
В таблице 1 даны формулы десяти первых и двадцатого предельных углеводородов. Если мысленно вычесть из их формул по одному атому водорода, то получаются группы атомов, которые называют радикалами. Названия радикалов образуются от названий соответствующих углеводородов путем изменения суффикса –ан на –ил, например: метил CH3 –, этил CH3 – CH2 –, пропил CH3 – CH2 –CH2 – и т.д.
получение
1.Декарбоксилирование натриевых солей карбоновых кислот. В лаборатории метан получают при нагревании ацетата натрия CH3COONa с твердым гидроксидом натрия:
CH3COONa+NaOH –-- CH4 +Na2CO3
2.Синтез Вюрца. Этан и другие предельные углеводороды с более длинной цепью можно получить при взаимодействии однородных галогенпроизводных предельных углеводородов с металлическим натрием:
CH3 - I Na
+ –--CH3 – CH3 +2Na I
CH3- I Na
йодметан этан
Первым эту реакцию в 1855 году осуществил французский химик А.Вюрц (реакция Вюрца)
Простейший представитель предельных углеводородов – метан – образуется в природе в результате разложения остатков растительных и животных организмов без доступа воздуха.Он содержится и в газах, выделяющихся при добыче нефти. В состав природного газа и нефтяных газов входят также этан C2H6, пропан C3H6, бутан C4H6 и некоторые другие. Газообразные, жидкие и твердые предельные углеводороды содержаться в нефти
ФС Метан – газ без цвета и запаха, почти в 2 раза легче воздуха, мало растворим в воде. Этан, пропан, бутан при нормальных условиях – газы, от пентана до пентадекана – жидкости, а следующие гомологи – твердые вещества (таблица 1). Пропан и бутан под давлением могут находиться в жидком состоянии и при обыкновенной температуре.
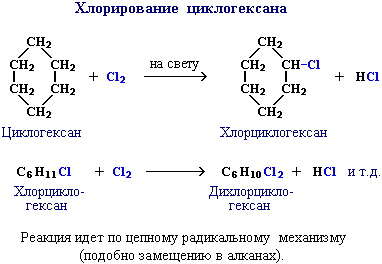
ХС 1.Наиболее характерными реакциями предельных углеводородов являются реакции замещения. Так, например, при освещении метан реагирует с хлором (при сильном освещении может произойти взрыв):
H H
| t |
H – C – H + Cl –Cl ----H – C –Cl + HCl
| |
H H
2.Все предельные углеводороды горят с образованием оксида углерода (IV) и воды. Метан горит бесцветным пламенем, с выделением теплоты:
CH4+2O2=CO2+H2O+880 кДж
Вопрос 2,3. Конец
Смесь метана с кислородом (в объемном отношении 1:2) или с воздухом (1:10) при поджигании сгорает со взрывом. Взрыв может происходить и при др.соотношениях смеси с воздухом.
3.При сильном нагревании(выше 1000 градусов) без доступа воздуха предельные углеводороды разлагаются:
CH4 ----C+2H2
Если метан нагреть до более высокой температуры (1500 градусов), то реакция происходит так:
2CH4 ---- C2H2 +3H2
ацетилен
4.Углеводороды нормального строения под влиянием катализаторов и при нагревании подвергаются реакциям изомеризации и превращаются в углеводороды разветвленного строения:
CH3- CH2- CH2- CH2- CH3 ---- CH3 - CH- CH2- CH3
|
CH3 хлорметан
Вопрос 4.
Циклоалканы относят к карбоциклическим углеводородам – вещества, молекулы которых содержат замкнутую цепь атомов углерода (цикл).
Номенклатура
Циклоалканы
–
это
циклические углеводороды, не содержащие
в молекуле кратных связей и соответствующие
общей формуле:![]()
Точно такой же формулой описывается гомологический ряд алкенов. Из чего следует, что каждому циклоалкану изомерен соответствующий алкен. Это пример так называемой межклассовой изомерией.
Изомерия Для циклоалканов как и для всех классов органических соединений, характерна изомерия углеродного скелета (1. Структурная изомерия). Для циклоалканов характерно структурная изомерия связанная с размером цикла,
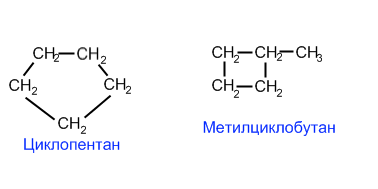
со взаимным расположением заместителей в кольце,

со строением заместителя

Структурная изомерия для циклоалканов, во-первых, обусловлена размером цикла. Так, существует два циклоалкана формулы С4Н8: циклобутан и метилциклопропан. Во-вторых, такая изомерия обусловливается положением заместителей в цикле (например, 1,1 и 1,2-диметилбутан).
Изомерия положения заместителей в кольце
Вопрос 4. Продолжение
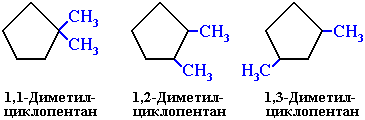
3. Межклассовая изомерия с алкенами:
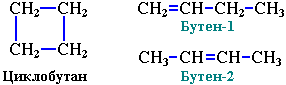
Отсутствие свободного вращения вокруг связей С-С в цикле создает предпосылки для существования пространственных изомеров у некоторых замещенных циклоалканов. Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цисизомер) или по разные стороны (трансизомер):
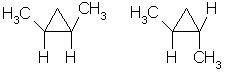
цисизомер трансизомер
По размеру цикла циклоалканы делятся на ряд групп, из которых мы рассмотрим малые (С3, С4) и обычные (С5-С7) циклы.
2. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цисизомерах заместители находятся по одну сторону от плоскости кольца, в трансизомерах – по разные: 3. Оптическая изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение. 4. Поворотная изомерия циклоалканов. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями. Это достигается поворотами по у-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, т.е. более устойчивые. Например, в циклогексане наиболее устойчивой является конформация "кресла".
В этой пространственной форме отсутствует угловое напряжение, т.к. все валентные углы имеют нормальные для sp3-гибридизованных атомов значения 109°28’. Кроме того, каждая пара соседних атомов углерода (фрагмент этана) находится в заторможенной конформации.
Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5 – С16 – жидкости, начиная с С17, – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур.
Химические свойства