
Руководство к практическим по биохимии
.pdf
3. Константинов А. А., Поступаев В. В. Избранные лекции по патобиохимии. - 1989. - С. 154-172.
Вопросы и задания для самоподготовки
1.Выясните принцип классификации ферментов.
2.Нарисуйте и дополните табл. 3. отражающую классификацию ферментов, дополнив ее конкретными ферментами
3.Выясните, какие методы используются для выделения фермен тов из биологических объектов.
4.Поясните, как можно доказать наличие фермента в биологиче ском объекте и определить его активность.
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3 |
|
|
Поряд |
|
Название |
Характер реакции |
Пример |
|||||||||
|
ковый № |
|
класса |
|
|
|
|
|||||||
|
класса |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
1 |
|
Оксидоредуктазы |
Окислительно-восстанови |
Каталаза |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
тельные реакции |
|
Н202 -> 02 +Н2 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
5. Зарисуйте табл. |
4, поясняющую свойства ферментов, и укажи |
||||||||||||
|
|
те, какие свойства а) обусловлены белковой природой, б) прису |
||||||||||||
|
|
щи и ферментам, и неорганическим катализаторам, в) характерны |
||||||||||||
|
|
только для биокатализаторов. |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 4 |
|
, |
|
_ — |
, |
. |
|
• - |
- |
— |
• |
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Свойства ферментов |
|
|
1 |
|
|
|
|
|
? |
|
|
|
|
|
? |
|
? |
|
|
Подчиняются |
закону |
Высокая молекулярная масса. |
Воздействие факторов |
|||||||||||
действующих масс. |
Перемещение в агектрическом |
на скорость реакции. |
||||||||||||
Не |
сдвигают |
подвиж |
поле. |
|
Высокая специфичность. |
|||||||||
ного равновесия. |
|
|
|
Термолабильность. |
Регулируемость |
коли |
||||||||
Влияют |
только |
на |
ско |
Высаливание. |
чества и активности. |
|||||||||
рость химической |
ре |
Денатурация. |
Физиологические |
усло |
||||||||||
акции. |
|
|
|
|
|
|
Расщепление протеолити- |
вий протекания катализа. |
||||||
Выходят из реакции в |
ческим ферментами. |
|
|
|
||||||||||
неизменном виде. |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.Зарисуйте схему (рис.3), поясняющую значение медицинской энзимологии, дополнив ее конкретными примерами.
Рис. 3. Роль медицинской энзимологии
7.Выясните, какие факторы влияют на активность ферментов в клетке!.
8.Выясните причины изменения активности ферментов в крови при патологии различных органов.
9.Объясните механизмы возникновения патологических изменений при нарушении синтеза ферментов.
10.Выясните, механизм действия ферментных препаратов при их применении с лечебной целью.
Задания по УИРС:
Подготовьте реферативное сообщение по одной из тем:
1.Наследственные энзимопатии.
2.Применение ферментов, их ингибиторов или активаторов с лечеб ной целью.
3.Иммобилизованные ферменты, их использование в медицине.
Задания для контроля усвоения темы
1 Назовите основной принцип классификации ферментов. Приве дите примеры ферментов, относящихся к каждому классу.
2.Исходя из белковой природы ферментов, укажите современные методы их выделения и очистки.
3.Фермент сукцинатдегидрогеназа локализован в митохондриях. Предложите схему его выделения и доказательства, что выде ленный белок является этим ферментом.
4.Укажите, от чего зависит количество фермента в клетке.
38 |
35 |
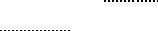
5Перечислите факторы, регулирующие скорость ферментативной реакции в клетке.
6Поясните, почему при ряде заболеваний изменяется активность ферментов в крови.
jорганоспецифическими ферментами для печени являются сорбитолдегидрогеназа, гистидаза, уроканииаза Объясните, о чем может свидетельствовать появление этих: ферментов в сыворот ке крови.
8. фермент лактатдегидрогеназа в печени присутствует преимуще ственно в виде изоферментных форм ЛДГ4 и ЛДГВ, а в миокарде - ЛДП и ЛДГ2. Объясните, как эти различия можно использовать в распознавании заболеваний печени и сердца.
gпоясните, какие биохимические сдвиги произойдут при наруше нии синтеза одного из ферментов.
10. Приведите примеры ферментов, применяемых в качестве ле чебных препаратов.
Тестовые задания
1.установите соответствие между ферментом, катализирующим реакцию, и классом, к которому он относится.
д.СНэ-CO-SKoA + С02 + АТФ -> COOH~CH2-CO-SKcA + АДФ + Фн;
Б.СООН-СН2-СН2-СНМН2-СООН -> С02 + CОOM-CH2-CH2-CH2NH2
1. Оксидоредук газы;
2. Трансферазы;
3 Гидролазы;
4. Лиазы;
5 Изомеразы;
6.Лигазы (синтетазы).
2.Фермент, катализирующий реакцию превращения глюкозо-6- фосфата во фруктозо-6-фосфат, относится к классу
3.Фермент, катализирующий реакцию разрыва связи с участием молекулы воды, относится к классу
4.Укажите, какой из перечисленных факторов осложняет примене ние ферментных препаратов.
1. Термолабильность; |
4. Высокая специфичность; |
2.Антигенные свойства ферментов; 5. Высокая стабильность.
3.Низкая специфичность;
5.Сульфаниламидные лекарственные препараты являются антаго нистами
1. Янтарной кислоты, |
4. Никотинамида; |
|
2. |
Витамина в6; |
5. Витамина В12. |
3. |
Парааминобензойной кислоты; |
|
6. Дня обработки гнойных ран применяется фермент
1. Амилаза; |
4. Тирозиназа; |
2. Каталаза; |
5. Трипсин. |
3.Пепсин,
7.При нарушении синтеза фермента, окисляющего фенилаланин в тирозин, развивается заболевание
1. Фенилкетонурия; |
4. Альбинизм; |
2. Тирозиноз; |
5. Серповидноклеточная |
3. Алкаптонурия; |
анемия. |
8.При увеличении проницаемости клеточных мембран при патоло гии активность ферментов в крови..................
9.Органоспецифичным ферментом печени является
1. Амилаза; |
4. |
Креатинфосфокиназа; |
2. Гистидаза; |
5. Лактатдегидрогеназа. |
|
3.Каталаза;
10.При инфаркте миокарда в крови повышается активности
1.ЛДГ1, |
2. ЛДГ2; з.ЛДГ3; 4. ЛДГ4; 5. ЛДГ6. |
РАЗДЕЛ IV: СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ. МАТРИЧНЫЕ БИОСИНТЕЗЫ
Занятие 8. Химия нуклеиновых кислот
Мотивация: Представление о строении нуклеиновых кислот и нуклеопротеинов необходимо для понимания универсального меха низма хранения и передачи генетической информации.
Цель занятия: Закрепить представления о строении, свойствах и функциях нуклеиновых кислот и нуклеопротеинов, их роли в биосин тезе белков.
|
Студент должен: |
||
|
|
|
|
|
Знать |
|
Уметь |
1. Функции ДНК и РНК. |
1. |
Объяснять сходство и различия |
|
2. |
Строение нуклеотидов. |
|
химического состава ДНК и РНК. |
3. |
Особенности структурной |
2. |
Охарактеризовать особенности |
|
организации ДНК и РНК. |
|
химических связей в молеку |
4. |
Схему постадийного кис |
|
лах ДНК и РНК РНК. |
|
лотного гидролиза нуклео |
3. |
Объяснить уникальные функ |
|
протеинов. |
|
ции нуклеиновых кислот |
|
|
4. |
Объяснить термины «ген», «ко |
|
|
|
дон», «антикодон», «хромосома». |
|
|
|
|
40 |
41 |
|

Вопросы, изученные ранее и необходимые дпя данного занятия:
|
Вопросы |
Где изучались |
1. |
Строение азотистых оснований и |
Кафедра органической |
|
пентоз. |
химии |
2. |
Состав и функции нуклеопротеинов. |
Кафедра биохимии |
|
|
(предыдущие занятия) |
Основная литература:
1.Березов Т. Т., Коровкин Б. Ф. Биологическая химия. - 1990. - С. 71-73, 77-91; 1998. - С. 86-88, 96-113;
2.Николаев А. Я. Биологическая химия. - 1998. - С. 92-105.
3.Биохимия / Под ред. Е. С. Северина. - 2003. - С. 140-148.
4.Алейникова Т. Л., Рубцова Г. В. Руководство к практическим за нятиям по биологической химии. •- 1988. - С. 94-96.
Дополнительная литература:
1.Овчинников Ю. А. Биоорганическая химия. - 1987. - С. 296-348; 397-406,
2.Ленинджер А. Основы биохимии. - 1985. - Т . 3. - С. 849-893.
3.Страйер Л. Биохимия. - 1984. - Т. 3. - С. 6-14, 67-84.
4.Мусил Я., Новакова О., Кунц К. Современная биохимия в схемах.
-1981. - С . 123-127, 139-141.
5.Молекулярная биология: Структура и биосинтез нуклеиновых ки слот / Под ред. А. С. Спирина. -1990. - 352 с.
6.Эллиот В., Эллиот Д. Биохимия и молекулярная биология. - 2000.
-С . 193-203.
7. Марри Р., Греннер Д., Мейес П., Родуапл В. Биохимия человека.
-1993. - Т . 2. - С . 5-14,55-63.
8.Уайт А., Хендлер Ф., Смит Э., Хилл Р., Леман И. Основы биохи мии. - 1981. - Т. 2. - С. 207-236.
Вопросы и задания дпя самоподготовки:
1.Поясните, в чем заключаются особенности состава и физикохимических свойств белков, входящих в состав нукпеопротеинов.
2.Напишите формулу фрагмента РНК-тетрануклеотида, содержа щего различные азотистые основания, отметьте связи, его ста билизирующие.
3.Покажите роль водородных связей в формировании вторичной структуры нуклеиновых кислот (на примере двух комплементар ных нуклеотидов),
4.Назовите разновидности РНК и поясните их биологическую роль.
5.Укажите условия, при которых происходит денатурация ДНК.
6.Дополните и зарисуйте схему полного кислотного гидролиза нук
пеопротеинов, укажите конкретные названия компонентов (рис, 4}.
7.Охарактеризуйте особенности строения и роль тРНК.
8.Поясните, что такое полисома.
9.Укажите;, что лежит в основе самосборки вирусных нуклеопротеиновых частиц.
10. Поясните биологическую роль мононуклеотидов (АТФ, цАМФ, ГТФ, цГМФ, УТФ и др.), а также динуклеотидов.
42 |
43 |
Рис. 4. Схема кислотного гидролиза нуклеопротеинов
Ориентировочная карта действия
№ |
Вопросы, подлежащие |
Последовательность |
работы |
|
п/п |
изучению |
и способ оформления результатов |
||
|
|
|
|
|
1 |
Проделать |
реакции на |
1. Выполнить работу (53). |
|
|
компоненты |
нуклеопро |
Ход работы: 1). Проделать биуре- |
|
|
теинов в |
гидролизате |
товую реакцию на полипептиды. |
|
|
дрожжей. |
|
2). Серебряная проба на пуриновые |
|
|
|
|
основания. 10 к гидролизата ней |
|
|
|
|
трализовать 1 к концентрированного |
|
|
|
|
аммиака и добавить 5 к 1%-ного |
|
|
|
|
раствора AgN03. Через 3-5 мин вы |
|
|
|
|
падает рыхлый бурый осадок се |
|
|
|
|
ребряных соединений |
аденина и |
|
|
|
гуанина. |
|
|
|
|
3). Провести пробу Троммера на ри- |
|
|
|
|
бозу и дезоксирибозу. |
|
|
|
|
|
|
4). Молибденовая проба на фос форную кислоту К 20 к молибде нового реактива (раствор молибдата аммония в азотной кислоте) доба
вить 2-3 к гидролизата и несколько минут кипятить на водяной бане. Жидкость окрашивается в лимонножелтый цвет. При охлаждении вы падает желтый кристаллический
осадок комплексного соединения фосфорномолибдеиового аммония.
2. Результаты работы записать в виде таблицы:
Химическая Реак Продукты Чем структура тивы реакции обуслов
компонента |
лена |
нуклео- |
реакция |
протеина |
|
Сделать вывод о качественном со ставе нуклеопротеинов.
Задания для контроля усвоения темы:
1.Отметьте сходство и различие в нуклеотидном составе ДНК и РНК.
2.Укажите, какие связи участвуют в образовании первичной струк туры нуклеиновых кислот
3.Напишите комплементарную последовательность для отрезка цепи ДНК: -ЦАГТАЦГАЦ-.
4Одна из цепей ДНК содержит 22% гуанина и 34% тимина. Под считайте, каково суммарное содержание аденина и цитозииа в этой цепи, а также сумму аденина и цитозина в комплементарной цепи.
5.Назовите функции ДНК.
6.Поясните, какой из типов РНК богат "минорными" основаниями, приведите примеры этих оснований.
7.Укажите, какие связи стабилизируют вторичную структуру РНК.
8.Укажите три нуклеотида, завершающих аминокислотный конец тРНК.
44 |
45 |

9. Функции антикодоновой петли тРНК.
10. Охарактеризуйте третичную структуру ДНК, какими химическими связями она стабилизируется?
Тестовые задания
1.Адапторная функция характерна для нуклеиновой кислоты
2.К пуриновым азотистым основаниям относятся
1. Цитозин; |
4. Тимин; |
2. Аденин; |
5. Гуанин. |
3. Урацил,
3.Установите соответствие
A. Нуклеозид |
1. Азотистое основание + моносахарид ; |
|
Б. Нуклеиновая кислота |
2. |
Азотистое основание+моносахарид+НзР04» |
B. Нуклеотид |
3. |
Полинуклеотид , |
4.Азотистое основание+полисахарид;
5.Полинуклеозид.
4.К минорным основаниям относится
1. 6-Аминопурин , |
4. 5-Метилцитозин;, |
2. 5-Метилурацил; |
5. 2,4-Диоксипиримидин. |
3. 2-Окси,4-аминопиримидин;
5.Коэффициент видовой специфичности - это отношение
1.Г+Ц/А+Т; |
4.Т+Ц/Г+А; |
2. А+У / Г+Ц ; |
5. Г+А / Ц+Т. |
3.Г+Т/А+Ц;
6.На долю минорных оснований в тРНК приходится {в %)
1. |
80; |
2.30, |
з. |
100; |
4.10; |
5. 50. |
7. Рибоза присутствует в составе |
|
|
|
|||
1.ДНК; |
2. тРНК, |
3. иРНК; |
4. рРНК. |
|
||
8.Название химического соединения состава: аденин + дезоксирибоза
9.Одна из цепей ДНК содержит 27% аденина и 31% гуанина. Сум марное содержание в этой цепи тимина и цитозина
10.Установите соответствие: продукт кислотного гидролиза ДНК - качественная реакция для его обнаружения
A. Дезоксирибоза |
1. Молибденовая проба; |
Б. Азотистые основания |
2. Проба Тромэдера; |
B. Фосфорная кислота |
3. Серебряная проба; |
|
4. Биуретовая реакция; |
|
5. Ксантопротеиновая реакция. |
Занятие 9. Коллоквиум «Биосинтез нуклеиновых кислот и белков»
Мотивация: Изучение основ матричных биосинтезов позволит по лучить представления об их биологической универсальности, меха низмах регуляции и причинах развития патологии.
Цель занятия: Закрепить представления о механизме кодирования, хранения и передачи наследственной информации, регуляции био синтеза белка.
|
|
|
|
Студент должен: |
|
|
|
|
|
|
|
|
|
|
|
|
Знать |
|
|
|
уметь |
|
|
1. Механизм процесса репли |
1. Объяснить |
биологическую зако |
|||||
|
кации (синтез ДНК), |
|
номерность хранения и передачи |
||||
2. Механизм |
процесса транс |
генетической информации. |
|||||
|
крипции (синтез РНК). |
2. Объяснить сущность и значение |
|||||
3. |
Характеристику |
генетиче |
генетического кода для биосинтеза |
||||
|
ского (триплетного кода). |
белка. |
|
|
|||
4. Механизм |
процесса транс |
3. Дать схематическое представле |
|||||
|
ляции (синтез белков). |
ние о механизмах |
репликации |
||||
5. |
Роль макроэргических со |
ДНК. |
|
|
|||
|
единений |
в |
матричных |
4. Отметить особенности синтеза и |
|||
|
биосинтезах. |
|
|
процессинга иРНК. |
|
||
6. Роль различных |
РНК при |
5. Объяснить |
участие |
различных |
|||
|
биосинтезе белка. |
|
типов РНК в биосинтезе белка. |
||||
7. |
Участие |
белковых |
факто |
6. Объяснить этапы матричного био |
|||
|
ров и ферментных |
систем |
синтеза белка и посттрансляцмон- |
||||
|
в матричных синтезах. |
ные изменения. |
|
||||
8. Механизмы регуляции экс |
7. Дать схематическое представле |
||||||
|
прессии генов у про- и эу- |
ние о регуляции! действия генов. |
|||||
|
кариотов. |
|
|
|
8. Объяснить механизмы мутаций и |
||
9. Мутации, их причины и |
их последствия. |
|
|||||
|
классификация. |
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
Вопросы, изученные ранее и необходимые для данного занятия:
|
Вопросы |
Где изучались |
1. |
Состав и функции нуклеопротеинов. |
Кафедра биохимии |
|
|
(предыдущие темы) |
2. |
Матричные биосинтезы;, понятия: код, |
Кафедра биологии |
|
кодой, антикодон; генные, геномные |
|
|
и хромосомные мутации. |
|
46 |
47 |

3. Биохимия / Под ред. Е. С. Северина. - 2003. - С. 150-153, 162181, 185-200.
Дополнительная литература:
1. Овчинников Ю А. Биоорганическая химия 1987. - С. 348-397; 406-442.
2. Ленинджер А. Основы биохимии 1985. - Т. 3. - С. 894-991. 3. Страйер Л. Биохимия 1984. -Т. 3. - С. 14-67, 84-165.
4 Мусил Я., Новакова О., Кунц К. Современная биохимия в схемах. 1981. - С. 133-138, 142-144, 203.
5. Эллиот В., Эллиот Д. Биохимия и молекулярная биология. - 2000. С. 204-262, 270-280.
6 Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. 1993 - Т. 2. - С. 35-52, 64-126.
7 Уайт А., Хендлер Ф., Смит Э., Хилл Р., Леман И. Основы биохи мии. - 1981. - Т. 2. - С. 1000-1118.
Вопросы и задания доя самоподготовки:
1. Поясните, в чем заключается сущность центрального постулата генетики.
2. Поясните, в чем заключается механизм полуконсервативной ре пликации ДНК.
3. Поясните роль ферментов в репликации ДНК.
4. Поясните сущность процесса транскрипции.
5. Поясните сущность, этапность и назначение процесса созрева ния РНК.
6. Назовите этапы синтеза белка и поясните сущность каждого этапа. 7. Зарисуйте схему "Этапы синтеза белка" (рис. 5), дополнив ее кон
кретными примерами кодонов и аминокислот.
8. Поясните сущность посттрансляционной модификации белков.
9. Поясните механизм действия ингибиторов матричных биосинтезов.
10. Зарисуйте схему регуляции биосинтеза белка путем индукции и
репрессии.
Основная литература
1.Березов Т. Т., Коровкин Б. Ф. Биологическая химия. - 1990. -
С.377-390, 399-422; 1998. - С. 478-498, 509-544.
2.Николаев А. Я. Биологическая химия. -1993 - С. "105-130,135-139.
48
49

ЗАДАНИЕ ПО УИРС:
Подготовьте реферативное сообщение по одной из тем:
1..Перспективы генной инженерии.
2.Антибиотики - ингибиторы биосинтеза белка и нуклеиновых кислот.
3.Молекулярные механизмы мутаций в молекуле ДНК.
4.Биохимические механизмы развития наследственных болезней.
5.Рекомбинантные ДНК и клонирование генов.
Задания для контроля усвоения темы:
1.Назовите, в каком направлении идет образование фосфодизфирной связи при синтезе нуклеиновых кислот.
2.Напишите суммарное уравнение реакций синтеза ДНК из дезоксирибонуклеозидтрифосфатов.
3.Напишите нуклеотидную последовательность цепи мРНК, синте зированной на цепи ДНК со следующей последовательностью нуклеотидов: -АТГЦГТТАЦААГ-.
4.Укажите, при созревании какого типа РНК происходит присоеди нение 5-метилтуаниловой кислоты к 5'-концу и полиА к. 3 -'концу.
5.Назовите, какую аминокислоту транспортирует тРНК, если ее
антикодон - ЦУА? ГГА? УАА? ЦГА?
6 Перечислите факторы, необходимые для инициации синтеза белковой цепи.
7.Назовите этапы синтеза белка, требующие использования энер гии макроэргических соединений.
8.Белок; паратгормон состоит из 84 аминокислот. Подсчитайте, сколько макроэргических связей затрачивается при его синтезе.
9.Поясните биологический смысл терминирующих кодонов.
10.Поясните механизм индукции синтеза ферментов на примере лактозного оперона.
Тестовые задания:
1.Установите правильную последовательность участия ферментов
врепликации
1. ДНК-полимеразаIII; |
4. ДНК-лигаза; |
2. РНК-полимераза , |
5. Хеликаза. |
3. ДНК-полимеразаI, |
|
2Адапторная функция в процессе трансляции характерна для нук леиновой кислоты
1.ДНК, |
2. м-РНК, З.тРНК; |
4. р-РНК, |
51

3.Праймер (затравка) - это фрагмент, состоящий из нуклеотидов, которые встречаются в нуклеиновой кислоте
4.Синтез ДНК на матрице РНК называется
5.Установить соответствие между названием этапа процессинга и химической модификацией
A. Кэпирование; |
1. Присоединение поли-АМФ; |
Б. Полиаденилирование; |
2. Удаление поли-АМФ; |
B. Сплайсинг. |
3. Присоединение 7'-метилгуанозин- |
|
трифосфата; |
4.Удаление экзонов и сшивание интронов;
5.Удаление интронов и сшивание экзонов.
6.Для трансляции необходимы:
1.мРНК, тРНК, рибосомы, АТФ, ГТФ, ферменты, Mg2+, аминокислоты;
2.Аминокислоты, ДНК, мРНК, тРНК, рибосомы, ферменты, АТФ,
3.ДНК, мРНК, тРНК, рибосомы, ферменты, АТФ, УТФ, ГТФ, ЦТФ,
4.ДНК, мРНК, тРНК, рибосомы, аминокислоты, ферменты ;
5.мРНК, тРНК, АТФ, ГТФ, ферменты, Мд2+, аминокислоты.
7.Расположите в правильной последовательности этапы биосинтеза белка
1.Терминация,
2.Инициация;
3.Элонгация,
4.Процессинг белка;
5.Синтез аминоацил-тРНК.
8.Установите соответствие между этапом; трансляции и макроэрги-
ческим соединением, энергия которого используется
А. Активация аминокислот,. |
1. ЦТФ ; |
Б. Элогнация. |
2. УТФ; |
|
3. ГТФ ; |
|
4. ТТФ; |
|
5. АТФ. |
9.Для биосинтеза белка необходимы ионы
10.Терминирующими кодонами являются
1. |
AAA; |
4. |
УУА ; |
2. |
УГА ; |
5. |
УАГ. |
3. |
АУГ, |
|
|
РАЗДЕЛ V: БИОЛОГИЧЕСКИЕ МЕМБРАНЫ Занятое 10. Семинар «Биохимия мембран»
Мотивация: Знание химического состава и свойств мембран необ ходимо для понимания их биологической роли, механизмов возник новения заболеваний, связанных с патологическими изменениями мембран.
Цель занятия: Изучить, химический отстав, биохимическую организа цию и функцию мембран, механизмы мембранного транспорта, про цессы перекисного окисления липидов и антиоксидантной защиты. Познакомиться с некоторыми заболеваниями, обусловленными мембран ной патологией.
Студент должен: |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Знать |
|
|
|
Уметь |
|
|
|
1. Виды биологических мембран и |
1. Объяснить особенности хи |
||||||
их функции. |
|
мического состава и биоло |
|||||
2. Химический состав и строение |
|
гические функции |
биомем |
||||
липидного бислоя, мицеллы, ли- |
|
бран. |
|
|
|
|
|
посом. |
2. |
Объяснить |
изменения, |
||||
3. Мембранные белки (интеграль |
|
функций |
мембран |
возни |
|||
ные и периферические). |
|
кающие |
вследствие |
усиле |
|||
4. Углеводные компоненты мембран. |
|
ния процессов перекисного |
|||||
5. Молекулярную организацию био |
|
окисления липидов. |
|
||||
логических мембран. |
3. |
Обосновать |
использование |
||||
6. Свойства мембран (асимметрия, |
|
антиоксидантных |
препара |
||||
жидкостность, самосборка). |
|
тов, стабилизирующих мем |
|||||
7. Виды транспорта через мембра |
|
браны. |
|
|
|
|
|
ны. Разновидности ионных кана |
4, Объяснить |
изменения, ме |
|||||
лов мембран. Механизм действия |
|
таболизма |
возникающие |
||||
Na+/К+ - АТФазы. |
|
при |
нарушении |
мембран |
|||
8. Лекарственные препараты - инги |
|
ного |
транспорта |
или мем |
|||
биторы транспортных механизмов |
|
бранной рецепции. |
|
||||
мембран. |
|
|
|
|
|
|
|
9. Механизмы мембранной рецепции. |
|
|
|
|
|
|
|
10. Причины нарушения структуры и |
|
|
|
|
|
|
|
функции мембран. Перекисное |
|
|
|
|
|
|
|
окисление мембранных липидов. |
|
|
|
|
|
|
|
11. Механизмы антиоксидантной |
|
|
|
|
|
|
|
защиты. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
52 |
53 |

Вопросы, изученные ранее и необходимые для данного занятия:
|
Вопросы |
Где изучались |
1. |
Строение клетки, субклеточных |
Кафедра гистологии |
|
структур. |
|
2. |
Строение и свойства липидов. |
Кафедра органической |
|
|
химии |
3. |
Состав гликопротеинов. |
Кафедра биохимии |
|
|
(предыдущие темы) |
Содержание обучения. Граф логической структуры темы
Основная литература:
1.Березов Т. Т., Коровкин Б. Ф. Биологическая химия. - 1990. -
С.276-286, 316-317; 1998, - С . 289-305,314-318.
2.Николаев А. Я. Биологическая химия. - 1998. - С. 178-199, 223227, 270-273, 294-296.
3.Биохимия / Под ред. Е. С. Северина. - 2003. - С. 227-263, 428-432.
Дополнительная литература:
1.Овчинников Ю. А. - Биоорганическая химия. - М.: Просвещение, 1987.-С. 547-636.
2.Марри Р. и соавт. Биохимия человека. - 1993. - Т. 2. - С. 127-146.
3.Поступаев В. В. и соавт. Патобиохимия мембран. - Хабаровск, 1997.-43 с.
Вопросы и задания для самоподготовки
1. Заполните табл. 5 «Типы биологических мембран и их функ ции». Сделайте вывод о различии функций мембран.
|
Таблица 5 |
|
|
Название мембраны |
Функция мембраны |
|
|
Плазматическая мембрана |
j |
Ядерная: мембрана |
|
Мембраны митохондрий |
|
Мембрана лизосом |
|
Мембрана эндоплазматического |
|
ретикулума: |
|
- гладкого, |
|
- шероховатого |
|
Мембрана аппарата Гольджи |
|
|
|
2.Рассмотрите особенности строения липидов мембран, усвойте понятие амфифильность.
3.Используя учебник:, зарисуйте в альбом схему строения биологи ческих мембран. Укажите интегральные и периферические белки.
4Выясните функции отдельных компонентов мембран: фосфолипидов, холестерина, белков, углеводов, воды.
5.Рассмотрите основные свойства мембран (асимметрия, жидкостность, самосборка).
55

6.Рассмотрите различные механизмы транспорта веществ через мембрану.
7.Зарисуйте в альбом схему «Активный транспорт веществ через мембрану» (рис. 6). Приведите конкретные примеры транспорти руемых веществ.
Рис. 6. Активный транспорт веществ через мембрану
8.Выясните сущность процессов эндоцитоза, экзоцитоза, гетерофагии, аутофагии, секреции.
9.Выясните сущность процессов перекисного окисления липидов мембран, роль этих процессов в повреждении клетки.
10.Рассмотрите механизмы, осуществляющие антиоксидантную за щиту мембран.
Задания для контроля усвоения темы
1.Перечислите основные компоненты мембран, поясните, какие свойства мембран обусловлены этими компонентами.
2.Напишите формулу дипальмитоилфосфатидилхолина и укажите, какими частями молекулы сформированы гидрофильная «голов ка» и гидрофобные «хвосты».
3.Выясните, как влияет холестерин на свойства мембран.
4.Приведите примеры интегральных белков мембран, поясните, ка кую роль они играют.
5.Поясните, какими факторами обусловлена избирательная прони цаемость мембран.
6.Поясните, чем обусловлена асимметрия мембран, какова ее роль.
7.Поясните принцип активного транспорта веществ через мембра ны. Приведите конкретные примеры.
8.Поясните сущность передачи сигнала через клеточную мембра ну. Перечислите соединения, являющиеся мессенджерами раз личных систем.
9.Перечислите стадии перекисного окисления липидов мембран.
10.Приведите примеры заболеваний, в основе которых лежит нару шение мембранных структур.
56
Тестовые задания
1.Жирная кислота, в молекуле которой содержится 20 атомов уг лерода и 4 двойные связи
2.Увеличение жидкостности мембраны происходит при включении
в ее структуру |
|
1. Стеариновой кислоты', |
4. Лигноцериновой кислоты |
2. Пальмитиновой кислоты; |
5. Арахидоновой кислоты; |
3.Линоленовой кислоты;
3.Маркером плазматической мембраны является фермент
1. Сукцинатдегидрогеназа; |
4. Аденилатциклаза, |
2. Лактатдегидрогеназа ; |
5. Галактозиптрансфераза, |
3.Глюкозо-6-фосфатаза;
4.Сборка фрагментов плазматической мембраны происходит
1. |
На рибосомах; |
4. В ядре; |
2. |
В аппарате Гольджи: |
5. В митохондриях. |
3.В эндоплазматическом ретикулуме.,
5.Транспорт через мембрану двух веществ в противоположном направлении называется
6.При введении яда кобры, содержащего фосфолипазу А2, проис ходит гемолиз эритроцитов за счет
1.Увеличения образования лизофосфолипидов в мембранах эритроцитов;
2.Увеличения перекисного окисления липидов;
3.Торможения ферментов антиоксидантов,
4.Разрушения витаминов, обладающих антиоксидантной активностью
5.Расщепления эфиров холестерина в мембранах.
7.При введении флоридзина в организм возникает глюкозурия при нормальном уровне гликемии. Это обусловлено
1.Увеличением фильтрации глюкозы в почечных клубочках)
2.Секрецией глюкозы в почечных канальцах;
3.Увеличением реабсорбции натрия;
4.Нарушением реабсорбции глюкозы в эпителии почечных канальцев,
5.Увеличением реабсорбции калия.
8.При активации аденилатциклазной системы образуется второй посредник
9.Инициирует процесс пероксидации
1.Окисление свободного радикала жирной кислоты с образованием перекисного радикала;
2.Образование гидроперекиси жирных кислот;
3.Взаимодействие жирной кислоты с первичным свободным радикалом j
4.Образование диеновых конъюгатов;
5.Образование малонового диальдегида.
57
