
Руководство к практическим по биохимии
.pdf
6.Выясните, на каких свойствах белков основаны методы их разделе ния на фракции путем высаливания, электрофореза, хроматографии.
7.Выясните, какие существуют методы хроматографического ана лиза, на чем они основаны, для чего используются.
8.Приведите доказательства обратимости осаждения белка солями щелочных и щелочно-земельных металлов, приведите примеры использования этого метода.
9.Выясните, что обозначает понятие «изоэлектрическая точка белка», как влияет химический состав белка на изоэлектрическую точку.
10.Зарисуйте схему «Классификация методов; разделения белков».
Рис. 1. Классификация методов разделения белков
Ориентировочная карта действия
№ |
|
Вопросы, подлежащие |
Последовательность работы |
п/л |
|
изучению |
и способ оформления результатов |
1 |
|
Определение изоэлек- |
Проделать работу 12 (18). |
|
|
трической точки казеина. |
|
|
|
|
|
2 |
|
Высаливание простого |
Выполнить работу 8 (14) |
|
|
белка. |
|
|
|
|
|
3 |
|
Обессоливание белково |
Выполнить работу 10 {17) |
|
|
го раствора методом |
|
|
|
гель-фильтрации. |
|
|
|
|
|
|
|
Задания для контроля усвоения темы |
|
1. |
Перечислите методы, с помощью которых можно определить |
||
|
молекулярную массу белка. |
|
|
2.Укажите основные факторы стабилизации белков в растворах.
3.Укажите, какими методами можно выделить белки в осадок без потери ими нативных свойств.
4.Поясните, почему при высаливании глобулины выпадают в оса док при меньшей концентрации соли, чем альбумины.
5.Перечислите факторы, определяющие заряд белка.
6.Дайте определение понятию изоэлектрическая точка белка.
7.Поясните, почему изоэлектрическая точка белка казеина нахо дится в кислой среде.
8.Поясните принцип гель-фильтрации, укажите, для чего исполь
зуется данный метод.
9Перечислите способы очистки белков от низкомолекулярных со единений.
10. Поясните принцип электрофореза. Назовите фракции белков сыворотки крови при электрофорезе на бумаге.
Тестовые задания
1.Определите суммарный заряд (в условных единицах) данного пепти да при растворении его в воде при нейтральной реакции среды:
Н2N-лей-лиз-тир-лиз-три-арг-асп-СООН |
|
|
|||
1.+1; |
2.+2; |
з . + з ; |
4 |
. о; |
5. -1. |
2. Определите суммарный заряд пептида: |
|
|
|||
Н2N-ала-лиз-вал-арг-глу-лиз-асп-СООН |
в кислой среде при пол |
||||
ном подавлении диссоциации карбоксильных групп. |
|
||||
1.+1; |
2.+2,, |
3 + 3 ; |
|
4 . +4; |
5.+5. |
3.Укажите характер заряда белка при рН 7,0, если его изоэлектри ческая точка равна 9,0.
4.Присоединение к пептиду ала-вал-гли-тре одного из трипептидов
придает ему |
|
А. Кислотные свойства-, |
1. Сер-арг-лиз ; |
Б. Основные свойства. |
3. Асп-лиз-лей; |
|
3. Лей-три-фен; |
|
4. Глу-глн-иле; |
|
5. феи-цис-три. |
5.Определите, в какой среде находится изоэлектрическая точка белков гистонов, богатых аминокислотами лизин и аргинин.
6.Расположите в логической последовательности приемы, позво ляющие выделить из ткани индивидуальный белок
1. Гель-фильтрация, |
4. Высаливание; |
2. Гомогенизация, |
5. Кристаллизация. |
3. Экстракция; |
|
18 |
19 |
|
7.Укажите, в какой последовательности будут выходить белки при гель-фильтрации их смеси через колонку, заполненную сефадексом:
1.Трансферрин {молекулярная масса 88000);
2.Интерферон (молекулярная масса 25000);
3.Иммуноглобулин (молекулярная масса 95000);
4.Инсулин (молекулярная масса 6000);
5.Яичный альбумин (молекулярная масса 45000).
8.Укажите причину створаживания прокисшего молока
1.Кислотный гидролиз казеина;
2.Денатурация казеина в кислой среде;
3.Денатурация альбумина в кислой среде;
4.Достижение изоэлектрической точки казеина и его агрегация;
5.Образование комплекса белка с органическими кислотами.
9.Определите направление движения в электрическом поле (к ано ду или к катоду) белка, изоэлектрическая точка которого рН 9,0 в нейтральном буфере (рН 7,0).
10.Для разделения смеси белка и сульфата аммония можно ис пользовать
1. Электрофорез; |
4. Гель-хроматографию; |
2. Высаливание; |
5. Диализ. |
3. Афинную хроматографию; |
|
Занятие 4. Структурная организация белков
Мотивация: Знание структурной организации белков необходимо для понимания свойств белковых молекул, причин возникновения заболеваний, связанных с нарушением структуры и свойств белков.
Цель занятия: Изучить структурную организацию белковых моле кул, химические связи, формирующие ее; изменения свойств белков при денатурации; причины протеинопатий; классификацию белков.
Студент должен:
Знать |
Уметь |
|
|
1. Уровни структурной организации |
1. Объяснить изменение свойств |
||
белковых молекул. |
белкой при |
нарушении |
его |
2. Типы химических связей, форми |
первичной |
структуры |
(на |
рующих структуры белка. |
примере гемоглобина). |
|
|
3. Методы изучения белковых структур. |
2. Провести реакции осаждения |
||
|
|
|
|
4. |
Денатурацию |
белка. |
Денатурирую |
белка в различных усло |
|
|
щие агенты. Использование процес |
виях. |
|||
|
сов денатурации белка в медицине. |
|
|||
5. Гидролиз белка. Виды гидролиза. |
|
||||
6. |
Классификацию белков. |
Основ |
|
||
|
ные представители |
отдельных |
|
||
|
классов белков, их значение для |
|
|||
|
жизнедеятельности. |
|
|
|
|
7. |
Биологически |
активные |
пептиды, |
• |
|
|
их роль. |
|
|
|
|
|
|
|
|
|
|
Вопросы, изученные ранее и необходимые для данного занятия:
|
Вопросы |
Где изучались |
1. |
Свойства различных групп аминокислот. |
Кафедра органической |
|
|
химии |
2. |
Виды связей в органических соединениях. |
Там же |
20

Основная литература:
1.Березов Т. Т., Коровкин Б, Ф. Биологическая химия. - 1990. - С. 40-76; 1998.- С. 47-77.
2.Николаев А. Я. Биологическая химия. - 1998.- С. 18-36.
3.Биохимия / Под ред. Е. С. Северина. - 2003 - С. 16-38, 56-60.
4.Алейникова Т. Л. и соавт. Руководство к практическим занятиям по биологической химии - 1988. - С. 8-9, 30-32; 2000.- С, 19-22.
Дополнительная литература:
1.Ленинджер А. Основы биохимии. - 1985. - Т. 1. - С. 141-225.
2.Рис Э., Стерберг И. От клеток к атомам. - 1983. - С. 31-41.
3.Марри Р. и соавт. Биохимия человека. - 1993. - С . 42-51.
Вопросы и задания для самоподготовки
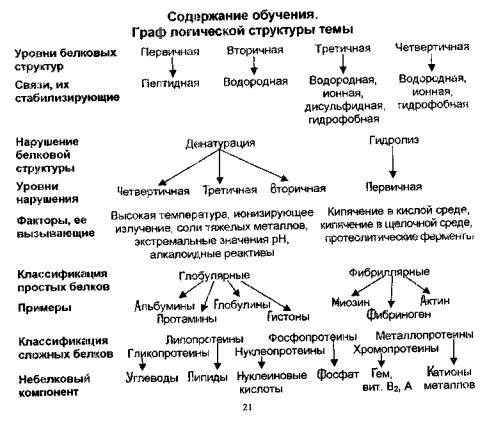
1.Выясните зависимость физико-химических свойств белков от их первичной структуры.
2.Дайте определение понятию «видовая специфичность белка». На примере инсулина различных видов ЖИВОТНЫХ покажите ви довую специфичность первичной структуры.
3.Выясните, что такое первичная структура белка, какие связи уча ствуют в ее образовании. Охарактеризуйте эти связи.
4.Выясните, как образуется вторичная структура белка, какие свя зи ее стабилизируют, какие типы ее выделяют.
5.Охарактеризуйте третичную структуру белка, поясните механизм образования связей, стабилизирующих ее. Используя учебник биохимии, представьте на рисунках примеры нековалентных связей, стабилизирующих нативную конформацию белка.
6.Выясните, что такое четвертичная структура белка, какие связи участвуют в ее образовании. Укажите роль шаперонов в форми ровании конформации белков.
7.На примере гемоглобина выясните сущность кооперативных из менений конформации протомеров и зависимость биологической активности от четвертичной структуры.
8.Выясните механизм денатурации белков, определите, какие свя зи разрушаются при денатурации и как это сказывается на бел ковых структурах.
9.Объясните процесс гидролиза белка, перечислите факторы ко торыми он вызывается. Назовите вид гидролиза, характерный для живых организмов.
10.Дайте классификацию белков, отметьте отличие простых белков от сложных, назовите простатические группы сложных белков.
Ориентировочная карта действия
№ |
Вопросы, подлежащие |
Последовательность работы |
|
и способ оформления результатов | |
|||
П/П |
изучению |
|
|
|
|
|
|
|
|
|
|
1 |
Осаждение белков при |
Проделать работу 14 (23). |
|
|
нагревании. |
В протоколе отметить условия, при |
|
|
|
которых белки выпадают в осадок |
|
|
|
или остаются в растворе. |
|
|
|
|
|
Задания для контроля усвоения темы
1.Укажите, в образовании каких химических связей могут прини мать участие радикалы аминокислот следующего фрагмента пептидной цепи: -фен-арг-асп-ала-лей-.
2.Назовите связи, стабилизирующие третичную структуру белка.
3.Поясните различие водородных связей, стабилизирующих вто ричную и третичную структуру.
4.Поясните влияние четвертичной структуры на свойства белка.
5.Поясните, как осуществляется генетический контроль белковой структуры.
6.Дайте определение понятию «олигомерный белок».
7.Дайте определение понятию «протеинопатия». Приведите при меры протеинопатий.
8.Поясните, почему соли тяжелых металлов вызывают денатура цию белка. Назовите связи, разрушающиеся при этом.
9.Назовите условия обратимой денатурации белков.
10.Назовите соединение, нарушающее взаимодействие гемоглоби на с его естественным лигандом кислородом.
Тестовые задания |
|
1. Первичная структура белка формируется за счет |
связей |
1.Пептидных;
2.Водородных между полярными радикалами,
3.Водородных между элементами пептидных группировок;
4.Гидрофобного взаимодействия;
5.Ионных.
22 |
23 |
|

2. Радикалы пептида -вал-фен-три-лей- могут участвовать в обра
зовании |
связей |
|
1. Пептидных-, |
|
4. Ионных, |
2. Дисульфидных; |
5. Воде родных, |
|
3.Гидрофобных,
3.Радикалы пептида -лиз-асп-вал-фен-глу- могут участвовать в об
разовании |
связей |
1. Пептидных; |
4. Ионных; |
2. Дисульфидных; |
5. Водородных; |
3.Гидрофобных;
4.Вторичная структура белка стабилизируется
1.Водородными связями между остатками амино- и карбок сильных групп пептидных связей,
2.Водородными связями между радикалами аминокислот;
3.Гидрофобными связями;
4.Ионными связями;
5.Пептидными связями,
5.Разрушение первичной структуры белка называется
1. Денатурация; |
4. Осаждение, |
2. Гидролиз; |
5. Растворение |
3.Высаливание,
6.При денатурации белка разрушается структура
1. |
Первичная; |
4. |
Четверг/иная; |
2. |
Вторичная; |
5. |
Все типы структур. |
3.Третичная;
7.Структурно и функционально обособленную область белка называют
8.Для определения N-концевой аминокислоты используется реак ция
1.С фтординитробензолом;
2.Гидролиза карбоксипептидазой;
3.Гидролиза трипсином;
4.Гидролиза химотрипсином,
5.Гидролиза пепсином
9.Замена глутаминовой кислоты в шестом положении В-цепи гемо глобина на валин приводит к возникновению заболевания
10.При гидролизе белка получена смесь аминокислот и фосфорная кислота. Назовите класс гидролизованного белка.
РАЗДЕЛ III: ФЕРМЕНТЫ
Занятие 5. Химическая природа ферментов, их специфичность и обнаружение
Мотивация: Знание химической природы ферментов, механизма их действия необходимо для понимания природы биокатализа и даль нейшего изучения свойств ферментов.
Цель занятия: Закрепить представления о химической природе ферментов, особенностях ферментативного катализа, специфично сти ферментов, принципе обнаружения ферментов.
Студент должен:
Знать |
Уметь |
1. Химическую природу фермен |
1. Составить схему обнаружения |
тов. Активный и аплостериче- |
фермента в биологическом |
ский центры. |
объекте. |
2. Особенности ферментативно |
2. Определить характер катали |
го катализа. Механизм дейст |
зируемой реакции по типу ко- |
вия ферментов, влияние на |
фермента. |
энергию активации. |
3. Доказать присутствие фер |
3. Строение небелковых |
ментов уреазы, каталазы, пе- |
компонентов ферментов. |
роксидазы, тирозииазы, ами |
4. Строение изоферментов. |
лазы в биологических объек |
5. Специфичность действия |
тах. |
ферментов, типы специфич |
4. Определить специфичность |
ности. |
сахаразы. |
6. Принцип качественного обна |
|
ружения ферментов в биоло |
|
гических объектах. Единицы |
|
ферментатив ной активности, |
|
|
|
Вопросы, изученные ранее и необходимые для данного занятия:
|
Вопросы |
Где изучались |
1. |
Теории катализа, энергетический |
Кафедра общей химии |
|
барьер реакции, энергия активации. |
|
2. |
Физико-химические свойства белков. |
Кафедра биохимии |
|
|
(предыдущие темы) |
24 |
2.5 |

Основная литература:
1.Березов Т. Т., Коровкин Б. Ф. Биологическая химия. - 1990. - С. 92-104, 112-115, 124-125; 1998. - С . 114-134.
2.Николаев А. Я. Биологическая химия. -199(3. - С. 53-78, В1-83, 89-90.
3.Биохимия / Под ред. Е. С. Северина. - 2003. - С. 76-80, 83-88, 9295,99, 120.
4.Алейникова Т. Л. и соавт. Руководство к практическим занятиям по биологической химии. - 1988. - С. 74-76; 2000.-- С. 31-32.
Дополнительная литература:
1.Ленинджер А. Основы биохимии. - 1985. -Т. 1. - С. 226-244.
2.Марри Р. и соавт. Биохимия человека. - 1993. - Т . 1 . - С . 63-81.
Вопросы и задания для самоподготовки
1. Рассмотрите основные различия в действии неорганических ка тализаторов и ферментов.
2.Предложите методы, с помощью которых можно доказать бел ковую природу ферментов.
3.Объясните, почему присутствие фермента снижает энергетиче ский барьер реакции.
4.Объясните роль активного центра в реакциях ферментативного катализа.
5.Рассмотрите химическую природу ферментов, поясните, какие компоненты могут входить в состав сложных ферментов.
6.Нарисуйте схему образования фермент-субстратного комплекса (учебник Т. Т. Березова, Б. Ф, Коровкина, 1990, с.105; 1998, с.131).
7.Начертите и дополните табл. 2, в которой укажите, какие ви тамины входят в состав перечисленных коферментов и в каких реакциях они участвуют.
|
|
Таблица 2 |
Кофермент |
Витамин |
В каких реакциях участвует |
|
||
|
|
|
НАД |
РР |
Перенос протонов и электронов |
НАДФ |
|
|
ФМН |
|
|
ФАД |
|
|
ТДФ |
|
|
ПФ |
|
|
Биотин |
|
|
|
|
|
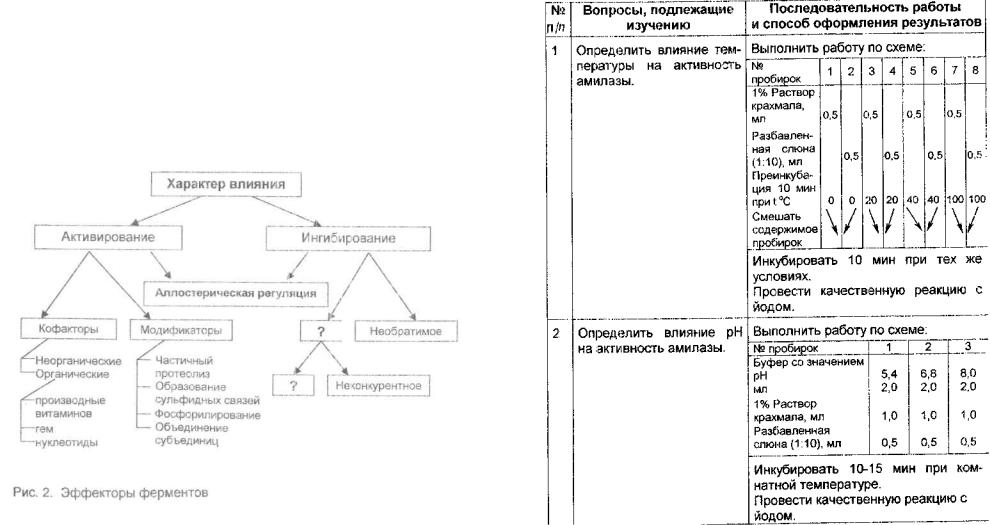
8.Выясните, что такое аллостерическии центр, объясните механизм изменения ферментативной активности при воздействии аллостерических эффекторов.
9.Рассмотрите примеры различной специфичности ферментов (абсолютная, относительная, стереохимическэя).
10.Выясните принцип обнаружения ферментов в биологических объектах, единицы ферментативной активности.
Ориентировочная карта действия
№ |
Вопросы, подлежащие |
Последовательность работы |
|||
и способ оформления результатов |
|||||
п/п |
изучению |
||||
1 |
Качественное обнару |
А. Уреаза - фермент, катализирующий |
|||
|
жение ферментов в био |
гидролиз мочевины с |
образованием |
||
|
логических объектах. |
аммиака и углекислого газа. |
|||
|
|
К 2 мл 2% раствора мочевины доба |
|||
|
|
вить |
помешивая 0,5 г соевой муки. |
||
|
|
Через несколько минут по запаху об |
|||
|
|
наруживается появление аммиака. При |
|||
|
|
прибавлении в пробирку 2 капель рас |
|||
|
|
твора |
фенолфталеина |
наблюдается |
|
|
|
появление розового |
окрашивания |
||
|
|
|
|
|
|
26 |
27 |
|

вследствие сдвига реакции в щелоч
ную сторону.
6. Тирозиназа - фермент, катализирую
щий первую стадию окисления тирозина и других производных фенола в окра шенные меланиноподобные вещества.
К 2 мл 1% раствора тирозина добавить 0,5 мл водной вытяжки картофеля, по ставить в термостат (температура 37°С).
В, Каталаза фермент, катализирующий реакцию разложения пероксида водоро да на молекулярный кислород и воду.
В пробирку налить 10-15 капель 1% раствора пероксида водорода, доба вить 1 каплю крови. Происходит бур ное выделение пузырьков кислорода,
жид кость вспенивается.
Г. Пероксидаза - Фермент, катализи рующий реакцию окисления фенолов, полифенолов, ароматических аминов в присутствии пероксида водорода.
В две пробирки налить по 5 капель гвая ковой смолы и по 5 капель 2% раствора
пероксида водорода. В первую пробирку добавить 5 капель вытяжки из хрена во вторую (контроль) - 5 капель воды. На
блюдать изменение окраски (синий цвет). Д. Амилаза - фермент, катализирую щий гидролитическое расщепление крахмала с образованием мальтозы (промежуточными продуктами могут быть различные декстрины).
В пробирку набрать 1 мл разведенной слюны (1:10), прилить 1 мл 1% рас твора крахмала. Инкубировать в тер мостате 15 мин при 37°С. Пробу раз лить поровну в 2 пробирки. В первой пробирке провес™ пробу Троммера (на наличие продукта реакции - маль тозы или глюкозы); во второй провести цветную реакцию с 1% раствором J2 в KJ (при наличии субстрата - крахмала - наблюдается синее окрашивание).
|
|
Протокол оформить в виде таблицы, |
|
|
|
в которой указать: источник фермен |
|
|
|
та, субстрат, на который он воздей |
|
|
|
ствует и продукты, по которым обна |
|
|
|
руживается действие фермента. |
|
|
|
|
|
2 |
Определение специ |
Д. Выполнить работу 19 (40). |
|
Сделать вывод о специфичности это |
|||
|
фичности сахаразы |
||
|
|
го фермента. |
|
|
|
|
Задания для контроля усвоения темы
1.Назовите, как изменяется скорость реакции, константа равнове сия в присутствии неорганических катализаторов и ферментов.
2.Перечислите основные свойства ферментов, обусловленные их белковой природой.
3.Объясните, почему в присутствии фермента скорость химической реакции увеличивается.
4.Реакция разложения пероксида водорода требует энергии актива ции 75,4 кДж/моль, в присутствии платины энергия активации сни жается до 48,9 кДж/моль, в присутствии фермента катапазы - до 5,4 кДж/моль. Укажите, в каком случае скорость реакции будет выше.
5.Назовите участки, которые можно выделить в активном центре фермента.
6.Дайте определения терминам «кофермент», «простетическая группа», «апофермент», «холофермент».
7.Поясните, каким типом специфичности обладает фермент липа за, гидролизующий триглицериды, обоснуйте ответ.
8. Укажите, в каких единицах выражается активность ферментов.
9Перечислите коферменты, участвующие в транспорте протонов и электронов.
10. Фермент пактатдегидрогеназа катализирует реакцию |
|
Перечислите методы, которыми можно диказстэ присутствие |
|
этого фермента в биологическом объекте. |
|
Тестовые задания |
|
1. В присутствии фермента энергетический барьер реакции |
. |
2 Комбинация аминокислот в ферменте, обеспечивающая взаимо действие с субстратом и катализ называется
1. Кофермент; |
4. Активный центр; |
2. Простетическая группа; |
5. Аллостерический центр, |
3. Апофермент; |
|
|
29 |
28

3.Небелковая часть фермента, прочно связанная с апоферментом, называется
4.В реакциях карбоксилирования участвует кофермент
1. ТДФ, |
4. НАД;, |
2. Пиридоксальфосфат; |
5. ФМН. |
3.Биотин;
5.В переносе водорода участвуют коферменты
1.НАД+; |
2. ФМН; 3. ПФ, |
4. ФАД; 5. КоА. |
6.Участок молекулы фермента, при связывании с которым опреде ленных веществ изменяется активность фермента, называется
1. Аллостерический центр; |
4. Кофермент; |
2. Связывающий центр; |
5. Простатическая группа. |
3.Каталитический центр,
7.Фермент сахараза, гидролизующий связь между глюкозой и га лактозой в олигосахаридах лактоза и рафиноза, обладает
специфичностью.
8.Фермент ЛДГ представлен сочетанием субъединиц
1.НННН, 2. нннм, з. НHMM; 4. нммм; 5. ММММ
9.Количество фермента, способное превратить 1 моль субстрата в продукт в 1 секунду, называется
1. Международная единица, |
4. Условная единица; |
2. Катал; |
5. Нанокатал. |
3.Число оборотов;
10.Удельную активность фермента принято выражать
1. В нанокаталах; |
4. Гили мг; |
2. Международных единицах, |
5. Катал/кг белка или МЕ/мг белка. |
3. Условных едини цах; |
|
Занятие 6. Основные свойства ферментов
Мотивация: Знание основных свойств ферментов необходимо для понимания условий функционирования ферментов в организме, из менения их активности под влиянием различных: факторов.
Цель занятия: Изучить основные свойства ферментов, кинетику ферментативных реакций.
Студент должен:
Знать |
|
Уметь |
|
|
|
|
|
||
1. Термолабильность ферментов. |
1. Определить |
кинетику |
фер |
|
2. Зависимость скорости |
фер |
ментативных |
реакций |
при |
ментативной реакции OT |
РH. |
изменении температуры и рН. |
||
3. |
Влияние концентрации |
фер |
2. |
Определить |
влияние активато- |
|
|
мента и субстрата на скорость |
|
ров и ингибиторов на скорость |
|||
|
реакции. |
|
|
ферментативных реакций. |
|
|
4. |
Активаторы ферментов. |
|
3. |
Уметь определить константу |
||
5. |
Ингибиторы ферментов, |
типы |
|
Михаэлиса (на графике). |
|
|
|
ингибирования. |
|
4. |
Уметь определить тип |
инги |
|
6. |
Аллостерическую регуляцию |
|
бирования |
по величине |
мак |
|
|
активности ферментов. |
|
|
симальной |
скорости реакции |
|
|
|
|
|
и константе Михаэлиса. |
|
|
|
|
|
|
|
|
|
Вопросы, изученные ранее и необходимые для данного занятия:
|
Вопросы |
Где изучались |
1. |
Зависимость скорости реакции |
Кафедра общей химии |
|
от температуры. |
|
2. |
Влияние рН на свойства белков. |
Кафедра биохимии |
|
|
(предыдущие темы) |
Основная литература:
1.Березоа Т. Т., Коровкин Б. Ф. Биологическая химия. - 1990. - С. 112-126; 1998.- С. 134-158.
2.Николаев А. Я. Биологическая химия. -- 1998. - С. 73-84.
3.Биохимия / Под ред. Е. С. Северина. -2003. - С . 97-108, 112-118.
4.Алейникова Т. Л. и соавт Руководство к практическим занятиям по биологической химии. - 1988. - С. 60-61, 63-65, 79-80.
30 |
31 |
|
Дополнительная литералу pa:
1. Ленинджер А. Основы биохимии. - 1985, -Т. 1. - С . 2319-250. |
8. Поясните, как можно реактивировать фермент, заблокированный |
|
по конкурентному типу. |
||
2. Марри Р. и соавт. Биохимия человека. - 1Э93. - Т. 1. - С. 81-97. |
||
9. Выясните механизм влияния неконкурентных ингибиторов. |
||
|
||
Вопросы и задания для самоподготовки |
10. Объясните принцип аллостерической регуляции активности фер |
|
ментов. |
||
1. Выясните, чем обусловлена зависимость скорости ферментатив |
||
|
||
ной реакции от температуры. |
Ориентировочная карта действия |
|
2. Выясните, почему скорость ферментативной реакции зависит от |
||
|
||
рН среды. |
|
|
3. Выясните зависимость скорости реакции от концентрации фермента. |
|
|
4. Начертите график зависимости скорости ферментативной реак |
|
|
ции от концентрации субстрата, определите графически значение |
|
|
константы Михаэлиса. |
|
|
5. Нарисуйте и дополните схему «Эффекторы ферментов» (рис. 2). |
|
|
6. Выясните пути химической модификации ферментов. |
|
|
7. Перечислите свойства, характерные для конкурентных ингибито |
|
|
ров. Укажите механизм их действия. |
|
32 |
33 |

3 |
Определить |
влияние ак |
Выполнить [заботу по схеме: |
|||
|
тиваторов И |
ИНГИбИТОрОВ |
№ пробирок |
1 |
2 |
3 |
|
на активность амилазы. |
|
|
|
|
|
|
|
Н20 |
NaCI(1%) |
CuS0.4(-|%) |
||
|
|
|
Разбавлен |
|
20 к |
20 к |
|
|
|
20 к |
|
|
|
|
|
|
ная слюна |
|
|
|
|
|
|
(1:10), мл |
|
0,5 |
0,5 |
|
|
|
1% Раствор |
0,5 |
|
|
|
|
|
крахмала, |
|
|
|
|
|
|
|
|
|
|
|
|
|
мл |
|
0,5 |
0,5 |
|
|
|
Инкубировать 10-15 мин при ком |
|||
|
|
|
|
0,5 |
|
|
|
|
|
натной температуре. |
|
||
|
|
|
Провести |
качественную |
реакцию с |
|
|
|
|
йодом. |
|
|
|
|
|
|
|
|
|
|
Задания для контроля усвоения темы
1.Объясните, почему при температуре выше 50° скорость фермен тативной реакции снижается.
2.Объясните, почему при изменении рН меняется образование фермент-субстратного комплекса.
3.Дайте определение понятию «константаМихаэлиса».
4.Приведите примеры кофакторов ферментов, объясните меха низм их влияния.
5.Приведите примеры ферментов, синтезируемых в виде профер ментов. Поясните механизм их превращения в активную форму.
6.Поясните, почему присутствие цистеина может изменить актив ность некоторых ферментов.
7.Укажите, по какому типу цианиды блокируют фермент цитохромоксидазу.
8.Назовите основные свойства конкурентных ингибиторов.
9.Укажите, для каких реакций характерно аллостерическое ингибирование.
10.Поясните, почему сульфаниламидные препараты подавляют рост бактериальных клеток.
Тестовые задания
1. Причиной быстрого снижения активности фермента при темпера туре 50-60° является
1.Гидролиз;
2.Денатурация;
3.Образование недиссоциирующего фермент-субстратного
комплекса;
4.Ингибирование фермента избытком субстрата;
5.Образование ингибиторов-
2При увеличении рН желудочного сока до 5 активность пепсина .....
3.Величина константы Михаэлиса характеризует
1.Максимальную скорость реакции;
2.Минимальную скорость реакции;
3.Зависимость от рН;
4.Сродство фермента и субстрата;
5.Скорость диссоциации фермент-субстратного комплекса.
4.Сродство фермента гексокиназы, катализирующего реакцию фосфорилирования гексоз, выше к субстрату
1.Сорбитол (Км=2,0х10-6 моль/л),
2.Фруктоза (Км=1,5х10-6 моль/.п);
3.Галактоза (Км-1,0х10-6 моль/л);
4.Манноза (Км=0,6х10-6 моль/л);
5.Глюкоза (Км=:0,15х10-6 моль/л).
5.Скорость реакции пропорциональна количеству фермента в ус
ловиях |
|
1. Оптимальной температуры, |
4. Присутствия активатора: |
2. Оптимума рН; |
5. Присутствия ингибитора. |
3. Избытка субстрата; |
|
6 Активирование пепсиногена под действием соляной кислоты происходит за счет
1.Гидролитического отщепления пептида;
2.Образования дисульфидных мостиков;
3.Присоединения ионов хлора,
4.Присоединения простатической группы;
5.Фосфорилирования
7В инкубационную смесь содержащую фосфатный буфер, янтар ную кислоту, ФАД и сукцинатдегидрогеназу, добавлена малоно вая кислота. Скорость реакции при этом
8 При отравлении синильной кислотой (цианидами) тормозится ак
тивность фермента |
|
1. Холинэстеразы, |
4. Цитохромоксидазы; |
2. Липазы: |
5. Амилазы, |
3.Трипсина;
9.В смесь, содержащую субстрат, фермент и ингибитор внесли до полнительное количество субстрата. Скорость реакции при этом увеличилась. Определите тип ингибирования.
34 |
35 |

10. Большинство биохимических процессов в организме протекает в несколько стадий, каждая из которых катализируется определен ным ферментом:
Определите, какой фермент с наибольшей вероятностью будет тормозиться продуктом реакции по аллостерическому ТИПУ.
Занятие 7. Коллоквиум «Строение и свойства ферментов»
Мотивация: Знание строения и свойств ферментов способствует пониманию механизма их действия, пониманию значения определе ния активности ферментов для диагностики различных заболеваний и применению ферментных препаратов в медицине Цель занятия: Изучить методы разделения и очистки ферментов.
Классификацию ферментов. Различия ферментного состава органов и тканей, органоспецифичные ферменты. Значение определения ак тивности ферментов для диагностики заболеваний Наследственные энзимопатий. Вопросы энзимотерапии: применение ферментов, их активаторов и ингибиторов. Иммобилизованные ферменты.
Студент должен:
|
Знать |
Уметь |
|
|||
|
|
|
|
|||
1. Методы выделения и очистки |
1. СОСТАВИТЬ |
схему выделения |
||||
|
ферментов. |
|
фермента |
из биологического |
||
2. |
Классификацию ферментов. |
|||||
объекта и определения его ак |
||||||
3. |
Механизм гиперферментемии. |
тивности. |
|
|
||
|
Ферментный |
и изофермент- |
2. Определить по уравнению ре |
|||
|
ный спектр печени, миокарда, |
акции принадлежность |
фер |
|||
|
скелетных |
мышц. Органо- |
||||
|
мента к определенному классу. |
|||||
|
специфические ферменты. |
|||||
|
3. Определить |
пораженный |
ор |
|||
4. |
Применение |
ферментов, их |
||||
|
активаторов и ингибиторов с |
ган по ферментному спектру. |
||||
|
4. Обосновать |
применение фер |
||||
|
лечебной целью. |
ментных препаратов. |
|
|||
5. |
Причины энзимопатий. |
|
||||
|
|
|
||||
|
|
|
|
|
|
|
Вопросы, изученные ранее и необходимые для данного занятая:
|
Вопросы |
Где изучались |
1. |
Химическая природа ферментов, |
Кафедра биохимии |
|
механизм их действия. |
(предыдущие темы) |
2. |
Свойства ферментов. |
Кафедра биохимии |
|
|
(предыдущие темы) |
Основная литература:
1.Березов Т. Т., Коровкин Б. Ф. Биологическая химия. - 1990. - С. 92-132; 1998.- С. 153-168.
2.Николаев А. Я. Биологическая химия. - 1998.- С. 83-92.
3.Биохимия / Под ред. Е. С. Северина. - 2003. - С. 80-83, 119-123.
Дополнительная литература:
1.Ленинджер А. Основы биохимии. - 1985. - Т. 1. - С. 137-160,226-269.
2.Марри Р. и соавт. Биохимия человека. -1993.-Т. 1.-С. 98-116.
36 |
37 |
