
- •2. Производные моносахаридов, образующиеся в организме (фосфорные эфиры, уроновые кислоты, аминосахара), их биологическое значение.
- •3. Биосинтез хс. Схема процесса. Атеросклероз и связь нарушений метаболизма хс и липопротеинов.
- •4.Минеральные вещества крови (Са, р, Na, k, Fe). Участие в обмене.
- •1. Основные этапы биосинтеза белка. Роль нуклеиновых кислот, активация ак, рабочий цикл рибосомы.
- •2. Гетерополисахариды (классы гликозаминокликанов). Строение, распространение в организме. Биологическая роль.
- •3.Структура ферментов. Активный центр. Механизм обр-ия фермент-субстратного комплекса. Аллостерические участки, их биороль.
- •4. Состав молока и роль в питании растущего ор-ма. Сравнительная оценка состава коровьего и женского молока. Преимущества естественного вскармливания.
- •1. Свойства и биолоическая роль белков. Белки как гидрофильные коллоиды. Реакция осаждения белков, использование реакций осаждения в мед.Практике. Методы очистки и разделения белков.
- •2. Переваривание и всасывание у в жкт. Возрастные особенности. Судьба всосавшихся моносахаридов.
- •3. Понятие об энергии активации. Образование фs-комплекса. Принципы количественного определения активности ф. Единицы активности.
- •4.Содержание и формы билирубина в крови. Диагностическое значение форм билирубина.
- •1. Белки как амфотерные электролиты. Механизм образования заряда. Изоэлектрическая точка белка. Св-ва б в ит.
- •2. Биосинтез и мобилизация гликогена, последовательность реакций. Биол.Роль. Регуляция активности фосфорилазы и гликогенсинтетазы.
- •3.Основные сведения о кинетике ферментативных реакций. Факторы влияющие на скорость р-ий.
- •4. Содержание глюкозы в крови. Возрастные особенности.
- •1.Гидролиз белков. Методы, условия, продукты гидролиза. Определение степени гидролиза. Использование гидролизатов в медицине.
- •2. Анаэробный распад глюкозы. Последовательность р-ий, локализация. Биологическая роль.
- •3. Стероидные гормоны, представители. Механизм действия. Особенности биосинтеза стероидных гормонов.
- •4. Содержание белков в плазме крови, возрастные особенности.
- •2. Роль анаэробного и аэробного распада глюкозы в мышцах. Судьба молочной кислоты.
- •3. Кофакторы и их связь с витаминами. Типичные примеры.
- •4. Содержание остаточного азота в крови. Компоненты остаточного азота.
- •1. Белки. Классификация б. Характеристика сложных б. Хромопротеины, классификация, строение, распространение.
- •2. Аэробное окисление у, схема процесса. Образование пвк из глю, последовательность р-ий. Челночный механизм транспорта водорода.
- •3. Регуляция активности ф. Аллостерические механизмы, ограниченный протеолиз, хим.Модифиация ферментов. Биологическая роль регуляции активности ф.
- •4. Возврастные особенности состава крови (белки, остаточный азот, глюкоза).
- •1. Нуклеопротеины. Современные представления о структуре и функциях нуклеиновых кислот. Продукты их гидролиза.
- •2. Окислительное декарбоксилирование пвк. Последовательность реакций, связь с дыхательной цепью.
- •3. Активаторы и ингибиторы ферментов. Типы ингибирования. Применение ингибиторов в качестве лекарственных средств.
- •4. Минеральные вещества крови. Распределение между плазмой и эритроцитами.
- •1. Днк. Первичная, вторичная и третичная структуры. Биологическая роль днк.
- •2. Цикл трикарбоновых кислот, последовательность реакций, связь с дыхательной цепью. Биологическое значение.
- •3. Классификация ферментов. Важнейшие представители основных классов.
- •4. Содержание Са и р в плазме крови.
- •1. Рнк. Первичная и вторичная структура. Типы рнк, особенности строения, локализация в клетке. Биологическая роль.
- •2. Строение коэнзима а, участие в обмене веществ.
- •3. Энергетический обмен. Стадии катаболизма б, л, у. Источники восстановительных эквивалентов для электрон-транспортной цепи. Роль митохондрий в окислении водорода.
- •4. Изменение содержания белков, остаточного азота, глюкозы при заболеваниях.
- •1. Гликопротеины. Их строение, классификация, представители. Биологическая роль.
- •2. Пентозофосфатный путь окисления глюкозы, основные этапы процесса. Биологическое значение цикла. Наследственные нарушения.
- •3. Митохондриальная цепь окисления кислорода. Образование электрохимического трансмембранного потенциала, его использование.
- •4. Анализ желудочного сока.
- •1. Липопротеины. Их строение, классификация. Состав и функции липопротеинов крови.
- •2. Роль печени в обмене углеводов. Глюконеогенез, субстраты для синтеза, схема реакций.
- •3. Тканевое дыхание, последовательность реакций. Продукция энергии в дыхательной цепи.
- •4. Формы кислотности желудочного сока.
- •1. Хромопротеины, их строение, биологическая роль. Основные представители хромопротеинов.
- •2. Поддержание постоянства глюкозы в крови. Источники и пути расходования глюкозы в крови. Гипо- и гипергликемия, причины их возникновения.
- •3. Надн-оксидазная система: надн-зависимые дегидрогеназы, флавиновые дг, железосеоцентры. Строение, их роль в транспорте электронов.
- •4. Возрастные особенности желуд сока.
- •1. Заменимые и незаменимые ак. Потребность ор-ма в б в зависимости от возраста. Белковый минимум. Формы баланса азота в организме. Возрастные особенности.
- •2. Биосинтез глюкозы (глюконеогенез). Возможные предшественники, последовательность реакций. Глюкозолактатный цикл (цикл Кори). Физиологическое значение.
- •3. Цикл кислорода дыхательной цепи. Цитохромоксидаза, строение, биологическая роль.
- •4.Физико-химические показатели мочи. Возрастные особенности.
- •1. Переваривание белков в жкт. Промежуточные и конечные продукты гидролиза белков. Использование амк в тканях.
- •2. Сахарный диабет. Характер нарушений обменных процессов при сах.Диабете. Нарушение уранатного пути использования глюкозы как основа нарушений структуры гликозаминогликанов.
- •3. Образование макроэргических соединений в цепи тканевого дыхания. Характеристика процесса с помощью коэффициента р/о. Разобщение окисления и фосфорилирования в дых.Цепи.
- •4. РН мочи в норме и при патологии.
- •1. Процессы превращения аминокислот в толстом кишечнике под влиянием гнилостных бактерий. Обзвреживание проуктов гниения.
- •2. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, фруктоземия, непереносимость дисахаридов. Гликоген- и агликогенозы
- •3. Окислительное и субстратное фосфорилирование в процессе биологического окисления.
- •4. Пигменты мочи и их происхождение.
- •2. Современные данные об активных формах углеводов, жирных кислот и аминокислот.
- •3. Надн – оксидазная система: убихинон, цитохромы. Строение, их роль в транспорте электронов
- •4.Органические вещества мочи, их происхождение.
- •1. Роль нуклеиновых кислот в биосинтезе белка. Характеристика генетического кода. Строение и роль т-рнк.
- •2.Взаимосвязь белкового, углеводного и липидного обменов. Роль ключевых метаболитов глюкозо-6-фосфатов, пировинограной кислоты и ацетил-КоА.
- •3. Образование со2 в процессах биологического окисления. Типы декарбоксилирования в цтк.
- •4. Азотсодержащие вещества мочи. Возрастные особенности.
- •1.Основные этапы биосинтеза белков (активация амк, фазы трансляции, участие рибосом).
- •2. Липиды, классификация и распространение. Химическая природа, свойства и биол.Роль триацилглицеридов.
- •3. Микросомальное и митохондриальное окисление. Сходства и различия. Пути использования кислорода. Токсичность кислорода. Механизмы защиты.
- •4. Содержание мочевой кислоты в крови. Причины гиперурикемии.
- •1.Современные представления о регуляции биосинтеза белка. Регуляция действия генов. Строение и функционирование лактозного оперона. Индукция и репрессия синтеза белков в организме человека.
- •2.Классификация глицеролипидов, хим строение и биологическая роль в организме
- •3. Витамины и их значение в жизнедеятельности человека. Классификация. Участие в обмене веществ.
- •4. Индикан мочи,значение исследования.
- •3. Парные соединения мочи.
- •2 Переваривание и всасывание простых и сложных липидов в жкт. Возрастные особенности.
- •1.Процессы образования конечных продуктов обмена простых белков. Основные источники аммиака. Роль глутамина в оезвреживании аммиака и синтезе ряда соединений(как донор амидной группы).
- •2.Депонирование и мобилизация жиров в жировой ткани, физиологическое значение. Транспорт и использование жрных кислот, образующихся при мобилизации жиров. Биосинтез и использование кетоновых тел.
- •3.Витамин рр. Химическая природа. Растпространение, участие в обменных процессах.
- •4.Способы определения белка в моче.
- •1. Распад пуриновых и пиримидиновых азотистых оснований. Конечные продукты. Пути выведения.
- •2. Желчные кислоты, строение. Свойства. Участие в переваривании и всасывании липидов. Конъюгация желчных кислот, биологическая роль.
- •3. Функции почек. Транспорт веществ в процессе секреции и реабсорбции. Реабсорбция глюкозы, аминокислот, профильтровавшихся белков. Пороговые и беспороговые вещества.
- •4. Фенилкетонурия, алкаптонурия. Причины их возникновения.
- •3. Гомополисахариды (крахмал и гликоген). Химическое строение, свойства. Особенности распада в желудочно-кишечном тракте и тканях.
- •4. Нервная ткань. Химический состав, особенности обмена. Возрастные особенности.
- •1. Хромопротеины, их строение, биологическая роль. Основные представители хромопротеинов.
- •2. Аэробное окисление углеводов, схема процесса. Образование пировиноградной кислоты из глюкозы, последовательность реакций. Челночные механизмы транспорта водорода.
- •3. Гормоны половых желез. Химическое строение и участие в обменных процессах.
- •4. Индикан мочи, происхождение, диагностическая роль.
1.Процессы образования конечных продуктов обмена простых белков. Основные источники аммиака. Роль глутамина в оезвреживании аммиака и синтезе ряда соединений(как донор амидной группы).
Источники аммиака:
1)дезаминирование АК(в тканях и кишечнике)
2)дезаминирование аминов
3)дезаминирование азотистых оснований
Аммиак в крови – 12-65мкмоль/л(10-120мкг%), в моче – 35,7 – 71,4ммоль/сут(0,5-1,0г)
Аммиак исключительно токсичен.
Обезвреживание:
1)образование амидов(локально)
Гутамат + NH3,NH4+,АТФ, магний++, глутамин-синтетазаглутамин +АДФ +Фн
Глутаминпочки( –аммиак, глутаминаза) Глутамат -аммиак2аммоний+аммониогенез
альфа-КГ
печень, синтез мочевины
синтез пуринов, пиримидинов.
2)восстановительное аминирование
А. альфа-КГ (глутаматДГ, аммоний, 2Н, НАДФ)глутамат, Н2О, НАДФН
Б. глутамат + ПВК (трансаминирование)альфа-КГ +ала
3)образование аммонийных солей
4)синтез мочевины.
2.Депонирование и мобилизация жиров в жировой ткани, физиологическое значение. Транспорт и использование жрных кислот, образующихся при мобилизации жиров. Биосинтез и использование кетоновых тел.
3.Витамин рр. Химическая природа. Растпространение, участие в обменных процессах.
Никотиновая к-та/ниацин/никотинамид/антипеллагрический витамин. Водорастворимый.
 Потребность
18мг. Рис, хлеб, картофель, мясо, печень,
почки, морковь. Актив.форма – НАД, НАДФ.
Потребность
18мг. Рис, хлеб, картофель, мясо, печень,
почки, морковь. Актив.форма – НАД, НАДФ.
Вход.в состав НАД, НАДФ – коферменты дегидрогеназ в ОВР. Процессы биологического окисления(промежуточные переносчики электронов и протонов)
Авитаминоз: пеллагра – дерматиты, диарея, деменция, анорексия, тошнота, понос, обезвоживание. Стоматиты, гингивиты. Головные боли, депрессии, психозы.
4.Способы определения белка в моче.
1.Турбидиметрические методы. основаны на преципитации белка различными агентами: сульфосалициловой кислотой (ССК), трихлоруксусной кислотой (ТХУ), бензетоний хлоридом.
2. Колориметрические методы. К группе колориметрических методов определения белка относятся методы Лоури, биуретовый и методы, основанные на связывании белка с органическими красителями.
3. Определение белка диагностическими полосками. Диагностические полоски позволяют быстро провести полуколичественную оценку содержания белка в моче. По интенсивности сине-зеленой окраски реакционной зоны, развивающейся после кратковременного контакта полоски с мочой, содержащей белок, судят о содержании белка в моче. Основной предпосылкой получения надежных результатов является поддержание стабильного рН, обеспечивающего связывание белком индикатора в стандартных условиях.
4. Определение белка в моче в системе внешней оценки качества
Билет№25
1. Распад пуриновых и пиримидиновых азотистых оснований. Конечные продукты. Пути выведения.
2. Желчные кислоты, строение. Свойства. Участие в переваривании и всасывании липидов. Конъюгация желчных кислот, биологическая роль.
Желчные к-ты – конечный продукт обмена ХС – производные холановой к-ты:
Желчные кислоты:
- первичные 3,7,12-триоксихолановая = холевая; 3,7-диоксиходановая = хенодезоксихолевая(образ.из печени из ХС)
- вторичные 3,12-диоксихолановая = дезоксихолевая; 3-оксихолановая=литохолевая(образ.в кишечнике под действием м/флоры)
**Конъюгирование желчных кислот: 1)с глицином – при у/в питании; 2)с таурином(образ.из цистеина)-при Б питании
![]()
роль: - эмульгируют жиры; -активируют липазу, -способсвуют всасыванию продуктов гидролиза жиров в кишечнике.
В сутки из ХС образ. 1г желчи в гепатоцитах→по печеночным пузырным протокам→концентр.в желч.пузыре.Опорожнение происходит постоянно, но усил.под действием поступившей пищи и ХЦкинина.
После выполенния своих ф.85%желчных кислот всас.в подвздошной кишке и вновь поступ.в состав секретируемой желчи – энтерогепатальный круг.
Общий пул желч.к-т 2,8-3,5г. Совершают 6-8 оборотов в сут.
Недостаток желч.к-т: желчекам.болезнь, стеаторрея.
Витамин В6. Химическая природа, распространение, участие в обменных процессах.
Антидерматитный. Адермин, пиридоксин. Водрастворимый.
Прозводные 3-оксипиридина:
 пиридоксин
пиридоксин
 пиридоксаль
пиридоксаль
 пиридоксамин
пиридоксамин акт.форма-
пиридоксальфосфат.
акт.форма-
пиридоксальфосфат.
Сут.потр. 2мг. Хлеб, горох, фасоль, картофель, мясо, почки, печень.
Коферментные ф.выполняют только фосфорилированные производные – ПФ. 20пиридоксалевых ферментов, катализирующих ключевые р.азотистого метаболизма в организме.
Авитаминоз:акродилия – дерматит с преим.поражением кожи лопаток, носа, ушей. Эпилептиформные припадки; дегенерация ЦНС. Гомоцистинурия, цистатионурия, нарушения обмена трп.
Глюкозурия и ее причины.
Обычно присутствие глюкозы в моче (глюкозурия) является результатом нарушения углеводного обмена вследствие патологических изменений в поджелудочной железе (сахарный диабет, острый панкреатит и т.д.). Реже встречается глюкозурия почечного происхождения, связанная с недостаточностью резорбции глюкозы в почечных канальцах. Как временное явление глюкозурия может возникнуть при некоторых острых инфекционных и нервных заболеваниях, после приступов эпилепсии, сотрясения мозга.
Отравления морфином, стрихнином, хлороформом, фосфором также обычно сопровождаются глюкозурией. Наконец, необходимо помнить о глюкозурии алиментарного происхождения, глюкозурии беременных и глюкозурии при нервных стрессовых состояниях (эмоциональная глюкозурия).
Билет№26
Окисление высших жирных кислот. Последовательность реакций бета-окисления. Связь окисления жирных кислот с цитратным циклом и дыхательной цепью.
Процесс окисления жирных кислот складывается из следующих основных этапов.
Активация жирных
кислот.
Свободная жирная
кислота независимо
от длины углеводородной цепи является
метаболически инертной и не может
подвергаться никаким биохимическим
превращениям, в том числе окислению,
пока не будет активирована. Активация жирной
кислоты протекает
на наружной поверхности мембраны митохондрий при
участии АТФ, коэнзима A
(HS-KoA) и ионов Mg2+. Реакция
катализируется ферментом ацил-КоА-синтетазой:![]()
В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты.
Первая стадия дегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в α- и β-положениях, превращаясь в КоА-эфир ненасыщенной кислоты.

Стадия гидратации. Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется β-оксиацил-КоА (или 3-гидроксиацил-КоА):

Вторая стадия дегидрирования. Образовавшийся β-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Эту реакциюкатализируют НАД+-зависимые дегидрогеназы:

Тиолазная реакция. представляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (β-ке-тотиолазой):

Образовавшийся ацетил-КоА подвергается окислению в цикле трикар-боновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь β-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА.
Баланс энергии. При каждом цикле β-окисления образуются одна молекула ФАДН2 и одна молекула НАДН. Последние в процессеокисления в дыхательной цепи и сопряженного с ним фосфорилирования дают: ФАДН2 – 2 молекулы АТФ и НАДН – 3 молекулы АТФ, т.е. в сумме за один цикл образуется 5 молекул АТФ. При окислении пальмитиновой кислоты образуется 5 х 7 = 35 молекул АТФ. В процессе β-окисления пальмитиновой кислоты образуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цикле трикарбоновых кислот, дает 12 молекул АТФ, а 8 молекул ацетил-КоА дадут 12 х 8 = 96 молекул АТФ.
Таким образом, всего при полном β-окислении пальмитиновой кислоты образуется 35 + 96 = 131 молекула АТФ. С учетом одноймолекулы АТФ, потраченной в самом начале на образование активной формы пальмитиновой кислоты (пальмитоил-КоА), общий энергетический выход при полном окислении одной молекулы пальмитиновой кислоты в условиях животного организма составит 131 – 1 = 130 молекул АТФ.
Витамин А. Химическая природа, распространение, участие в обменных процессах.
Жирорастворимый. Антиксерофтальмический/ретинол. Депонируется в печени. Сут.потребность 1-2,5мг.
Только животные продукты:печень, яич.желток, молочные продукты, рыбий жир. В растит.продуктах каротиноиды – провитамины А. Актив.форма – ретиналь.
Регуляция роста и дифференцировки клеток(ретино-ретиналь-ретиноевая к-та);
участие в зрит.акте. Палочки: сумуречное зр.(пигмент родопсин);колбочки:цвет.зр.(йодопсин). Кофермент – 11-цис-ретиналь, альд.произв вит.А.
Антиоксидант.
Авитаминоз: гемералопия(сумеречная слепота), ксерофтальмия – сухость роговицы глаза(закупорка слезканала – ороговение эпителия), конъюнктивит, отек, изъязвление роговицы – кератомаляция. Избыточное ороговение кожи, поражения эптелия ЖКТ, мочепол.с-мы, дыхат.с-мы.
Соединительная ткань. Классификация. Клеточные элементы. Основные белки соединительной ткани. Межклеточный матрикс, представление о гликопротеинах соединительной ткани.
1)собственно СТк
2)скелет СТк(хрящевая, костная. в т.ч. зубы)
3)СТк со спец.св-вами: жировая, слизистая, пигментная, ретикулярная, кровь, лимфа, синовиальная и т.д.
Общие свойства: происхождение из мезенхимы, сходство стр-ры, выполняют опорные функции.
СТк – межкл.матрикс с клетками различно типа и волокнистыми стуктурами.
По физиологич.состоянию: волокнистые, твердые(кости), гелеобразные(хрящи), жидкие.
Собственно СТк распределена: по ходу сосудов, в обл.почечных лоханок, вход.в сост.хрящей связок сухожилий, сост.основу м/кл.в-ва паренхиматозных органов, подстил.кожу.
Коллаген.
основной Б СТк. Составляет 25-33% от общего кол-ва Б, 6% от массы тела. Химический состав: 1/3 АК глицин, 1/5 пролин, оксипролин, 1/10 аланин.
Генетические дефекты коллагена:
дерматоспораксис – заболев.круп.рогат.скота – повышенная ломкость кожи. Дефект проколлагеновой пептидазы.
латиризм – ингибирование лизиноксидазы, аминооксидазы
синдром Элерса-Данлоса: коллагенозы
несовершенный остеогенез(врожд.ломкость костей, б.»стеклянного мужчины», врожд.рахит)
синдром Марфана
врожденный атеросклероз. Коллаген 3 типа в сосудах.
50% коллагена обновляется за 50 лет.
Эластин.
Беден о-пролином, о-лизином. 1/3 часть АК – глицин. Основа стр-ры: десмозин, изодесмозин.
Десмозин.
Обеспечивает растяжимоть, стретч-свойства. Образ-ся из 4 остатков лизина. Нарушение резиноподобных св-в приводит: эмфизема, аневризмы сосудов. Причины: нарушение активности эластазы при дефиците меди и витамина В6, разрушение эластина под действием эластазы. Эластазу синт.нейтрофилы(в легких – эмфизема!). В норме не происходит, т.к. эластазу ингибирует альфа-1-антитрипсин(б.острой фазы), синтезируемый альвеолярными макрофагами, что защищает от действия эластазы. При дефиците – усиленное действие эластазы – эмфизема.
Основное в-во СТк. Межклеточный матрикс.
Представлено гликопротеинами:
1)собственно ГП(95%белка и 5%у/в нерегулярного строения) – муцины, гаптолобины, ФСГ, ЛГ и др.
2)протеогликаны(5%белок и 95%ГАГ) Небелковая часть: ГАГ – ВМС, ВПС(кислые мукополисахариды). Мономер – дисахаридная единца(у/в регулярного строения)
Заболевния: коллагенозы, остеопороз, врожд.пороки сердца, сколиозы, близорукость, гипермобильность суставов, дисплазия СТк, опущение органов.
Билет№27
Обмен триптофана. Образование серотонина, биологическая роль. Кинурениновый и серотониновый пути превращения триптофана.
Трп – незаменимая АК. В физиологических условиях более 95% триптофана окисляется по кинурениновому пути и не более 1% – по серотониновому. Серотонин в организме подвергается окислительному дезаминированию с образованием индолилук-сусной кислоты, которая выделяется с мочой. Содержание этой кислоты в моче повышено при поражениях кишечника злокачественными карци-ноидами, когда около 60% триптофана окисляется по серотониновому пути.
серия р-ций→серия р-ций +ФРПФ→рибонуклеотид никотин.к-ты +АТФ, +глутамин→НАД+ перенос е в дых.цепи→НАДФ+
ТРп гидроксилаза, О2→Н2О →5-окситриптофан декарбоксилаза, ПФ→ серотонин
- сужает сосуды
- стимулирует активность мозга
- регулирует сон, поведение, кровяное давление, температуру
- стимулирует секрецию гастроинтестинальных Г
- стимулирунт перистальтику
- серотонин – мелатонин(образ.в шишковид.железе)
Биосинтез жирных кислот, последовательность реакций. Регуляция биосинтеза.
Синтез жирных кислот протекает в цитоплазме клетки. В митохондриях в основном происходит удлинение существующих цепей жирных кислот. Установлено, что в цитоплазме печеночных клеток синтезируется пальмитиновая кислота (16 углеродных атомов), а в митохондриях этих клеток из уже синтезированной в цитоплазме клетки пальмитиновой кислоты или из жирных кислот экзогенного происхождения, т.е. поступающих из кишечника, образуются жирные кислоты, содержащие 18, 20 и 22 углеродных атома.
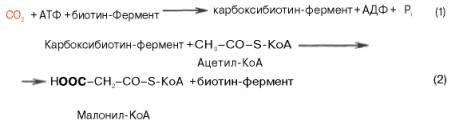
Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуются бикарбонат, АТФ, ионы марганца. Катализирует эту реакцию фермент ацетил-КоА-кар-боксилаза. Фермент содержит в качестве простетической группы биотин. Авидин – ингибитор биотина угнетает эту реакцию, как и синтез жирных кислот в целом.
Установлено, что ацетил-КоА-карбоксилаза состоит из переменного числа одинаковых субъединиц, каждая из которых содержит биотин, биотинкарбоксилазу, карбоксибиотинпереносящий белок, транскарбоксилазу, а также регуляторный ал-лостерический центр, т.е. представляет собой полиферментный комплекс.
Реакция протекает в два этапа: I – карбоксилирование биотина с участием АТФ и II – перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА:
Мультиферментный комплекс, называемый синтетазой (синтазой) жирных кислот, состоит из 6 ферментов, связанных с так называемым ацилпереносящим белком (АПБ). Данный белок в синтетазной системе выполняет роль КоА.Приводим последовательность реакций, происходящих при синтезе жирных кислот:
 образованием
бутирил-АПБ завершается лишь первый из
7 циклов, в каждом из которых началом
является присоединение молекулы
малонил-АПБ к карбоксильному концу
растущей цепи жирной кислоты. При этом
отщепляется дистальная карбоксильная
группа малонил-АПБ в виде СО2. Например,
образовавшийся в первом цикле бутирил-АПБ
взаимодействует с малонил-АПБ:
образованием
бутирил-АПБ завершается лишь первый из
7 циклов, в каждом из которых началом
является присоединение молекулы
малонил-АПБ к карбоксильному концу
растущей цепи жирной кислоты. При этом
отщепляется дистальная карбоксильная
группа малонил-АПБ в виде СО2. Например,
образовавшийся в первом цикле бутирил-АПБ
взаимодействует с малонил-АПБ:

Завершается синтез
жирной кислоты отщеплением HS-АПБ от
ацил-АПБ под влиянием фермента деацилазы.
Например:
![]()
Суммарное уравнение
синтеза пальмитиновой кислоты можно
записать так:

Образование ненасыщенных жирных кислот. Элонгация жирных кислот.
пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот.
Наряду с десатурацией жирных кислот (образование двойных связей) в микросомах происходит и их удлинение (элонгация), причем оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН. Энзиматическая система, катализирующая удлинение жирных кислот, получила название элонгазы. На схеме представлены пути превращения пальмитиновой кислоты в реакциях десатурации и элонгации.

Регуляция синтеза ЖК:
ассоциация/диссоциация комплексов субъединиц фермента Ац-КоА-карбоксилазы. Активатор – цитрат; ингибитор – пальмитоил-КоА.
фосфорилирование/де=//=. Фосфорилированный ф. неактивен(глюкагон и адреналин). Инсулин вызывает дефосфорилирование – становится активной.
индукция синтеза ферментов. Избыт.потребление у/в – ускорение превращения продуктов катаболизма в жиры; голодание или богатая жирами пища приводит к снижении синтеза ферментов и жиров.
Кетонурия и ее причины.
Кетоновые (ацетоновые) тела. В нормальной моче эти соединения встречаются лишь в самых ничтожных количествах (не более 0,01 г в сутки). При выделении больших количеств кетоновых тел качественные пробы становятся положительными. Это явление патологическое и называется кетонурией. Например, при сахарном диабете ежедневно может выделяться до 150 г кетоновых тел.
С мочой никогда не выделяется ацетон без ацетоуксусной кислоты, и наоборот. Обычные нитропруссидные пробы позволяют определить не только присутствие ацетона, но также и ацетоуксусной кислоты; β-оксимас-ляная кислота появляется в моче лишь при сильном увеличении количества кетоновых тел (сахарный диабет и др.).
Кетоновые тела выделяются с мочой не только при сахарном диабете, но и при голодании, исключении углеводов из пищи. Кетонурия наблюдается при заболеваниях, связанных с усиленным расходом углеводов: например, при тиреотоксикозе, кровоизлияниях в подпаутинные пространства, черепно-мозговых травмах. В раннем детском возрасте (продолжительные заболевания пищеварительного тракта (дизентерия, токсикозы) могут вызвать кетонемию и кетонурию в результате голода и истощения. Кетонурия нередко наблюдается при инфекционных заболеваниях: скарлатине, гриппе, туберкулезе, менингите. В этих случаях кетонурия не имеет диагностического значения и является вторичной.
Билет№28
Переваривание и всасывание нуклеопротеинов в ЖКТ. Судьба всосавшихся продуктов.
Переваривание нуклеопротеинов и всасывание продуктов их распада осуществляются в пищеварительном тракте. Под влиянием ферментов желудка, частично соляной кислоты, нуклеопротеины пищи распадаются на полипептиды и нуклеиновые кислоты; первые в кишечнике подвергаются гидролитическому расщеплению до свободных аминокислот. Распад нуклеиновых кислот происходит в тонкой кишке в основном гидролитическим путем под действием ДНК- и РНКазы панкреатического сока. Продуктами реакции при действии РНКазы являются пуриновые и пи-римидиновые мононуклеотиды, смесь ди- и тринуклеотидов и резистентные к действию РНКазы олигонуклеотиды. В результате действия ДНКазы образуются в основном динуклеотиды, олигонуклеотиды и небольшое количество мононуклеотидов. Полный гидролиз нуклеиновых кислот до стадии мононуклеотидов осуществляется, очевидно, другими, менее изученными ферментами (фосфодиэстеразами) слизистой оболочки кишечника.
В отношении дальнейшей судьбы мононуклеотидов существует два предположения. Считают, что мононуклеотиды в кишечнике под действием неспецифических фосфатаз (кислой и щелочной), которые гидролизируют фосфоэфирную связь мононуклеотида («нуклеотидазное» действие), расщепляются с образованием нуклеозидов и фосфорной кислоты и в таком виде всасываются. Согласно второму предположению, мононуклеотиды всасываются, а распад их происходит в клетках слизистой оболочки кишечника. Имеются также доказательства существования в стенке кишечника нуклеотидаз, катализирующих гидролитический распад моно-нуклеотидов. Дальнейший распад образовавшихся нуклеозидов осуществляется внутри клеток слизистой оболочки преимущественно фосфороли-тическим, а не гидролитическим путем.
Всасываются преимущественно нуклеозиды, и в таком виде часть азотистых оснований может быть использована для синтеза нуклеиновых кислот организма. Если происходит дальнейший распад нуклеозидов до свободных пуриновых и пиримидиновых оснований, то гуанин не используется для синтетических целей. Другие основания, как показывают опыты с меченными по азоту аденином и урацилом, в тканях могут включаться в состав нуклеиновых кислот. Однако экспериментальные данные свидетельствуют, что биосинтез азотистых оснований, входящих в состав нуклеиновых кислот органов и тканей, протекает преимущественно, если не целиком, de novo из низкомолекулярных азотистых и безазотистых предшественников.
Биосинтез триацилглицеринов, способы синтеза, последовательность реакций. Роль инсулина, адреналина, глюкагона в регуляции синтеза. Значение процесса.
Известно, что скорость биосинтеза жирных кислот во многом определяется скоростью образования триглицеридов и фосфолипидов, так как свободные жирные кислоты присутствуют в тканях и плазме крови в небольших количествах и в норме не накапливаются.
Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование α-глице-рофосфата (глицерол-3-фосфата) как промежуточного соединения.
В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:
В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с процессами гликолиза и гликогенолиза. Известно, что в процессе гли-колитического распада глюкозы образуется дигидроксиацетонфосфат (см. главу 10). Последний в присутствии цитоплазматической глицерол-3-фос-фатдегидрогеназы способен превращаться в глицерол-3-фосфат:
Отмечено, что если содержание глюкозы в жировой ткани понижено (например, при голодании), то образуется лишь незначительное количество глицерол-3-фосфата и освободившиеся в ходе липолиза свободные жирные кислоты не могут быть использованы для ресинтеза триглицеридов, поэтому жирные кислоты покидают жировую ткань. Напротив, активация гликолиза в жировой ткани способствует накоплению в ней триглицеридов, а также входящих в их состав жирных кислот. В печени наблюдаются оба пути образования глицерол-3-фосфата.
Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты (т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная кислота (фосфатидат):
Как отмечалось, ацилирование глицерол-3-фосфата протекает последовательно, т.е. в 2 этапа. Сначала глицерол-3-фосфат-ацилтрансфераза катализирует образование лизофосфатидата (1-ацилглицерол-3-фосфата, а затем 1-ацилглицерол-3-фосфат-ацилтрансфераза катализирует образование фосфатидата (1,2-диацилглицерол-3-фосфата) .
Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидро-лазой до 1,2-диглицерида (1,2-диацилглицерола):
Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой:
Синтез триглицеридов (триацилглицеролов) в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из β-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров.
Установлено, что большинство ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,– в митохондриях.
Регуляция: Адреналин и норадреналин увеличивают скорость липолиза в жировой ткани; в результате усиливается мобилизация жирных кислот из жировых депо и повышается содержание неэстерифи-цированных жирных кислот в плазме крови. Как отмечалось, тканевые липазы (триглицеридлипаза) существуют в двух взаимопревращающихся формах, одна из которых фосфорилирована и каталитически активна, а другая – нефосфорилирована и неактивна. Адреналин стимулирует через аденилатциклазу синтез цАМФ. В свою очередь цАМФ активирует соответствующую протеинкиназу, которая способствует фосфорилированию липазы, т.е. образованию ее активной формы. Следует заметить, что действие глюкагона на липолитическую систему сходно с действием кате-холаминов.
Гормоны и их классификация. Представления об основных механизмах гормональной регуляции метаболизма.
Г – это химические посредники, регулирующие обмен в-в и развитие органзма.
Биологические признаки:
Дистантность действия
Строгая специфичность, т.е. один Г нельзя заменить другим
Высокая биологическая активность(в крови конц.10-6 – 10-11ммоль/л)
Г оказывают действие путями:
- изменяют проницаемость клеточных мембран
- изменяют скорость ферментативных р-ций – модулируют активность готовых мо-д Б-ферментов, это Г срочной регуляции(сек, мин)
- изменяют скорость синтеза Б-ферментов – Г медленной регуляции.
Классификация:
по химич.природе:
производные АК – адреналин(эпинефрин), норадреналин, тироксин и др.
пептидные (белковые) – АКТГ, ЛТГ, МЦС, инсулин
стероидные – половые, кортикостероиды.
по механизму передачи горм.сигнала в кл-мишени:
стероидные Г и тироксин. Их рецепторы располагаются в цитозоле клеток; они проникают во внутрь и реализуют гормональный эффект по цитозольному механизму.
пептидные и адреналин; рецепторы к этим Г на пов-ти клет.мембран, и Г не проникают вутрь клеток.
в звисимости от посредника:
Г реализуют свой эфф.через циклические нуклеотиды(цАМФ, цГМФ)
с участием ионизированного Са++ и инозитолполифостфатов (ИПФ)
Креатинурия и ее причины.
КРЕАТИНУРИЯ— появление креатина в моче. Моча здорового мужчины почти не содержит креатина, у женщин и детей — незначительная физиологическая креатинурия; у женщин она увеличивается при беременности, лактации. Избыточное содержание в пище мяса может привести к экзогенной креатинурией.
Основной причиной патологической креатинурии являются поражения мышц: миозиты, мышечная дистрофия, тяжелая миастения, тонические и клонические судороги.
Кроме того, креатинурия отмечается при ряде эндокринных заболеваний — диабете, гипертиреозе, акромегалии, а также при ацидозе, алкалозе, авитаминозах Е и С.
В норме образующийся в мышцах креатин ангидрируется н выделяется с мочой в виде креатинпна (около 2 г в сутки). Т. к. возможность организма ангидрировать креатин ограничена, возникновение креатинурии может иметь место как при повышенном распаде белка, так и при нарушении нормального превращения креатина в креатинин.
Определение креатина в моче производят путем превращения его в креатинин при помощи гидролиза 1 н. раствором соляной кислоты. Определяют количество креатинина в моче реакцией Яффе до и после гидролиза. Вычитанием первой величины из второй узнают содержание в моче креатина.
Билет№29
Пути распада пуриновых и пиримидиновых нуклеотидов в тканях. Конечные продукты. Нарушения обмена нуклеотидов. Биохимические основы подагры.
Распад пуриновых: Пиримидиновых:
конечные продукты – СО2, аммоний
и бета-аланин(бета-аминоизомасляная к-та):
-трансаминирование(в альфа-ала)
-исп-ся в мышцах на образование дипептидов –
ансерина и карнозина
- под действием м/флоры кишечника
включ.в пантотеновую к-ту – на образ.КоА
Превращение и всасывание липидов в желудочно-кишечном тракте.
Сут. потребность 180г. Должны быть представлены в разных кол-вах насыщенные, полиненасыщенные и мононасыщенные. 30% по калорийности от всей пищи. ХС в сут.должно быть менее 300мг.
рНопт. липазы жел.сока =5,5-7,5, а у взрос. 1,5, поэтому расщепление в желудке не происходит(в кишечнике!)
У груд.детей рНжел.сока 5,0. Л.расщепляются лингвальной липазой(рНопт 4,5)и желудочной липазой.
Основные фазы превращения:
Эмульгирование – образование из большиз липидных капель мелкодисперсной эмульсии(0,5мкм). Э.способствует: *натриевые сили желчных кислот, *СО2 – образ-ся при разложении бикарбонатов под действием соляной к., поступающей с пищевым комком из желудка, *образующиеся по мере расщеп.липидов мыла(соли жир.к-т и натрия R-COONa)
Осн.роль в эмульгировании у желчи – смеси натриевых солей желчных к-т, ФЛ и ХС желчных к-т в соотн. 12,5 : 2,5 : 1.
рН желчи больше 7,0.
Желчные к-ты – конечный продукт обмена ХС – производные холановой к-ты:
Желчные кислоты:
- первичные 3,7,12-триоксихолановая = холевая; 3,7-диоксиходановая = хенодезоксихолевая(образ.из печени из ХС)
- вторичные 3,12-диоксихолановая = дезоксихолевая; 3-оксихолановая=литохолевая(образ.в кишечнике под действием м/флоры)
**Конъюгирование желчных кислот: 1)с глицином – при у/в питании; 2)с таурином(образ.из цистеина)-при Б питании
роль: - эмульгируют жиры; -активируют липазу, -способсвуют всасыванию продуктов гидролиза жиров в кишечнике.
В сутки из ХС образ. 1г желчи в гепатоцитах→по печеночным пузырным протокам→концентр.в желч.пузыре.Опорожнение происходит постоянно, но усил.под действием поступившей пищи и ХЦкинина.
После выполенния своих ф.85%желчных кислот всас.в подвздошной кишке и вновь поступ.в состав секретируемой желчи – энтерогепатальный круг.
Общий пул желч.к-т 2,8-3,5г. Совершают 6-8 оборотов в сут.
Недостаток желч.к-т: желчекам.болезнь, стеаторрея.
Липолитическая фаза.
Осн.продукты – бета-моноацилглицерин и жир.к-ты.
Эфиры ХС(ферм.холестерол-эстераза панкреатич.и кишеч.соков) →жир+жир.к-ты.
Фосфатидилхолин (ф.панкреатич.фосфолипаза А2) →лизофосфолипид(панкреатич.лизофосфолипаза) →жир.к-та(из альфа)+глицерофосфохолин→всас.в кровь или выводятся.
Мицеллярная фаза. Транспортировка продуктов расщепления липидов от места образования к всас.пов-ти кишечника. Глицерин и жир.к-ты с Сменьше 10 всас-ся хорошо. Жир.к-ты с числом С-атомов больше 10, ХС, нерасщепленные ФЛ всас.с помощью мицелл. Они в сотни раз меньше эмульсий. В центрк гидрофобное ядро из жир.к-ты, моноглицерида и ХС. Снаружи гидрофильн.оболочка из ФЛ и жнлч.к-т.
мукозная фаза. Процессы ресинтеза в клетках эпителия кишечника – бета-моноглицеридный синтез ТАГ: поскольку жир.к-ты поступили извне(с пищей), из них образ.экзогенные:
R-COOH + HSKoA + АТФ (1)→ RCOSKoA + АМФ + ФФн
бета-МАГ + R1COSKoA(2) → ДАГ (3)→ ТАГ
Триглицеридсинтетаза: (1)ацилКоАсинтетаза, (2)моноглицеридацилтрансфераза, (3)диглицеридацилтрансфераза.
5) Транспортная фаза. Трансп.форма липидов – ЛП. Л, образованные в энтероцитах тонкогг киш. – экзогенные ТАГ, а также ФЛ и всосавшийся ХС – окружаются белком и формир. ХМ – очень крупные частицы, не способные проникать в кров. капилляры, поэтому диффундируют в димфатич.с-му кишечника→грудной лимфатич.проток. Легкие ограничивают поступление ХМ в арт.кровь(липопектическая ф.легких). ХМ не облад. атерогенностью: из-за больших размеров не проникают в капилляры. После приема пищи наблюдается гипергликемия(алиментарная) за счет ХМ. Х гидролизуются ЛП-липазой(крепится к стенкам сосудов гепарином)
Гормоны щитовидной и паращитовидной желез. Химическое строение и участие в обменных процессах.
тироксин. Фолликулярная часть щит.ж. 3,5,3’,5’-тетрайодтиронин

Регулирует скорость основного обмена, рост и дифференцировку тканей, обмен белков, у/ви липидов, водно-солевой обмен, деят-ть ЦНС, ЖКТ…
гипофункция: в детском возрасте – кретинизм, остановка роста, изменения кожи, волос. мышц, наруш.психики.
Гпотиреоидный отек(микседема). Слизистый отек, ожирение, выпад.волос и зубов, психич.расстройства.
Эндемический зоб(недостаток иода)
Гиперфункция: гипертиреоз – диффуз.токсич.зоб/Базедова болезнь: тахикардия, пучеглазие+зоб, общее истощение+психич.расстройства.
паратгормон. Паращитовид.ж. Белковая природа: 84 АК-остатка;состоит из 1 п/п цепи. Физиологическое влияние паратГ на клетки почек кост.ткани через систему аденилатциклаза-цАМФ. Регуляция конц.Са++ и связанных с ним анионов фосфотной к-ты в крови. В почках уменьш.реабс.Са++
Гипоф: тетанические судороги
Гиперф: вымывание солей Са в виде цитратов и фосфатов из костной ткани→деструкция мин.и орг. компонентов костей.
3) кальцитонин. С-клетки щит.ж. Пептидная природа. Выделяется в ответ на повышение Са++ в крови. Пост. конц. Са в крови → уменьш.резорбции кост.тк., гипокальциемия, гипофосфатемия – антагонист паратгормона.
Протеинурия и ее причины.
почечная
функциональная – временное проходящее нарушение почечного фильтра. Физиогогическая – у новорожд., обусловлена увелич. прониц-тью поч.фильтра; к 4-10 дню проходит. Ортостатическая(циклич.) – у детей 6-12 лет и подростков(приходящие изменения гемодинамики почки, например, из-за аномалии осанки). Инсулярная – у детей раннего возр.(повыш.раздражимость почесного фильтра)
органическая. Гломерулярная – поврежд.почеч.фильтра(селективная – в моче Б с массой менее 100кДа, и неселективная – в моче все Б крови). Тубулярная – поврежд.канальцев и наруш.работоспособности Б.
внепочечная
преренальная/перегрузочная – увелич. конц.общ.Б или появление парапротеинов в плазме: легкие цепи иммуноглоб(Б Бенс-Джонса), Нв(ППВ=1,25г/л), миоглобин(раюдомиолиз)
постренальная – попадание в мочу Б из мочевывод.путей при воспал.или опухолях.
Билет№30
Биосинтез ДНК. ДНК-полимеразы. Повреждения и репарация ДНК. Наследственные заболевания, связанные с нарушением репарации ДНК.
Буферные системы крови. Роль буферных систем в поддержании гомеостаза pH. Кислотно-основное состояние. Понятие об ацидозе и алкалозе.
В организме кислотообразование преобл.над образованием соед-й основного характера.
Источники Н+ в организме:
1.летучая кислота Н2СО3, в сутки образ.10-20тыс.ммоль СО2 при окислении белков, Ж, У.
2.нелетучие кислоты в сут.образ. 70 ммоль:
- фосфорная при расщепл.орг.фосфатов(нуклеотидов, ФЛ, фосфопротеидов)
-серная, соляная при окислении Б
3.орг.к-ты:молочная, кетоновые тела, ПВК и др.
рН удерживается на слабощелочном уровне благодаря участию буф.с-м и физиологическому контролю(выделит.ф.почек и дыхат.ф.легких)
Уравнение Гендерсона-Хессельбаха: pH = pKa + lg [акц.протонов]/[донор протонов].
( Соль) ( кислота)
Любая буф.с-ма состоит из сопряженной кислотно-основной пары: донор+акцептор протонов.
Буферная емкость: зависит от абсолютных концентраций компонентов буфера.
Бикарбонатная.
10%буф.емкости крови.
![]()
При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4.
Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрация Н2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси).
Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната иводу. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основногоравновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких.
NaHCO3 + H+ → Na+ + H2CO3
Реабс.в почках ↓карбоангидраза
СО2 + Н2О
↓увеличение вентиляции легких
Фосфатная представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донорпротонов) и иона НРО42– (акцептор протонов):
![]() Фосфатная буферная
система составляет
всего лишь 1% от буферной емкости крови.
Во
внеклеточной жидкости,
в том числе в крови,
соотношение [НРО42–]:
[Н2РО4–]
составляет 4:1.
Буферное
действие фосфатной системы основано
на возможности связывания
водородных ионов ионами НРО42– с
образованием Н2РО4– (Н+ +
+ НРО42– —>
Н2РО4–),
а также ионов ОН– с ионами Н2РО4– (ОН– +
+ Н2 Р
О4– —>
HPO42–+
H2O).
Буферная пара (Н2РО4––НРО42–)
способна оказывать влияние при изменениях
рН в интервале от 6,1 до 7,7 и может
обеспечивать определенную буферную
емкость внутриклеточной жидкости,
величина рН которой в пределах 6,9–7,4.
В крови максимальная
емкость фосфатного буфера проявляется
вблизи значения рН 7,2.
Фосфатная буферная
система составляет
всего лишь 1% от буферной емкости крови.
Во
внеклеточной жидкости,
в том числе в крови,
соотношение [НРО42–]:
[Н2РО4–]
составляет 4:1.
Буферное
действие фосфатной системы основано
на возможности связывания
водородных ионов ионами НРО42– с
образованием Н2РО4– (Н+ +
+ НРО42– —>
Н2РО4–),
а также ионов ОН– с ионами Н2РО4– (ОН– +
+ Н2 Р
О4– —>
HPO42–+
H2O).
Буферная пара (Н2РО4––НРО42–)
способна оказывать влияние при изменениях
рН в интервале от 6,1 до 7,7 и может
обеспечивать определенную буферную
емкость внутриклеточной жидкости,
величина рН которой в пределах 6,9–7,4.
В крови максимальная
емкость фосфатного буфера проявляется
вблизи значения рН 7,2.
1 и 2 – выводящие.
Белковая имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы. Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н+ (кислота, донорпротонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови. состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донорпротонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются вза-имопревращающимися системами и существуют как единое целое.
Механизм действия:
- в тканях: Н2О + СО2(карбоангидраза) —>Н2СО3—>Н+ + НСО3-(диффундирует в плазму крови)
КНвО2 —>КНв + 4О2
КНв + 2Н+ —> ННв + 2К+ (К-гемоглобин неитрализует ионы Н+)
- в легких: ННв + 4О2 —>2Н+ + НвО2
2Н+ + НвО2 + 2К+ + 2НСО3- —>КНвО2 + 2Н2СО3(карбоангидраза) —>Н2О + 2СО2
рН и концентрация СО2 влияют на освобождение и связывание О2 немоглобином – эфф.Бора.
Повышение концентрации протонов, СО2, способствует освобождению О2, а повышение концентрации О2 стимулирует высвобождение СО2 и протонов.
Гормоны надпочечников. Глюкокортикоиды и минералокортикоиды. Химическое строение и участие в обменных процессах.
Кортизол/гидрокортизон – гормон пучковой зоны коры надпочечников. Глюкокортикоид/кортикостероид.
Влияние на обмен у/в, белков, жиров и нукл.к-т. Стимулирует образование глю в печени, усил.глюконеогенез, синтез глк в печени, и уменьш.потребление глю периферическими тканями. Липолиз в конечностях и липогенез в теле.
Альдостерон - клубочковая зона коры. Минералокортикоид.
Гл.образом регулир.обмен натрия, калия, хлора, воды. Способств. Удержанию натрия и хлора в организме и выведению с мочой ионов калия.
Нарушения:
Первичная недостаточность – б.Аддисона(поражение коры). Снижение массы тела, слабость, снижение аппетита, тошнота, снижение АД, «бронзовая болезнь»
Вторичная – отсутствует гиперпигментация кожи, -//-.
Врожденная гиперплазия надпочечников. Нарушение синтеза кортизола – усиление роста тела, раннее половое созревание у мальчиков и муж.пол.признаки у девочек.
Гипекортицизм(при опуходях гипофиза.). Гипергликемия, уменьш.толерантности к глю, уменьш.мыш.массы, истончение кожи, остеопороз.
Гематурия и гемоглобинурия, их причины.
Гематурия:
Ренальная – поражение эпителия канальцев или интерстиция почки
Постренальная – травматическое повреждение мочевыводящих путей(например, отхождение камней)
Выделяют следующие формы гемоглобинурий: 1. Ночная гемоглобинурия Маркиафава. 2. Токсические гемоглобинурии. 3. Маршевая гемоглобинурия (редкое заболевание).
После долгих переходов (маршей) может наблюдаться типичная гемоглобинурия. Всегда имеется выраженный поясничный лордоз. Других патологических явлений нет. Гемоглобинурия через несколько часов прекращается. Особого клинического значения эта форма не имеет.
4. Холодовая гемоглобинурия: при пароксизмальной холодовой гемоглобинурии, в большинстве случаев после длительного воздействия холода (купание в холодной воде, реже только холодный наружный воздух), наблюдается гемоглобинурия.
Билет№31
Биосинтез РНК. Процессинг матричной и транспортной РНК. Обратная транскрипция, биологическая роль.
Транскрипция – синтез РНК на матрице ДНК.
Последовательность дезоксирибонуклеотидов в гене ДНК переписывается в виде комплементарной последовательности РНК.
Кодирующая – с которой пишется.
Транскриптон – участок ДНК, на котором происходит синтез РНК: *стр-рные гены, кодирующие белки, * промотор, * терминатор.
Синтез РНК катализирует ДНК-зависимая РНК-полимераза. Холофермент РНК-полимеразы состоит из 5 субъединиц: α, α’, β, β’, δ. РНК-полимераза без δ – корфермент(ядро). Субъединица δ нужна для узнавания промотора и связывания с ним.
Этапы транскрипции:
Связывание РНК-полимеразы с ДНК
Холофермент РНК-пол.двигается по ДНК, пока не найдет промотор, образуя с ним сначала закрытый промоторный комплекс. Чтобы информация стала открытой, он должен стать открытым. Расплетается с участием δ. Связь РНК-пол.с промотором становится прочнее.
Инициация
Состоит в образовании первых звеньев в цепи РНК. Субстраты и источники Е – макроэргические рибонуклеозидтрифосфаты(АТФ, ГТФ, УТФ, ЦТФ)
РНК-полимеразы не треб.затравки(в отл.от ДНК-пол). Первый нуклеотид вход.в состав цепи в виде трифосфата;следующий присоед.к его 3’-группе.
Синтез РНК идет комплементарно и антипараллельно кодирующей цепи РНК. Когда образована цепь из 3-9 нуклеотидов, дельта-субъединица отщепляется.
Стадию элог\нгации и терминации катализирует корфермент.
На стадии элонгации расплетено 18 пар нуклеотидов;12 из них образуют гибридную спираль с растущей ДНК.
РНК-полимераза двигается по ДНК; впереди нее водород.связи разрываются, сзади замыкаются.
РНК-пол.не проверяет правильность синтеза;ошибки чаще, чем при ДНК.
Терминация
Участок ДНК перед терминатором богат цитозиновыми и гуаниловыми нуклеотидами.
Шпилька останавливает ДНК-полимеразу;транскрипция заканчивается. РНК-полимераза и синтезированная РНК отделяются от ДНК. Терминации способствуют белки-факторы терминации.
Транскрипция идет консервативно – ДНК-матрица полностью сохраняется; РНК синтезируется заново.
РНК-пол.у эукариот:
РНК-пол.1 – синт.в ядрышке рибосомальную РНК
РНК-пол.2 – синт. Информационную РНК
РНК-пол.3 – транспортные и др.РНК
Синтезированная РНК(первичный транскрипт) не может выполнять свою биологич.ф., т.к. является незрелой. Для ее созревания нужен процессинг
У прокариот не происходит. Транляция начинается еще до завершения транскрипции
У прокариот включает модификацию 5’-конца(кэпирование) и 3’-конца(полиаденилирование)
Обратная транскрипция.
Синтез ДНК на матрице РНК.
Характерна для ретровирусов. Имеют фермент ревертазу(обратная транскриптаза). Используют в качестве матрицы как ДНК, так и РНК.
В клетке хозяина ревертаза вируса синтезирует цепь ДНК, комплементарную матрице РНК. Затем расщепляет всю вирусную РНК. На основе ДНК происходит синтез второй ДНК. Далее двойная ДНК встраивается в кл-хозяина.
Гемоглобин, строение и свойства. Возрастные особенности. Понятие об аномальных гемоглобинах.

В крови 130-160г/л(у муж.132-164, жен.115-145г/л), в эритр.300-400г/л(в ед.СИ)
Нв – хромопротеин(не энзимный гемопротеин). Небелковая часть – гемм, и белковая – глобин.
Имеет 4 уровня стр-ры:
первичная – послед-ть АК в п/п цепях, попарно одикановых. Так. НвА(взрос) имеет 2альфа и 2бета-цепи. Альфа-цепь имеент 141 АК, бета – 146, и вся мол-ла =574АК.
Спиральзация п/п цепей. Мол-ла Нв спирализована на 80%, и представляет правозакрученную спираль. Альфа-цепь имеет 7 спиральных участков., бета – 8. Спир.участки обознач.буквами лат.алф. – А,В,С…Н. Они чередуются с неспирализованными, обозначаемыми двумя буквами спиралей, между кот.они находятся(АВ,ВС)
П/п цепи образ.множнство связей. В отдельных местах спиральные участки делают изгибы, повороты, образуя третич.стр-ру:
упаковка спирали в простр-ве. При этом гемм оказ-ся окутанным в слое белка. При упаковке цепей глобина неполярные АК оказ-ся внутри(окружая гем) придавая высокую устойчивость железу гемма(защищ.от окисл-я)
Каждая п/п цепь связана с гемом: гемм+глобин = субъед-ца/протомер
Связь осущ.через железо гемма и атом азота гистидина(в п/п цепи). п/п цепи образ.для гемма карманы, окруженные неполярными АК и ужерживают. Железо гемма имеет координационное число 6: 4 связи направлены к 4 атомам азота пиррольных колец гемма, 5я – к атому азота гистидина в п/п цепи, 6я – на связь с О2(в дезоксиНв она свободна).
ассоциация протомеров, ориентированных в пространстве определенным образом относительно друг друга. Вся мол-ла Нв имеет 4 гема и 4 глобина(п/п цепи)
Между субъед-цами возникает множ-во контактов – α1-α2, β1-β2, α 1-β1, α 2-β2…
Эти контакты удерживают м-лу Нв в виде димера и тетрамера.
Субъед-цы ассоциированы ак, что в центре образ.впадина – центр.полость, в к-рой фиксируются орг.фосфаты.
Свойства:
*транспорт О2 к тканям (через железо гемма-простетич.гр)
*транспорт СО2 из тканей (через своб.амынные гр.АК-белк.часть)
Высокая р-римость СО2(в 20 раз больше чем у О2)создает благоприят.усл.для транспорта, к-рый осущ.своб.аминн.гр.глобина – карбаминоНв.
*обеспеч.поддержание постоянства рН, входя в состав гемоглобиновой буф.с-мы
*выполн.антитоксич.ф. – связ.цианиды – цианметНв, монооксид углерода – карбоксиНв.
Гетерогенность Нв.
Онтогенетическая/созревания.
Смена типов зависит от:
-особенностей снабжения тканей О2. у эмбриона источник – интерстиц.жидкость, у плода – плацента, у новорожденного – легкие.
- смены органов кроветворения
1. эмбриональные Нв. Их синтез идет с 2х недель эмбр.развития;ощутимые кол-ва опр-ся в 8 нед.
(Gower-1(эпсилон2,эпсилон2), Gower-2(эпсилон4), Portland-1(гамма2,епсилон2))
Синтез прекращ.к 14 нед.(образование плаценты)
фетальные. HbF(альфа2,гамма2)-гетерогенен(3-5компонентов)
свойства: лучше р-рим, чем НвА;высокая скорость окисления железа гемма – легко происх.образоване метНв. Устойчив к денатурации щелочью. Обладают более высоким сродством к О2. имеет специфич.спектр поглощения. Высокая скорость при электрофорезе. Синтезируется с 14нед.внутриутр.разв.
возрастные изменения: н/р 80%,3мес 40%,6мес 23%,9мес 10%, 1год 4-5%, 3года 1,5%, больше3лет 1%.
2)Нв взрослого типа.
Синтез НвА начинается у эмбр.на 8-11нед., идет медленно и у н/р сост.20%от общего. 1мес 43%, 5мес 75%.
При комплексировании Нв с у/в. Конмлекс аминогр.с альд.гр. глю образ.А1с, образуется альдиминная связь, к-рая при длительной гликемии превращ.в стойкую кетоаминную с образованием гликированных Нв.
