
УПП Коллоидная химия 260800.62
.pdf
rad Kdesи |
(3.3) |
При адсорбционно-десорбционном равновесии, когда rad = rdes, введя понятие
константа адсорбционного равновесия или адсорбционный коэффициент (b = Кad/Кdes),
можно получить:
|
|
|
|
и |
|
b P |
|
(3.4) |
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
1 |
b P |
|
||||||
|
|
|
|
|
|
|
|
|||||
Так как и |
б |
, то окончательно имеем: |
|
|
|
|
|
|||||
|
|
|
|
|
|
|||||||
б |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б |
b P б |
или |
Г Г |
|
bP |
(3.5) |
||||
|
|
|
|
|
|
|
||||||
|
|
1 |
b P |
|
bP |
|||||||
|
|
|
|
|
1 |
|
||||||
Это и есть уравнение изотермы Ленгмюра (изотерма адсорбции Ленгмюра). В нем
б и Г
и Г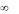 - емкость монослоя, т.е. предельное количество адсорбата, способное адсорбироваться на поверхности адсорбента при ее полном монослойном покрытии.
- емкость монослоя, т.е. предельное количество адсорбата, способное адсорбироваться на поверхности адсорбента при ее полном монослойном покрытии.
Проанализируем полученное уравнение:
1) если (b∙P) <<1 (область низких давлений), то (3.5) преобразуется в уравнение:
б б b P KГ P |
(3.6) |
Получается линейная зависимость между α и Р, которую часто называют изотермой Генри, а KГ и область малых Р – константой и областью Генри соответственно. На рис.2 область Генри представлена прямой линией, выходящей из начала координат.
Рис.2. Графический анализ уравнения Ленгмюра
2) Если (b∙P) >> 1 (область высоких давлений), то уравнение (3.5) преобразуется в:
б б |
(3.7) |
В этом случае наблюдается независимость α от Р: при больших Р все центры адсорбции заполнены (на каждой «клетке доски» уже стоит своя «фигура») и

дальнейшее увеличение давление не изменяет адсорбции. На рис.2. эта область изображена прямой, параллельной оси абсцисс.
Адсорбционный коэффициент b характеризует способность веществ адсорбироваться на поверхности, т.е. степень его «сродства» к адсорбционным центрам адсорбента. На рис 3
представлены изотермы адсорбции при различных значениях b3> b2> b1.
Рис.3. Изотермы Ленгмюра 1-го типа при различных значениях константы b: b3> b2> b1 (А) и температуры T: T1> T2> T3 (Б)
Как и всякая константа равновесия, адсорбционный коэффициент связан с теплотой адсорбции ∆Hα уравнением изотермы Вант-Гоффа:
|
ДS |
|
ДH |
|
|
|
|
|
|
b e R |
e R T |
(3.7) |
||
Так как всегда ∆Hα<0, то с повышением температуры b экспоненциально уменьшается, т.е. физическая и химическая адсорбции (величины α и Г) уменьшаются с повышением температуры (рис.3)
Изотерма адсорбции на рис.3 также иллюстрирует данное положение: при повышении температуры адсорбция снижается и для поддержания ее постоянного значения (α или θ = const) следует помнить, что α∞ и Г∞ зависят только от количества адсорбционных центров и при всех температурах одинаковы (рис.3).
Константы уравнения Ленгмюра могут быть также определены графическим методом.
Для этого изотерму Ленгмюра (3.5) представляют в линейной форме (берут обратные величины от обеих частей уравнения), т.е. если экспериментальные точки зависимости α от Р в координатах 1/α против 1/P группируются вдоль прямой, то уравнение Ленгмюра пригодно для описания опытных данных (рис.4).
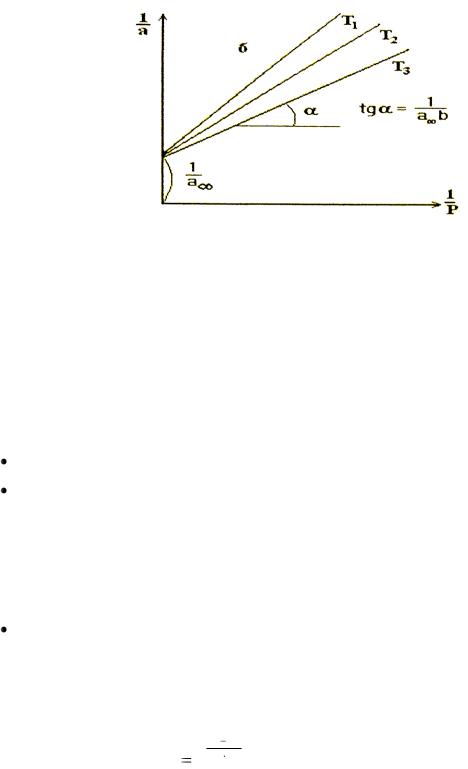
Рис.4. Линейные координаты изотермы Ленгмюра
Тогда, отрезок, отсекаемый прямой на оси ординат, равен ЮЮЮ, а тангенс наклона прямой дает ЮЮЮ.
Определив ѐмкость монослоя α∞ можно вычислить удельную поверхность адсорбента
Sуд
Для описания опытных данных в случае полимолекулярной адсорбции обычно применяют изотерму Брунауэра, Эммета и Таллера (изотерма БЭТ). Она выводится с учетом
следующих положений:
Поверхность адсорбента однородна;
Теплота адсорбции во втором, третьем, четвертом и последующих слоях одинакова и равна теплоте конденсации паров адсорбата в жидкость ∆Нкон. Другими словами,
предполагается, что молекулы во всех слоях, кроме первого уже не «чувствуют» поверхности. Теплота конденсации может быть или больше, или меньше теплоты адсорбции в первом слое (по абсолютной величине) т.е. – теплоты адсорбции;
Адсорбция локализованная, т.е. на один центр адсорбции может поместиться только одна молекула адсорбата первого слоя, на неѐ – одна молекула адсорбата второго слоя и т.д.
В результате было получено уравнение:
Ea EL |
|
C e R T |
(3.11) |
Здесь Ea - теплота адсорбции (в первом слое);
ЕL – теплота конденсации адсорбата.
Для 1-го и 2-го типов изотерм (рис 1) Еа>ЕL, т.е. энергия взаимодействия молекул адсорбата друг с другом в первом слое (непосредственно с поверхностью) больше, чем в последующих слоях. В случае изотермы 3-го типа Еа<ЕL. Это означает, что подобный тип изотерм должен наблюдаться при адсорбции сильно полярных веществ на полярных адсорбентах.
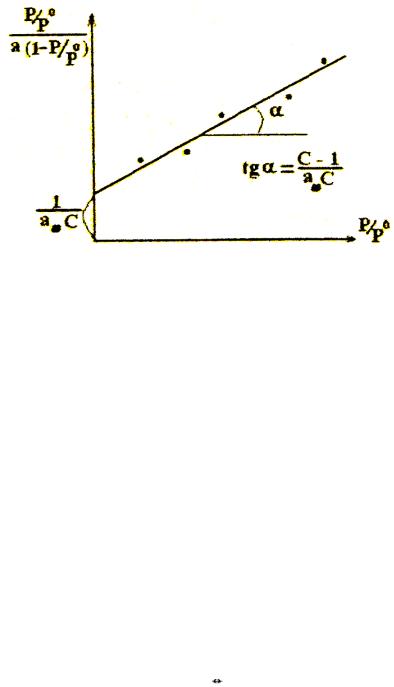
Обычно уравнение БЭТ применяют для определения удельной поверхности адсорбентов, катализаторов и других дисперсных систем. С этой целью уравнение (3.10)
представляют в линейной форме:
Полученные адсорбционные данные располагают в координатах: от из тангенса угла наклона прямой и отрезка, отсекаемого прямой на оси ординат, вычисляют константы С и α∞
как это показано на рис.5. Далее по уравнению (3.9) рассчитывают Sуд.
Рис. 5. Линейный график уравнения БЭТ
Раздел 3.3. Адсорбция из жидких растворов на твердых адсорбентах
Адсорбция из жидкой фазы более распространена, чем адсорбция из газов. Еще в
XVIII веке Т. Ловиц (1785 г.) для очистки спирта от сивушных масел и удаления из воды неприятно пахнущих веществ начал применять адсорбцию на древесном угле.
При рассмотрение адсорбции из жидких растворов принято различать адсорбцию неэлектролитов (молекулярная адсорбция) и электролитов (ионная адсорбция).
Раздел 3.3.1. Молекулярная адсорбция из жидких растворов
Процесс адсорбции в этом случае представляет собой конкуренцию за места поверхности между молекулами адсорбата и растворителя (свободных мест на поверхности,
как в случае адсорбции из газовой фазы, нет): |
|
A(N2) + SB(SN1) SA(SN2) + B(N1) |
(3.12) |
Прежде чем адсорбироваться молекула адсорбата А должна вытеснить с поверхности |
|
адсорбированную молекулу растворителя SB. В (3.12) N1 и N2 – молярные доли растворителя и адсорбата в растворе, SN1 и SN2 – молярные доли растворителя и адсорбата в адсорбционном слое.

Константа адсорбционного равновесия в случае конкурентной адсорбции (3.12)
выражается уравнением:
N Ns
K 1 2 (3.13)
N2 Ns2
Анализ (3.13) приводит к уравнению:
б б ( |
b' |
N2 |
) |
(3.14) |
1 b' |
N2 |
При малых концентрациях молярную долю N2 можно заменить пропорциональной ей молярной концентрацией С, а вместо абсолютной адсорбции подставить Г. Тогда равенство
(3.14) можно записать как:
Г Г ( |
|
b C |
) |
(3.15) |
|
|
|||
1 |
b C |
|
|
|
т. е. подобная модель адсорбции приводит к изотерме Лэнгмюра.
Основные закономерности адсорбции из жидких растворов на твердых адсорбентах:
1) Адсорбция происходит в соответствии с правилом Траубе: при движении вверх по гомологическому ряду адсорбция органических веществ из водных растворов сильно и неуклонно возрастает. Это положение иллюстрирует рис.6, на которых изображены изотермы адсорбции муравьиной (1), уксусной (2), пропионовой (3) и масляной (4) кислот на саже из водных растворов.
Правило Траубе объясняется двумя причинами: чем больше по размерам углеводородная часть молекулы адсорбата, тем более она гидрофобна, тем сильнее тенденция выхода такой молекулы на поверхность раздела фаз – в том числе и на твердую поверхность адсорбента. С другой стороны, для адсорбции из водной фазы обычно применяют неполярные адсорбенты (см. правило Ребиндера). Понятно, что поверхность такого адсорбента более склонна адсорбировать молекулы с большей неполярной углеводородной частью. Т.е. вода интенсивнее выталкивает из себя, а поверхность адсорбента более охотно принимает высшие гомологи, чем низшие: отсюда и преобладающая их адсорбция.
При адсорбции из органических растворителей правило Траубе обращается. Это видно из рис.6, на котором изображены изотермы адсорбции тех же веществ, но из толуола.
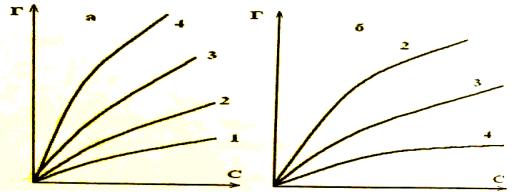
Рис. 6. Абсорбция на саже муравьиной (1), уксусной (2), пропионовой (3) и масляной
(4) кислот из водных (а) и толуольных (б) растворов
Правило Траубе часто нарушается и в случае адсорбции на микропористых адсорбентах в силу стерических (пространственных) факторов. Крупных молекул в тонких порах помещается просто меньше, чем мелких (центры адсорбции могут остаться при этом не занятыми).
2) Выполняется правило выравнивания полярностей Ребиндера: адсорбция идет в сторону выравнивания полярностей контактирующих фаз и тем сильнее, чем больше первоначальная разность полярности растворителя и адсорбента. В согласии с правилом Ребиндера, для адсорбции органических веществ из водных растворов следует выбрать неполярный адсорбент, например, активированный уголь, а для адсорбции их из органических растворителей следует выбрать полярный адсорбент, например, силикагель.
Действительно, чем больше разность полярностей адсорбента и растворителя, тем слабее их межмолекулярные взаимодействия, тем больше нескомпенсированность молекулярных сил в поверхностном слое и больше поверхностная энергия Гиббса (SG). Снижение SG в этом случае достигается адсорбцией молекул адсорбата. При малой же разности полярностей адсорбента и растворителя из-за сильного их взаимодействия избыточная поверхностная энергия мала и адсорбция молекул адсорбата незначительна.
Особый случай адсорбции имеет место, когда молекулы адсорбата имеют дифильное состояние, т.е. содержат как полярную, так и неполярную группу – это так называемые поверхностно активные вещества (ПАВ). Такие дифильные молекулы способны взаимодействовать одновременно с полярной и неполярной средами. В адсорбционных слоях они ориентируются полярной частью в сторону полярной фазы, а неполярной – к неполярной фазе. Например, при адсорбции уксусной кислоты из водных растворов на неполярном адсорбенте (саже) ориентация молекул происходит по схеме рис.7(а); при адсорбции из неполярного растворителя на полярном адсорбенте (силикагеле) – по схеме рис.7(б).
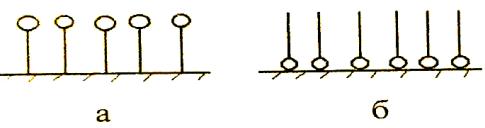
Рис.7. Ориентация молекул уксусной кислоты при адсорбции: а) из водяных растворов на саже; б) из бензола на силикагеле
(«шарик» символизует полярную СООН-группу, а «палочка» углеводородный радикал –СН3)
В случае хемосорбции ПАВ указанная ориентация молекул может быть нарушена.
Например, при хемосорбции жирных кислот из водных растворов на поверхности металлов наблюдается ориентация полярных групп в сторону металла и неполярных групп в сторону воды. Это явление широко применяется в полиграфической технологии при изготовлении форм плоской печати.
Раздел 3.3.2. Адсорбция в растворах-электролитах (ионная адсорбция)
Адсорбция в растворах-электролитах имеет огромное значение в окружающей нас природе. Именно адсорбция ионов почвой обуславливает еѐ плодородие, а, следовательно – и жизнь на Земле.
Ионная адсорбция возможна на адсорбентах любой природы: полярных и неполярных, корпускулярных и губчатых. Уравнения, описывающие этот процесс,
аналогичны рассмотренным выше. Однако имеются и некоторые специфические особенности: главной из которых является образование в поверхностном слое адсорбента
двойного электрического (ионного) слоя, который сокращенно обозначается как ДЭС.
Дело в том, что адсорбционная способность катионов и анионов по тем или иным причинам (о них речь пойдет ниже) различна: одни из ионов адсорбируются сильнее и соответственно заряжают поверхность адсорбента зарядом своего знака. Заряженная поверхность электростатически притягивает к себе ионы противоположного знака заряда,
которые закономерным образом располагаются в приповерхностном слое, образуя как бы две обкладки конденсатора – двойной электрический слой. Так, при погружении платиновой пластины в водный раствор NaCl наблюдается преимущественная адсорбция анионов Cl-,
которые заряжают поверхность отрицательным знаком заряда, а катионы Na+ при этом располагаются у поверхности платины.
Ионы, преимущественно адсорбирующиеся на поверхности адсорбента, называют
потенциалопределяющими (или потенциалобразующими), а ионы противоположного знака
заряда, располагающиеся в приповерхностном слое – противоионами. В рассмотренном примере ионы Cl- - потенциалопределяющие, а ионы Na+ - противоионы.
Экспериментально установлено, что адсорбционная способность ионов в сильной степени зависит от их радиуса и электростатического заряда. Чем больше радиус иона, тем больше его адсорбционная способность. Так, в ряду катионов Li+ - Na+ - K+ - Rb+
максимальной способностью к адсорбции обладают ионы Rb+. Казалось бы, все должно быть наоборот: ионы Li+ имеют наименьший в ряду радиус и им проще внедрится в адсорбционный слой. Дело же в том, что ионы в водных растворах гидратированы, т.е.
окружены плотной оболочкой ориентированных диполей воды, так называемой «гидратной шубой». При одинаковом заряде ионы с малым радиусом имеют меньшую площадь поверхности и, соответственно, большую поверхностную плотность заряда. Гидратирующая же способность иона как раз и определяется указанной плотностью заряда: чем она больше,
тем толще «шуба», тем больше эффективный радиус иона (в растворе он перемешается вместе со всей гидратной оболочкой). Ионы, расположенные в порядке способности гидратироваться (т.е. связывать воду), называют лиотропными рядами (или рядами Гофмейстера).
При сближении с поверхностью ион вынужден часть своей «гидратной шубы» сбросить, а этот процесс энергетически не выгоден. Так как в рассматриваемом ряду наиболее слабо гидратированы ионы Rb+, то и адсорбционная способность у них максимальна.
Впримере с адсорбцией ионов Na+ и Cl- при одинаковой с ионами Na+ валентности ионы Cl- имеют больший размер, отсюда и их преимущественная адсорбция на поверхности
ироль потенциалопределяющих ионов.
Вочень сильной степени адсорбционная способность ионов возрастает с увеличением их заряда. Вклад заряда в адсорбционную способность ионов преобладает над явлением их размера. Так, ионы Ba2+ адсорбируются сильнее, чем ионы Rb+, не смотря на то, что радиус последних больше (1,34А0 и 1,47А0, соответственно). Аномально высокую адсорбционную способность имеют органические ионы. Например, олеат-анионы (C17H33COO-)
адсорбируются в большей степени, чем многовалентные ионы, и это при их формальном заряде -1.
Следует отметить, что двойной электрический слой на поверхности адсорбентов может образовываться не только вследствие адсорбции потенциалопределяющих ионов, но и за счет диссоциации полярных групп поверхности. Например, кремнезѐмы способны диссоциировать в воде с образованием ионов гидроксония H3O+, которые и образуют ДЭС.

Особый интерес для практики имеет случай, когда потенциалопределяющие ионы способны не только адсорбироваться на поверхности адсорбента, но и входить в состав его кристаллической решѐтки (достраивать решѐтку). Их называют неиндифферентными.
Согласно эмпирическому правилу Пескова-Фаянса, такими ионами могут быть:
Ионы, входящие в состав кристаллической решетки адсорбента. Например, если адсорбент – кристаллы AgI, то неиндифферентными ионами являются ионы Ag+ и I-.
Ионы, образующие малорастворимую соль и изоморфные с ними. В рассмотренном примере неиндифферентными ионами могут быть ионы Cl-, Br-, CN-, CNS- и т.п.
Достроив кристаллическую решѐтку адсорбента, неиндифферентные ионы заряжают поверхность знаком своего заряда. Они образуют адсорбционный слой потенциалопределяющих ионов и являются частью твердой фазы. Противоионы находятся в жидкой фазе (растворе). Их расположение определяется взаимным наложением двух противоположно направленных векторов. С одной стороны заряженная поверхность притягивает электростатическими силами противоионы, стремясь расположить их мономолекулярным слоем рядом с потенциалопределяющими ионами на расстоянии, не превышающем ионные радиусы катиона и аниона. Этот слой называется адсорбционным слоем противоионов. С другой стороны противоионы находятся под действием градиента концентрации, т. е. стремятся равномерно распределиться по всему объему жидкой фазы. В
результате часть противоионов выходит из адсорбционного слоя, образуя диффузный слой противоионов. При этом отдельные противоионы могут удаляться от поверхности на расстояния, составляющие до 10 и более радиусов. Схематически это можно изобразить так,
как показано на рис.8.
Неиндифферентные ионы I- (в этом случае они являются потенциалопределяющими)
достроили кристаллическую решѐтку AgI, зарядив поверхность раздела фаз отрицательным знаком заряда. Противоионы K+ концентрируются у поверхности AgI в двух слоях:
адсорбционном (он непосредственно примыкает к поверхности) и диффузном. Граница раздела обозначается пунктирной линией, называемой поверхностью скольжения. При перемещении твердой фазы в растворе адсорбционный слой противоионов движется вместе с ней, а диффузный – вместе с жидкой фазой. Разрыв между слоями проходит по поверхности скольжения.
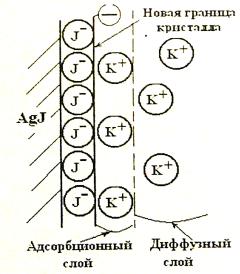
Рис. 8. Схема строения двойного электрического слоя на поверхности кристалла AgJ
Важность для практики рассмотренного случая адсорбции неиндифферентных ионов обусловлена тем, что коллоидные системы обычно получают при избытке одного из реагентов (методом химической конденсации). В рассмотренном случае кристаллы AgI
образовали в ходе реакции между KI и AgNO3 при избытке KI. Избыток реагента обеспечивает преобладание скорости роста числа зародышей (здесь AgI) над скоростью укрупнения образовавшихся зародышей. Только в этом случае можно получить истинно коллоидные (высокодисперсные) системы.
Аналогичным образом формируется двойной электрический слой и в случае электролитов, не способных к специфической адсорбции или достраиванию кристаллической решетки. Такие электролиты называются индифферентными.
При адсорбции ионов часто наблюдают так называемую обменную адсорбцию. Она заключается в том, что твердый адсорбент поглощает из раствора-электролита катионы или анионы, выделяя одновременно в раствор эквивалентное количество других катионов или анионов.
Сорбенты, способные к обмену ионов, называют ионообменниками или ионитами, а
иониты, обменивающиеся с раствором катионами, - катионитами, а обменивающиеся анионами – анионитами. Амфотерные иониты способны обмениваться как катионами, так и анионами. К катионитам следует отнести алюмосиликаты (цеолиты, пермутиты),
силикагель, целлюлозу и т.д. Примерами анионитов могут служить гидроксилы алюминия и железа, а амфотерных ионитов – материалы, имеющие состав типа Н+SO3- R или R – N+(CH3)3OH- , где R – органическая полимерная основа.
