
Вопросы по БИОХИМИИ
.doc№27 Строение митохондрий. Дыхательная цепь как полиферментная система транспорта атомов водорода на кислород. Ее структура и роль.
Внешняя мембрана Внутренняя мембрана Матрикс м-на, матрикс, кристы. она имеет ровные контуры, не образует впячиваний или складок. На нее приходится около 7% от площади всех клеточных мембран. Ее толщина около 7 нм, она не бывает связана ни с какими другими мембранами цитоплазмы и замкнута сама на себя, так что представляет собой мембранный мешок. Наружнюю мембрану от внутренней отделяет межмембранное пространство шириной около 10-20 нм. Внутренняя мембрана (толщиной около 7 нм) ограничивает собственно внутреннее содержимое митохондрии, ее матрикс или митоплазму. Характерной чертой внутренней мембраны митохондрий является их способность образовывать многочисленные впячивания внутрь митохондрий. Такие впячивания чаще всего имеют вид плоских гребней, или крист. Расстояние между мембранами в кристе составляет около 10-20 нм. Часто кристы могут ветвиться или образовывать пальцевидные отростки, изгибаться и не иметь выраженной ориентации. Матрикс митохондрий имеет тонкозернистое гомогенное строение, в нем иногда выявляются тонкие собранные в клубок нити (около 2-3 нм) и гранулы около 15-20нм. Теперь стало известно, что нити матрикса митохондрий представляют собой молекулы ДНК в составе митохондриального нуклеоида, а мелкие гранулы – митохондриальные рибосомы. Дыхательная цепь Дыхательная цепь является частью процесса окислительного фосфорилирования. Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н+ или восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора (НАДН + Н+ и, соответственно, QH2) и акцептора (О2) реакция является высокоэкзергонической. Большая часть выделяющейся при этом энергии используется для создания градиента протонов и, наконец, для образования АТФ с помощью АТФ-синтазы. Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза иногда называется комплексом V, хотя она не принимает участия в переносе электронов. Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками. К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена. Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин (см. с. 166), При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образуется сильный основной анион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом.
№28 Взаимосвязь между циклом Кребса и работой дыхательной цепи митохондрий. Дыхательный контроль
Водорододонорная функция — цикл Кребса поставляет на дыхательную цепь митохондрий протоны в виде трех НАДН.Н+ и одного ФАДН2.
Дыхательный контроль.
Сопряжение окисления с фосфорилированием в митохондриях отличается прочностью: если невозможен синтез АТФ, то прекращается и перенос электронов в дыхательной цепи. Эти реакции можно изучать in vitro в суспензии митохондрий. Если в инкубационной смеси есть все исходные вещества, за исключением АДФ, то поглощения 02 (дыхания) не наблюдается. После внесения АДФ сразу же начинается и дыхание, и синтез АТФ; по мере расходования АДФ скорость дыхания снижается и совсем прекращается, когда вся АДФ превратится в АТФ.
Зависимость дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Этот механизм регуляции имеет очень важное значение, так как в результате его действия скорость синтеза АТФ определяется потребностью клетки в энергии: при увеличении расходования АТФ в клеточных процессах (реакции, катализируемые синтетазами, транспорт ионов и др.) увеличивается концентрация АДФ, а это автоматически ведет к ускорению дыхания и фосфорилирования. Можно сказать, что темп работы митохондриям задается фактическими затратами АТФ.
Механизм дыхательного контроля отличается высокой чувствительностью и точностью, поэтому относительные концентрации АТФ и АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой (т. е. частота оборотов цикла АДФ-АТФ) может изменяться в десятки раз.Некоторые вещества разобщают окисление и фосфорилирование. Примером может служить 2,4-динитрофенол (рис. 8.6). Это липофильное вещество легко диффундирует через митохондриальную мембрану как в ионизированной, так и в неионизированной форме и, следовательно, может переносить ионы водорода через мембрану в сторону их меньшей концентрации.Потребление кислорода и окисление субстратов при этом продолжаются, но синтез АТФ, естественно, невозможен.
Поскольку энергия окисления при разобщении рассеивается в форме теплоты, то разобщители повышают температуру тела (пирогенное действие).
№29 Роль митохондриальной мембраны в сопряжении процессов окисления и фосфорилирования. Механизм сопряжения окисления и фосфорилирования (хемиосмотическая теория Митчелла).
Известно, что через мембрану митохондрии могут свободно проникать только небольшие незаряженные молекулы, а также гидрофобные молекулы.
Принципиально новый механизм сопряжения дыхания и фосфорилирования был разработан английским биохимиком Митчеллом (1961), гипотеза которого получила название хемиосмотической или протондвижущей. По мнению Митчела, энергия переноса электронов и протонов вдоль дыхательной цепи первоначально сосредоточивается в виде протонного потенциала, или электрохимического градиента ионов Н+, создающегося движением через мембрану заряженных протонов. Диффузия протонов обратно через мембрану сопряжена с фосфорилированием, которое осуществляется Н+ -АТФ-синтетазой. Дыхание совершает осмотическую работу (концентрирует протоны во внешней среде митохондрий) и электрическую (создает разность электрических потенциалов), которая используется АТФ-синтетазой на химическую работу, т.е. синтез АТФ. Движущей силой фосфорилирования является протонный потенциал.
Синтез одной молекулы АТФ из АДФ и фосфата сопровождается проникновением двух протонов из внешней среды внутрь митохондрий. Разность концентраций ионов Н+ выравнивается и происходит разрядкам мембраны (исчезает электрический потенциал).
Хемиосмотическая система Митчела не требует каких-либо высокоэнергетических посредников между дыханием и фосфорилированием. Общим продуктом для двух процессов является протонный потенциал. Нарушение структурной целостности мембраны или повреждение её проницаемости для протонов делает невозможным образование протонного потенциала, что вызывает разобщение между дыханием и фосфорилированием.
№30 Коэффициент сопряжения окисления и фосфорилирования.
В Цикле Кребса образуется 3 NADH, каждый имеет по 1 протону. В итоге образуется 3 АТФ, а FAD в Цикле Крэбса обрз-ся1, он имеет 2 протона=>даёт 2АТФ.
Работу дых.цепи характер-ет k сопряжения окислительн. фосфорилирован.-P/O: показыв-ет отношение кол-ва потреблённого неорганич.фосфата, идущего на синтез АДФ к атому O, поглощённого в процессе дыхания. Для NADH=3, для FAD=2.
№31 Разобщение окисления и фосфорилирования
Разобщение дыхания и фосфорилирования- это процесс переноса некторыми хим. вещ-ва(протонофорами) протонов или др. ионов(ионофоры) из межмембр.прострн-ва в матрикс, минуя протонные каналы АТФ-синтазы. В рез-те этого исчез-ет Эл/хим потенциал и прекращ-ся синтез АТФ. => кол-во АТФ сниж-ся, АДФ-увелич. В этом случае скор-ть окисл. NADH и FADH2 => кол-во поглощён-го О2 ув., но Е выд-ся в виде теплоты и K P/О сниж-ся
Разобщители:
Естественные-термогенин-образ. В мемб. H+ каналы, не связан с АТФ-синтазным комплексом.
Липофильные анионы:
1)эндогенные-анионы жирн.к-т Ув. При инт.физ.нагрзке, голодан
*косвенные-гормоны щит.железы-стимулир.распад жировой тк.; стероидн.горм(женские), билирубин
2)экзогенные-токсич вещ-ва, лек.преп( динитрофенол, барбитураты)
№32 Термогенная характеристика энергетического обмена в бурой жировой ткани.
Буровая ж.ткань – особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования, содержащая много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на разобщающий белок (РБ-1)- термогенин. По своей структуре темогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями. На внешней стороне анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембране диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующий анион возвращается на наружную сторону мембраны с помощью АТФ/АДФ-антипортера. При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только теплом, но и важнейшим регулятором разобщения дыхания и фосфорилирования.
№33 Значение убихинона в работе дыхательной цепи митохондрий
Кофермент Q(убихинон) является компонентом цепи переноса электронов, принимает участие в переносе электронов с NADH-дегидрогеназного комплекса (комплекс I) и сукцинатдегидрогеназного комплекса (II) на комплекс III, и участвует таким образом в синтезе АТФ. Комплекс I ( НАДН дегидрогеназа) окисляет НАД-Н, отбирая у него два электрона и перенося их на растворимый в липидах убихинон ( который при этом превращается в убихинол, т. Е. убихинон принявщий 2 электрона), который внутри мембраны диффундирует к комплексу III. Комплекс III ( Цитохром bc1 комплекс) переносит электроны с убихинола на два водорастворимых цитохрома с, расположенных на внутренней мембране митохондрии. Убихинол передаёт 2 электрона, а цитохромы за один цикл переносят по одному электрону. При этом туда также переходят 2 протона убихинола и перекачиваются комплексом.
№34 Значение цитохромов в работе дыхательной цепи митохондрий
Цитохромы (гемопротеины) — это маленькие глобулярные белки (в первом приближении их структура может быть представлена в виде шара или вытянутого эллипсоида), которые содержат ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками. Цитохромы присутствуют во всех клетках организмов. В клетках эукариот они локализованы в митохондриальных мембранах. Цитохромы катализируют окислительно-восстановительные реакции. Известно около 30 видов цитохромов. Все они содержат гем в качестве простетической группы и различаются структурами боковых и полипептидных цепей. В зависимости от типа гема выделяют 8 классов цитохромов. В зависимости от спектров поглощения, цитохромы делят на группы a, b, c. Цитохром B Принимает электрон от убихиола, отдает его железосерным белкам. Цитохром C1 Принимает электрон от железосерных белков и отдаёт его цитохрому с. Цитохром c Его роль заключается в переносе электрона между комплексом III и комплексом IV дыхательной цепи. Принимает электрон от цитохрома с1 и отдаёт его цитохрому а. Цитохромы А-А3 Комплекс принимает электрон от цитохрома с и отдаёт его на кислород.
№35 Активированные кислородные метаболиты (АКМ) в биологических системах Характеристика основных форм АКМ: супероксидный анион-радикал, перекись водорода, гидроксильный радикал, синглетный кислород, гипогалоиды, алкоксильные и перекисные радикалы, оксид азота. Биологическая роль АКМ
АКМ играют важную роль в процессах жизнеобеспечения клеток в различных биологических системах, участвуя в реакциях окислит.фосфорилирования, биосинтеза простагландинов и нуклеиновых кислот, в регуляции липидного обмена, в процессах митоза, а также метаболизма катехоламинов. Но эта роль чрезвычайно динамична, потому что кислородные радикалы являются высокореактогенными молекулами. Эти молекулы спонтанно ускоряют цепные реакции пероксидного окисления ненасыщенных липидов и реагируют с различными биомолекулами (белки,НК и мн.др.), вызывая нарушение их функции. Если создаются условия для обр-ния своб.радикалов О2, то самоускоряющийся процесс пероксидного окисления может полностью разрушить ненасыщенные липиды биомембран, что вызывает неминуемую гибель клеток. Но в фагоцитирующих клетках для уничтожения поглощенных микробов и неинфекционного материала используется наряду с пероксидом водорода супероксидный радикал.
Супероксидный радикал. Присоединение одного электрона к молекуле кислорода в основном состоянии приводит к образованию супероксидного анион радикала (), который при взаимодействии с протоном переходит в гидроперекисный радикал (). В живых системах супероксидный анион является промежуточным продуктом многих биохимических реакций – окисление тиолов, флавинов, хинонов, катехоламинов, птеринов, ксонобиотиков. Но основные источники его образование – ферментативные системы: NADFH-оксидаза фагоцитирующих клеток, ксантиноксидаза, митохондриальная цитохром-с-оксидаза и микросомальные монооксигеназы. При активации фагоцитов в очаге воспаления генерация служит пусковым звеном целого каскада реакций, приводящих к образованию других форм АФК. Для регуляции уровня в клетках служит высокоспецифичный фермент – антиоксидант супероксиддисмутаза, которая существенно ускоряет реакции дисмутации до перекиси водорода.
Перекись водорода. Присоединение двух электронов к молекуле кислорода или одного электрона к аниону сопровождается образованием двухзарядного аниона , который в свободном состоянии не существует, присоединяя протоны он переходит в гидроперекисный анион. Перекись водорода – слабый окислитель, в отсутствии каталазы и ионов металлов переменной валетности она относительно стабильна и может мигрировать в клетке и ткани. В живых организмах источниками служат ферментативные реакции с оксидазами, реакция дисмутации, катализируемая SOD.
Клетки млекопитащих достаточно устойчивы к воздействию , благодаря наличию глутатионпероксидазной и каталазной ферментативных систем, первая из которых эффективно работает при малых концентрациях перекиси, вторая – при высоких.
Гипогалоиды. Образуются главным образом в результате ферментативной реакции перекиси водорода с галидами, катализируемой миелопероксидазой, пероксидазой эозинофилов, которые различаются по структуре и субстратной специфичности. Основным продуктом миелопероксидазы является , пероксидаза эозинофилов катализирует образование и. Гипогалоиды инактивируют -антитрипсин, переводят коллагеназу в активную форму Б, окисляют лейкотриены, иммуноглобулины, альбумин, церулоплазмин, трансферрин. Вызывают структурную модификацию и инактивацию ,-SOD могут как индуцировать, так и ингибировать процессы ПОЛ.
Гидроксильный радикал является наиболее реакционноспособным АФК, образующимся в биологических системах, он может разрывать любую углеродную связь [Андреев, 1999]. Образование ОН-радикала показано в реакциях окисления арахидоновой кислоты, в реакции Габера-Вейса, при микросамальном окислении, в реакциях с флавиновыми ферментами и убихиноном, но основным источником OH-радикалов в биологических системах служит реакция Фентона с участием металлов переменной валентности.
Обратное восстановление возможно при взаимодействии с аскорбиновой кислотой, глутатионом, цистеином и другими окисляющимися соединениями.
Синглетный кислород. В кислороде внутримолекулярно происходит перестройка электронов и возникает более высокий энергетический уровень. Источником синглетного кислорода являются реакции фотосенсибилизированного окисления биологических субстратов, при не фотохимических реакциях не ферментативная дисмутация супероксидных радикалов, протекающие с образованием перекиси водорода. обладает высокой химической активностью, особенно по отношению к молекулам, содержащим участки повышенной электронной плотности.
Алкоксильные и перекисные радикалы. При развитии радикальных окислительных процессов взаимодействие органических радикалов молекулярным кислородом приводят к образованию перекисных радикалов, которые с алкоксильными радикалами могут образовываться в реакциях разложения перекиси в присутствии ионов металлов переменной валентности. По физико-химическим свойствам алкоксильные и перекисные радикалы это очень гетерогенный класс соединений, включающий высокореакционный OH-радикал и мало активные радикалы фенольных антиоксидантов. Взаимодействие и с углеводородами, приводящие к образованию и - это наиболее медленная стадия развития радикальных окислительных процессов.
Биологический эффект и реализуется через повреждающее действие на белки, ферменты, нуклеиновые кислоты, через продукты ПОЛ – органические перекиси, альдегиды, кетоны, эпоксиды, которые высокотоксичны для клеток. Ингибиторы – аскорбиновая кислота, мочевая кислота, убихинон, селен, -токоферол.
Все формы АФК обладают высокой цитотоксичностью для клеток и клеточных образований. Можно выделить четыре мишени окислительной цитотоксической атаки АФК: индукция процессов ПОЛ в биологических мембранах, повреждение мембрансвязанных белков, инактивация ферментов и повреждение ДНК клеток.
№36 Образование и обезвреживание АКМ в эритроцитах
Образование активных форм кислорода
Последовательное присоединение электронов к кислороду в присутствии металлов переменной валентности имеет место в митохондриях и микросомах клеток растительного и животного происхождения, в фагоцитах.
Суть его заключается в присоединении к кислороду последовательно от одного до четырех электронов в окислительных реакциях, катализируемых ферментами класса оксигеназ. При этом образуются радикалы, получившие обобщенное название –«активные формы кислорода»: супероксидный анион радикал (О*2), синглетная форма кислорода ('O2), гидроксильный радикал (OH*), перекись водорода (Н2О2). Время полужизни OH* составляет 10-9 сек, 'O2 –10-6 сек, О*2 –10-5 сек, NO* - менее 1 сек, Н2О2 –минуты.
Активные формы кислорода обычно появляются первыми в цепи реакций свободнорадикального окисления и дают начало серии других радикалов – окисленных галогенов, окислов азота, перекисных радикалов жирных кислот.
Обезвреживание активных форм кислорода в эритроцитах
Большое содержание кислорода в эритроцитах определяет высокую скорость образования супероксидного анион-радикала (О2-), пероксида водорода (Н2О2) и гидроксил радикала (ОН.). Эритроциты содержат ферментативную систему, предотвращающую токсическое действие активных форм кислорода и разрушение мембран эритроцитов (рис. 14-4). Постоянный источник активных форм кислорода в эритроцитах - неферментативное окисление гемоглобина в метгемоглобин:
В течение суток до 3% гемоглобина может окисляться в метгемоглобин. Однако постоянно метгемоглобинредуктазная сисгема восстанавливает метгемоглобин в гемоглобин. Метгемоглобинредуктазная сисгема состоит из цитохрома B5 и флавопротеина цитохром B5редуктазы, донором водорода для которой служит NADH, образующийся в глицеральдегиддегидрогеназной реакции гликолиза (рис. 14-4).
Цитохром B5 восстанавливает Fe3+ метгемог-лобина в Fe2+:
Hb-Fe3+ + цит. b5 восст. → HbFe2+ + цит. b5 ок. .
Окисленный цитохром B5 далее восстанавливается цитохром B5 редуктазой:
Цит. B5 ок + NADH → цит. B5 восст. + NAD+.
Супероксидный анион с помощью фермента супероксидцисмутазы превращается в пероксид водорода:
O2- + O2- + Н+ → H2О2 + O2 .
Пероксид водорода разрушается каталазой и содержащим селен ферментом глутатионпероксидазой. Донором водорода в этой реакции служит глутатион - трипептид глутамилцистеинилглицин (GSH) (см. раздел 12).
2Н2О → 2Н2О + О2; 2GSH + 2Н2О2 → GSSG + 2Н2О .
Окисленный глутатион (GSSG) восстанавливается NADPH-зависимой глутатионредуктазой. Восстановление NADP для этой реакции обеспечивают окислительные реакции пентозофосфатного пути.
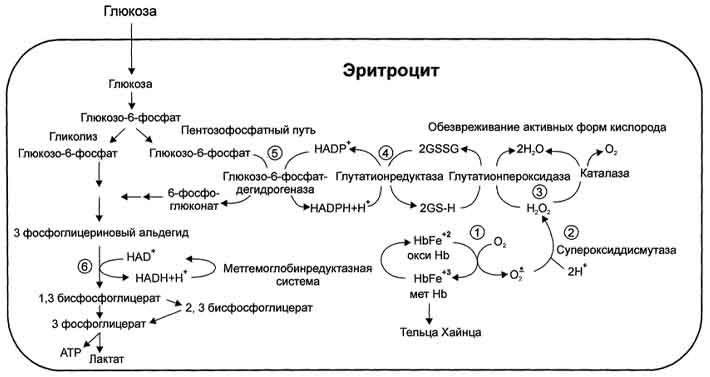
Рисунок 14-4. Образование и обезвреживание активных форм кислорода в эритроците:
1 - спонтанное окисление Fe2+ в теме гемоглобина - источник супероксидного аниона в эритроцитах;
2 - Супероксиддисмутаза превращает супероксидный анион в пероксид водорода и воду: О2-+ О2- + 2Н+ → Н2О2 + О2;
3 - пероксид водорода расщепляется каталазой: 2 Н2О2 → 2 Н2О + О2или глутатионпероксидазой: 2 GSH +Н2О2 → GSSG +2 Н2О;
4 - Глутатионредуктаза восстанавливает окисленный глутатион: GSSG + NADPH + Н+ → 2GSH + NADP+;
5 - NADPH, необходимый для восстановления глутатиона, образуется на окислительном этапе пентозофосфатного пути превращения глюкозы;
6 - NADH, необходимый для восстановления гемоглобина метгемоглобинредуктазной системой, образуется в глицеральдегидфосфатдегидрогеназной реакции гликолиза.
№37 Значение свободно-радикального окисления для организма
|
ЗНАЧЕНИЕ СВОБОДНО- РАДИКАЛЬНОГО ОКИСЛЕНИЯ |
|
|
В норме: |
При патологии: |
|
Необходимое звено метаболизма, Обеспечивающее нормальную жизнедеятельность
|
Универсальная неспецифическая основа Патогенеза различных заболеваний |
|
|
№38 Повреждение биомолекул АКМ, механизм. Перекисное окисление липидов (ПОЛ) и белков, нуклеиНовых кислот.
Перекисное окисление белков:
Действие на белки
-
Окисление тиоловых групп
-
Инактивация ферментов
-
Агрегация белковых молекул
Перекисное окисление липидов.
Действие на липидный бислой
-
Увеличение вязкости
-
Рост поверхностного заряда
-
Увеличение проницаемости для ионов
-
Снижение электрической прочности


LH+O2=LOOH
№39. Антиоксиданты и ингибиторы радикальных окислительных процессов:
А). Ферментативные антиоксиданты (супероксиддисмутаза, каталаза, глутатионзависимые ферменты
Б). Соединения, содержащие енольные группы: фенольные антиоксиданты, аскорбиновая кислота, SH-содержащие соединения.
В).Хелаторы ионов металлов переменной валентности
Г). Гуморальные антиоксидантные факторы: церулоплазмин и трансферрин
Антиоксиданты-вещ-ва, препятствующие образованию свободных радикалов.
А). Ферментативные:
1.Супероксиддиссмутаза
Локализац:цитозоль клеток, много в печени, лёгких, эритроцитах, митхондриях эукариотических клеток
Катализирует дисмутацию супероксида в кислород и пероксид водорода.
O2− + O2−+ 2H+ H2О2+О2
2. Каталаза разлагает образующуюся в процессе биологического окисления перекись водорода на воду и молекулярный кислород (2H2O2 → 2H2O + O2), а также окисляет в присутствии перекиси водорода низкомолекулярные спирты и нитриты. Содержится почти во всех организмах. Участвует в тканевом дыхании.
3. Глутатионпероксидаза-инактивирует гидроперекиси липидов, катализируют восстановление перекисей липидов в соответствующие спирты и восстановление пероксида водорода до воды
Локализац: в эритроцитах: для того, чтобы регенерировать фермент требуется NADPH2(продукт оксиления глюкозы), в составе селена
S-CHО2(гидроперекись)+Глу-SH2H2О+Глу-Глу
Б). фенольные антиоксиданты, витамины
Витамины-осуществляют обрыв цепной реакции за счёт захвата электрона и превращ. в стабильн. Св-R частицу
1.ВитЕ(токоферол)-связывает жирорастворимые св-R: ROO*+Е-OH ROOH+ Е-О*
