
Вопросы по БИОХИМИИ
.doc№1 Общая характеристика хромопротеидов. Гемоглобин, структурная характеристика. Зависимость биологической активности белков от четвертичной структуры: кооперативные изменения конформации протомеров (на примере гемоглобина в сравнении с миоглобином).
Общая хар-ка хромопротеидов: Хромопротеины содержат окрашенные простетические группы. К этим белкам относят гемопротеины (содержат гем),ретинальпротеины (содержат витамин А), флавопротеины (содержат витамин В2), кобамидпротеины (содержат витамин В12).
Гемопротеины
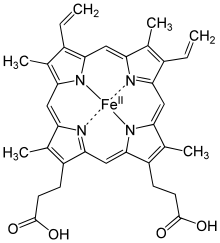 подразделяются
на неферментативные (гемоглобин,
миоглобин) и ферменты (цитохромы,
каталаза, пероксидаза). Небелковой
частью их является гем –
структура, включающая в себя порфириновое
кольцо (состоящее из 4 пиррольных колец)
и иона Fe2+.
Железо связывается с порфириновым
кольцом двумя координационными и двумя
ковалентными связями.
подразделяются
на неферментативные (гемоглобин,
миоглобин) и ферменты (цитохромы,
каталаза, пероксидаза). Небелковой
частью их является гем –
структура, включающая в себя порфириновое
кольцо (состоящее из 4 пиррольных колец)
и иона Fe2+.
Железо связывается с порфириновым
кольцом двумя координационными и двумя
ковалентными связями.
Цитохромы отличаются аминокислотным составом пептидных цепей и числом цепей и разделяются на типы а, b, с, d. Все они неспособны связывать кислород, кроме цитохрома а3, который содержит ионы меди. Цитохромы находятся в составе дыхательной цепи и цепи микросомального окисления.
Флавопротеины являются ферментами окислительно-восстановительных реакций, содержат производные витамина В2 флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД).
.Гемоглобин структур хар-ка: имеет 4-ную структуру,4 соединенные цепи образуют правильную форму шара,где каждая α-цепь контактирует с двумя β-цепями. Т.к. в обл.контакта м\у этими цепями находится мног гидрофоб.радикалов,то м\у ними формируется сильное соед-е за счет возникновения гидрофоб и ионных и водородных связей.в рез-те обр димеры, м\у этими димерами в молекуле возникают в основном полярные связи.кроме того димеры могут перемещаться относительно друг-друга.так пов-ть протомеров не ровная, полипептидные цепи в центральной обл. не могут плотно прилегать др к др в рез-те формир центральная полость проходящая сквозь молекулу гемоглобина.
кооперативные изменения конформации протомеров (на примере гемоглобина в сравнении с миоглобином):кооперативную работу можно наблюдать на кривых диссоциации. Кривая диссоциации О2 для миоглобина имеет вид простой гиперболы. Это указывает на то, что миоглобин обратимо связ-ся с лигандом,и на это не оказ-т влияние никакие посторонние факторы: Мв+О2↔МвО2 процессы обр и распада оксимиоглобина находятся в равновесии и это равновесие смещ-ся влево или вправо в зависимости от того,добав-я или удал-я кислород из системы.миоглобин связ-т О2 который в капиллярах тканей высвобождает гемоглобин,и сам миоглобин может высвоб-ть о2 в ответ на возрастание потребностей в нем мыш.тк и при физ нагрузке. Миоглобин имеет выс сродство к О2. Даже при парциальном давлении О2 равном 1-2 мм.рт.ст миоглобин остается связанным с О2 на 50%.
Кривая диссоциации О2 для гемоглобина:гемоглобин имеет низкое сродство к О2,полунасыщение гемоглобина наступает при более высоком давлении О2(около 26 мм.рт.ст.)кривая диссоциации имеет S-образную форму,это указывает на то,что протомеры гемоглобина работают кооперативно:чем больше О2 отдают протомеры,тем легче идет отщепление молекул О2.в капиллярах покоящихся мышц большая часть О2 возвращается в составе оксигемоглобина в легкие.при физ.работе давление О2 в капиллярах падает до 10-20 мм.рт.ст. именно в этой обл.располагается крутая часть S-образной кривой,где больше проявляется св-во кооперативной работы протомеров. Каждый из белков способен выполнять свою функ-ю. миоглобин-присоед-ть О2 высвобождаемый гемоглобином,накап-ть и высвобождать при крайних необходимостях. Гемоглобин-присоединять О2 в легких,где его насыщение доходит до 100% и отдавать его в капиляры тк.в зависимости от изменения в них давления О2.
№2 Типы гемоглобинов в процессе онтогенеза и их биологическое значение. Особенности структуры.
Гемоглобин А-основной Г.взрослого организма,составляет около 98% от общего кол-ва гемоглобина,тетрамер,состоит из 2 полипептидных цепей α и 2β (2α2β)протомеры гемоглобина,так же как и апомиоглобин,состоят из 8 спиралей,свернутых в плотную глобулярную структуру содержащую внутреннее гидрофобное ядро и карман для связывания гема.
Гемоглобин А2-находится в организме взрослого человека в меньшей концентрации,на его долю приходится около 2% общего гемоглобина.он состоит из 2α и 2δ цепей.
Гемоглобин А 1с- гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы(гликозилированный гемоглобин)
Эмбриональный гемоглобин-синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2ξ2ε. Через 3 недели после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
Гемоглобин F-фетальный гемоглобин,синтезируется в печени костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2α и 2ϒ цепей. После рождения ребенка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
№3 Вариации первичной структуры и свойств гемоглобина человека. Серповидно-клеточная анемия, биохимические основы нарушений функции.
Альфа-полипептидная цепь заканчивается комбинацией аминокислот валина-лейцина, а бета-полипептидная цепь - комбинацией валина-гистидина-лейцина. Альфа- и бета-полипептидные цепи в гемоглобиновой молекуле не размещены линейно, как это выглядит на первый взгляд из данных, это первичная структура .
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают "слипаться", образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок "замаскирован" в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина S друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение рН, условия высокогорья, полёт на самолёте).
Так как "серповидные" эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли "даже некроз клеток в данной области.
Серповидно-клеточная анемия - гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена бета-цепей глобина. После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген НЬА, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
№4 Гемоглобин плода и его физиологическое значение. Роль 2.3-дифосфоглицерата в регуляции сродства гемоглобина к кислороду
Олигомерный белок гемоглобин, в отличие от мономерного родственного белка миоглобина, способен присоединять к специфическим участкам 4 различных лиган-да: О2, Н+, СО2 и БФГ. Все эти лиганды присоединяются к пространственно разобщённым участкам, но конформационные изменения белка в месте присоединения одного лиганда передаются на весь олигомерный белок и изменяют сродство к нему других лигандов. Так, количество поступающего в ткани О2 зависит не только от парциального давления О2, но и концентрации аллостерических лигандов, что увеличивает возможность регуляции функций гемоглобина. в капиллярах работающей мышцы увеличение концентрации СО2 и Н+ уменьшает сродство гемоглобина к О2 и увеличивает отдачу его в ткани. При длительной гипоксии усиливается синтез 2,3-БФГ в эритроцитах, что также снижает сродство гемоглобина к О2 и при том же парциальном давлении О2 увеличивает его транспорт в ткани.
Следовательно, благодаря воздействию регуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и фунцию к изменениям, происходящим в окружающей среде.
№5 Буферная роль гемоглобина
Гемоглобиновая буферная система – самая мощная буферная система крови. На ее долю приходится 75% от всей буферной емкости крови.
Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения кислородом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb).
Итак, гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются взаимопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
КНb + Н2СO3—> КНСO3 + ННb.
Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кисло реагирующих продуктов обмена.
Гемоглобин (ННb), попадая в капилляры легких, превращается в окси-гемоглобин (ННbО2), что приводит к некоторому подкислению крови, вытеснению части Н2СО3 из бикарбонатов и понижению щелочного резерва крови.
№6 Гемоглобинопатии, биохимические основы нарушений.
Гемоглобинопатия — наследственное или врождённое изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов.
Серповидноклеточная анемия - тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина. В результате в эритроцитах больных присутствует HbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-HbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху.
Талассемии - наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина - транспорту кислорода к тканям. Нарушение эритропоэза и ускоренный гемолиз эритроцитов и клеток-предшественников при талассемиях приводит к анемии.
При β-талассемии не синтезируются β-цепи гемоглобина. Это вызывает образование нестабильных тетрамеров, содержащих только α-цепи. При этом заболевании в костном мозге из-за преципитации нестабильных α-цепей усиливается разрушение эритробластов, а ускорение разрушения эритроцитов в циркулирующей крови приводит к внутрисосудистому гемолизу. Как известно, для образования фетального гемоглобина р-цепи не требуются, поэтому клинически β-талассемия не проявляется до рождения, после чего происходит переключение синтеза HbF на НbА.
В случае α-талассемии недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НbН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НbА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Наследственный сфероцитоз. Причиной этой патологии чаще всего является дефект белков цитоскелета эритроцитов - спектрина или ан-кирина, которые обеспечивают поддержание двояковогнутой формы клетки и эластичности мембраны. Эритроциты приобретают шарообразную форму, что приводит к уменьшению площади их поверхности и снижению скорости газообмена. Потеря эластичности клеточной мембраны приводит к повышению хрупкости и травматичности клеток и, как следствие, к ускорению их разрушения в сосудистом русле и селезёнке. Заболевание сопровождается анемией и желтухой. Удаление селезёнки (спленэктомия) при наследственном сфероцитозе улучшает состояние больных, так как предотвращает разрушение сфероцитов в селезёнке.
Мегалобластная (макроцитарная) анемия развивается при дефиците фолиевой кислоты или витамина В12. Фолиевая кислота в виде кофермента (Н4-фолата) участвует в синтезе нуклеотидов. Недостаток фолиевой кислоты приводит к снижению скорости синтеза ДНК в быстроделящихся клетках, и в первую очередь в предшественниках эритроцитов. Клетки дольше пребывают в интерфазе, синтезируя гемоглобин, и становятся крупнее. Кроме того, из-за недостатка нуклеотидов они реже делятся, и количество эритроцитов снижается, а крупные мегалобласты быстрее разрушаются. Всё это в конечном итоге приводит к развитию анемии.
Персистенция фетального гемоглобина — наследственная гемоглобинопатия, при которой после рождения ребёнка не происходит постепенной замены фетального гемоглобина на гемоглобин А, обладающий большей функциональной стабильностью в широком интервале pH, хотя и меньшей кислород-связывающей способностью. При этом, поскольку фетальный гемоглобин менее стоек и стабилен, у страдающих этой формой гемоглобинопатии укорочен срок жизни эритроцитов, повышен гемолиз и повышено разрушение эритроцитов в селезёнке, со всеми вытекающими последствиями в виде перегрузки организма железом и желчными пигментами и хронического «перенапряжения» эритроцитарного ростка костного мозга.
№7 Метаболизм эритроцита. Транспорт кислорода кровью. Транспорт двуокиси углерода кровью. Эффект Бора.
Эритроциты - высокоспециализированные клетки, которые переносят кислород от лёгких к тканям и диоксид углерода, образующийся при метаболизме, из тканей к альвеолам лёгких. Транспорт О2 и СО2 в этих клетках осуществляет гемоглобин, составляющий 95% их сухого остатка. Организм взрослого человека содержит около 25×1012 эритроцитов, при этом каждые сутки обновляется примерно 1% этого количества клеток, т.е. в течение одной секунды в кровоток поступает около 2 млн эритроцитов.
Транспорт кислорода кровью. Кровь ежедневно должна переносить из лёгких в ткани около 600 л ,О2. Так как О2 плохо растворим в воде, то практически весь кислород в крови связан с гемоглобином эритроцитов.
От способности гемоглобина насыщаться О2 в лёгких и относительно легко отдавать его в капиллярах тканей зависят количество получаемого тканями О2 и интенсивность метаболизма. С другой стороны, О2 - сильный окислитель, избыток поступления О2 в ткани может привести к повреждению молекул и нарушению структуры и функций клеток. Поэтому важнейшая характеристика гемоглобина - его способность регулировать сродство к О2 в зависимости от тканевых условий.
Основная функция гемоглобина - доставка О2 от лёгких к тканям. Олигомерная структура гемоглобина обеспечивает быстрое насыщение его кислородом в лёгких (образование оксигемоглобина - Нb(О2)4), возможность отщепления кислорода от гемоглобина в капиллярах тканей при относительно высоком парциальном давлении О2, а также возможность регуляции сродства гемоглобина к О2 в зависимости от потребностей тканей в кислороде.
О2 связывается с протомерами гемоглобина через Fe2+ , который соединён с четырьмя атомами азота пиррольных колец гема и атомом азота Гис F8 белковой части протомера. Связывание О2 с оставшейся свободной координационной связью Fe2+ происходит по другую сторону от плоскости гема в области Гис Е7. Гис Е7 не взаимодействует с О2, но обеспечивает оптимальные условия для его связывания.
В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fe2+ выступает из плоскости гема в направлении Гис F8. Присоединение О2 к атому Fe2+одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F8 и полипептидная цепь, в состав которой он входит. Происходит изменение конформации всего белка. Конформационные изменения, произошедшие в других протомерах, облегчают присоединение следующей молекулы О2, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы О2.
Аналогичным образом в тканях диссоциация каждой молекулы О2 изменяет конформацию всех протомеров и облегчает отщепление последующих молекул О2.
Гемоглобин способен присоединять О2 в лёгких, где его насыщение доходит до 100%, и отдавать О2 в капиллярах тканей в зависимости от изменения в них давления О2
Перенос Н+ и С02 из тканей в лёгкие с помощью гемоглобина. Эффект Бора
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада - СО2 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+ и НСО3-
СО2 + Н2О - H2CO 3 - H+ + HCO3-.
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α -аминогруппам двух α -цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём . Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора.
В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О - Н2СО3 - Н+ + НСО3-сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом.
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани.
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3-. Небольшое количество СО2 (около 15-20%) может переноситься в лёгкие, обратимо присоединяясь к неионизированным концевым α -аминогруппам. R-NH2+ СО2 = R-NH-COO + Н+, в результате образуется карбогемоглобин, где R - полипептидная цепь гемоглобина. Присоединение СО2 к гемоглобину также снижает его сродство к О2.
2,3-Бифосфоглицерат - аллостертеский регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) - вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
В нормальньж условиях 2,3-бифосфоглицерат присутствует в эритроцитах примерно в той же концентрации, что и гемоглобин. БФГ, присоединяясь к гемоглобину, также может менять его сродство к О2.
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров.
Центральная полость - место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление О2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами α 1 β 1 и α 2 β 2. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух β -цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к О2. Присоединение БФГ к дезоксигемоглобину происходит в аллостерическом центре.
В лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина. Разрыв
ионных связей между димерами α 1 β 1 и α 2 β 2 приводит к "расслаблению" белковой молекулы, уменьшению центральной полости и вытеснению БФГ.
№8 Карбоксигемоглобин. Метгемоглобин. Анемические гипоксии.
Карбоксигемоглобин (COHb) — трудноразъединимое соединение гемоглобина и угарного газа. Переизбыток в крови карбоксигемоглобина приводит к кислородному голоданию, головокружению, тошноте, рвоте или даже смерти, т.к. угарный газ, связанный с гемоглобином, лишает его возможности присоединять к себе кислород.
Карбоксигемоглобин искусственно разъединяется медицинским путём, также он может распасться естественным путём, период полураспада — 4-6 часов. Это возможно, если его содержание в крови мало, и жизнедеятельность организма не нарушается.
Карбоксигемоглобин, HbCO, продукт присоединения CO (углерода окись, угарный газ) с гемоглобином (Hb). Растворы карбоксигемоглобина ярко-красного цвета, их спектр поглощения характеризуется максимумами при длине волны 570 и 539 ммк.
Расщепление карбоксигемоглобина на Hb и CO происходит в 10 000 раз медленнее, чем расщепление оксигемоглобина на Hb и O2. Поэтому при наличии во вдыхаемом воздухе CO кислород постепенно вытесняется из гемоглобина. Уже при концентрации 0,1 % CO в воздухе больше половины Hb крови превращается в карбоксигемоглобин; в результате нарушается перенос кислорода от лёгких к тканям и развивается так называемое угарное отравление, химическое соединение, образующееся при взаимодействии окиси углерода с красящим пигментом крови гемоглобином.
Карбоксигемоглобин образуется очень быстро, поскольку способность присоединяться к гемоглобину у угарного газа примерно в 200 раз выше, чем у кислорода. Карбоксигемоглобин не способен переносить кислород к тканям организма, поэтому при отравлении окисью углерода у человека может быстро наступить смерть. В больших количествах карбоксигемоглобин образуется при отравлении окисью углерода, а в небольших всегда присутствует в крови всех курильщиков и жителей огромных городов. СО может быть частично вытеснен из гема при повышении парциального давления кислорода в легких.
Метгемоглобин, MtHb (HbOH), гемиглобин, ферригемоглобин, форма гемоглобина, в которой железо гема находится в трёхвалентном состоянии; не способен переносить кислород. Метгемоглобин легко образуется из свободного гемоглобина под действием различных окислителей, а в организме — при некоторых отравлениях. MtHb может выделяться с мочой (метгемоглобинурия), иногда повреждая почки. Лечение метгемоглобинемии: введение противоядий (метиленовая синь, аскорбиновая кислота), кислородная терапия.
Гипоксия анемическая — кислородная недостаточность, развивающаяся из-за уменьшения количества эритроцитов или снижения в них гемоглобина. Типы анемической гипоксии (отравление СО, кровяные яды) – токсические анемии.
.№9 Миоглобин его строение и функции. Маршевая миоглобинурия. Содержит небелковую часть - гем и белковую - апомиоглобин. Гем- молекула имеет структуру циклического тетрапиррола, где 4 пиррольных кольца соеденины метиленовыми мостиками и содержат 4 метильные,2 винильные и 2 пропионатные боковые цепи. Эта часть называется протопорфирином. В геме 4 атома азота пиррольных колец протопорфирина связаны с Fe2+, находящегося в центре молекулы. Апомиоглобин- белговая часть,первичная структрура из 153 аминокислот,кот во вторичной структуре уложены в 8 a-спиралей.a-спирали обознач. лат. буквами от А до Н,начиная с N конца полип. цепи и содержат от 7 до 23 аминокислот. для обозначен. аминокисл. используют либо порядков. номер (Гис 64) либо букву а-спирали и номер в этой спирали (Гис F8). Третичн. структура имеет вид компактной глобулы. Гем специфический лиганд апомиоглобина,присоединяется между F и E спиралями. Атом Fe2+ в геме имеет 6 координационных,4 из них связаны с атомами азота в пиррольном кольце,удерживают его в центре протопорфирина, 5 связана с Гис F8,6 связыв. с О2. Гис Е7 необходим для правильной ориентации и присоединении О2.Основная функция-связывание кислор. в мышцах.Миоглобин связывает О2,кот в капиллярах тканей высвобождает гемоглобин и сам может освобождать О2 при интенсивной физич нагрузке,возрастании потребности в мышечн. ткани. Имеет очень высокое сродство к О2. Маршевая миоглобинурия возникает при больших физических нагрузках на мышцы, преимущественно связанных с занятием спортом: интенсивная ходьба, кросс, длительные переходы, бег, лыжные гонки, плавание, езда на велосипеде. Развивается травматический миозит с повреждением клеточных мембран и выходом миоглобина в кровь, а затем миоглобинурия. Характерны выраженный мышечный болевой синдром, отечность, припухлость пораженных мышц, судороги (крампи), повышение температуры, увеличение СОЭ, высокий лейкоцитоз, сгущение крови. Поражаются почки и печень. Темно-коричневый цвет мочи. Это связано с высоким содержанием в моче миоглобина. Почечные канальцы забиваются распавшимся миоглобином и перестают функционировать,в итоге- острая почечная недостаточность.
