
Тарасов ЭУМК_Физика_бак_1_2 / 4 - лаб раб / I семестр / Лабораторная работа № 14
.pdfОглавление |
|
|
ЛАБОРАТОРНАЯ РАБОТА № 14.............................................................................................................. |
2 |
|
1. |
ОПИСАНИЕ УСТАНОВКИ И МЕТОДА ИЗМЕРЕНИЙ ............................................................. |
2 |
2. |
ПОРЯДОК РАБОТЫ.............................................................................................................................. |
4 |
|
ОБЩИЕ УКАЗАНИЯ ............................................................................................................................. |
4 |
|
ЧАСТЬ 1. ОПРЕДЕЛЕНИЕ ОБЪЁМА СОСУДА VX...................................................................... |
5 |
|
ЧАСТЬ 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ВОЗДУХА М............................................ |
5 |
3. |
ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ............................................................................... |
5 |
|
УСЛОВИЯ ПРОВЕДЕНИЯ ОПЫТА ................................................................................................. |
5 |
|
ДАННЫЕ УСТАНОВКИ ....................................................................................................................... |
5 |
КОНТРОЛЬНЫЕ ВОПРОСЫ................................................................................................................... |
6 |
|

2
Лабораторная работа № 14
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ВОЗДУХА
Цель работы: определение молярной массы воздуха и его плотности на основании уравнения Клапейрона-Менделеева.
Для любого однокомпонентного идеального газа справедлива запись уравнения Клапейрона-Менделеева для молярной массы М в форме
M |
mRT |
|
pV |
||
|
,
(1)
где m – масса газа, T – его термодинамическая температура, p – давление, V – объём, R – универсальная газовая постоянная. Однако в данной работе определяется молярная масса воздуха, являющегося смесью нескольких газов (в основном азота и кислорода). Для смеси газов можно говорить лишь об «эффективной» молярной массе. Под эффективной молярной массой смеси понимается молярная масса такого идеального газа, который при одинаковых параметрах (p, V, T) со смесью газов имеет равную ей массу. Поэтому для нахождения эффективной молярной массы воздуха может быть использовано соотношение (1).
1. Описание установки и метода измерений
Общий вид установки показан на РИС. 1. Она состоит из съёмного баллона 2 (объём Vx), крана 3, зажимной гайки 4, баллона 5 (объём V1), вакуумметра 6, вакуумпровода 7 с краном 8 для соединения с атмосферой (8 – пуск воздуха в систему). С помощью крана 1 система отсоединяется от вакуумного насоса, который является неотъемлемой частью установки.
Вакуумметр представляет собой пружинящую полую трубку овального сечения, которая с помощью ниппеля соединяется с установкой. При удалении из трубки воздуха давление внутри трубки уменьшается и запаянный её конец приходит в движение под влиянием разности давлений атмосферного воздуха и воздуха внутри трубки. При этом механизм из рычажка и шестеренки поворачивает стрелку-указатель. Поворот стрелки-указателя пропорционален достигнутому в системе разрежению, т. е. разности между атмосферным давлением и давлением воздуха в установке. Нулевое значение на шкале вакуумметра соответствует атмосферному давлению в установке. Прибор начинает показывать только при откачке воздуха из системы, т. е. при давлении воздуха в установке ниже атмосферного.
При отклонении стрелки на n делений разрежение в системе составляет |
|
nγ pатм p , |
(2) |
где γ – цена деления шкалы вакуумметра. |
|
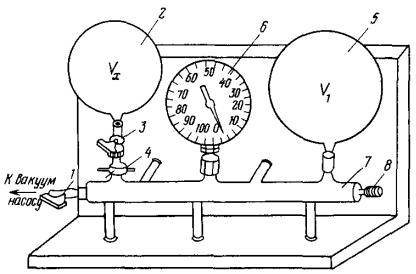
3
Рис. 1
Если максимальное число делений вакуумметра равно N, то цена деления шкалы вакуумметра определяется соотношением
γ |
р |
|
атм |
||
|
||
|
N |
.
(3)
Это объясняется тем, что отклонение стрелки вакуумметра на N делений соответствует так называемому техническому вакууму (давление воздуха в системе принимается равным нулю). Тогда давление воздуха в системе согласно равенствам
(2) и (3) запишется
p N n γ
.
(4)
Представим себе два объёма V1 и Vx, соединённых между собой переходом с краном 3 между ними (см. РИС. 1). Обозначим давление в этих сосудах соответственно p1 и p2. Если открыть кран 3, то газ из сосуда объёмом Vx распространится по все-
му объему и создаст парциальное давление p , которое связано с первоначаль- 2
ным давлением законом Бойля–Мариотта
p V |
|
V |
p |
||
2 x |
2 |
x |
V |
|
1 |
|
.
Для сосуда объёмом V1, рассуждая аналогично, получим
|
|
|
|
|
|
|
p1V1 p1 Vx V1 . |
||
где |
|
– парциальное давление газа, первоначально находившегося в объёме V1. |
||
p1 |
||||
Складывая оба уравнения, получим |
p1 |
p2 Vx V1 . |
||
|
|
p2Vx p1V1 |
||
|
|
|
|
|
Однако по закону Дальтона общее давление газа после открытия крана должно быть равно сумме парциальных давлений, т. е.
p2Vx p1V1 p Vx V1 .
Таким образом, искомый объём
V |
p p1 |
V |
, |
(5) |
|
p p |
|||||
x |
1 |
|
|
||
|
2 |
|
|
|
4
т. е. для нахождения интересующего нас объёма Vx необходимо знать первоначальные давления в правой и левой частях установки (p1 и p2), давление в установке, установившееся после соединения объёмов Vx и V1, значение объёма V1. Температура воздуха в установке равна температуре окружающей среды.
Для нахождения М воздуха из уравнения (1) необходимо знать, кроме давления p1, объёма V1 и температуры Т, ещё и массу воздуха m. Массу воздуха можно найти по разнице между массой сосуда Vx до и после откачки из него воздуха. Но этот способ требует длительной откачки сосуда с воздухом до предельного разрежения. Поэтому для определения молярной массы воздуха пользуются другим методом.
Пусть в сосуде объёмом Vx находится газ массой m под давлением p при температуре Т. В этом случае уравнение состояния газа запишется как
p Vx
m RT M
.
(6)
Откачаем часть газа из сосуда, не изменяя его температуры, тогда масса газа бу-
дет равна |
|
. Давление теперь будет |
p |
|
и уравнение состояния газа запишется |
||||
m |
|
||||||||
как |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
RT . |
|
(7) |
|
|
|
|
|
|
|
||||
|
|
p Vx |
|
M |
|
||||
|
|
|
|
|
|
|
|
|
|
Вычитая выражение (7) из (6), получим |
|
|
|
|
|
|
|||
|
|
(p p )V |
|
m m |
RT |
|
|||
|
|
|
|
|
|||||
|
|
|
x |
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
|
|
|
|
M |
(m m )RT |
. |
(8) |
||||
|
|
(p p )V |
|||||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
x |
|
|
Таким образом, соотношение (8) позволяет найти молярную массу воздуха, не откачивая полностью воздух из объёма Vx.
Найдя экспериментально величину М, можно найти также и другую важную ха-
рактеристику воздуха – плотность ρ
(1) имеем
ρ
mV . Из уравнения Клапейрона-Менделеева
|
pM |
. |
(9) |
|
RT |
||||
|
|
|
2. Порядок работы
Общие указания
Вакуумные краны поворачивайте как можно медленнее. Резкие изменения давления вредны для прибора и могут внести ошибку в измерения.
Так как один и тот же насос обслуживает обычно два стенда, следует согласовать свои действия с бригадой, работающей на второй установке.
Если стрелка прибора не стоит на нуле, попросите лаборанта установить её на
нуль.
5
Часть 1. Определение объёма сосуда VX
1.Записать в ТАБЛ. 1 величину атмосферного давления в объёме Vx как значение
p2.
2.Перекрыть краны 3 и 8 и открыть кран 1.
3.Включить вакуумный насос и откачать воздух из установки примерно до n = 50 делений.
4.Перекрыть кран 1 (прекратить откачку воздуха из установки, не останавливая насоса) и записать в ТАБЛ. 1 давление p1 в объёме V1.
5.Медленно открыть кран 3 и установившееся в системе давление записать как p.
6.Закрыть кран 3. Открыть кран 1 и откачать объём V1 еще на n = 10-15 делений шкалы вакуумметра.
Повторить пп. 4 и 5 и записать в таблицу новые значения p2, p1 и p, причём за p2 в повторном опыте следует брать давление, установившееся в системе после соединения объёмов Vx и V1 в предыдущем опыте.
7. Повторить П. 6 ещё раз.
Часть 2. Определение молярной массы воздуха М
1. Продолжить откачку воздуха из системы установки (Vx и V1) до n = 75-80 делений шкалы вакуумметра.
2. Перекрыть кран 1 и записать давление p |
|
в ТАБЛ. 2. |
|
3.Перекрыть кран 3 и медленно запустить воздух в установку с помощью крана 8.
4.Снять сосуд Vx с установки. Для этого отвернуть зажимную гайку 4, вращая её по часовой стрелке.
5.Взвесить откачанный сосуд Vx на весах (при взвешивании сосуд Vx на чашку весов не класть, а закрепить на крючок).
Взвешивание (как и все последующие) провести 3 раза. Записать результат
ТАБЛ. 2.
m
в
6.Открыть кран 3 на сосуде Vx и, заполнив воздухом при атмосферном давлении, вновь взвесить сосуд. Записать результат m в ТАБЛ. 2.
7.Установить сосуд Vx на место и повторить опыт 2 раза.
3. Обработка результатов измерений
Условия проведения опыта
Т = … … |
pатм = … … |
Данные установки
V1 = … |
|
γ = … (атм/дел) |
|
|
||||
|
|
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
|
|
|
№ п/п |
|
р2 |
|
р1 |
р |
|||
|
|
Деления |
|
|
Деления |
|
Деления |
|
|
|
|
|
|
|
|
|
|
р1 = …; |
р2 = …; р = …; |
ринс = … |
|
|
||||

6
Таблица 2
№ п/п |
p |
|
p |
|
p p |
m |
m |
m m |
|
|
Деления |
|
Деления |
|
Деления |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p
;
p
; ринс = …;
m
;
m 
1.Рассчитать объём сосуда Vx по формуле (5).
2.Найти среднюю величину объёма сосуда Vx .
3.Рассчитать молярную массу воздуха по формуле (8).
4.Рассчитать плотность воздуха по формуле (9) для двух значений р.
5.Найти относительную и абсолютную погрешности определения Vx из формулы
|
V |
|
2 |
|
|
||||
|
x |
|
|
|
|
|
|
|
|
|
V |
|
|
|
x |
|
V1 V1
|
2 |
|
p |
|
2 |
|
р |
|
|
||||||
|
|
|
инс |
|
|
|
инс |
|
|
|
|
|
|
||
|
|
|
р р |
|
|
|
р р |
|
1 |
|
2 |
|
2 |
|
|
|
|
|
|
|
|
(р р )Δр |
|
|
2 |
||
|
|
|
|||||
|
1 |
2 |
инс |
|
|
||
|
|
||||||
|
(р р)(р |
р ) |
|
||||
|
|
|
|
||||
|
1 |
|
|
2 |
|
||
.
6. Найти относительную и абсолютную погрешности М из формулы
|
M 2 |
|
|
m |
2 |
|
|
ринс |
2 |
|
R 2 |
|
T 2 |
|
Vx |
2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
M |
|
|
|
|
R |
T |
|
||||||||||||
|
|
m |
m |
|
|
р |
р |
|
|
|
|
|
|
Vx |
|||||
7. |
Найти относительную и абсолютную погрешности ρ из формулы |
||||||||||||
|
|
2 |
|
2 |
|
M |
2 |
|
|
2 |
|
|
2 |
|
ρ |
р |
|
R |
T |
||||||||
|
|
|
|
|
|
|
|
|
R |
|
|
T |
. |
|
|
ρ |
|
р |
|
M |
|
|
|
|
|
||
8. |
Окончательные результаты измерений записать в виде |
|
|||||||||||
|
|
|
Vx Vx |
Vx , M M |
M , |
|
|
|
|||||
ρ ρ |
|
1 |
1 |
ρ1
(для p1), ρ2 ρ2
Т = …
ρ2
(для p2),
Контрольные вопросы
1.При каких условиях уравнение Клапейрона-Менделеева применимо к воздуху?
2.Написать формулу для расчёта молярной массы воздуха в данной работе.
3.Сформулировать закон Дальтона.
4.Описать вакуумную установку. Для чего служат краны 1, 3, 8?
5.Что понимается под объемом вакуумной установки и как измеряется этот объём?
6.Вывести формулу для вычисления объёма установки.
7.Сформулировать закон Бойля-Мариотта.
8.Записать уравнение Клапейрона-Менделеева. Дать определение всех величин, входящих в это уравнение.
9.Каков физический смысл универсальной газовой постоянной?
10.Что такое эффективная молярная масса воздуха? Как измеряется эта величина в работе?
11.Вывести формулу для расчёта молярной массы воздуха в данной работе.
7
12.Записать первое начало термодинамики для процесса, происходящего в установке при соединении баллонов после откачки воздуха из одного из них.
