
- •1. Основные понятия и показатели химической технологии
- •2. Безопасность химических производств и защита окружающей среды
- •4. Классификация моделей хтс
- •5. Сырьевая база химических производств
- •6.Вода как сырье и компонент химического производства
- •Схемы водооборота
- •7. Энергетическая база химических производств
- •8. Термодинамика химико-технологических процессов
- •9. Кинетика химико-технологических процессов
- •1. Температура
- •1. Коэффициент скорости процесса
- •Зависимость V от т:
- •11. Катализ в химической промышленности
- •12.Основные типы химических реакторов
- •13. Основы теории подобия
- •14. Основные закономерности гидравлики
- •15. Общие сведения о насосах и компрессорных машинах
- •16. Псевдоожиженный слой зернистых материалов
- •17. Характеристика гетерогенных систем и методы их разделения
- •1. Осаждение
- •2. Фильтрование
- •18. Характеристика процесса перемешивания материалов
- •19. Тепловые процессы в химической технологии
- •20. Технологические способы нагревания и охлаждения
- •21. Характеристика процесса выпаривания
- •22. Массообменные процессы в химической технологии
- •23. Перегонка жидкостей
- •24. Абсорбция и адсорбция
- •25. Материалы как важная категория продуктов химической технологии
- •26. Производство серной кислоты
- •28. Производство азотной кислоты и нитрата аммония
- •30. Производство фосфорных и комплексных удобрений
- •35. Переработка нефти и нефтепродуктов
9. Кинетика химико-технологических процессов
микро-
и макрокинетика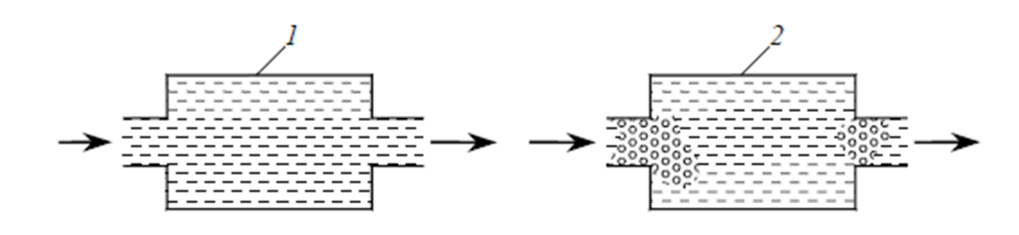
ПОТОК ИДЕАЛИЗИРОВАННЫХ ЖИДКОСТЕЙ В:
1 – МИКРОСОСТОЯНИИ; 2 – МАКРОСОСТОЯНИИ
В системе на микроуровнежидкость представляет собой свободные индивидуальные молекулы
В системе на макроуровнежидкость представляет собой совокупность большого числа небольших глобул, т. е. групп молекул, как бы заключенных в оболочку
Скорость
химических процессов, протекающих на
микроуровне

n-порядок реакции,k– константа скоростиk0 – предэкспоненциальный множитель; Еа – энергии активации реакции, Дж/моль; Т – температура, К;
R– универсальная газовая постоянная,
Дж/(моль·К);
Скорость химической реакции представляет зависимость
v =f(T,C,P,Kat)
Способы
увеличения скорости реакции![]()
![]()

1. Температура
При ↑Т → v↑, С=сonst
![]()
![]()
А
R+Q![]()


При Xa= сonst,
С
одной стороны при ↑ Т vдолжна↑, с другой - при повышении
Т в экзот. Кс↓, а значит 1/Кс↑иv
будет ↓ , при ↑Ха суммарнаяv↓![]()
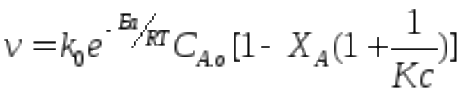
A R-Q При ↑Т → v↑, при ↑Ха суммарная v↓
Отрицательное влияние температуры состоит в следующем:
- увеличение потерь целевого продукта вследствие его испарения и образования побочных продуктов;
- снижение прочности и химической стойкости материалов;
-возможное снижение селективности сложных реакций.
2. Концентрация
При
увеличении концентрации исходных
реагентов v↑![]()
Например,
![]()
Чтобы судить об изменении скорости реакции, строят кривые зависимости концентраций реагентов от времени, т.е. С = f(τ)
после
интегрирования![]()

![]()




При ↑τ → СА0 ↓ → v ↓
3. Давление
для
реакций с участием газообразных веществ:![]()
↑P
приводит к ↑Среаг. и к ↑v

С
возрастанием порядка
P↑
Увеличение давления приводит к:
- возрастанию расхода электроэнергии,
- применению более прочных конструкционных материалов
4.
Катализатор 
Энергетическая
диаграмма некаталитической и каталитической
реакции 
10. Типы химико-технологических процессов: гомогенные и гетерогенные
В гомогенных системах все реагирующие вещества находятся в одной какой-либо фазе: газовой (г), жидкой (ж) или твердой (т).
В гетерогенных системах реагирующие вещества находятся в разных фазах:
газ-жидкость(г – ж), жидкость-твердое (ж – т),
газ-твердое (г – т), твердые фазы (т – т).
несмешивающиеся жидкости (ж – ж)
Наиболее часто в промышленных процессах встречаются системы г – ж, г – т и ж – т.
Иногда
в промышленных процессах участвуют три
или четыре фазы, например, г – ж – т, г
– ж – ж, г – ж – т – т.
![]()
Гомогенные
процессы в
большинстве случаев протекают в
кинетической области, т.е. общая скорость
процесса определяется скоростью
химической реакции и подчиняется
закономерностям, установленным для
процессов, протекающих на микроуровне.
для ↑v необходимо ↑ k путем ↑T, применения kat и ↑ СА.0
Гомогенный процесс на макроуровне протекает в том случае, когда на химическую реакцию накладываются другие физические или физико-химические процессы.
Например,
-при взаимодействии двух жидких исходных реагентов или их растворов скорость гомогенного процесса зависит от условий и скорости перемешивания жидкостей;
-
если химическое взаимодействие протекает
при подогреве, то скорость гомогенного
процесса будет зависеть также от способа
подвода тепла.
Гетерогенные процессы
Процесс горения угля состоит из пяти стадий: (Система газ-твердое вещество)
1. внешняя диффузия О2 (через пограничный газовый слой);
2. внутренняя диффузия О2 (через слой золы);
3. химическая реакция;
4. внутренняя диффузия СО2 (через слой золы);
5. внешняя диффузия СО2 (через пограничный слой газа).
1- уголь; 2-зола, 3- пограничный слой газа
В любом гетерогенном химическом процессе можно выделить три основных одновременно протекающих процесса:
диффузия реагентов к границе раздела фаз;
химическая реакция;
диффузия продуктов реакции из зоны реакции.

Скорость гетерогенного процесса
где v – скорость гетерогенного процесса;K – коэффициент скорости процесса;F – поверхность контакта фаз; ∆C – движущая сила процесса
Способы увеличения скорости гетерогенного процесса
