
Общая химия в комплексной химической переработке древесины
.pdf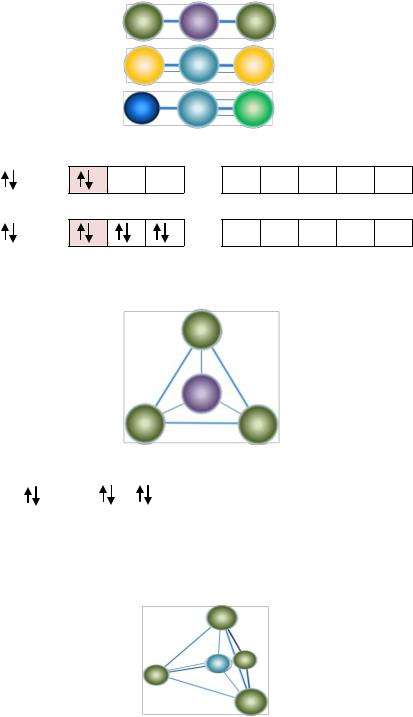
ПРИЛОЖЕНИЕ 5
ТИПЫ ГИБРИДИЗАЦИИ ЛАЙНУСА ПОЛИНГА
|
Пространственная |
|
|
|
Тип гибридиза- |
конфигурация моле- |
Расположение атомов |
Примеры со- |
|
ции (или участия |
кулы, центральный |
|||
в молекуле |
единений |
|||
электронных пар) |
атом которой подвер- |
|||
|
|
|||
|
гается гибридизации |
|
|
|
|
|
|
|
|
|
|
|
BeCl2 |
|
sp |
Линейная |
|
CO2 |
|
|
|
|
HCN |
|
|
|
|
|
sp – линейная |
s |
|
p |
|
|
|
|
|
|
ζ |
|
sp – линейная |
s |
|
p |
|
|||
|
|
|
|
|
|
ζ |
|
|
|
|
|
ζ |
ζ π π
d
d
sp2 |
|
Тригональная |
|
BF3, AlCl3, |
sd2 |
p2d |
(плоский треугольник) |
|
NO3–, [HgI3]–, |
spd |
|
Неправильный тре- |
|
[CdCl3]– |
|
|
угольник |
|
|
|
|
|
|
|
sp2 – пл. треугольник |
s |
|
p |
|
|
|
d |
|
|
|
|
|
|
|
ζ |
|
ζ ζ |
|
|
|
|
|
|
||
|
3 |
|
|
CH4, CCl4, |
||
sp |
|
|
XeO4,– |
|
||
|
3 |
Тетраэдрическая |
|
, |
||
рd |
|
|
|
[HgI4] |
||
|
|
|
|
|
[BF4]– |
|
|
|
|
|
|
|
|
17

ПРОДОЛЖЕНИЕ ПРИЛОЖЕНИЯ 5
sp3 – тетраэдр |
s |
|
|
p |
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ζ ζ ζ ζ
sp3(→p2)
SO2
sp3d(→p2) Уголковая
H2O
sp3d(→p2) |
s |
|
p |
|
|
|
d |
|
|
|
|
|
|
|
|
|
ζ ζ |
π |
|
π |
|||||
sp3(→p2) |
|
|
|
|
|
|
||||||
s |
|
p |
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
ζ |
ζ |
|
|
|
|
|
|
sp 3d2 |
Неправильный тетраэдр (иска- |
|
SO2Cl2, |
(→sp3) |
|
||
p3d, pd3 |
женный тетраэдр) |
|
CCl2F2 |
|
|
|
|
|
|
|
|
|
|
[PdCl4]2–, |
|
|
d sp |
2 |
Тетрагональная |
|
[Pt(NH3)4]2+, |
||||
|
|
[Ni(CN)4] |
2– |
, |
||||
2 |
|
2 |
|
|
|
|||
p |
d |
|
|
(плоский квадрат) |
|
[PtCl4]2–, |
|
|
|
|
|
|
|
|
XeF4. |
|
|
|
|
|
|
|
|
|
|
|
d sp2
s |
p |
|
d |
ζ |
ζ |
ζ |
ζ |
18

|
|
|
ПРОДОЛЖЕНИЕ ПРИЛОЖЕНИЯ 5 |
|||
|
|
|
|
|
|
|
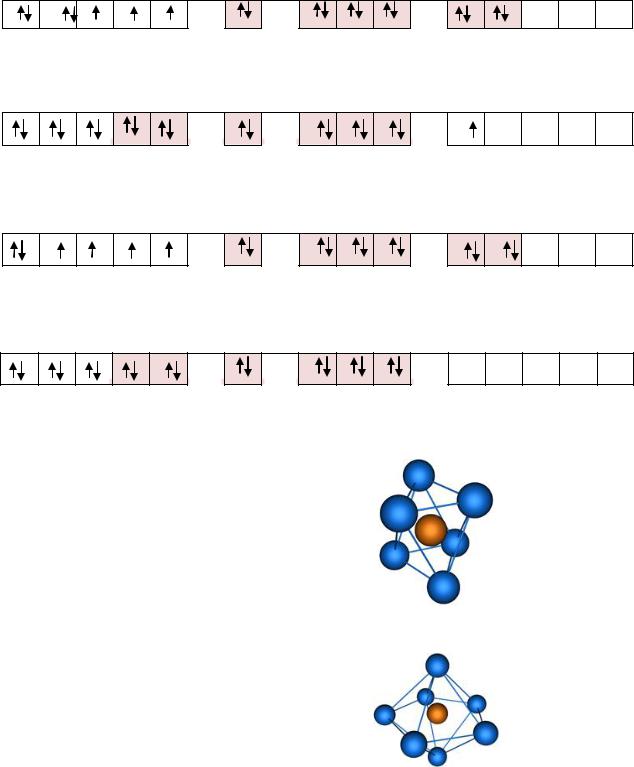
sp3d |
|
|
|
|
|
|
|
|
Пирамидальная |
|
|
Sb(C6HC5)5, |
|
|
|
|
|
|
|
|
sp2d2, sd4, |
(квадратная пирамида) |
|
|
Ni(PR3)2Br3, |
|
|
4 |
3 2 |
|
|
|
BrCl5. |
|
pd |
, p d |
|
|
|
|
|
|
|
|
|
|
|
|
sp3d |
|
|
PF5, PCl5, |
Тригонально– |
|
SbCl5, |
|
d3sp |
бипирамидальная |
|
[Fe(CO)5]. |
|
|
|
|
sp3d |
s |
p |
|
|
|
d |
|
|
ζ |
ζ |
ζ |
ζ |
ζ |
sp3 d
s |
p |
|
|
d |
ζ |
ζ |
ζ |
ζ |
ζ |
d sp3
ζ |
ζ |
ζ |
ζ |
ζ |
|
|
|
|
|
SF6, PF6–, |
3 |
|
2 |
|
|
SiF62–, |
sp |
d |
|
Октаэдрическая |
|
XeO64–, , |
|
|
|
|
|
[MnCl6]3– , |
|
|
|
|
|
[Fe (CN)6]3– |
|
|
|
|
|
|
19
ПРОДОЛЖЕНИЕ ПРИЛОЖЕНИЯ 5
sp3 d2
s |
p |
|
|
d |
|
ζ |
ζ |
ζ |
ζ |
ζ |
ζ |
d2sp3
|
s |
p |
σ |
σ |
σ |
|
|
d |
σ |
σ |
σ |
sp3 d2
s |
p |
|
|
d |
|
ζ |
ζ |
ζ |
ζ |
ζ |
ζ |
d2sp3
|
s |
p |
ζ |
ζ |
ζ |
|
|
d |
ζ |
ζ |
ζ |
p2d3 |
Тригонально– |
|
|
|
антипризматическая |
|
|
|
|
|
|
|
Пентагонально– |
|
XeF6, IF7, |
sp3d3 |
|
ZrF73–, |
|
|
бипирамидальная |
|
UF73–. |
|
|
|
|
20
|
|
ОКОНЧАНИЕ ПРИЛОЖЕНИЯ 5 |
|
|
|
|
|
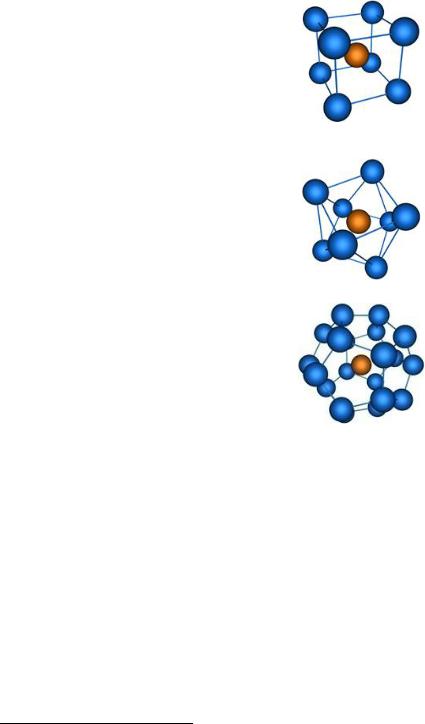
sp3d4 |
Кубическая |
|
PbF48– |
|
|
|
|
sp3d4 |
Тетрагонально– |
|
TaF83–, Cs4[U(NCS)8] |
|
антипризматическая |
|
|
|
|
|
|
|
|
|
Водоросль воль- |
|
|
|
вокс, вирус полио- |
sp3d4 |
Додекаэдрическая |
|
миелита29, |
|
|
|
FeS |
|
|
|
|
29 Водоросль вольвокс — один из простейших многоклеточных организмов — представляет собой сферическую оболочку, сложенную в основном семиугольными, шестиугольными и пятиугольными клетками (то есть клетками, имеющими семь, шесть или пять соседних; в каждой «вершине» сходятся три клетки). Вирус полиомиелита имеет форму додекаэдра. Он может жить и размножаться только в клетках человека и приматов.
21
ПРИЛОЖЕНИЕ 6
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ МАЛОРАСТВОРИМЫХ В ВОДЕ СОЕДИНЕНИЙ (ПРИ 25 С)
СОЛЬ |
ПР |
СОЛЬ |
ПР |
СОЛЬ |
ПР |
|
|
|
|
|
|
Ag2C2O4 |
3,5 10–11 |
Bа(IOз)2 |
1,5·10 –9 |
Cа(Н2РO4)2 |
1,0 10 –3 |
Ag2CO3 |
1,4 10–12 |
Bа(OН)2 |
5,0 10 –3 |
Cа3(АsO4)2 |
6,8·10–11 |
Ag2Cr2O7 |
1,0 10–10 |
Bа(ВrО3)2 |
5,5 10 –6 |
CаCО3 |
3,8·10 –9 |
Ag2CrO4 |
1,1 10–12 |
Bа2Р2O7 |
3,0·10–11 |
CаSО3 |
1,3 10 –8 |
Ag2S |
6,3 10–50 |
Bа3(АsO4)2 |
7,8 10–51 |
CdC2O4 |
1,5 10 –8 |
Ag2SO3 |
1,5 10–14 |
Bа3(РO4)2 |
6,0·10–39 |
CdSeO3 |
1,3 10 –9 |
Ag2SO4 |
1,6 10 –5 |
BаC2O4 |
1,1 10 –7 |
CdCO3 |
5,2 10–12 |
Ag3AsO4 |
1,1 10–22 |
BаCOз |
4,0 10–10 |
Сd(OН)2 |
2,2 10–14 |
Ag3PO4 |
1,3 10–20 |
BаCrO4 |
1,2·10–10 |
CoS |
4,0 10–21 |
AgBr |
5,3 10–13 |
BаS2O3 |
1,6·10 –5 |
CoS |
2,0 10–25 |
AgCH3COO |
4,0 10 –3 |
BаSOз |
8,0·10 –7 |
Со3(АsO4)2 |
7,6 10–29 |
AgCl |
1,8 10–10 |
Bе(OН)2 |
6,3 10–22 |
Сo(OН)3 |
4,0 10–45 |
AgClO2 |
2,0 10 –4 |
BеCO3 |
1,0·10 –3 |
CоCО3 |
1,4 10–13 |
AgClO3 |
5,0 10 –2 |
Bi2(C2O4)3 |
4,0·10–36 |
Сo(OН)2 |
2,0 10–16 |
AgCN |
1,4 10–16 |
Bi2S3 |
1,0·10–97 |
CoC2O4 |
6,3 10 –8 |
AgI |
8,3 10–17 |
BiAsO4 |
2,8·10–10 |
CrPO4 |
1,0 10–17 |
AgIO3 |
3,0 10 –8 |
BiI3 |
8,1·10–19 |
Сr(OН)2 |
1,0 10–17 |
AgNO3 |
1,6 10 –4 |
BiOCl |
7,0·10 –9 |
CrAsO4 |
7,8 10–21 |
AgSCN |
1,1 10–12 |
BiPO4 |
1,3·10–23 |
Сr(OН)3 |
6,3 10–31 |
AgВrО3 |
5,8 10 –5 |
CaC2O4 |
2,3·10 –9 |
Сu(IO3)2 |
7,4 10 –8 |
Al(OН)3 |
3,7 10–15 |
CaCrO4 |
7,1 10 –4 |
Сu(OН)2 |
2,2 10–20 |
AlAsO4 |
1,6·10–16 |
CaF2 |
4,0 10–11 |
Cu3(АsO4)2 |
7,6 10–36 |
AlPO4 |
5,7 10–19 |
CaHPO4 |
2,7 10 –7 |
CuBr |
5,2 10 –9 |
Ba(NO3)2 |
4,5·10 –3 |
CaSO4 |
9,1 10 –6 |
CuCl |
1,2 10 –6 |
BaSO4 |
1,1·10–10 |
Cа(IO3)2 |
7,0 10 –7 |
CuCrO4 |
3,6 10 –6 |
BaМnO4 |
2,5·10–10 |
Cа(OН)2 |
6,3 10 –6 |
CuI |
1,1 10–12 |
BaF2 |
1,1·10 –6 |
Са3(РO4)2 |
2,0 10–29 |
CuS |
6,3 10–36 |
22
ОКОНЧАНИЕ ПРИЛОЖЕНИЯ 6
СОЛЬ |
ПР |
СОЛЬ |
ПР |
СОЛЬ |
ПР |
CuSe |
1,0 10–49 |
MgSO3 |
3,0·10 –3 |
Рb3(АsO4)2 |
4,1·10–36 |
Fe(OН)2 |
8,0 10–16 |
Mn3(АsO4)2 |
1,9·10–29 |
Рb3(РO4)2 |
7,9·10–43 |
Fe(OН)3 |
6,3 10–38 |
MnNH4PO4 |
1,0·10–12 |
РbВr2 |
9,1·10 –6 |
FeC2O4 |
2,0 10 –7 |
Мn(OН)2 |
1,9 10–13 |
РbС2O4 |
4,8·10–10 |
FePO4 |
1,3 10–22 |
MnS |
2,5·10–10 |
РbСl2 |
1,6·10 –5 |
FeS |
5,0 10–18 |
Мn(OН)3 |
1,0 10–36 |
РbСО3 |
7,5·10–14 |
FeS2 |
6,3 10–31 |
Мn(OН)4 |
1,0 10–56 |
Sn(OН)2 |
6,3 10–27 |
FеAsO4 |
5,8·10–21 |
Na[Sb(OH)6] |
4,0·10 –8 |
Sn(OН)4 |
1,0 10–57 |
FеСО3 |
3,5 10–11 |
NaIO4 |
3,0 10 –3 |
SnI2 |
8,3·10 –6 |
Hg2Br2 |
5,8 10–23 |
Ni(CN)2 |
3,0·10–23 |
SnS |
2,5·10–27 |
Hg2Cl2 |
1,3 10–18 |
Ni(IO3)2 |
1,4·10 –8 |
Sr3(АsO4)2 |
1,3 10–18 |
Hg2I2 |
4,5 10–29 |
Ni(OН)2 |
2,0 10–15 |
SrC2O4 |
5,6·10 –8 |
HgS |
1,6 10–52 |
Ni3(АsO4)2 |
3,1·10–26 |
SrCrO4 |
3,6·10 –5 |
K2Na[Co(N02)6] |
2,2 10–11 |
NiC2O4 |
4,0·10–10 |
SrSО4 |
3,2·10 –7 |
K3[Co(N02)6] |
4,3 10–10 |
NiS |
1,0·10–24 |
Sb2S3 |
1,6·10–93 |
KClO4 |
1,1 10 –2 |
NiS |
3,2·10–11 |
Sr3(PO4)2 |
1,0·10–31 |
KIO4 |
8,3 10 –4 |
NiСО3 |
1,3·10 –7 |
Sr(IO3)2 |
3,3 10 –7 |
Li2CO3 |
1,9 10 –3 |
Рb(ВrО3)2 |
8,0 10 –6 |
SrF2 |
2,5·10 –9 |
Li3PO4 |
3,2 10 –9 |
Pb(IO3)2 |
2,6 10–13 |
SrSO3 |
4,0·10 –8 |
LiF |
1,5·10 –3 |
Pb(OН)2 |
7,9 10–16 |
SrSеO3 |
4,4·10 –6 |
LiOН |
4,0 10 –2 |
Pb(SCN)2 |
2,0·10 –5 |
ZnS |
2,5·10–22 |
Mg(IO3)2 |
3,0 10 –3 |
PbCrO4 |
1,8·10–14 |
ZnS |
1,6·10–24 |
Mg(OН)2 |
6,8 10–12 |
PbF2 |
2,7·10 –8 |
ZnСО3 |
1,4·10–11 |
Mg3(AsO4)2 |
2,1 10–20 |
PbI2 |
1,1·10 –9 |
Zn(CN)2 |
2,6·10–13 |
Mg3(PO4)2 |
1,0 10–13 |
PbS |
2,5·10–27 |
Zn(IO3)2 |
2,0 10 –8 |
MgC2O4 |
8,5 10 –5 |
PbS2O3 |
4,0·10 –7 |
Zn(OН)2 |
1,2 10–17 |
MgCO3 |
2,1 10 –5 |
PbSO4 |
1,6·10 –8 |
Zn3(AsO4)2 |
1,3·10–27 |
MgF2 |
6,5 10 –9 |
PbSе |
1,0·10–38 |
Zn3(РO4)2 |
9,1·10–33 |
MgNH4PO4 |
2,5 10–13 |
PbSеО4 |
1,4·10 –7 |
ZnC2O4 |
1,5·10 –9 |
23
Оглавление |
|
Введение .................................................................................................. |
3 |
1. Неорганические соединения в составе древесного комплекса |
.. 4 |
1.1. Классификация неорганических соединений ............................. |
6 |
1.2. Номенклатура неорганических соединений ................................. |
8 |
1.3. Графические формулы .................................................................... |
9 |
Задания к разделу 1 ...................................................................... |
11 |
2. Закон эквивалентов в химической технологии ............................. |
14 |
2.1. Основные понятия химии ............................................................ |
15 |
2.2. Расчет эквивалентной массы различных соединений ............... |
19 |
Задания к разделу 2........................................................................ |
21 |
3. Способы выражения концентраций растворов ........................... |
25 |
Задания к разделу 3......................................................................... |
30 |
4. Основы теории строения вещества ................................................ |
48 |
4.1. Строение вещества в комплексной химической переработке |
|
древесины ............................................................................................. |
48 |
4.2. Строение атомов. Периодическая система элементов .............. |
49 |
Задания к разделу 4......................................................................... |
56 |
5. Химическая связь.............................................................................. |
59 |
5.1. Основы метода молекулярных орбиталей (ММО) ................... |
62 |
5.2. Метод валентных связей (МВО) ................................................. |
66 |
Задания к разделу 5 ........................................................................ |
68 |
6. Растворы ............................................................................................ |
77 |
6.1. Роль процессов растворения при химической переработке |
|
древесины ............................................................................................. |
77 |
6.2. Процессы растворения .................................................................. |
77 |
6.3. Сильные электролиты ................................................................... |
83 |
Задания к подразделу 6.3................................................................ |
88 |
6.4. Слабые электролиты ..................................................................... |
90 |
Задания к подразделу 6.4 ............................................................... |
93 |
6.5. Ионное произведение воды .......................................................... |
96 |
Задания к подразделу 6.5................................................................ |
98 |
6.6. Произведение растворимости и его роль в процессе |
|
водоподготовки ................................................................................... |
101 |
Задания к подразделу 6.6 ............................................................. |
106 |
6.7. Гидролиз ....................................................................................... |
109 |
24 |
|
6.7.1. Равновесие в растворах солей, образованных катионами |
|
сильного основания и анионами слабой кислоты .......................... |
110 |
6.7.2. Равновесие в водных растворах солей, образованных |
|
катионами слабого основания и анионами сильной кислоты ...... |
114 |
6.7.3. Равновесие в водных растворах солей, образованных катио- |
|
нами слабых оснований и анионами слабых кислот .................... |
117 |
6.7.4. Взаимодействие растворов двух солей, взаимно усиливаю- |
|
щих гидролиз друг друга ................................................................... |
118 |
6.7.5. Буферные системы ................................................................... |
119 |
Задания к подразделу 6.7.......................................................... |
120 |
Варианты заданий к разделам 1–5 .................................................... |
125 |
Варианты заданий к разделу 6 .......................................................... |
126 |
Алфавитный указатель....................................................................... |
127 |
Список терминов ................................................................................ |
128 |
Библиографический список............................................................... |
134 |
П Р И Л О Ж Е Н И Я......................................................................................... |
135 |
Приложение 1. Классификация неорганических веществ ............ |
135 |
Приложение 2. Константы диссоциации некоторых |
|
электролитов ..................................................................................... |
136 |
Приложение 3. Традиционные и систематические названия |
|
некоторых кислот ............................................................................ |
140 |
Приложение 4. Относительные электроотрицательности |
|
некоторых элементов ...................................................................... |
141 |
Приложение 5. Типы гибридизации Лайнуса Полинга ................... |
142 |
Приложение 6. Произведение растворимости малорастворимых |
|
в воде соединений (при 25 С) .......................................................... |
147 |
25
