
himorgsoedinenii
.pdf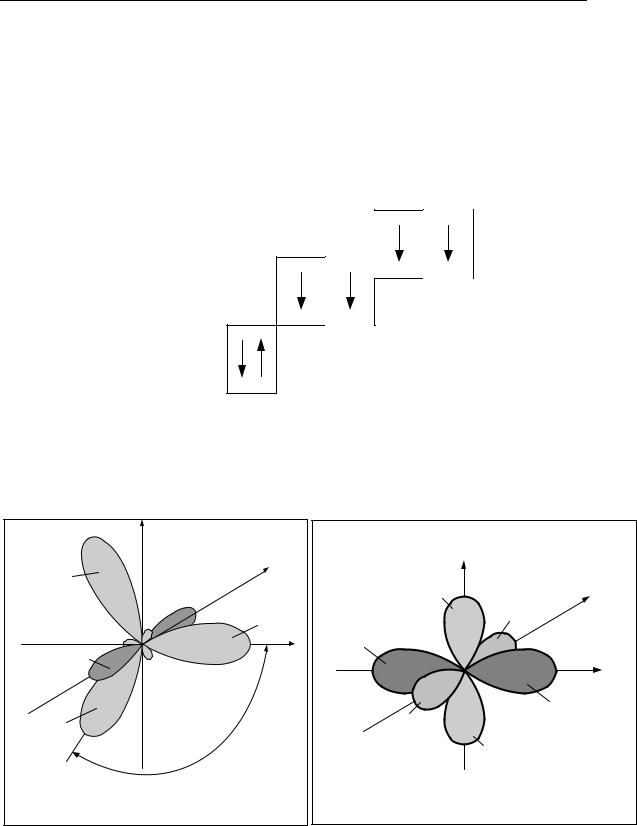
|
Глава 1. Природа химических связей в органических соединениях |
|
|||
При этом образуются три гибридные орбитали, расположенные в одной |
|
||||
плоскости под углом120° друг к другу(плоскость равностороннего |
|
||||
треугольника). Третья 2р-орбиталь, |
не |
принимающая |
участия |
в |
|
гибридизации, сохраняет свою прежнюю форму и располагается в |
|||||
плоскости, перпендикулярной плоскости гибридных орбиталей. Такое |
|
||||
состояние атома углерода называется вторым валентным состоянием |
|
||||
(рис. 2). |
|
|
|
|
|
sp-Гибридизация происходит при смешении одной2s- и одной 2р- |
|
||||
орбитали: |
|
|
|
|
|
|
|
2p |
|
|
|
|
sp |
|
|
|
|
|
1s |
|
|
|
|
При этом образуются две гибридные орбитали, расположенные на одной |
|||||
прямой линии. Остальные две 2р-орбитали, не участвующие в гибридиза- |
|||||
ции, располагаются во взаимно перпендикулярных плоскостях. При таком ти- |
|||||
пе гибридизации атом углерода находится в третьем валентном состоянии |
|||||
(рис. 3). |
|
|
|
|
|
|
Y |
|
Y |
|
|
|
Z |
|
|
|
|
sp2 |
|
|
|
|
|
|
|
2 py |
|
Z |
|
|
sp2 |
|
2 pz |
||
|
|
sp |
|
||
|
X |
|
|
|
|
2 pz |
|
|
|
X |
|
|
|
|
|
|
|
sp2 |
|
|
2 pz |
sp |
|
1200 |
|
|
|
||
|
|
2 py |
|
||
|
|
|
|
||
Рис. 2. Электронные орбитали атома углерода |
Рис. 3. Электронные орбитали атома углерода |
||||
во втором валентном состоянии |
|
в третьем валентном состоянии |
|
||
|
11 |
|
|
|
|

Раздел 1. Теоретические основы органической химии
§ 3. Типы химической связи в органических соединениях
Наиболее распространенным типом химической связи в органических соединениях является ковалентная связь. Она образуется за счет перекрывания орбиталей двух атомов с образованием общей электрон-
ной пары. Ковалентная связь может быть простой (одинарной), двойной и тройной.
Простая (одинарная) или σ(сигма)-связь – связь между атомами, осуществляемая одной парой электронов, максимальная плотность которых расположена на линии, соединяющей центры этих атомов.
Такая связь может быть образована при перекрывании орбиталей как s-, так и 2р-электронов, а также электронов орбиталей, находящихся в состоянии sp3-, sp2- и sр-гибридизации.
Кратная химическая связь – это связь, образованная обобществлением двух или трех электронных пар.
Кратная связь может быть двойной (в случае двух пар электронов) или тройной (с участием трех пар электронов). Кратные связи состоят из одной σ-связи и одной или двух π-связей. В этом случае σ-связь образуется в результате перекрыванияsр2-гибридных орбиталей, а π-связь негибридизованных 2р-орбиталей. Электроны,
принимающие участие в образовании π-связи, называют -π электронами.
Молекула с ковалентной связью может быть неполярной, если связанные этой связью атомы имеют одинаковую электроотрицательность (например, в случае молекулы водорода). Если же один из атомов обладает большим сродством к электрону и по этой причине электронная плотность смещена в его сторону, то такая моле-
кула или связь будет полярной. Так, в формуле СН3δ+Сlδ- знаки δ+ и δ- означают, что на атоме хлора имеется избыточная электронная плотность (частичный отрицательный заряд), а на атоме углерода – их дефицит (частичный положительный заряд). Смещение электронной плотности можно показать стрелкой: СН3 → С1. Чем больше разница в электроотрицательности атомов, связанных ковалентной связью, тем более полярна молекула (или связь). Практически все ковалентные связи полярны(за исключением симметричных молекул).
Полярность является важной характеристикой химических связей, во многом определяя физические и химические свойства и по-
12

Глава 1. Природа химических связей в органических соединениях
ведение органических соединений. От наличия того или иного заряда на атоме зависит его реакционная способность.
В ряде органических соединений присутствуютсемиполярные (от англ. semi – «наполовину»), или ковалентно-координационные связи.
Такие связи совмещают в себе свойства ковалентных и ионных связей. Графически их обозначают стрелкой, указывающей направление смещения электронов. Примером такой связи является одна из связей N-O в
O
R N
нитрогруппе: O .
Эта структура показывает, что связи атома азота с двумя атомами кислорода неравноценны. Одна из них является типичной двойной ковалентной связью. Во второй, кроме пары валентных электронов, образующих ковалентную связь, имеют место разноименные заряды на атомах азота и кислорода. Таким образом, связь N-O в нитрогруппе является и ковалентной, и ионной.
Водородная связь возникает между атомами, имеющими свободную электронную пару (кислород, азот, сера и др.), и водородом, который связан с другим атомом высокополярной ковалентной связью. В этом случае водород обладает довольно высокой протонной подвижностью, в результате чего возникает связь особого типа. Возникновение такой
связи между молекулами этилового спирта можно изобразить в виде схемы:
О-Н |
О-Н |
О-Н |
С2Н5 |
С2Н5 |
С2Н5 |
Водородные связи гораздо менее прочны, чем обычные ковалентные; их энергия составляет всего12,5–21 кДж/моль. Также их влияние сильно отражается на химических и физических свойствах веществ. Водородная связь играет огромную роль в живой природе, в процессах крашения, в приготовлении некоторых полимерных материалов, во многих системах, используемых в качестве строительных растворов и вяжущих материалов.
§ 4. Типы разрыва ковалентных связей
Напомним, что ковалентная связь образована парой«валентных» электронов. При протекании химической реакции происходит разрыв ко-
13
Раздел 1. Теоретические основы органической химии
валентной связи в реагирующих молекулах. При этом образуются промежуточные частицы – интермедиаты. Такие частицы, как правило, неустойчивы и быстро вступают в дальнейшие реакции. Различают гетеро- и
гомолитические виды разрыва связи.
Гетеролитический разрыв связей возникает при полном смеще-
нии электронного облака в молекуле в сторону одного из атомов. Химическая связь может разрываться по двум направлениям:
A  В
В  А++
А++ В-
В-
A В
В  А-+ В+
А-+ В+
При |
этом |
происходит |
образованиеорганических ионов – активных |
|
||
заряженных частиц. Время жизни таких ионов незначительно. Однако |
|
|||||
их роль в органической химии велика, так как многие реакции протека- |
|
|||||
ют с их участием. К гетеролитическому разрыву склонны сильно по- |
|
|||||
лярные и легкополяризуемые связи. Разрыву способствуют раствори- |
|
|||||
тели |
с |
высокой |
диэлектрической |
проницаемостью |
и |
большой |
полярностью.
При гетеролитическом разрыве ковалентной связи для атома -уг лерода возможно образование карбаниона и карбкатиона (иона карбония).
Карбкатионы – интермедиаты, в которых атом углерода имеет три ковалентные связи и положительный заряд R3C+ . Они обра-
зуются в том случае, если электронная пара смещается от атома углерода. При этом углеродный атом теряет электрон:
-е-
|
|
|
С* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С+ |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
1s2 2s1 2р3 |
|
|
|
|
|
1s2 2s1 2р2 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
карбкатион
Такой разрыв реализуется в молекулах, в которых присутствуют более электроотрицательные атомы или группы, чем углерод:
14

Глава 1. Природа химических связей в органических соединениях
|
|
|
|
|
С+ + Сl- |
|
|
|
|
|
|
С Сl |
|
|
|
||
|
|
|
|||
Карбанионы – интермедиаты, в которых атом углерода имеет три ковалентные связи и отрицательный заряд за счет наличия неподеленной электронной пары. Такие частицы образуются при смещении электронной пары к атому углерода, при этом атом углерода принимает электрон:
|
|
|
|
|
|
|
|
|
|
+е- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
С* |
|
|
|
|
|
С- |
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
1s2 2s1 2р3 |
|
|
|
|
1s2 2s2 2р3 |
||||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
карбанион |
|||||
Это реализуется в молекулах, содержащих атомы или заместители менее электроотрицательные, чем углерод:
С Н |
С- + Н+ |
|
карбанион |
Присоединение к углеродному атому или отрыв от него двух или более электронов связаны с очень большой затратой энергии, поэтому получение высокозарядных углеродных ионов– маловероятный процесс.
Гомолитический разрыв ковалентной связи заключается в разъеди-
нении связующей электронной пары. При таком разрыве связи образу-
ются свободные радикалы:
A В |
hν |
А + В |
|
Свободные радикалы – электронейтральные частицы, в которых атом углерода трехвалентнен и имеет один неспаренный элек-
трон (не путать с понятием радикала как мысленно выделяемого фрагмента молекулы).
Радикальному разрыву подвергаются обычно неполярные или малополярные связи (С–С, N–N, C–N) при высокой температуре, под дей-
15

Раздел 1. Теоретические основы органической химии
ствием ультрафиолетового света или радиоактивного излучения. Образовавшиеся при гомолитическом разрыве связи радикалы и свободные атомы неустойчивы и способны существовать лишь непродолжительное время. Эти промежуточные частицы подвергаются дальнейшим -пре вращениям, переходя в устойчивые конечные продукты. Так, например, радикал метил CH3 может стабилизироваться путемдимеризации: •СН3 +•СН3 ® Н3С:С3Н
ГЛАВА 2. ТЕОРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
§5. Классификация органических соединений
Внастоящее время известно огромное число органических соединений. Для сведения их в компактную и легкую для понимания систему необходимо провести классификацию. За основу классификации органических соединений берут различные признаки.
1. Классификация по природе углеводородного скелета.
Основу любого органического вещества составляет последовательность химически связанных атомов углерода– его углеродный скелет. Различают следующие типы углеродного скелета:
а) ациклический – углеродные цепи неразветвленные (нормальные)
(I)и разветвленные (II), содержащие одинарные и кратные(двойные, тройные) связи:
С
С-С-С-С-С |
С-С-С-С-С-С |
С=С-С |
С º С-С |
|
|
|
|
|
|
I |
С |
III |
IV |
|
|
II |
|||
б) карбоциклический – циклические углеродные цепи, содержащие насыщенные (V – VI) и сопряженные связи (ароматические, VII):
|
С |
|
С |
|
|
|
|
|
С |
||
|
|
|
С |
С |
С |
С |
|||||
С |
|
С |
|
|
|
|
|
|
|
|
|
|
С |
С |
|||||||||
|
С |
С |
|||||||||
|
|||||||||||
|
|
|
|
С |
|
|
|
|
|
С |
|
|
V |
|
VI |
|
|
|
|
|
VII |
||
в) гетероциклический – циклические цепи, содержащие углеродные и другие атомы – O, N, S (VIII и IX):
16
Глава 2. Теория органических соединений
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
VIII |
|
|
|
|
|
|
|
|
IX |
|
|
|
|
|
|
||
|
Органические вещества с углеродными цепями типа I и II называют |
|
||||||||||||||||||||||
соединениями жирного ряда, ациклическими или алифатическими. Со- |
|
|||||||||||||||||||||||
единения с углеродными циклами, изображенными формулами V и VI, |
|
|||||||||||||||||||||||
называют алициклическими. |
Схемой VII изображен углеродный скелет |
|
||||||||||||||||||||||
бензола – важнейшего представителя ароматических соединений. Фор- |
|
|||||||||||||||||||||||
мулы VIII и IX показывают, что в |
составгетероциклического |
кольца |
|
|||||||||||||||||||||
входят атомы не только углерода, но и других элементов – гетероатомы |
|
|||||||||||||||||||||||
(от греч. «гетерос» – разный). Здесь название «углеродный скелет» ус- |
|
|||||||||||||||||||||||
ловно, так как в него входят не только атомы углерода. Все эти схемы |
|
|||||||||||||||||||||||
показывают последовательность химической связи атомов, но не пере- |
|
|||||||||||||||||||||||
дают их пространственного расположения. Так, неразветвленная угле- |
|
|||||||||||||||||||||||
родная цепь на самом деле имеет зигзагообразную форму и может быть |
|
|||||||||||||||||||||||
по-разному изогнута в пространстве. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
2. Классификация по природе функциональной группы. |
|
|
|
|
|
|
|||||||||||||||||
|
«Органическая |
химия |
есть химия углеводородов и их производ- |
|
||||||||||||||||||||
ных» – говорил К. Шорлеммер еще в ХIХ веке. При этом под производ- |
|
|||||||||||||||||||||||
ными он имел в виду вещества, получаемые при введении функцио- |
|
|||||||||||||||||||||||
нальных |
групп |
в |
|
молекулы |
|
углеводородов. Таким |
образом, |
|
||||||||||||||||
органические соединения по вышеуказанному признаку могут делиться |
|
|||||||||||||||||||||||
на углеводороды и их производные. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
Углеводороды – органические соединения, в молекулы которых |
|
||||||||||||||||||||||
входят атомы лишь двух элементов: углерода и водорода. Их клас- |
|
|||||||||||||||||||||||
сификацию |
|
|
|
|
можно |
|
|
|
представить |
следующим: |
об |
|||||||||||||
|
|
|
|
|
|
|
|
|
углеводороды |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
алифатические |
|
|
|
|
|
|
|
|
циклические |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
насыщенные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
ненасыщенные |
|
|
насыщенные |
|
ароматические |
|
|||||||||||||||
|
|
(предельные) |
|
(непредельные) |
|
|
(предельные) |
|
(арены) Сn H2n-6 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
алканы Сn H2n+2 |
|
алкены Сn H2n |
|
алкины Сn H2n-2 |
|
|
циклоалканы Сn H2n |
|
|
|
|
||||||||||||
В большинстве органических молекул, помимо углерода и водорода, содержатся атомы других элементов. Именно от них в первую оче-
17

Раздел 1. Теоретические основы органической химии
редь зависят химические свойства органических веществ. Эти атомы (кислород, азот, сера и др.) входят в состав особых группировок, называемых функциональными группами. Присутствие той или иной функциональной группы, связанной с радикалом (углеводородный остаток), определяет принадлежность органических соединений к определенным классам. Общее число известных в настоящее время функциональных групп весьма велико и даже в больших курсах органической химии рассматривается лишь часть их. Основные функциональные группы и отвечающие им классы органических соединений приведены в табл. 1.
Таблица 1
Функциональные группы и классы органических соединений
Функциональные |
Класс соединений |
Типичные представители |
||||
группы |
|
название |
формула |
|||
|
|
|
|
|
|
|
Галогены -F, -Cl, |
Галогенопроизвод- |
Йодметан |
CH3-I |
|||
-Br, -I |
ные |
|
|
|
|
|
Гидроксил -ОН |
Спирты |
Метанол |
CH3-OH |
|||
|
Фенолы |
Фенол |
C6H5-OH |
|||
Карбонил >C=O |
Альдегиды |
Этаналь |
|
|
|
О |
|
|
|
СН3 |
|
|
С |
|
Кетоны |
Диметилкетон |
|
|
|
Н |
|
Н3С |
|
|
СН3 |
||
|
|
|
|
С |
||
|
|
|
|
|
|
|
|
|
|
|
О |
||
Карбоксил |
Карбоновые кисло- |
Уксусная кисло- |
|
|
|
О |
-CООН |
ты |
та |
СН3 |
|
С |
|
|
|
|
|
|
|
ОН |
|
|
|
|
|||
Нитрогруппа |
Нитросоединения |
Нитробензол |
С6Н5-NO2 |
|||
-NO2 |
|
|
|
|
|
|
Аминогруппа |
Амины |
Этиламин |
С2Н5-NH2 |
|||
-NH2 |
|
|
|
|
|
|
Диазогруппа |
Диазосоединения |
Хлористый бен- |
С6Н5-N2Cl |
|||
-N2X |
|
зилдиазоний |
|
|
|
|
Меркаптогруппа |
Тиолы (меркаптаны, |
Метантиол |
CH3-SH |
|||
-SH |
тиоспирты) |
|
|
|
|
|
Сульфогруппа |
Сульфокислоты |
Бензолсульфо- |
С6Н5-SO3H |
|||
-SO3H |
|
кислота |
|
|
|
|
Металлы |
Металлоорганиче- |
Метиллитий |
CH3-Li |
|||
|
ские соединения |
|
|
|
|
|
18

Глава 2. Теория органических соединений
Полифункциональными называют соединения, содержащие несколько одинаковых функциональных групп.
Гетерофункциональными называют органические соединения, характеризующиеся присутствием в молекуле нескольких различных функциональных групп.
В основу данного пособия положен принцип разделения органических соединений на углеводороды и их производные.
Для каждого класса органических соединений характерно существование гомологического ряда. Такие ряды являются подтверждением основного закона природы – перехода количественных изменений в качественные.
Гомологическим рядом (от греч. homos – «последовательный»)
называют ряд соединений с близкими химическими и закономерно изменяющимися физическими свойствами, в котором каждый член отличается от предыдущего на одну группу СН2.
Понятие гомологии, введенное в органическую химию, часто позволяет сделать выводы о химических свойствах отдельных соединений с однотипной структурой, зная общие свойства гомологического ряда в целом. Такая систематизация органических соединений облегчает изучение органической химии. Достаточно изучить свойства типичного представителя ряда, чтобы иметь понятие о свойствах ряда в целом. Гомологические ряды соединений, рассматриваемых в данном пособии, будут приводиться в соответствующих параграфах.
|
§ 6. Изомерия |
При исследовании |
неорганических соединений молекулярная |
формула чаще всего служит «визитной карточкой» соединения и отра- |
|
жает состав только этого вещества. Так, формула |
|
H2SO4, |
несомненно, является формулой серной |
кислоты, NaHCO3 – бикарбоната натрия. В органической химии одну и ту же молекулярную формулу могут иметь разные вещества из-за -яв ления изомерии.
Изомерия была открыта в1823 г. Ю. Либихом, показавшим, что серебряная соль гремучей кислоты Ag-О-N=C и изоцианат серебраAg- N=C=O имеют один и тот же состав, но совершенно разные свойства. Термин «изомерия» предло-
жен в 1830 г. И. Берцелиусом. Объяснить же явление изомерии стало
19

Раздел 1. Теоретические основы органической химии
возможным лишь после создания теории химического строения А.М. Бутлерова.
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся последовательностью соединения атомов или расположением их в пространстве и вследствие этого по химическими и физическим свойствам.
Изомеры – вещества, имеющие одинаковый состав и молекулярную массу, но различное химическое строение.
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга последовательностью связей между атомами в молекуле. Пространственные (стереоизомеры) изомеры отличаются друг от друга пространственным расположением атомов в молекуле.
Структурную изомерию подразделяют на:
1)изомерию углеродного скелета;
2)изомерию функциональной группы;
3)изомерию положения кратной связи или функциональной группы.
Изомерия углеродного скелета обусловлена различным порядком
связи между атомами углерода, образующими скелет молекулы. Так, может существовать только один алифатический насыщенный углеводород с тремя атомами углерода – пропан. Углеводородов такого же типа с четырьмя атомами С может быть уже два: н-бутан и изобутан, с тремя атомами – три: н-пентан, изопентан и неопентан:
СН3 |
|
|
СН2 |
|
|
СН2 |
|
|
СН3 |
|
СН3 |
СН3 |
|
СН3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|||||||||||
|
СН |
|
СН3 |
|
С |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
н-бутан |
|
|
|
изобутан |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
неопентан |
||||||
СН3 |
|
|
СН2 |
|
|
СН2 |
|
СН2 |
|
СН3 |
|
|
СН3 |
|
СН |
|
|
СН2 |
|
|
СН3 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
н-пентан
СН3
изопентан
Для углеводорода C20H42 возможно 366 319 изомеров.
Изомерия функциональной группы обусловлена различием состава функциональной группы, определяющей химические свойства данного класса соединений. Так, формула С2Н6О может соответствовать двум
20
