
- •1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •1.1.Основные понятия и определения
- •1.1.1.Термодинамическая система
- •1.1.2.Термодинамический процесс
- •1.1.3.Термодинамические функции состояния
- •1.2.Тепловые эффекты физико-химических процессов
- •1.2.2.Первое начало термодинамики
- •1.2.3.Тепловой эффект химической реакции
- •1.2.4.Термохимические расчеты
- •1.2.5.Зависимость теплового эффекта реакции от температуры
- •1.3. Направление и пределы протекания химического процесса
- •1.3.1.Второе начало термодинамики
- •1.3.2.Энтропия
- •1.3.3.Направление химического процесса
- •1.3.4. Химический потенциал
- •2. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •2.1. Механизм химической реакции
- •2.1.1.Частицы, участвующие в химической реакции
- •2.1.2.Классификация химических реакций
- •2.2. Элементарная химическая реакция
- •2.2.1.Скорость химической реакции
- •2.2.2.Зависимость скорости химической реакции от концентрации реагирующих веществ
- •2.2.3. Константа скорости химической реакции
- •2.3.Формальная кинетика гомогенных реакций
- •2.3.1.Кинетическое уравнение необратимой реакции первого порядка
- •2.3.2. Кинетическое уравнение необратимой реакции второго порядка
- •2.3.3.Реакции нулевого и высших порядков
- •2.3.4. Зависимость скорости реакции от температуры
- •2.3.5.Определение кинетических параметров реакции
- •2.3.6.Кинетическое уравнение обратимой реакции первого порядка
- •2.4.Цепной механизм химической реакции
- •2.5.Индуцированные реакции
- •2.5.1. Фотохимические реакции
- •2.5.2.Радиационно–химические процессы
- •2.6.Макрокинетика
- •2.6.1.Гетерогенные реакции
- •2.6.2.Горение и взрыв
- •2.7.Катализ
- •2.7.1.Гомогенный катализ
- •2.7.2.Гетерогенный катализ
- •3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3.1.Термодинамическое условие химического равновесия
- •3.1.1. Изобара реакции
- •3.1.2. Изотерма реакции
- •3.3. Расчет равновесного состава газовой смеси
- •3.4. Равновесия в растворах
- •3.4.1.Растворы
- •3.4.2. Электролитическая диссоциация
- •3.4.3.Ионное произведение воды. Водородный показатель
- •3.4.4.Растворы кислот и оснований
- •3.4.5.Буферные растворы
- •3.4.6. Гидролиз солей
- •3.4.7.Обменные реакции с образованием осадка
- •3.5. Фазовые равновесия
- •3.5.1. Правило фаз Гиббса
- •3.5.2.Диаграмма состояния однокомпонентной системы
- •3.5.3. Диаграмма состояния двухкомпонентной системы
- •3.5.4. Кипение и кристаллизация растворов
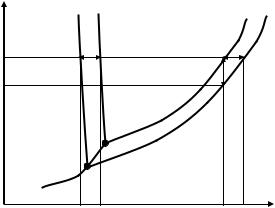
растворенного вещества p=f(T,СА). Температуры плавления и кипения растворов будут зависеть от давления и концентрации T=f(р,СА).
В этом случае состояние равновесия двухкомпонентной системы будет определяться тремя независимыми параметрами: температурой, давлением и концентрацией растворенного вещества. Фазовая диаграмма раствора будет трехмерной. На плоскости ее построение возможно для конкретного раствора с концентрацией С (рис. 3.4).
Рассмотрим двухфазное равновесие "твердая фаза газ". При кристаллизации водного раствора обычно растворенное вещество выделяется в отдельную фазу. Число фаз в системе становится равным Ф=3. Поскольку число компонентов К=2, то число степеней свободы С = 2 + 2 – 3 = 1. Система в этом состоянии равновесия остается моновариантной. Давление насыщенного пара растворителя зависит только от температуры p=f(T). На диаграмме состояния линия 3 сохраняет свое положение (рис. 3.4).
р, Па |
Л 2′ Л 2 |
Л 1 Л 1′ |
1,0133 105
Тпл |
Ткип |
|
р |
0
Л 3 |
0′ |
Т, К
Рис. 3.4. Диаграммы состояния воды и водного раствора концентрации С (без строгого соблюдения масштаба)
В случае трехфазного равновесия «твердое состояние жидкость газ» число степеней свободы С = 2 + 2 – 3 = 1 (Ф=3, К=2). Система моновариантна, точка трехфазного равновесия будет находиться на линии 3. В отличие от однокомпонентной системы, ее координаты будут зависеть от концентрации растворенного вещества. Так, для раствора концентрации С это будет точка 0′ (рис. 3.4).
3.5.4. Кипение и кристаллизация растворов
Кипение жидкости наступает, когда давление насыщенных паров становится равным внешнему давлению. Растворенное вещество понижает
111

давление насыщенного пара растворителя над раствором. Это приводит к повышению температуры кипения раствора по сравнению с чистым растворителем. Величина изменения температуры кипения зависит только от концентрации частиц растворенного вещества, и не зависит от их природы. На диаграмме состояния (рис.3.4) для раствора концентрации С пони-
жению давления насыщенных |
паров на величину р соответствует |
повышение температуры кипения |
Ткип при р0 = 1,013 105 Па. |
Повышение температуры кипения раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества:
Ткип = Kэб См,
где Ткип – повышение температуры кипения раствора по сравнению с чистым растворителем; См – моляльная концентрация растворенного вещества (число молей растворенного вещества, содержащихся в 1 кг растворителя); Kэб – эбуллиоскопическая постоянная растворителя. Она характеризует растворитель и не зависит от природы растворенного вещества. Эбуллиоскопическую постоянную растворителя можно вычислить, зная его температуру кипения (Tкип, К) и энтальпию парообразования ( vH, Дж/кг):
Kэб = R (Tкип)2 M , 1000 v H
R – универсальная газовая постоянная; М – молярная масса растворителя. Кристаллизация раствора происходит при температуре более низкой, чем температура кристаллизации чистого растворителя. Это вызвано взаимодействием частиц растворенного вещества с молекулами растворителя, которое препятствует образованию кристаллической структуры. На диаграмме состояния (см. рис.3.4) понижение температуры кристаллизации Ткр соответствует расстоянию между кривыми 2′ и 2, измеренному
по изобаре р0 = 1,013 105 Па.
Понижение температуры кристаллизации раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества:
Ткр = Kкр См,
где Ткр – понижение температуры кристаллизации раствора по сравнению с чистым растворителем; Kкр – криоскопическая постоянная растворителя. Она характеризует растворитель и не зависит от природы растворенного вещества.
Криоскопическую постоянную растворителя можно вычислить, зная температуру кристаллизации растворителя (Tкр, К) и энтальпию плавления( mH, Дж/кг):
112

Kкр = R (Tкр)2 M . 1000 mH
Эбуллиоскопические и криоскопические постоянные некоторых растворителей:
Растворитель |
Ткип |
Kэб |
Ткр |
Kкр |
|
°С |
К кг/моль |
°С |
К кг/моль |
Вода H2O |
100 |
0,51 |
0 |
1,86 |
Ацетон (CH3)2CO |
56,3 |
1,71 |
-95 |
2,40 |
Бензол C6H6 |
80,1 |
2,53 |
5,53 |
5,12 |
Четыреххлористый углерод |
76,7 |
4,95 |
-23 |
30 |
CCl4 |
|
|
|
|
Свойства растворов, зависящие от числа частиц растворенного вещества, а не от их химической природы, в частности повышение температуры кипения и понижение температуры кристаллизации, получили название
коллигативных свойств.
В растворе электролита за счет диссоциации увеличивается число частиц по сравнению с раствором неэлектролита той же концентрации. Это должно отразиться на коллигативных свойствах растворов электролитов. Следовательно, повышение температуры кипения и понижение температуры кристаллизации растворов будет зависеть не только от концентрации, но и от степени диссоциации растворенного вещества. Кроме того, при диссоциации молекулы в зависимости от ее химического состава образуется различное количество ионов. Увеличение числа частиц в растворе электролита характеризует изотонический коэффициент (i).
Если при растворении вещества KatxAny устанавливается динамическое равновесие: KatxAny x Kat+ + y An-, то изотонический коэффициент равен отношению суммарного числа частиц (ионов и недиссоциированных молекул) в растворе к числу растворенных молекул:
i = |
∑(N |
Kat |
+ + N |
An |
− + NKat |
x |
An |
y |
) |
, |
|
|
|
N0 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
где N0 – число молекул растворенного вещества; Σ(Ni) – суммарное число катионов, анионов и недиссоциированных молекул растворенного вещества.
Если степень диссоциации вещества равна α, то с учетом уравнения диссоциации изотонический коэффициент
i = x α N0 + y α N0 +(N0 −α N0 ) = α m +1−α,
N0
i = α(m –1)+1,
где x – число катионов, y – число анионов, m = x + y – суммарное число частиц, образующихся в результате единичного акта диссоциации.
113
В случае сильного электролита (α→1) все растворенные молекулы распадаются на ионы и изотонический коэффициент равен i = m.
Пример. |
|
NaCl → Na+ + Cl- |
i = m = 1+1 =2, |
K2SO4 → 2 K+ + SO4-2 |
i = m = 2+1 =3. |
В соответствии с изотоническим коэффициентом в i раз возрастают эффекты повышения температуры кипения и понижения температуры кристаллизации, а также величины относительного понижения давления насыщенных паров растворителя:
Ткип = i Kэб См , |
Ткр = i Kкр См , |
p = i X A . |
|
|
p0 |
Библиографический список
1.М.Х. Карапетьянц Химическая термодинамика. М.: Химия, 1975. 584 с.
2.Пригожин И., Кондепуди Д. Современная термодинамика. М.: Мир, 2002. 461с.
3.Эмануэль Н.М., Кнорре Д.Г. Курс химической кинетики. М.: Высшая школа, 1984. 463 с.
4.Денисов Е.Т. Кинетика гомогенных химических реакций. М.: Высшая школа, 1988. 391 с.
5.Горбунов А.И., Гуров А.А., Филиппов Г.Г., Шаповал В.Н. Теоретические основы общей химии. М.: МГТУ им. Н.Э. Баумана, 2001. 720 с.
6.Хаускрофт К., Констебл Э. Современный курс общей химии. М.: Мир, 2002. Т.1,2.
7.Слесарев В.И. Химия – основы химии живого. СПб.: Химиздат, 2000. 767 с.
8.Физическая химия / Под ред. К.С. Краснова. М.: Высшая школа, 2001. Кн.1 – 512 с.,
Кн. 2 – 319 с.
9.Стремберг А.Г., Семченко Д.П. Физическая химия. М.: Высшая школа, 2001. 527 с.
10.Кнорре Д.Г., Крылова Л.Ф., Музыкантов В.С. Физическая химия. М.: Высшая школа, 1990. 416с.
11.Пикаев А.К. Современная радиационная химия: В 3 т. М.: Наука, 1985.
12.Франк–Каменецкий Д.А. Диффузия и теплопередача в химической кинетике. М.:
Наука, 1987. 491 с.
13.Челышев В.П., Шехтер Б.И., Шушко Л.А. Теория горения и взрыва. М.: МО СССР, 1970. 521 с.
14.Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.М. Пономаревой. Л.: Химия, 1983. 232 с.
15.Общая химия / Под ред. Е.М. Соколовой, Г.Д. Вовченко, Л.С. Гузея. М.: Изд-во Моск.
ун-та, 1980, 726 с.
114
Оглавление |
|
Введение...................................................................................................................................... |
3 |
1.Химическая термодинамика............................................................................................... |
3 |
1.1.Основные понятия и определения.................................................................................. |
4 |
1.1.1.Термодинамическая система.................................................................................... |
4 |
1.1.2.Термодинамический процесс..................................................................................... |
6 |
1.1.3.Термодинамические функции состояния............................................................... |
10 |
1.2.Тепловые эффекты физико-химических процессов.................................................... |
10 |
1.2.1.Внутренняя энергия................................................................................................. |
10 |
1.2.2.Первое начало термодинамики.............................................................................. |
12 |
1.2.3.Тепловой эффект химической реакции.................................................................. |
14 |
1.2.4.Термохимические расчеты..................................................................................... |
16 |
1.2.5.Зависимость теплового эффекта реакции от температуры........................... |
19 |
1.3.Направление и пределы протекания химического процесса..................................... |
21 |
1.3.1.Второе начало термодинамики............................................................................. |
22 |
1.3.2.Энтропия.................................................................................................................. |
23 |
1.3.3.Направление химического процесса....................................................................... |
27 |
1.3.4.Химический потенциал............................................................................................ |
31 |
2.Кинетика химических реакций........................................................................................ |
34 |
2.1.Механизм химической реакции.................................................................................... |
35 |
2.1.1.Частицы, участвующие в химической реакции.................................................... |
35 |
2.1.2.Классификация химических реакций...................................................................... |
38 |
2.2.Элементарная химическая реакция.............................................................................. |
40 |
2.2.1.Скорость химической реакции............................................................................... |
41 |
2.2.2.Зависимость скорости химической реакции от концентрации |
|
реагирующих веществ...................................................................................................... |
42 |
2.2.3.Константа скорости химической реакции........................................................... |
45 |
2.3.Формальная кинетика гомогенных реакций................................................................ |
53 |
2.3.1.Кинетическое уравнение необратимой реакции первого порядка..................... |
54 |
2.3.2.Кинетическое уравнение необратимой реакции второго порядка.................... |
56 |
2.3.3.Реакции нулевого и высших порядков.................................................................... |
57 |
2.3.4.Зависимость скорости реакции от температуры.............................................. |
57 |
2.3.5.Определение кинетических параметров реакции................................................. |
59 |
2.3.6.Кинетическое уравнение обратимой реакции первого порядка......................... |
61 |
2.4.Цепной механизм химической реакции....................................................................... |
63 |
2.5.Индуцированные реакции............................................................................................. |
65 |
2.5.1.Фотохимические реакции....................................................................................... |
65 |
2.5.2.Радиационно-химические процессы....................................................................... |
67 |
2.6.Макрокинетика............................................................................................................... |
70 |
2.6.1.Гетерогенные реакции............................................................................................ |
71 |
2.6.2.Горение и взрыв........................................................................................................ |
74 |
2.7.Катализ............................................................................................................................ |
76 |
2.7.1.Гомогенный катализ............................................................................................... |
77 |
2.7.2.Гетерогенный катализ............................................................................................ |
77 |
3.Химическое равновесие..................................................................................................... |
78 |
3.1.Термодинамическое условие химического равновесия.............................................. |
78 |
3.1.1.Изобара реакции....................................................................................................... |
80 |
3.1.2.Изотерма реакции................................................................................................... |
81 |
3.2.Кинетическое условие химического равновесия. Константа равновесия................ |
83 |
3.3.Расчет равновесного состава газовой смеси................................................................ |
88 |
3.4.Равновесия в растворах.................................................................................................. |
93 |
3.4.1.Растворы.................................................................................................................. |
93 |
115
3.4.2.Электролитическая диссоциация.......................................................................... |
96 |
3.4.3.Ионное произведение воды. Водородный показатель....................................... |
100 |
3.4.4.Растворы кислот и оснований............................................................................. |
100 |
3.4.5.Буферные растворы.............................................................................................. |
101 |
3.4.6.Гидролиз солей........................................................................................................ |
103 |
3.4.7.Обменные реакции с образованием осадка......................................................... |
105 |
3.5.Фазовые равновесия..................................................................................................... |
106 |
3.5.1.Правило фаз Гиббса............................................................................................... |
106 |
3.5.2.Диаграмма состояния однокомпонентной системы......................................... |
107 |
3.5.3.Диаграмма состояния двухкомпонентной системы......................................... |
109 |
3.5.4.Кипение и кристаллизация растворов................................................................. |
111 |
Библиографический список.................................................................................................... |
114 |
Киселев Алексей Петрович, Крашенинников Александр Алексеевич
Основы общей химии Часть 2
Термодинамика и кинетика химического процесса
Редактор Г.М.Звягина
Корректор Л.А.Петрова Подписано в печать 28.10.2003. Формат бумаги 60х84/16. Бумага документная.
Печать трафаретная. Усл.печ. л. 7,25. Уч-изд. л. 8,25. Тираж 350 экз. Заказ № Балтийский государственный технический университет
Типография БГТУ 190005, С-Петербург, 1-я Красноармейская ул., д.1
116
