
- •1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •1.1.Основные понятия и определения
- •1.1.1.Термодинамическая система
- •1.1.2.Термодинамический процесс
- •1.1.3.Термодинамические функции состояния
- •1.2.Тепловые эффекты физико-химических процессов
- •1.2.2.Первое начало термодинамики
- •1.2.3.Тепловой эффект химической реакции
- •1.2.4.Термохимические расчеты
- •1.2.5.Зависимость теплового эффекта реакции от температуры
- •1.3. Направление и пределы протекания химического процесса
- •1.3.1.Второе начало термодинамики
- •1.3.2.Энтропия
- •1.3.3.Направление химического процесса
- •1.3.4. Химический потенциал
- •2. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •2.1. Механизм химической реакции
- •2.1.1.Частицы, участвующие в химической реакции
- •2.1.2.Классификация химических реакций
- •2.2. Элементарная химическая реакция
- •2.2.1.Скорость химической реакции
- •2.2.2.Зависимость скорости химической реакции от концентрации реагирующих веществ
- •2.2.3. Константа скорости химической реакции
- •2.3.Формальная кинетика гомогенных реакций
- •2.3.1.Кинетическое уравнение необратимой реакции первого порядка
- •2.3.2. Кинетическое уравнение необратимой реакции второго порядка
- •2.3.3.Реакции нулевого и высших порядков
- •2.3.4. Зависимость скорости реакции от температуры
- •2.3.5.Определение кинетических параметров реакции
- •2.3.6.Кинетическое уравнение обратимой реакции первого порядка
- •2.4.Цепной механизм химической реакции
- •2.5.Индуцированные реакции
- •2.5.1. Фотохимические реакции
- •2.5.2.Радиационно–химические процессы
- •2.6.Макрокинетика
- •2.6.1.Гетерогенные реакции
- •2.6.2.Горение и взрыв
- •2.7.Катализ
- •2.7.1.Гомогенный катализ
- •2.7.2.Гетерогенный катализ
- •3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3.1.Термодинамическое условие химического равновесия
- •3.1.1. Изобара реакции
- •3.1.2. Изотерма реакции
- •3.3. Расчет равновесного состава газовой смеси
- •3.4. Равновесия в растворах
- •3.4.1.Растворы
- •3.4.2. Электролитическая диссоциация
- •3.4.3.Ионное произведение воды. Водородный показатель
- •3.4.4.Растворы кислот и оснований
- •3.4.5.Буферные растворы
- •3.4.6. Гидролиз солей
- •3.4.7.Обменные реакции с образованием осадка
- •3.5. Фазовые равновесия
- •3.5.1. Правило фаз Гиббса
- •3.5.2.Диаграмма состояния однокомпонентной системы
- •3.5.3. Диаграмма состояния двухкомпонентной системы
- •3.5.4. Кипение и кристаллизация растворов
Если экспериментальные точки в соответствующих координатах не ложатся на прямую линию в пределах ошибки измерений, то порядок реакции не равен 0,1,2 и должен определяться другим способом.
Энергия активации химической реакции определяется из экспериментальной зависимости константы скорости (скорости реакции) от темпера-
туры. Поскольку ln k = ln k0 − |
Eак |
|
1 |
, то очевидно, что в координатах |
|
T |
|||
|
R |
|
||
lnk–1/T зависимость константы скорости от температуры представляет собой прямую линию. Тангенс угла наклона прямой равен Eак/R (рис. 2.8).
2.3.6.Кинетическое уравнение обратимой реакции первого порядка
Изменение концентрации исходных веществ и продуктов реакции во времени в случае протекания обратимой реакции можно показать на примере реакции первого порядка: А В.
Пусть в начальный момент времени при t=0 концентрация исходного вещества А равняется C0A, а концентрация продукта В – C0B.
Согласно закону действующих масс скорость прямой и обратной реакций будут описываться уравнениями
→ |
→ |
← |
← |
v |
= − dCA = k C1А , |
v |
= − dCB = k C1B . |
|
dt |
|
dt |
Скорость двухсторонней реакции определяется скоростью как прямого, так и обратного процессов:
|
|
dCA |
→ 1 |
← |
|
|
dCB |
← 1 → 1 |
|
|
1 |
|
|||||||
v |
= − |
|
= k CА − k CB , |
v |
= − |
|
= k CB − k CA . |
||
dt |
dt |
||||||||
|
|
|
|
|
|
|
|||
Кинетические уравнения содержат три переменные: CA,CB и t. Для интегрирования одну необходимо исключить. Это можно сделать на основе материального баланса. Пусть к моменту времени t концентрации реагентов изменятся на величину x. Тогда CA = CA0 – x, а CB= CB0 + x,
|
d(СA0 |
− x) |
|
|
→ |
← |
|
− |
|
|
|
= k (CA0 |
− x) − k (CB0 |
+ x) , |
|
dt |
|
||||||
|
|
|
|
|
|
|
|
|
d(CB0 |
+ x) |
|
|
← |
→ |
|
− |
|
|
|
= k (CB0 |
+ x) − k (CA0 |
− x) . |
|
dt |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
← |
→ |
→ ← |
|||
Если обозначить |
α = ( k CB0 − k CA0 ) , β = (k |
+ k ) , то можно пре- |
|||||
образовать первое уравнение (или второе, результат будет одинаков) к виду
dx |
← |
→ |
→ ← |
|
dx |
= α +β x , |
|
= −( k CB0 |
− k CA0 ) − x (k + k ) , |
− |
|||||
dt |
dt |
||||||
|
|
|
|
|
|||
61
|
dx |
|
= −dt , |
|
∫ |
d(β x + α) |
= ∫− dt , |
||
|
β x + α |
|
|
|
|
|
(β x + α) β |
||
ln(β x + α) = −β t + const при t=0 |
x=0 |
const = ln(α) , |
|||||||
ln( |
β x + α) = −β t , |
ln(1+ β x) = −β t , x = α (e−β t −1) , |
|||||||
|
α |
|
|
|
|
α |
|
β |
|
|
|
|
|
|
← |
→ |
|
→ ← |
|
|
СA = CA0 − |
k CB0 − k CA0 |
|
|
|||||
|
[exp(−( k + k ) t) −1] , |
||||||||
|
|
→ ← |
|||||||
|
|
|
|
|
|
k + k |
|
|
|
|
|
|
|
|
← |
→ |
|
→ ← |
|
|
СB = CB0 + |
k CB0 − k CA0 |
|
|
|||||
|
[exp(−( k + k ) t) −1] . |
||||||||
|
|
→ ← |
|||||||
|
|
|
|
|
|
k + k |
|
|
|
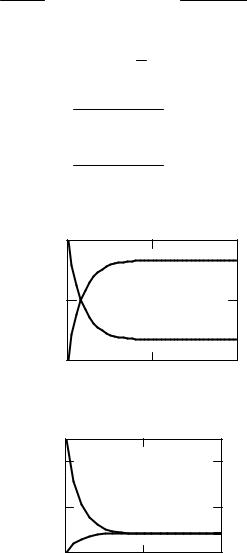
Изменение концентрации веществ А и В во времени приведено на |
|||||||||
рис.2.9. |
|
|
|
С(t) |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
СB |
|
|
|
|
|
|
0.5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
СA |
|
|
|
|
|
0 |
0 |
|
1 |
|
2 |
|
Рис. 2.9. Изменение концентрации веществ А и В во времени при протекании обратимой |
|||||||||
|
|
|
|
|
|
→ |
|
← |
|
|
реакции первого порядка А В. k |
= 5; k =1 ; C0A=1; C0B=0 |
|||||||
|
|
v(t) |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
2 |
|
|
vr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 0 |
|
v |
|
|
|
|
|
|
|
|
1 |
|
2 |
|
||
Рис. 2.10. Изменение во времени скоростей прямой и обратной реакций первого порядка
→ ←
А В: k = 5; k =1 ; C0A=1; C0B=0
62
