
- •1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •1.1.Основные понятия и определения
- •1.1.1.Термодинамическая система
- •1.1.2.Термодинамический процесс
- •1.1.3.Термодинамические функции состояния
- •1.2.Тепловые эффекты физико-химических процессов
- •1.2.2.Первое начало термодинамики
- •1.2.3.Тепловой эффект химической реакции
- •1.2.4.Термохимические расчеты
- •1.2.5.Зависимость теплового эффекта реакции от температуры
- •1.3. Направление и пределы протекания химического процесса
- •1.3.1.Второе начало термодинамики
- •1.3.2.Энтропия
- •1.3.3.Направление химического процесса
- •1.3.4. Химический потенциал
- •2. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •2.1. Механизм химической реакции
- •2.1.1.Частицы, участвующие в химической реакции
- •2.1.2.Классификация химических реакций
- •2.2. Элементарная химическая реакция
- •2.2.1.Скорость химической реакции
- •2.2.2.Зависимость скорости химической реакции от концентрации реагирующих веществ
- •2.2.3. Константа скорости химической реакции
- •2.3.Формальная кинетика гомогенных реакций
- •2.3.1.Кинетическое уравнение необратимой реакции первого порядка
- •2.3.2. Кинетическое уравнение необратимой реакции второго порядка
- •2.3.3.Реакции нулевого и высших порядков
- •2.3.4. Зависимость скорости реакции от температуры
- •2.3.5.Определение кинетических параметров реакции
- •2.3.6.Кинетическое уравнение обратимой реакции первого порядка
- •2.4.Цепной механизм химической реакции
- •2.5.Индуцированные реакции
- •2.5.1. Фотохимические реакции
- •2.5.2.Радиационно–химические процессы
- •2.6.Макрокинетика
- •2.6.1.Гетерогенные реакции
- •2.6.2.Горение и взрыв
- •2.7.Катализ
- •2.7.1.Гомогенный катализ
- •2.7.2.Гетерогенный катализ
- •3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3.1.Термодинамическое условие химического равновесия
- •3.1.1. Изобара реакции
- •3.1.2. Изотерма реакции
- •3.3. Расчет равновесного состава газовой смеси
- •3.4. Равновесия в растворах
- •3.4.1.Растворы
- •3.4.2. Электролитическая диссоциация
- •3.4.3.Ионное произведение воды. Водородный показатель
- •3.4.4.Растворы кислот и оснований
- •3.4.5.Буферные растворы
- •3.4.6. Гидролиз солей
- •3.4.7.Обменные реакции с образованием осадка
- •3.5. Фазовые равновесия
- •3.5.1. Правило фаз Гиббса
- •3.5.2.Диаграмма состояния однокомпонентной системы
- •3.5.3. Диаграмма состояния двухкомпонентной системы
- •3.5.4. Кипение и кристаллизация растворов
2.3.Формальная кинетика гомогенных реакций
Большинство гомогенных реакций имеют сложный механизм и протекают через ряд последовательных стадий, каждая из которых представляет собой моно-, биили тримолекулярную элементарную реакцию. Как правило, скорость превращения промежуточных веществ велика. Общая скорость реакции будет определяться скоростью самой медленной стадии (лимитирующая стадия сложной химической реакции). В этом случае зависимость скорости сложной реакции от концентрации реагирующих веществ может быть описана законом действующих масс. Такие сложные реакции называются формально простыми. Но показатели степени в общем случае не равны стехиометрическим коэффициентам. Так, для формально простой гомогенной реакции νAA + νBB → νDD + νEE зависимость скорости реакции от концентрации реагентов определяется уравнением
v = k CAx CBy |
x≠νA; y≠νB. |
Такое уравнение называется кинетическим уравнением реакции.
Показатели степени в данном случае называются порядком реакции. Каждый из показателей степеней (x; y) называется порядком реакции по соответствующему компоненту, а сумма всех показателей (x + y) – ки-
нетическим порядком реакции. Порядок реакций по компонентам определяется экспериментально.
В общем случае кинетический порядок реакции и порядок по компонентам может быть целым или дробным числом. В некоторых случаях, например в фотохимических реакциях, скорость реакции не зависит от концентрации реагирующих веществ и порядок реакции является нулевым.
Отметим, что для элементарных реакций молекулярность реакции и кинетический порядок численно совпадают, а порядок по компонентам совпадает со стехиометрическими коэффициентами в уравнении реакции. Также необходимо отметить, что в этом случае определение скорости реакции как числа элементарных актов в единицу времени в единице реакционного пространства теряет физический смысл. Для формально простых реакций скорость определяется через изменение количества исходных веществ и продуктов реакции в единицу времени.
При протекании химической реакции происходит превращение одних веществ в другие, в ходе которого количество исходных веществ уменьшается, а количество продуктов реакции возрастает. Изменение количества i-го вещества (Δνi число молей) в единицу времени ( t) в единице реакционного пространства (R) называется скоростью реакции по i–му компоненту (скоростью образования или расходования i–го вещества):
53

v = ± |
1 |
|
νi |
при t→0 |
v |
= ± |
1 |
|
dνi |
. |
|
|
|
|
|||||||
i |
R |
|
t |
|
i |
R |
|
dt |
||
|
|
|
|
|
|
|||||
Изменение числа молей Δνi продуктов реакции положительно, а исходных веществ отрицательно. Изменения количеств каждого из реагентов не являются независимыми, а связаны между собою стехиометрическими коэффициентами. Так, для реакции νAA + νBB → νDD + νEE
− |
νA = − |
νB = + |
|
νD = + |
νE . |
||||
|
νA |
νB |
|
νD |
|
νE |
|||
Следовательно, величина v |
= ± |
1 |
|
1 |
|
dνi |
не зависит от выбора реа- |
||
|
|
|
|||||||
|
i |
|
νi |
R |
|
dt |
|
|
|
|
|
|
|
|
|
||||
гента, изменение количества которого во времени наблюдают. Таким образом, она однозначно характеризует скорости превращения всех веществ в ходе химической реакции – скорость реакции в целом.
Пример. Экспериментально определенное кинетическое уравнение реакции взаимодействия иодистого водорода с перекисью водорода
2HI + H2O2 → 2H2O + I2 имеет вид ν = k CHI1 CH1 2O2 .
Несовпадение порядков реакции по компонентам со стехиометрическими коэффициентами связано с тем, что данная реакция является сложной и протекает через ряд промежуточных стадий. Например:
1)H2O2 → 2OH•,
2)OH• + HI → H2O + I•,
3)I• + I• → I2.
Практический интерес представляет зависимость концентрации реагирующих веществ от времени протекания реакции (изменение концентрации во времени: C=f(t)).
Поскольку скорость реакции является первой производной изменения концентрации во времени, то кинетическое уравнение есть дифференци-
альное уравнение, решением которого и является функция C=f(t): v = − dCdti = k CAx CBy .
2.3.1.Кинетическое уравнение необратимой реакции первого порядка
Рассмотрим необратимую (одностороннюю) реакцию распада:
A → B + D.
Кинетическое уравнение:
− ddtСA = k СA .
54
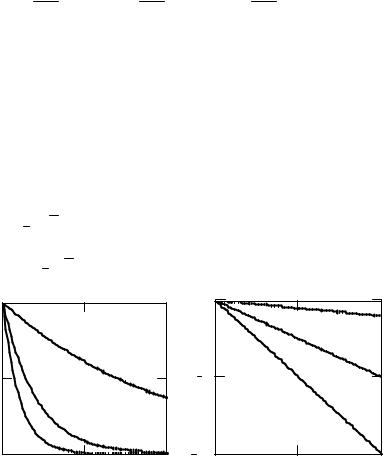
Начальные условия: концентрация вещества А в начальный момент |
||||||||
времени (t = 0) равна CA0. |
|
|
|
|
|
|
||
Уравнения данного типа решаются методом разделения переменных: |
||||||||
− dСA |
= k СA → |
dСA = −k dt → |
∫ |
dСA = −k |
∫ |
dt , |
||
dt |
|
СA |
|
СA |
|
|||
|
|
lnСA = −k t + const , |
|
|
|
|||
|
|
при t = 0; C = CA0 |
ln СA0 = const , |
|
|
|||
|
|
ln СA = −k t +ln СA0 , |
|
|
|
|||
|
|
|
СA = СA0 e−k t . |
|
|
|
|
|
Поскольку |
концентрация |
вещества |
А уменьшается в |
ходе реакции |
||||
(рис.2.4) и асимптотически приближается к нулю, рассчитать точно время |
||||||||
полного превращения вещества А невозможно. Для оценки времени про- |
||||||||
текания реакции используется такая характеристика, как время полупре- |
||||||||
вращения (полураспада) – время, за которое прореагировала половина |
||||||||
исходного вещества, т. е. концентрация вещества А уменьшилась в два |
||||||||
раза ( СA (t1 ) = |
1 |
СA0 ): |
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t1 |
= 1 ln 2 – время полупревращения (полураспада). |
|||||||
2 |
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CA |
|
|
lnCA |
|
|
|
|
|
1 |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
k=0,1 |
||
|
|
k=0,1 |
|
|
|
k=0,5 |
||
|
|
|
|
|
|
|||
0.5 |
|
|
|
5 |
|
k=1 |
|
|
k=0,5 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
k=1 |
|
|
|
|
|
|
|
|
0 0 |
|
5 |
10 |
10 0 |
|
5 |
|
10 |
Рис. 2.4. Изменение концентрации вещества А во времени при протекании односторон- |
||||||||
|
|
ней реакции первого порядка (CA0=1) |
|
|
||||
Время полупревращения для реакций первого порядка не зависит от исходной концентрации вещества, а определяется только величиной константы скорости.
55
2.3.2. Кинетическое уравнение необратимой реакции второго порядка
К необратимым реакциям второго порядка относятся химические реакции типа:
A + A → A2, A + B → AB, A + BС → AB + С.
Рассмотрим как наиболее простую первую реакцию. Ее кинетическое уравнение имеет вид
− ddtСA = k СA2 .
Начальные условия: концентрация вещества А в начальный момент времени (t = 0) равна CA0:
− |
dCA |
= k CA |
2 |
, |
|
|
dCA |
|
= −k |
dt , |
|
|
|
∫ |
dCA |
= −k |
|
∫ |
dt , |
||||
dt |
|
|
|
CA2 |
|
|
|
|
CA2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
1 |
|
= k t + const , |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
CA |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
при t = 0; С = СA0 |
|
|
1 |
= const , |
|
|
1 |
= k t + |
1 |
|
, |
|
|||||||||||
|
|
|
|
|
|
CA |
CA0 |
|
|
||||||||||||||
|
|
|
|
|
CA0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
CA |
= |
|
CA0 |
|
. |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
CA0 |
k t |
+1 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
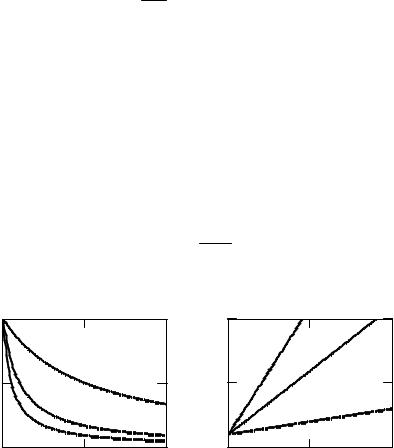
Зависимость концентрации вещества от времени для реакций второго порядка (рис. 2.5) линейна в координатах – t, причем тангенс угла наклона равен константе скорости реакции.
C A |
|
|
|
1/C A |
|
|
|
1 |
|
|
|
10 |
|
|
|
|
k= 0,1 |
|
|
|
k= 1 |
|
|
|
|
|
|
|
k= 0,5 |
||
0.5 |
|
|
|
5 |
|
||
k= 0,5 |
|
|
|
|
|||
|
|
|
|
|
|
||
|
k= 1 |
|
t |
|
|
k= 0,1 |
|
0 0 |
10 |
20 |
0 0 |
10 |
20 |
||
|
Рис. 2.5. Изменение концентрации вещества А во времени при протекании реакции второго порядка (CA0=1)
56
