
Курило_ТОХ
.pdf
151
В группах потенциал ионизации уменьшается с увеличением атомного номера элемента:
Li |
Na |
K |
Rb |
Cs |
I, эВ 6,39 |
5,14 |
4,34 |
4,18 |
3,89 |
Это связано с большей удаленностью валентных электронов от ядра и, следовательно, с их более легким отрывом по мере увеличения количества электронных слоев. Величина потенциала ионизации может служить мерой “ металличности” элемента: чем меньше потенциал ионизации, тем легче удалить электрон из атома, тем сильнее выражены металлические свойства.
В периодах слева направо заряд ядра возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается, а металлические свойства
ослабевают: |
|
|
|
|
|
|
|
Li |
Be |
B |
C |
N |
O |
F |
Ne |
I, эВ 5,39 |
9,32 |
8,30 |
11,26 |
14,53 |
13,61 |
17,42 |
21,56 |
Нарушение тенденции возрастания I наблюдается для атомов с целиком заполненным внешним энергетическим подуровнем, либо для атомов, у которых внешний энергетический подуровень заполнен ровно наполовину:
Это свидетельствует о повышенной энергетической устойчивости электронных конфигураций с полностью или ровно наполовину занятыми подуровнями.
Степень притяжения электрона к ядру и, следовательно, потенциал ионизации зависят от ряда факторов, и прежде всего от заряда ядра. (, от расстояния между электроном и ядром, от экранирующего влияния других электронов. Так, у всех атомов, кроме элементов первого периода, влияние ядра на электроны внешнего слоя экранировано электронами внутренних слоев.
Поле ядра атома, удерживающее электроны, притягивает также и свободный электрон, если он окажется вблизи атома. Правда, этот электрон испытывает отталкивание со стороны электронов атома. Для многих атомов энергия притяжения дополнительного электрона к ядру превышает энергию его отталкивания от электронных оболочек. Эти атомы могут присоединять электрон, образуя устойчивый однозарядный анион. Энергия присоединения электрона к нейтральному атому (равеая энергии отрыва электрона от отрицательного однозарядного иона в процессе X– – e X0) называют сродством атома к электрону (A), измеряемым в кДж/моль или эВ (электронвольт = 1,602.10-19 Дж или 96,485 кДж/моль). При присоединении двух и более электронов к атому отталкивание преобладает над притяжением – сродство атома к двум и более электронам всегда отрицательно. Поэтому одноатомные многозарядные отрицательные ионы (O2– , S2– , N3– и т.п.) в свободном состоянии существовать не могут.
Сродство к электрону известно не для всех атомов. Максимальным сродством к электрону обладают атомы галогенов.
в) Электроотрицательность. Эта величина характеризует способность атома в молекуле притягивать к себе связывающие электроны. Электроотрицательность не следует путать со сродством к электрону: первое понятие относится к атому в составе молекулы, а второе – к изолированному атому. Абсолютная электроотрицательность (кДж/моль или эВ ) равна сумме энергии ионизации и сродства к электрону:
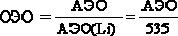
152
АЭО=I+A. На практике часто применяется величина относительной электроотрицательности, равная отношению АЭО данного элемента к АЭО лития (535 кДж/моль):
Электроотрицательность уменьшается сверху вниз по группе и увеличивается слева направо по периоду. Ниже приведены относительные электроотрицательности некоторых элементов.
|
Li |
Be |
B |
C |
N |
O |
F |
ЭО |
1,0 |
1,5 |
2,0 |
2,5 |
3,1 |
3,5 |
4,0 |
|
|
Na |
K |
Rb |
|
Cs |
|
|
|
ОЭО 0,9 |
0,8 |
0,8 |
|
0,7 |
|
|
|
|
Cl |
Br |
I |
|
|
|
|
ОЭО |
3,0 |
2,8 |
2,6 |
|
|
Наибольшее значение электроотрицательности имеет фтор, наименьшее – цезий. Водород занимает промежуточное положение, т.е. при взаимодействии с одними элементами (например, с F) он отдает электрон, а при взаимодействии с другими (например, с Rb) – приобретает электрон.
г) Окислительно-восстановительные свойства нейтральных атомов. Эти свойства определяются значениями энергии ионизации и сродства к электрону. Восстановительные свойства проявляет атом, отдающий электрон, а окислительные – атом, принимающий электрон. В периоде слева направо восстановительные свойства ослабевают, т.к. потенциал ионизации возрастает. В подгруппах сверху вниз восстановительные свойства нейтральных атомов усиливаются, поскольку потенциал ионизации в этом направлении уменьшается. Окислительные свойства, напротив, усиливаются слева направо в периоде и ослабевают сверху вниз в подгруппе, что связано с тенденциями в изменении сродства к электрону.
д) Кислотно-основные свойства соединений. Свойства оксидов и гидрокси-
дов элементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее, степени окисления) центрального атома кислотный характер этих соединений становится более выраженным:
Na+ |
Mg2+ |
Al3+ |
Si4+ |
P5+ |
S6+ |
Cl7+ |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
NaOH |
Mg(OH)2 |
Al(OH)3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
основные |
|
амфотерный слабо ки- |
средне ки- |
сильно кислотные |
||
|
|
|
слотный |
слотный |
|
|
Сверху вниз в подгруппе при одинаковости заряда (степени окисления) центрального атома с увеличением его радиуса кислотные свойства оксидов и гидрокси-
дов ослабевают, а основные – |
усиливаются: |
|
|
|
B3+ |
H3BO3 |
слабая кислота |
|
Al3+ |
Al(OH)3 |
амфотер- |
|
Ga3+ |
Ga(OH)3 |
ные гидрок- |
|
In3+ |
In(OH)3 |
сиды |
|
Tl3+ |
Tl(OH)3 |
более выражены ос- |

153
новные свойства Аналогичный пример можно привести для кислородсодержащих кислот эле-
ментов VI группы: сила кислот убывает в ряду: H2SO4 - H2SeO4 - H2TeO4.
154
22. ХИМИЧЕСКАЯ СВЯЗЬ
Атомы объединяются в молекулы при возникновении между ними химических связей.
Образование химического соединения (молекулы, сложного иона и др.) происходит потому, что оно более энергетически устойчиво, чем состояние отдельных атомов. Природа химической связи объясняется взаимодействием электрических полей, электронов и ядер атомов, участвующих в образовании химического соединения. В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную,
ионную, металлическую.
Для описания химических связей в любых молекулах в настоящее время наибольшее распространение получили полуэмпирические методы – метод валентных связей (ВС) и метод молекулярных орбиталей (МО). В основе этих методов лежат представления квантовой механики.
Химическая связь характеризуется следующими параметрами: длиной, прочностью, валентным углом.
Длина связи – это расстояние между ядрами химически связанных атомов. Валентный угол – угол между воображаемыми прямыми, проходящими через
ядра химически связанных атомов.
Прочность связи определяется энергией связи – количеством энергии, которое затрачивается на ее разрыв или выделяется при ее образовании.
Например, энергия связи О– О в молекуле О2 составляет 494 кДж/моль. Это означает, что при образовании из изолированных атомов 1 моля газообразного кислорода выделяется 494 кДж. Такое же количество энергии потребуется на разрыв связи О– О в молекуле О2.
Метод валентных связей
В 1916 г. американский ученый Льюис высказал предположение о том, что химическая связь образуется за счет обобществления двух электронов. При этом электронная оболочка атома стремится по строению к электронной оболочке благородного газа. В дальнейшем эти предположения послужили основой для развития метода валентных связей. В 1927 г. Гайтлером и Лондоном был выполнен теоретический расчет энергии двух атомов водорода в зависимости от расстояния между ними. Оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. При противоположно направленных спинах на энергетической кривой имеется минимум, т.е. образуется устойчивая система – молекула водорода Н2 (рисунок 1).

155
Зависимость энергии от расстояния между атомами водорода при однонаправленных и противоположно направленных спинах.
Межъядерное расстояние r0, соответствующее минимуму, называется длиной связи, а энергия связи равна глубине потенциальной ямы E0– E1, где Е0 – энергия двух невзаимодействующих атомов, находящихся на бесконечном расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом взаимопроникновения (перекрывания) электронных облаков. Вследствие этого перекрывания плотность отрицательного заряда в межъядерном пространстве возрастает, и положительно заряженные ядра притягиваются к этой области. Такая химическая связь называется ковалентной.
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). Модель метода валентных связей (или метод локализованных электронных пар) основана на положении, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Согласно методу ВС, химическая связь локализована между двумя атомами, т. е. она двухцентровая и двухэлектронная.
Основные положения метода ВС:
1.Ковалентная связь образуется между двумя атомами за счет взаимодействия электронных орбиталей с антипараллельными спинами электронов.
2.Связь располагается в направлении, обеспечивающем наибольшую степень перекрывания электронных орбиталей.
3.Ковалентная связь тем прочнее, чем более полно перекрываются электронные орбитали.
Комбинации двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем. Примеры построения валентных схем:
В валентных схемах наиболее наглядно воплощены представления Льюиса об образовании химической связи путем обобществления электронов с формированием

156
электронной оболочки благородного газа: для водорода – из двух электронов (оболочка He), для азота – из восьми электронов (оболочка Ne).
Свойства ковалентной связи: насыщаемость, направленность и поляризуемость.
Вследствие насыщаемости связи молекулы имеют определенный состав и существуют в виде частиц с определенной структурой. Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении.
Различают следующие механизмы образования ковалентной связи: спин-
валентный и донорно-акцепторный.
1) Спин-валентный механизм образования химической связи осуществляется парой электронов и предполагает взаимодействие орбиталей валентных электронов разных атомов с антипараллельными спинами. Например, образование молекулы водорода из атомов:
↑ Н + ↓ Н → Н −↓ Н или более упрощенно: Н × + × Н → Н : Н.
Поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле действия своего ядра, в образовании ковалентных связей принимают участие все одноэлектронные облака. Например, атомы кислорода и азота могут соединяться с двумя и тремя атомами водорода соответственно:
В этом случае для образования связи каждый из атомов предоставляет по одному электрону.
Число неспаренных электронов в атоме может быть различным. Элементы 3-го периода – фосфор, сера, хлор – могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные
орбитали 3d-подуровня: |
|
P* 1s22s22p63s13p33d1 |
(валентность 5) |
S* 1s22s22p63s13p33d2 |
(валентность 6) |
Cl* 1s22s22p63s13p33d3 |
(валентность 7) |
В приведенных выше электронных формулах возбужденных атомов подчеркнуты подуровни, содержащие только неспаренные электроны. На примере атома хлора легко показать, что валентность может быть переменной:

157
В отличие от хлора, валентность атома F постоянна и равна 1, т.к. на валентном (втором) энергетическом уровне отсутствуют орбитали d-подуровня и другие вакантные орбитали.
В случае образования химической связи между атомами одного элемента, осуществляемой двумя или тремя парами электронов, связь является кратной и называется двойной или тройной соответственно. Например:
..
.О.
. .
. . .
.N
.
.О...
+ . .
. . .
+ N. .
.. . ..
.О.О. → . . .
.
.
.
→ . . .
.N . N .
.
или (О = О)
или (N ≡ N)
2) Донорно-акцепторный механизм образования ковалентной связи возможен при взаимодействии частиц (атомов), одна из которых имеет свободную орбиталь, другая – пару электронов:
Частица, предоставляющая для связи двухэлектронное облако, называется донором, частица со свободной орбиталью, принимающая электронную пару, называется акцептором. В рассмотренном случае молекула аммиака за счет пары электронов азота
– донор, а ион водорода Н+, имеющий свободную орбиталь, – акцептор.
Электронные облака атомов имеют различную форму, их взаимное перекрывание может осуществляться разными способами. В зависимости от способа перекрывания и симметрии образующегося облака различают сигма (σ), пи (π) и дельта (δ) связи.
σ-связи образуются при перекрывании облаков по линии, соединяющей ядра атомов.
s-s |
р-p |
s-p |
d-d |
Пример σ-связи
π-связи образуются при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра атомов.
158
р-р |
d-р |
d-d |
Пример π-связи
δ-связи образуются при перекрывании всех четырех лопастей d-электронных облаков, расположенных в параллельных плоскостях.
Степень перекрывания электронных облаков определяет прочность любой связи. Максимальное число σ-связей, образованных атомами одного элемента, определяется числом связанных с ним соседних атомов. Так как гантелевидные р-орбитали расположены в атомах под углом 90о друг к другу, то и образующиеся в молекулах π-связи должны располагаться перпендикулярно относительно друг друга.
Схема связей в молекуле N2
Направленность ковалентной связи обусловливается тем, что электронные облака атомов имеют определенную конфигурацию – расположение в пространстве. Часто в образовании связи участвуют орбитали разных конфигураций. Для объяснения того, как неравноценные по исходному состоянию орбитали образуют равноценные химические связи используются представления о гибридизации валентных орбиталей. Гибридизация сопровождается изменением формы и энергии электронных облаков, которое происходит при поглощении энергии и сопровождается образованием одинаковых по форме и энергии гибридных облаков (орбиталей). Понятно, что незначительные затраты энергии при таких изменениях окупаются при образовании равноценных связей. Гибридные орбитали изображают в виде неправильной сильно смещенной в одну сторону гантели.
Форма гибридной орбитали может быть определена математически путем сложения волновых функций исходных орбиталей:

159
Врезультате сложения волновых функций s- и p-орбиталей с учетом их знаков оказывается, что плотность электронного облака (величина 2) по одну сторону от ядра повышена, а по другую – понижена.
Вцелом процесс гибридизации включает следующие этапы: возбуждение атома, гибридизация орбиталей возбужденного атома, образование связей с другими атомами. Затраты энергии на первые два этапа компенсируются выигрышем энергии при образовании более прочных связей с гибридными орбиталями. Тип гибридизации определяется типом и количеством участвующих в ней орбиталей
Например, при смешивании одной s- и одной р-орбиталей происходит sp- гибридизация, за счет которой образуются две гибридные sр-орбитали (q-орбитали). Эти
орбитали в силу расталкивания расположены друг относительно друга под углом 180° .
→
(s + p)-орбитали |
две sр-орбитали |
Схема образования sр-гибридных орбиталей
Перекрывание sp-орбиталей бериллия и p-орбиталей хлора в молекуле BeCl2
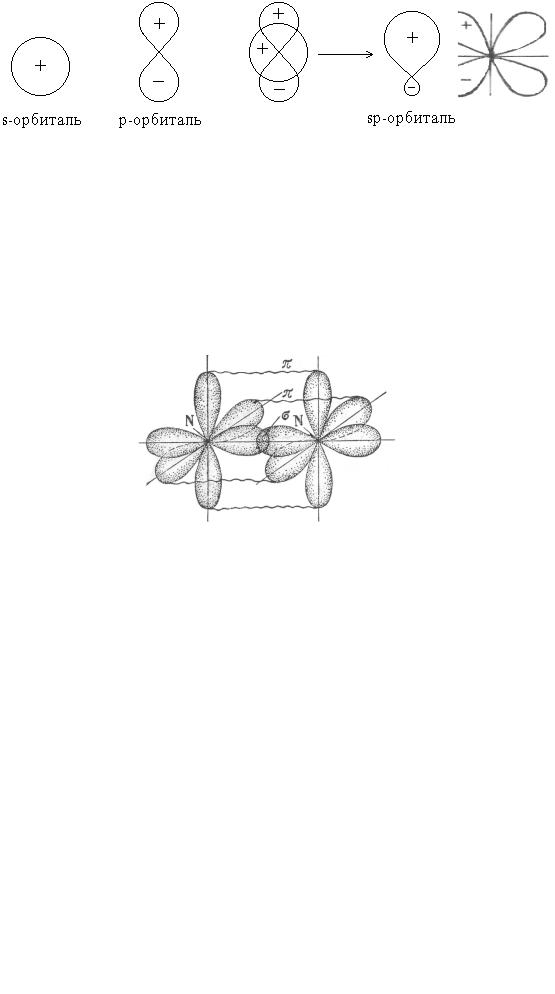
Комбинация трех орбиталей – одной s- и двух р-орбиталей приводит к sp2- гибридизации. Три sp2-гибридные орбитали направлены к вершинам равностороннего треугольника под углом 120°.
→
(s + p + р)-орбитали |
три sp2-орбитали |
Схема образования sp2-гибридных орбиталей
160
Перекрывание sp2-орбиталей бора и p-орбиталей хлора в молекуле BCl3
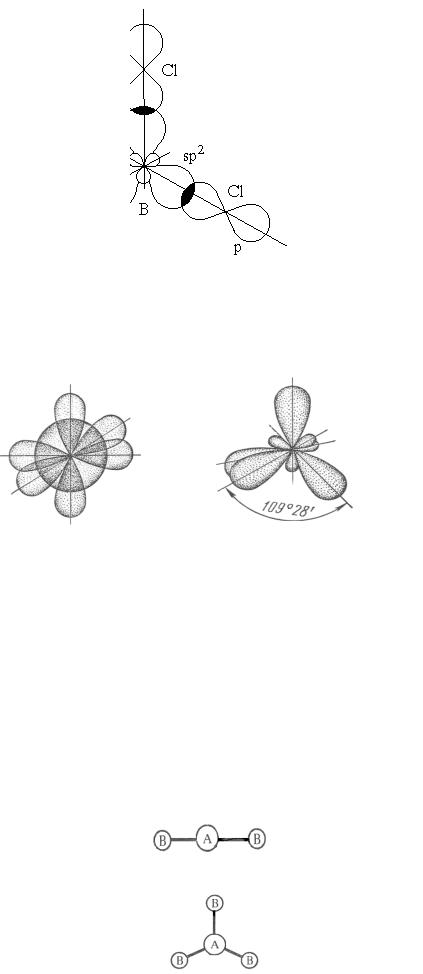
Комбинация четырех орбиталей – одной s- и трех р-типа – приводит к sp3- гибридизации, при которой четыре гибридные орбитали симметрично ориентированы в пространстве к четырем вершинам тетраэдра, т.е. под углом 109о28′.
→
(s + p + р + р)-орбитали |
четыре sp3-орбитали |
Схема образования sp3-гибридных орбиталей
Кроме рассмотренных, возможны и другие типы гибридизации валентных орбиталей. Каждый тип гибридизации объясняет пространственную конфигурацию молекул. Примеры строения молекул некоторых веществ и ионов с различным типом гибридизации приведены в таблице.
Тип гибридиза- |
Геометрическая форма |
Примеры |
|
ции орбиталей |
молекулы |
||
|
|||
|
|
|
|
sp |
линейная |
BeF2, |
|
|
|
[Ag(CN)2]– |
|
|
|
|
|
sp2 |
треугольная |
BF3, NO 3− |
|
|
|
|
