
- •Федеральное агентство по образованию
- •Введение
- •Основные законы химии Краткие теоретические сведения
- •Определение z* и расчет мэ простых и сложных веществ
- •Математически закон эквивалентов для условной реакции вида
- •Примеры решения задач
- •По закону эквивалентов [формула (13)]: .
- •С.О. Кислорода в любом оксиде равна –2, тогда по формуле (9)
- •Следовательно, .
- •Строение атомов и свойства химических элементов Краткие теоретические сведения
- •Основная масса атома сосредоточена в ядре и характеризуется массовым числом а, которое равно сумме числа протонов z и числа нейтронов n:
- •Основные характеристики подуровней
- •Зависимость некоторых свойств элементов и их соединений от z
- •Относительная электроотрицательность некоторых элементов
- •Примеры решения задач
- •Химическая связь и строение молекул
- •Разрыв связи в молекуле может быть осуществлен:
- •Виды гибридизаций ао и геометрические параметры частиц
- •Строение и ожидаемая полярность молекул
- •Примеры решения задач
- •По табл.4 определяем что эо атомов хлора и йода равны 2,83 и 2,21 соответственно. Найдем разность эо атомов
- •По графику на рис.1 определяем си связи. Си 5 %. Тогда
- •Литература
- •Содержание
Примеры решения задач
Пример 1. Средняя энергия связи N–Н в молекуле NH3 равна 385 кДж/моль. Какое количество энергии необходимо затратить, чтобы разложить на атомы: а)1 молекулу аммиака; б) 10 г аммиака?
Р е ш е н и е
По формуле (15) найдем энергию образования 1 моль молекул аммиака
![]()
![]() кДж/моль.
кДж/моль.
Тогда на разрушение 1 молекулы аммиака понадобиться энергия
![]() Дж.
Дж.
Энергия, необходимая для разложения 10 г аммиака
![]()
![]() кДж.
кДж.
Пример
2. Укажите
механизм образования связей, направление
смещения общих электронных пар и способ
перекрывания АО в ионе SiF![]() .
Установите тип гибридизации центрального
атома, форму и полярность молекулы.
.
Установите тип гибридизации центрального
атома, форму и полярность молекулы.
Р е ш е н и е
Ион
SiF![]() может быть получен при взаимодействии
двух ионов F–
c
молекулой SiF4.
Запишем электронные формулы валентных
подуровней взаимодействующих атомов
и ионов
может быть получен при взаимодействии
двух ионов F–
c
молекулой SiF4.
Запишем электронные формулы валентных
подуровней взаимодействующих атомов
и ионов
Si:…3s23p23d0 F:…2s22p5 F–: :…2s22p6
В основном состоянии атом кремния имеет 2 непарных электрона на 3p подуровне, атом фтора – 1 непарный электрон на 2р, а ион фтора – не имеет непарных электронов. Для образования четырех связей с четырьмя атомами фтора по обменному механизму атому кремния необходимо иметь четыре одноэлектронных АО, поэтому он перейдет в возбужденное состояние
Si + E Si*: …3s13p3.
Свободные
АО 3d-подуровня
со стороны Si
участвуют в образовании двух связей с
ионами F–
по донорно-акценторному механизму, где
кремний выполняет роль акцептора, а
ионы фтора являются донорами. Таким
образом, в частице SiF![]() четыре связи образованы по обменному
механизму, а две по донорно-акцепторному.
четыре связи образованы по обменному
механизму, а две по донорно-акцепторному.
По табл.4 находим ЭО(Si) = 1,74 и ЭО(F) = 4,00. ЭО(F) > ЭО(Si), значит смещение общих электронных пар происходит к атому F.
Поскольку
все связи в ионе SiF![]() являются одинарными, значит по способу
перекрывания АО все они являются
-связями.
являются одинарными, значит по способу
перекрывания АО все они являются
-связями.
Тип
гибридизации определяем по числу АО
кремния, которые участвовали в образовании
связей независимо от механизма их
возникновения. Со стороны атома Si
связи образованы с участием одной s-,
трех p-
и двух d-АО,
следовательно тип гибридизации sp3d2.
По табл.5 определяем, что геометрическая
форма – октаэдр, так как все гибридные
АО являются связывающими (количество
Ё = 0). По табл.6 определяем, что
частица SiF![]() неполярная, то есть
неполярная, то есть
![]() .
.
Пример 3. ЭМД молекулы IСl равен 0,54 D. Определите степень ковалентности связи и длину диполя молекулы.
Р е ш е н и е
По табл.4 определяем что эо атомов хлора и йода равны 2,83 и 2,21 соответственно. Найдем разность эо атомов
ЭО(Cl–I) = 2,83 – 2,21 = 0,62.
По графику на рис.1 определяем си связи. Си 5 %. Тогда
СК = 100 – 5 = 95 %.
По формуле (17) вычисляем эффективные заряды атомов
![]() Кл.
Кл.
В молекуле IСl присутствует только одна связь I–Cl, поэтому ЭМД молекулы и ЭДМ связи совпадают. По формуле (16) оценим длину диполя
![]() .
.
Пример 4. Составьте энергетическую диаграмму МО молекулы C2 и определите порядок связи в частице. Каковы ее магнитные свойства?
Р е ш е н и е
Образование химической связи в молекуле C2 может быть представлено следующим образом:
2C: 1s22s22p5 → C2 [(σ![]() )2(σ
)2(σ![]() )2(σ
)2(σ![]() )2(σ
)2(σ![]() )2(π
)2(π![]() )2(π
)2(π![]() )2].
)2].
Строим энергетическую диаграмму молекулы (см. рис.4), из которой следует, что молекула С2 диамагнитная (все электроны спаренные).
Порядок связи оценим по формуле (18)
![]()
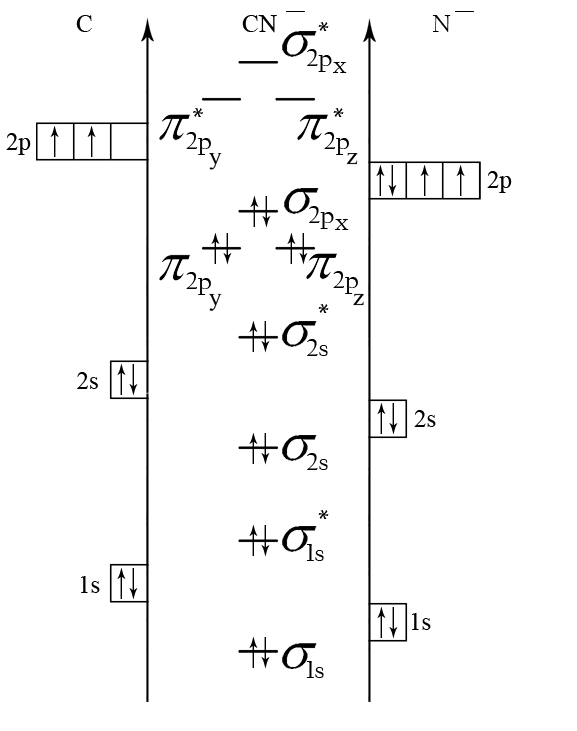
Пример 5. Составьте энергетические диаграммы МО для частиц СN– и NО. Определите магнитные свойства каждой частицы. Какая из них более прочная и почему?
Р е ш е н и е
Ион СN– состоит из атома углерода и иона N–. Электроны в этих частицах распределяются по АО следующим образом
С: 1s22s22p2 N–: 1s22s22p4.

Рис. 4. Энергетическая диаграмма молекулы С2 по ММО.

а) б)
Рис. 5 Энергетические диаграммы СN– и NO.
Для распределения электронов по МО необходимо сравнить ЭО атомов. Из табл.4 выбираем ЭО(С) = 2,5 и ЭО(N) = 3. Поскольку ЭО(С) < ЭО(N), то энергия исходных АО иона N– будет меньше, чем у атома углерода. Строим энергетическую диаграмму (см. рис.5 а). Определяем порядок связи
n = (9 – 4) /2 = 2,5.
В ионе СN– нет непарных электронов, значит частица диамагнитная.
Молекула NО состоит из атомов азота и кислорода. Электроны в этих атомах распределяются по АО следующим образом
N: 1s22s22p3 О: 1s22s22p4.
ЭО(N) = 3, а ЭО(О) = 3,5. Значит энергия АО кислорода будет меньше, чем у азота. Последовательность возрастания энергии МО принимаем по более ЭО элементу, то есть по кислороду (см. рис.5 б). Порядок связи в молекуле
n = (10 – 5)/2 = 2,5.
NО – парамагнетик.
Прочность частиц СN– и NO можно сравнить по величине порядка связи. Чем больше порядок связи, тем больше энергия связи и меньше длина связи. В нашем случае n(CN–) = n(NО), следовательно эти частицы имеют приблизительно одинаковые значения энергий и длин связей, то есть обладают одинаковой прочностью.
Пример 6. Радиусы ионов Na+ и Cu+ одинаковые (0,098 нм). Объясните, почему температура плавления NaCl (801°С) больше температуры плавления CuCl (430°С).
Р е ш е н и е
При одинаковых зарядах и размерах ионов Na+ и Cu+ различие в их поляризующем действии определяется особенностями их электронного строения.
Запишем электронные формулы ионов:
Cu+: …3s23p63d10 Na+: …2s22p6.
У иона Cu+ ПД выражено сильнее, чем у иона Na+, так как главное квантовое число внешних АО у первого иона равно 3, а у второго – 2. В результате связь в кристаллах CuCl является в меньшей степени ионной, чем в NaCl. Поэтому кристаллическая решетка NaCl более близка к чисто ионному типу и имеет более высокую температуру плавления, чем у CuCl.
Пример 7. CaF2 не распадается на атомы даже при 1000°С, а CuI2 неустойчив уже при обычной температуре. Чем объяснить различную прочность этих соединений?
Р е ш е н и е
Ион Cu2+, имеющий небольшой радиус 0,08 нм, обладает сильным ПД, а большой по размеру ион I– (r = 0,22 нм) характеризуется высокой поляризуемостью. Поэтому поляризация аниона I– катионом Cu2+ приводит к практически полному переходу электрона от аниона к катиону. В результате ион Cu2+ восстанавливается до Cu+, а ион I– окисляется до свободного йода. Поэтому соединение CuI2 неустойчивое.
Радиус иона Са2+ составляет 0,104 нм, поэтому он оказывает более слабое ПД на анион, чем ион Cu2+. С другой стороны, поляризуемость иона F–, имеющего сравнительно малый размер (r = 0,133 нм), значительно меньше, чем у иона I–. При взаимодействии слабополяризующего катиона Са2+ со слабо поляризующимся анионом F– электронные оболочки ионов почти не деформируются, СИ связи практически не снижается, поэтому соединение СаF2 устойчиво.
Пример 8. H2S при обычной температуре – газ, а вода – жидкость. Чем можно объяснить это различие в физических свойствах?
Р е ш е н и е
Кислород более ЭО элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода. Разрыв этих связей требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Пример 9 . Ниже приведены Ткип (в К) благородных газов
Не Nе Ar Kr Xe Rn
4,3 27,2 87,3 119,9 165,0 211,2
Чем объясняется повышение Ткип в данном ряду?
Р е ш е н и е
С ростом порядкового номера благородных газов увеличиваются размеры их атомов при сохранении аналогичной структуры внешнего электронного слоя атома. Поэтому поляризуемость атомов возрастает, вследствие чего возрастают и силы межмолекулярного взаимодействия между ними. Отрыв атомов друг от друга, происходящий при переходе вещества из жидкого в газообразное состояние, требует все большей затраты энергии. Это и приводит к повышению температуры кипения.
