
Лабораторная работа №1
Определение скорости коррозии меди и её сплавов при высоких температурах.
Общие сведения о коррозии металлов при высоких температурах.
Схема установки для выполнения работ.
Методика выполнения работы.
Таблица результатов опытов.
Графические зависимости увеличения веса образцов в мг/см2 от продолжительности испытаний и изменения веса образцов в мг/см2 за 40 мин от температуры.
Анализ полученных результатов и выводы по работе.
Принял _____________
Лабораторная работа № 2 Определение скорости коррозии металлов по количеству выделившегося водорода.
а. Общие сведения
В некоторых случаях коррозии металлов в электролитах на негодных
участках металла происходит разряд ионов водорода, и процесс сопровождается выделением газообразного водорода.
Количество выделившегося водорода, являющегося мерой скорости коррозии, зависит от суммарного тока, возникшего в коррозионной системе.
Предполагая, что токи, протекающее через микроэлементы, равны между собой, объём выделившегося водорода будет пропорциональным количеству микропор, имеющихся на поверхности металла, т. е. его неоднородности.
Величина тока, протекающего через каждый микроэлемент, пропорционально разности потенциалов, установившихся в процессе растворения между анодным и катодным участками.
Введение в сплав легирующих элементов, вызывающих пассивацию сплава должно вызвать увеличение перенапряжения выделение водорода на микрокатодах и уменьшение скорости коррозии.
Увеличение структурной неоднородности и образование ликокатодов с малым перенапряжение выделяющего водорода должно вызвать увеличение количества выделившегося водорода, т. е. скорость коррозии.
Этот метод позволяет непрерывно следить за изменением скорости коррозии.
Пред проведением работ необходимо ознакомится:
с влиянием примесей и присадок на коррозионную устойчивость металлов в кислотах;
с объёмны методом определения скорости коррозии;
с оценкой коррозионной стойкости металлов.
б. Проведение работы
Для определения скорости коррозии по выделению водорода широко применяется метод при котором водород вытесняет раствор, объём которого измеряется
.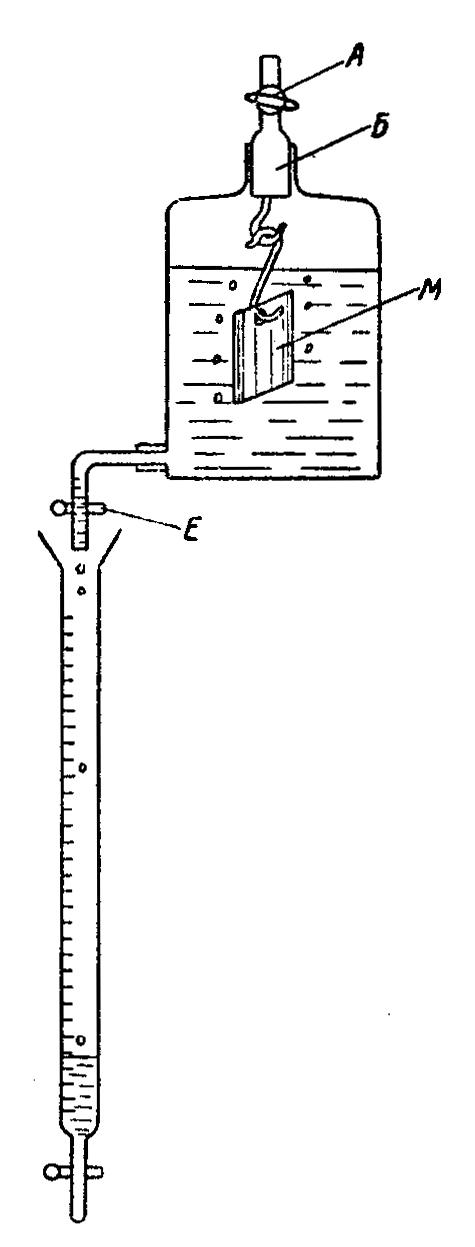
Выделяющийся водород вытесняет из герметически закрытой бутылки кислоту, которая капает в бюретку; объём вытесненной жидкости соответствует объёму выделившегося водорода.
I. Образцами для испытаний служат:
1. серый чугун – феррит + перлит + зеерлит ;
2. сталь 0,4% - феррит + перлит
3. хромистая сталь с 12% Cr – твёрдый раствор + карбиды;
4. хромоникелевая сталь с 8% Ni + 18% Cr – аустенит;
II Образцы с измеренной поверхностью должны быть зачищены наждачной бумагой, тщательно обезжирены содой, промыты в проточной воде и вытерты фильтровальной бумагой.
III. Подготовленные образцы М помещают в стеклянные держатели, которые подвешивают на стеклянные крючки, укреплённые в пробке Б.
IV. В склянки с тубусом наливают 5% - ную Н2SO4, пробку Б и кран А плотно закрывают, после чего открывают зажим Е, из которого при этом вытекает в бюретку небольшое количество раствора. Зажим Е в дальнейшем при работе оставляют открытым.
V. Загрузив образец, записывают уровень жидкости в бюретке – этот момент и является началом опыта.
VI. В дальнейшем в течение 100 мин такую запись повторяют каждые
20 мин.
VII. После окончания опыта закрывают зажимы Е и вынимают образцы с пробками.
VIII. Образцы хорошо ополаскивают водой и вытирают
IX. Результаты опытов записывают по форме.
Х. Результаты опытов т. е. объём выделившегося водорода в см3 относят к единице поверхности образцов и выражают в см3/см2.
XI. Кроме того, результаты опытов оформляются в виде диаграмм, показывающие зависимость количества выделившегося водорода с единицы поверхности образца ( см3 /см2 ) от продолжительности испытания для каждого образца.

![]()

τ, мин
XII Зная объём водорода, выделившегося за время опыта, можно вычислить весовые потери корродировавших образцов.
При вычислении исходят из того, что при растворении одного гремиэквивалента металла выделившегося при нормальных условиях 11,2л. водорода.
Условно принимаем, что во всех взятых для испытания образцах происходит растворение железа.
Характеризую коррозионную устойчивость испытанных образцов по шкале коррозионной стойкости.
-
Группа
Стойкости
Стойкость
коррозии
(проницаемость)
Балл.
I Совершенно стойкие
< 0,001
1
II Весьма стойкие
0,001 – 0,005
0,005 – 0,01
2
3
III Стойкие
0,01 – 0,05
0,05 – 0,1
4
5
IV Понижено стойкие
0,1 – 0,5
0,5 - 1,0
6
7
V Малостойкие
1,0 – 5,0
5,0 - 10,0
8
9
VI Нестойкие
> 10
10
XIII. Глубинный показатель коррозии мм/год - проницаемость:
вычисляется из потери веса металла
![]()
К– скорость коррозии, г/м2/час
![]() –удельный
вес металла
–удельный
вес металла
Анализ полученных результатов с выводами.

Фонд отчёта
КФ СП ,,ИЭНТ’’ Студент……………
Кафедра Группа…………….
Лабораторная работа № 2.
Определение скорости коррозии металлов по количеству выделившегося углерода.
Общие сведения о коррозии металлов в электролитах.
Метод определения скорости коррозии по количеству выделившегося водорода. Схема прибора.
Методика выполнения работы.
Таблица результатов опытов с необходимыми расчётами.
Графические зависимости по каждому образцу (на одной координатной сетке)
Анализ полученных результатов и выводы по работе.
Принял____________
