
- •1. Теоретична частина
- •2. Експериментальна частина
- •2.2. Гідроксиди кобальту (іі) і нікелю (іі)
- •2.3. Комплексні сполуки кобальту та нікелю
- •2.4. Хімічні властивості сполук цинку та кадмію
- •2.5. Отримання гідроксиду міді (іі) і дослідження його властивостей
- •2.6. Отримання малорозчинних солей міді (іі).
- •2.7. Відновлювальні властивості сполук марганцю (іі)
- •2.8. Окисно-відновні властивості сполук марганцю (VI)
- •2.9. Окиснювальні властивості сполук марганцю (VII)
- •2.10. Хромати та дихромати
- •3. Питання для самоконтролю
- •4. Задачі і вправи для самостійної роботи
Міністерство освіти і науки України
ДВНЗ «Криворізький національний університет»
Кафедра хімії
МЕТОДИЧНІ ВКАЗІВКИ
до виконання лабораторної та самостійної роботи з теми
«Хімія d-елементів»
для студентів І курсу
всіх спеціальностей
(денної та заочної форм навчання)
м. Кривий Ріг
2014
Укладачі: канд. хім. наук, доц. Часова Е. В.,
канд. біол. наук, доц. Івчук В. В.
Відповідальна за випуск: канд. хім. наук, доц. Часова Е. В.
Рецензент: канд. хім. наук, доц. Мовчан В. В.
Методичні вказівки до виконання лабораторної та самостійної роботи з теми «Хімія d-елементів», містять теоретичну та експериментальну частину, питання для самоконтролю, задачі і вправи для самостійної роботи, список літератури, що рекомендується для самостійного опрацювання.
|
Розглянуто на засіданні кафедри хімії Протокол №_____ від «___»_________2014 р. |
Схвалено на вченій раді факультету рудопідготовки та обробки металів Протокол №_____ від «___»_________2014 р. |
1. Теоретична частина
Загальна характеристика d-елементів
d-Елементами періодичної системи Д. І. Менделєєва називають елементи, в атомах яких валентними електронами є електрони зовнішнього ns- та передостаннього (n-1) d-підрівня. Вони складають І В – VII B групи. d-Елементи називають також перехідними, оскільки вони розташовані в періодичній системі у великих періодах між s- та p-елементами.
На фізичні та хімічні властивості d-елементів суттєво впливають особливості їх електронної будови. З одного боку, (n-1) d-підрівень в міру заповнення електронами сприяє екрануванню зовнішніх ns-електронів, що мусить послабити їх зв'язок з ядром, з іншого – зростання кількості електронів на передостанньому рівні приводить до зменшення атомних радіусів. Це явище, яке має назву d-стискання, переважає, тому, хоча d-елементи і мають металічні властивості, вони менш виражені, ніж у s- та p-металів.
Зверху вниз у групах спостерігають зростання атомних радіусів при переході від 3d- до 4d-елементів і зменшення від 4d- до 5d-елементів. Зменшення атомних радіусів 5d-елементів обумовлено лантаноїдним стисканням і приводить до збільшення енергії іонізації Au та Hg у порівнянні з Ag та Cd і відповідно до зменшення їх металічних властивостей.
Загальна характеристика елементів VIII В групи
VIII В група періодичної системи є особливою. На відміну від інших груп вона містить по три елементи у кожному періоді. Це метали, які, по-перше, не мають типових аналогів, а, по-друге, не утворюють сполук, ступінь окиснення в яких відповідав би повному числу валентних електронів, а саме – восьми.
До складу VIII В групи входять дев’ять d-елементів, що об’єднуються у тріаду (родину) Феруму Fe, Co, Ni та платинові метали, які містять всі інші елементи групи.
Найбільше значення мають метали родини заліза. Зовнішні електрони їх ізольованих атомів мають однакову будову 4s2. При збільшенні заряду ядра атома у цих елементів добудовується 3d-підрівень, ступінь заповнення якого майже не впливає на розміри атомів та іонів.
Фізичні властивості простих речовин
У компактному кристалічному стані залізо, кобальт і нікель – це сріблясто-білі метали, стійкі на повітрі внаслідок утворення захисної оксидної плівки. У дрібнодисперсному стані ці метали пірофорні – самозаймаються на повітрі.
Метали родини заліза схожі за властивостями. Всі ці метали мають велику міцність, пластичність, ковкість. Всі три метали – феромагнетики, вони притягуються магнітом.
На механічні та фізико-хімічні властивості Fe, Co і Ni значний вплив мають домішки інших елементів. Тому при розгляді їх хімічних властивостей мають на увазі властивості чистих металів.
Хімічні властивості металів родини Феруму
Атом Fe – валентні електрони …3d64s2, ступені окиснення +2, +3 (+6 – рідко). Атом Co – валентні електрони …3d74s2, ступені окиснення +2, +3 (+4 – рідко). Атом Ni – валентні електрони …3d84s2, найбільш характерна ступінь окиснення +2 (+3 – нестійка).
Катіони Fe2+ та Fe3+ – активні комплексоутворювачі з координаційним числом 6. В якості лігандів можуть бути: органічні сполуки (білки), CN-, NH3, CO.
Катіони Co2+, Co3+, Ni2+ теж можуть бути комплексоутворювачами. Координаційне число 6. Причому більш стійкі комплексні сполуки кобальту (ІІІ). Лігандами частіше можуть бути: H2O, NH3, CN-, NO2-, CO.
Під час нагрівання метали родини Феруму здатні безпосередньо сполучатися з сіркою, галогенами, киснем, фосфором. Сухий хлор із залізом не взаємодіє, тому його зберігають у стальних балонах. За наявності вологи метали родини Феруму енергійно взаємодіють з хлором:
![]()
![]()
![]()
З сіркою залізо, кобальт і нікель утворюють сульфіди MeS, що мають чорне забарвлення.
У водному середовищі метали родини Феруму майже не кородують. Найстійкіший проти корозії – нікель. Стійкість заліза проти корозії залежить від ступеня його чистоти. Залізо з високим ступенем чистоти не піддається корозії. Технічне залізо у вологому повітрі легко окиснюється і вкривається іржею.
У електрохімічному ряді напруг залізо, кобальт та нікель розташовані ліворуч від водню (між Zn та Sn), тобто це метали середньої хімічної активності.
Вони легко взаємодіють з розчинами кислот, в яких гідроген виступає окисником, з виділенням водню:
![]()
Концентровані H2SO4 та HNO3 пасивують поверхню металів, що дає змогу зберігати і перевозити ці кислоти у залізній тарі.
При нагріванні у концентрованій сульфатній кислоті, залізо розчиняється і утворює сполуки зі ступенем окиснення +3:
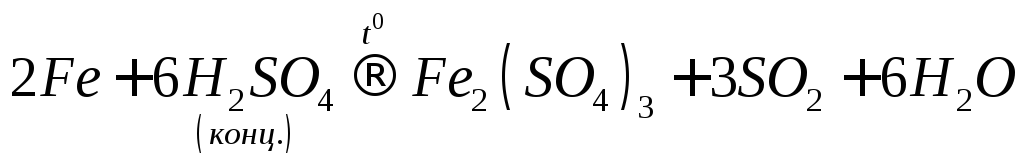
Розведена та помірно концентрована нітратна кислота розчиняє залізо:
![]()
Концентрована HNO3 пасивує залізо.
Залізо, кобальт і особливо нікель належать до небагатьох металів, стійких до розчинів і розплавів лугів.
Чисті метали в компактному стані при кімнатній температурі стійкі по відношенню до води, але у вологому повітрі в нейтральному середовищі відбуваються реакції:
![]()
![]()
Внаслідок корозії щорічно втрачається до 20 % отриманого заліза.
Сполуки феруму (ІІ)
Найбільш важливими сполуками феруму (ІІ) є його солі.
Солі феруму (ІІ) одержують дією на метал розчинами кислот, в яких водень виступає в ролі окисника або розбавлених розчинів кислот, в яких окисником виступає неметал у вищому ступені окиснення. При випарюванні з водних розчинів зазвичай утворюється кристалогідрати зеленого кольору, наприклад: FeSO4·7H2O, Fe(ClO4)2·6H2O, Fe(NO3)2·6H2O, (NH4)2Fe(SO4)2·6H2O (сіль Мора). Сіль Мора найстійкіша на повітрі.
Оксид феруму (ІІ) FeO – кристалічна сполука чорного кольору, нерозчинна у воді. Оксид Fe (II) одержують відновленням оксиду (ІІ, ІІІ) оксидом карбону (ІІ):
![]()
Оксид заліза (ІІ) – основний оксид, який легко реагує з кислотами, при цьому утворюються солі феруму (ІІ):
![]()
Гідроксид феруму (ІІ) Fe(OH)2 – порошок білого кольору з зеленуватим відтінком, нерозчинний у воді. Це основа середньої сили, яка має ознаки амфотерності. Сполуки Fe (II) –є сильними відновниками. Так, наприклад Fe(ОН)2 на повітрі швидко змінює колір – буріє. Зміна кольору обумовлена окисненням Fe(OH)2 у Fe(OH)3 киснем повітря:
![]()
Сполуки феруму (ІІІ)
Сполуки феруму (ІІІ) одержують дією окисників на металічне залізо або окисненням сполук феруму (ІІ).
Найбільш поширеними сполуками феруму (ІІІ) є: Fe2O3, гідрат оксиду Fe2O3·х·Н2О; солі FeCl3·6H2O, Fe2(SO4)3·10H2O, Fe(NO3)3·9H2O, NH4Fe(SO4)2·12H2O – ферум-амонійні галуни.
Сполуки
Fe
(ІІІ) мають окисні властивості:
![]() .
.
Оксид Fe (ІІІ) – червоно-коричневого кольору.
Гідроксид Fe (III) одержують дією лугу на розчини солей феруму (ІІІ):
![]()
Гідроксид феруму (ІІІ) – слабка основа. Але в зв’язку з тим, що аніонні комплекси Fe(III) стійкіші і легше утворюються, ніж аналогічні комплекси Fe(II), свіжоприготований Fe(OH)3 розчиняється у концентрованих лугах, виявляючи тим самим амфотерні властивості:
![]()
При сплавленні Fe2O3 або Fe(OH)3 з лугами чи карбонатами лужних металів утворюються ферити:
![]()
![]()
Дією води ферити повністю гідролізуються:
![]()
Солі
феруму (ІІІ).
У водному розчині солі феруму (ІІІ)
утворюють гексааквакомплекс
![]() червоно-бурого
кольору. Інтенсивність забарвлення
змінюється в залежності від ступеня
гідролізу.
червоно-бурого
кольору. Інтенсивність забарвлення
змінюється в залежності від ступеня
гідролізу.
Солі феруму (ІІІ) гідролізовані сильніше, ніж солі феруму (ІІ). По-перше, це пов’язано з тим, що гідроксид феруму (ІІІ), якому відповідає сіль, є більш слабкою основою, ніж Fe(OH)2, а значить його сіль сильніше гідролізується, по-друге, катіон Fe3+ сильніше поляризує молекули води, що його оточують, ніж катіон Fe2+.
Внаслідок гідролізу водні розчини солей Fe(III) мають сильно кислу реакцію. Механізм гідролізу солей феруму (ІІІ) – дуже складний. Тільки у сильно кислих розчинах (pH < 1) гідроліз солей феруму (ІІІ) пригнічується. Додаванням лугу чи тривалим кип’ятінням водних розчинів гідроліз можна довести до кінця. Внаслідок полімеризації продуктів гідролізу утворюються багатоядерні комплекси, які виділяються з розчинів у вигляді червоно-коричневої колоїдної маси, якій відповідає формула Fe2O3·х Н2О.
Катіони Fe2+ та Fe3+ це активні комплексоутворювачі. Координаційні числа Fe (ІІ) та Fe (ІІІ) дорівнюють 6, рідше – 4. У якості лігандів виступають: органічні сполуки (наприклад білки), CN-, SCN-, NH3, H2O, CO.
Хімічні
властивості сполук феруму (VI).
На відміну від кобальту та нікелю, для
феруму відомі сполуки зі ступенем
окиснення +6. Це головним чином солі
гіпотетичної залізної кислоти H2FeO4
– ферати складу
![]() .
Існує декілька способів їх одержання.
Оскільки іон
.
Існує декілька способів їх одержання.
Оскільки іон![]() досить стійкий тільки у лужних розчинах,
а в нейтральному чи кислому середовищі
розкладається, одержання ферату натрію
або калію відбувається у лужному
середовищі окисненням сполук феруму
(ІІІ) хлором чи бромом:
досить стійкий тільки у лужних розчинах,
а в нейтральному чи кислому середовищі
розкладається, одержання ферату натрію
або калію відбувається у лужному
середовищі окисненням сполук феруму
(ІІІ) хлором чи бромом:
![]() ,
,
або внаслідок сплавлення твердих реагентів:
![]() .
.
Ферати – це червоно-фіолетові кристалічні речовини. Вони мають сильні окиснювальні властивості, які перевершують такий сильний окисник, як перманганат калію:
![]() .
.
Важливі сполуки кобальту та нікелю. Для кобальту та нікелю найбільш характерний ступінь окиснення +2. Головними представниками цього ряду сполук є: оксиди CoO і NiO, відповідні їм гідроксиди Co(OH)2 і Ni(OH)2 та солі типу CoCl2, Co(NO3)2, CoSO4, NiCl2, NiSO4.
Оксиди кобальту (ІІ) CoO (сіро-зелені кристали) та нікелю (ІІ) NiO (зелені кристали) одержують взаємодією простих речовин або термічним розкладом гідроксидів Co(OH)2 і Ni(OH)2, наприклад:
![]()
У зв’язку з тим, що оксиди кобальту (ІІ) і нікелю (ІІ) малорозчинні у воді, відповідні їм гідроксиди утворюються дією лугів на розчини їх солей:
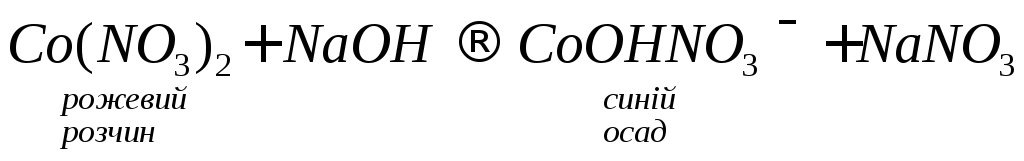
![]()
Похідні кобальту (ІІІ) та нікелю (ІІІ) одержують із сполук Co (ІІ) і Ni (ІІ). Так, гідроксид кобальту (ІІІ) утворюється при окисненні Co(OH)2 пероксидом гідрогену:
![]()
Гідроксид нікелю (ІІ) можна окиснити лише такими сильними окисниками, як Br2 чи KBrO:
![]()
Гідроксиди Co(OH)3 та Ni(OH)3 мають сильні окиснювальні властивості.
Загальна характеристика елементів І В та ІІ В груп
До елементів І В групи періодичної системи належать купрум Cu, арґентум Ag та аурум Au. Хоча усі вони є передостанніми d-елементами у своєму періоді, їх атоми містять на d-підрівні не 9, а 10 електронів. Їх загальна електронна формула валентного рівня (n-1)d10 ns1.
Подібно до елементів І А групи купрум, арґентум та аурум мають по одному електрону на s-підрівні зовнішнього шару, але вони мало схожі на лужні метали.
Мала хімічна активність елементів підгрупи купруму пояснюється ефектом проникнення зовнішнього ns-електрона під екран (n-1)d10-оболонки. Внаслідок цього, порівняно з лужними металами, вони характеризуються набагато більшим значенням першого потенціалу іонізації, відносної електронегативності.
Значення енергії іонізації (еВ) для елементів І А та І В груп
|
Li (5,39) |
Na (5,14) |
K (4,34) |
Rb (4,18) |
Cs (3,89) |
|
Cu (7,73) |
|
Ag (7,58) |
|
Au (9,23) |
Завдяки наявності одного s-електрона у зовнішньому шарі ці елементи мають характерний ступінь окиснення +1. У зв’язку з тим, що відносно легко відбувається збудження та перехід електронів із d- на s-підрівень, елементи підгрупи купруму можуть утворювати сполуки у ступенях окиснення +2 та +3.
Для арґентуму найбільш характерний ступень окиснення +1, для купруму +2, для ауруму +3. Усі вони мають яскраво виражену здатність до комплексоутворення. Як і для більшості d-елементів, із збільшенням ступеня окиснення тенденція до утворення аніонних комплексів зростає. Залежно від ступеня окиснення елементів їх координаційні числа у комплексних сполуках змінюється від 2 до 6.
До ІІ В групи періодичної системи належать цинк Zn, кадмій Cd та меркурій Hg. Усі елементи підгрупи цинку є електронними аналогами та останніми d-елементами відповідних періодів. Електронна конфігурація їх валентних електронів ns2 (n-1)d10. Така електронна конфігурація свідчить про те, що на зовнішньому енергетичному рівні цинк, кадмій та меркурій мають по 2s-електрони, як і елементи ІІ А групи. Однак елементи ІІ В групи мало схожі на лужноземельні метали. Це зумовлено наявністю у них на передостанньому рівні десяти d-електронів, які відсутні у елементів ІІ А групи.
У цинку, кадмію та меркурію радіуси атомів менші, а енергія іонізації вища ніж у металів ІІ А групи. У порівнянні з лужноземельними металами ці елементи мають значно меншу відповідну активність, яка зменшується при переході від цинку до меркурію.
Передостанній електронний рівень атомів цинку, кадмію та меркурію, на відміну від елементів І В групи, є досить стабільними. Тому в утворенні хімічного зв’язку приймають участь лише s-електрони зовнішнього енергетичного рівня.
Цинк, кадмій та меркурій у сполуках виявляють ступінь окиснення +2, але меркурій може утворювати сполуку із ступенем окиснення +1. Мова йде про радикал [Hg2]2+, в якому атоми меркурію зв’язані між собою ковалентним зв’язком – Hg – Hg – . Як показали дослідження, одновалентного меркурію не існує.
За фізичними і особливо за хімічними властивостями ртуть дуже відрізняється від цинку та кадмію.
Загальна характеристика елементів VI В групи
До d-елементів VI B групи періодичної системи відносяться хром Cr, молібден Mo та вольфрам W. В їх атомах добудовуються (n-1) d-підрівні. У зв’язку з тим, що електронна конфігурація d5, яка відповідає наполовину заповненому d-підрівню, є стійкою, d-елементи відповідних періодів прагнуть досягти цього стабільного d5-стану. У хрому і молібдену спостерігають проскок одного електрону з ns- на (n-1) d-підрівень. У вольфраму під зовнішнім ns- та передзовнішнім (n-1) d-підрівнями, на яких містяться валентні електрони, знаходиться завершений 4f14-підрівень. Цей підрівень стабілізує стан атомів без проскоку електрону.
На відміну від р-елементів у d-елементів не спостерігається закономірної зміни енергії іонізації. Так у ряді Cr-Mo-W збільшується перший потенціал іонізації, що зумовлює послаблення металічних властивостей від хрому до вольфраму. Атомні та іонні радіуси молібдену і вольфраму близькі внаслідок лантаноїдного стиску тому вони схожі за фізичними та хімічними властивостями, але істотно відрізняються від хрому.
Згідно з номером групи, в багатьох своїх сполуках хром, молібден та вольфрам знаходяться у ступені окиснення +6, який особливо типовий для молібдену та вольфраму. Крім ступеня окиснення +6, хром має стійкі сполуки у ступені окиснення +2 та +3.
Як і інші d-елементи, хром, молібден та вольфрам утворюють комплексні сполуки з координаційним числом 6 (рідше 4). У нижчому ступені окиснення для них більш характерні катіонні комплекси [Cr(H2O)6]2+, на проміжному – катіонні та аніонні [Cr(H2O)6]3+, [Cr(OH)6]3-, а у вищому ступені окиснення – тільки аніонні CrO42-, [MoF6]2-.
