
Петровский Б.В., Перельман М.И. - Аутотрансплантация лёгкого в эксперименте
.pdf292 |
Глава девятая |
Следовательно, в ткани легкого при консервации в условиях гипотермии (+4°) активность сукцинатдегидрогеназы и малатдегидрогеназы сохранялась в течение 48 часов, а глютаматдегидрогеназы — в течение 24 часов. В последующие сроки активность ферментов цикла Кребса значительно снижалась, определялись лишь конгломераты, состоящие из крупных зерен и глыбок диформазана.
Гликолитический цикл. Для характеристики этого цикла было произведено определение активности 3 ферментов: алкоголъдегидрогеназы, лактатдегидрогеназы и а-глицерофосфатдегидрогеназы.
До консервации в ткани легкого отмечалась умеренная актив ность ферментов в виде мелких зерен диформазана в эпителии бронха и слизистых желез, в клетках альвеолярных перегородок зерна диформазана располагались неравномерно. После консерва ции ткани легкого в течение 24 и 48 часов умеренная активность ферментов гликолитического цикла отмечалась в виде мелких не равномерных зерен диформазана в эпителии бронхов, кроме алкогольдегидрогеназы, активность которой в эпителии бронхов умень шалась уже после 24 часов консервации. Через 72 и 96 часов кон сервации отмечалась очень низкая активность ферментов гликоли тнческого цикла. Диформазан определялся в виде крупных кон гломератов, состоящих из грубых зерен (рис. 137).
Таким образом, проведенное гистохимическое исследование ткани легкого при консервации в условиях гипотермии (при +4°) отражало активность и локализацию основных циклов окислитель но-восстановительных процессов. Эти исследования показали, что в течение первых 24 часов существенных изменений в активности и локализации дегидрогеназ не наблюдалось. Лишь после 48 часов консервации ткани легкого снижалась активность ферментов, о чем свидетельствовало уменьшение количества зерен диформаза на в эпителии бронхов и исчезновение зерен в стенке альвеоляр ных перегородок. Зерна диформазана в эти сроки располагались неравномерно. После 72 часов они были представлены в виде от дельных крупных и грубых зерен и конгломератов зерен, что сви детельствовало о нарушениях окислительно-восстановительных процессов в ткани легких при этих сроках консервации.
Энергетические функции митохондрий легкого при консервации
Изучение метаболизма ткани легкого при консервации имеет определенное значение в комплексной оценке пригодности легко го для последующей трансплантации.
В литературе имеется очень мало сообщений об исследованиях метаболизма ткани легкого при консервации. А. А. Игнатенок
Консервация легкого с отсроченной аутотрансплантацией |
29Л |
(1970) установил электрометрическим методом снижение потреб ления кислорода тканью легкого при консервации от 1 до 6 су ток. К. А. Годзоева (1970) при изучении тканевого дыхания лег кого, консервированного при температуре + 3 ° или при сочетании: с 3 ата 02 , обнаружила через 24 часа резкое повышение потребле ния 02 , тогда как утилизация неорганического фосфора падала. Через 48 часов потребление 02 и утилизация фосфора снижались,, приближаясь к нулю к 72 часам. Содержание молочной кислоты, наоборот, нарастало начиная с 24 часов. Годзоева считала, что че рез 72 часа, когда усиливался распад гликогена и образование мо лочной кислоты, а дыхательный коэффициент становился значи тельно меньше единицы, можно было говорить о начавшемся рас паде белков. J. Takeda (1968) установил, что при консервации:
легкого при + |
4 ° с одновременной |
перфузией |
и вентиляцией тка |
невое дыхание |
снижалось через 8 |
часов до |
50% от исходного. |
Автор высказал предположение, что этот метод может служить одним из показателей жизнеспособности легкого при консерва ции.
В настоящее время появляется все больше доказательств того, что функциональное состояние ткани определяется энергетичес ким метаболизмом в митохондриях, ответственных за энергоснаб жение ткани. В связи с этим представлялось интересным сравнить способность митохондрий легкого к окислению и фосфорилированию непосредственно после удаления легкого и при его консер вации.
В этом разделе изложены результаты полярографического из мерения скоростей потребления кислорода митохондриями в раз ных метаболических состояниях1 .
Были измерены скорости потребления кислорода митохондрия ми легкого в метаболических состояниях: втором (дыхание в сре де с субстратом окисления), третьем (дыхание в среде с субстра том окисления и акцептором фосфата АДФ), четвертом (дыхание после превращения добавленной АДФ в АТФ) и при разобщении окисления и фосфорилирования 2,4-динитрофенолом. Полученные результаты приведены на диаграммах (рис. 138).
Митохондрии, выделенные из только что удаленного легкого, на добавку АДФ отвечали увеличением скорости потребления кис лорода в 2,5 раза (рис. 138, А). Фосфорилирование 0,4 мкг-моле- кулы АДФ длилось 3,3 минуты, после чего митохондрии перехо дили в четвертое метаболическое состояние. Коэффициент фосфо рилирования АДФ/О равнялся 2,7. Добавление 0,04 мкг-моле^- кулы ДНФ приводило к увеличению скорости потребления кисло-
1Исследования проведены в ЦНИЛ им. С. И. Чечулина 1-го ММИ совместно
сканд. биол. наук С. В. Елисеевой и канд. физ.-мат. наук К. И. Ко.товой..
'294 Глава девятая
рода до величины, имевшей место в третьем состоянии. Все это свидетельствовало о наличии сопряжения окисления и фосфори лирования в митохондриях легкого Собаки.
Через 1 минуту после добавления ДНФ скорость потребления кислорода снижалась, что связано с торможением дыхания щавелевоуксусной кислотой, так как торможение устранялось после добавления глютаминовой кислоты.
Обращала на себя внимание высокая скорость потребления кислорода митохондриями в течение 1 —1,5 минуты. Возможно, такое усиление связано с накоплением АДФ в митохондриях за время их выделения и хранения вследствие деятельности АТФаз, которых особенно много в ткани легкого (Диксон, Уэбб, 1966; Збарский, 1955; Павлова, 1962), и с ее фосфорилированием при введении митохондрий в среду инкубации с сукцинатом.
Через сутки консервации добавка АДФ вызывала примерно такое же увеличение скорости потребления кислорода (см. рис. 138, Б) . Скорости потребления кислорода в третьем состоянии и при добавлении ДНФ по-прежнему были равны, причем их ве личины были близки к таковым для митохондрий из только что удаленного легкого. Однако время фосфорилирования добавляе мой АДФ увеличивалось.
Через двое суток консервации (см. рис. 138, В) скорость по требления кислорода митохондриями в третьем состоянии уже не сколько снижалась. Время фосфорилирования добавляемой АДФ увеличивалось примерно в 2 раза: 3 минуты длилось фосфорилирование половинной дозы АДФ (0,2 микрограмм-молекулы). Ко эффициент фосфорилирования АДФ/О снизился до 2,2. Скорость потребления кислорода после добавления ДНФ выше скорости в третьем состоянии. Все это говорило о начавшихся повреждениях в цепи накопления энергии. Однако можно думать, что цепь транс порта электронов к этому сроку еще не была затронута, посколь ку скорости потребления кислорода во втором состоянии и при добавлении ДНФ имели значения, близкие к исходным.
Через 3 суток консервации ткани легкого наблюдались сущест венные повреждения окислительного фосфорилирования (см. рис. 138, Г). Добавление АДФ не вызывало стимуляции дыхания, т. е. налицо было полное разобщение окисления и фосфорилиро вания. Добавление ДНФ продолжало вызывать стимуляцию дыха ния, однако величина скорости потребления кислорода значитель но снизилась, что в совокупности со снижением скорости во вто ром состоянии свидетельствовало о нарушениях и в процессах транспорта электронов.
До последнего |
времени |
изучение |
дыхания ткани, гомогенатов |
|
и митохондрий легкого проводилось |
манометрическим |
методом, |
||
требующим, как |
известно, |
длительной преинкубации |
препарата. |
|

Консервация легкого с отсроченной аутотранснлантацией |
29^ |
.
Р и |
с. |
138. Скорость |
потребления |
кислорода |
митохондриями легкого |
собаки |
||||
при |
консервации в |
условиях |
гипотермии |
( + 4°) |
|
|
||||
На |
оси |
о})динат — скорость |
потребления |
кислорода, на оси |
абсцисс — время пре |
|||||
бывания |
митохондрий в |
полярографической |
ячейке |
|
|
|
||||
А — после удаления |
легкого; Б — через |
1 |
сутки |
консервации; |
В — через 2 |
суток; |
||||
Г — через 3 суток |
|
|
|
|
|
|
|
|
||
296 Глава девятая
Применение полярографического метода позволило зарегистриро вать окисление и фосфорилирование в первые минуты после выде ления митохондрий, т. е. более нативных препаратов. «Закрытый» электрод, обладающий большей стабильностью показаний, чем обычно применяемые «открытые» и «полузакрытые» электроды, дал возможность получить падежные характеристики слабого ды хания митохондрий легкого и их изменения при консервации лег кого.
Обнаружено, что митохондрии, выделенные из только что уда ленного легкого, способны функционировать во всех основных ме таболических состояниях, с величинами дыхательных контролей по Ларди — Велману и Чансу — Вильямсу порядка 2,6 и 1,3. Коэф фициент фосфорилирования АДФ/О для сукцината был порядка 2,7, т. е. значительно выше коэффициента фосфорилирования Р/О, приводимого в литературе для гомогенатов (Коган, 1967) п мито хондрий (Reiss, 1966) легкого. Несмотря на прочное сопряжение окисления и фосфорилирования, свидетельствующее о нативности полученного нами препарата, скорости потребления кислорода (в пересчете на 1 мг белка) были в 5—10 раз ниже таковых для мито хондрий печени. Этот результат подтверждал данные ряда авто ров о низких скоростях дыхания ткани легкого (Коган, 1967; Тринчер, 1960).
Установлено, что суточная консервация ткани легкого не по влияла существенно на энергетические реакции митохондрий. Че рез 2 суток наблюдались нарушения в наиболее чувствительном звене — в цепи накопления энергии, что выражалось в увеличении в 2 раза времени фосфорилирования, хотя способность к фосфорилированию добавленной АДФ и к переходу в четвертое состояние сохранялась. Через 3 суток консервации наблюдались существен ные повреждения как фосфорилирования, так и окисления.
Улътраструктура при отсроченной аутотрансплантации легкого '
Изучению ультраструктурной организации легкого посвящено много работ (Schulz, 1959; Поликар, Бо, 1962; Low, 1961; КНка, 1965; Романова, 1971), но лишь в единичных исследованиях при трансплантации и консервации легкого применялся электрон но-микроскопический метод исследования (Tsuyi et al., 1964; Сидоркин, 1966; Noirclerc et al., 1970; Рабинович и др. 1970; Masenti etal., 1971).
Исследования проведены в ЦНИЛ ЦОЛИУВ совместно с канд. биол. наук В. В. Глаголевой.

Консервация легкого с отсроченной аутотрансплантацией |
297 |
Рис. |
139. |
Ультраструктура стенки |
альвеолы |
интактного |
легкого |
собаки. |
|||
Видны |
цитоплазматические |
отростки |
клеток |
альвеолярного |
эпителия, |
базаль- |
|||
ная мембрана и |
цитоплазматические |
отростки |
эндотелия капилляров, |
Х.13 50uj |
|||||
АЭ — альвеолярный |
эпителий; |
ЭНД — эндотелий |
капилляров; |
ВПА — воздушное |
|||||
пространство |
альвеолы; БЫ — базальная мембрана; |
ОТ — осмиофильные |
тельца; |
||||||
ЦГ — цитоплазматические гранулы; К — коллагеновые |
волокна |
|
|
||||||
Известно, что стенка альвеолы состоит из клеток поверхност ного легочного эпителия (малые клетки) с одной стороны, грани чащих с воздушным пространством альвеолы, а с другой — плотно примыкающих к базальной мембране альвеолярных клеток (боль шие клетки) и эндотелия мелких кровеносных капилляров.
Малые альвеолярные клетки или клетки поверхностного ле гочного эпителия содержат ядро округлой или овальной формы, которое занимает почти всю уплощенную клетку. В сторону от клетки отходят цитоплазматические отростки, в которых сравни тельно редко встречаются мелкие округлые митохондрии.
Наиболее характерной особенностью больших альвеолярных клеток является наличие в их цитоплазме крупных осмиофильных тел, в матриксе которых располагаются мембранные структу ры. В центре клетки находится округлое ядро, митохондрии име-

298 |
Глава девятая |
Рис. |
140. |
Часть большой |
альвеолярной клетки интактного легкого собаки. |
Видны |
плотные осмиофильные |
тельца, X13 500 |
|
Я — ядро, остальные обозначения те же, что и на рис. 139 |
|||
ют плотный матрикс и небольшое число |
крист, агранулярный |
эндоплазматический ретикулум представлен |
системой пузырьков |
и трубочек различного диаметра. |
|
Ei настоящее время считается, что осмиофильные тела больших альвеолярных клеток содержат лшгопротеины и служат для фор мирования липопротеиновои пленки, выстилающей поверхность альвеолы. Основное назначение этой пленки — поддерживать по верхностное натяжение альвеолы и препятствовать проникновению жидкости в ее просвет, она также предохраняет цитоплазму кле ток, составляющих альвеолу, от подсыхания и облегчает газооб мен. Кроме того, липопротеиновая пленка поверхности альвеолы обладает бактерицидными свойствами, лизируя микроорганизмы (Macklin, 1954; Pattle et al., 1961; Comroe, 1962).
Структура эндотелиальных клеток капилляров легкого имеет типичное строение. Околоядерная расширенная часть эндотели альных клеток содержит мелкие митохондрии, аппарат Гольджи,

Консервация легкого с отсроченной аутотрансплантацией |
299 |
Рис. |
141. |
Участок |
альвеолярной |
стенки |
интактного |
легкого |
собаки. |
Видны |
|||
цитоплазматические |
отростки эндотелиалъных |
клеток |
капилляров, |
базалъ- |
|||||||
ная |
мембрана |
и |
цитоплазматический отросток |
клетки |
альвеолярного |
эпите |
|||||
лия, |
к стенке |
клетки |
альвеолярного |
эпителия прилегает |
фибробласт, У, 13 500 |
||||||
ПК — просвет |
|
капилляров; М — митохондрии; |
ГЭР — гранулярный |
эндоплазматиче- |
|||||||
спий ретикулум; ФБ — фибробласт. |
|
|
|
|
|
|
|||||
Остальные обозначения те же, что и на рис. 139, 140 |
|
|
|
|
|||||||
элементы гранулярного и агранулярного эндоплазматического ретикулума, гранулы гликогена и рибосомы. Истонченные части этих клеток, как правило, лишены клеточных органелл и содержат большое число пиноцитозных пузырьков.
Исследование ультраструктуры нормального легкого собаки до консервации свидетельствует, что цитоплазматические отростки клеток альвеолярного эпителия содержат небольшое количестве клеточных органелл. Цитоплазматические отростки плотно приле гают к базальной мембране, а с другой стороны к базальной мем бране примыкают цитоплазматические отростки эндотелия капил ляров. Между эндотелиальными и альвеолярными клетками нахо дятся пучки коллагеновых волокон. В цитоплазме альвеолярных клеток находится лопастное ядро, митохондрии, имеющие неболь шое число крист и плотный матрикс, цитоплазматические гранулы, пузырьки агранулярного эндоплазматического ретикулума, круп ные осмиофильные тела (рис. 139).

300 |
Глава девятая |
Рис. 142. Легкое собаки после консервации в течение 2 часов при + 4 и. отсроченной аутотрансплантации
а—ультраструптура стенки альвеолы, Х15000; б— видны отростки альвеолярных клеток, содержащие набухшие митохондрии, У.10 000; ПП — пиноцитозные пузырьки; остальные обозначения те же, что па рис. 139—Ш
Консервация легкого с отсроченной аутотрансплантацией |
301 |
Рис. |
143. |
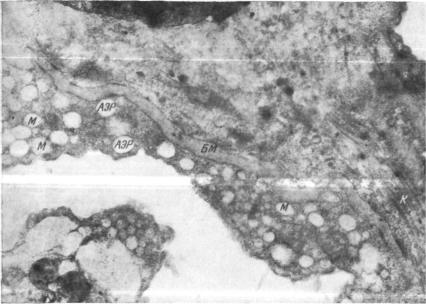
Легкое собаки после консервации в течение 24 часов при -\-4° и |
отсроченной |
аутотрансплантации. Стенка альвеолы. Вакуолизация цитоплаз |
|
мы |
клеток |
альвеолярного эпителия. Митохондрии имеют пузырьковидную |
структуру, |
кристы разрушены, Х7000 |
|
Обозначения те же, что на рис. 139—142. |
||
В большой альвеолярной клетке располагается лопастное ядро, плотные осмиофильные тельца, ограниченные мембраной, в матриксе которых видны плотные пластинчатые структуры, имеется
много |
цитоплазматических гранул. Край клетки неровный |
(рис. |
140). |
Участок альвеолярной стенки содержит капилляры, между ко торыми располагаются отростки клеток альвеолярного эпителия и фибробласты. Цитоплазма фибробластов занята развитым грану лярным эндоплазматическим ретикулумом (рис. 141).
После отсроченной аутотрансплантации с консервацией в те чение 2 часов изменения ультраструктурной организации легкого незначительны. Ультраструктура большинства клеток альвеолы не изменена по сравнению с таковой интактного легкого, хотя встре чаются отдельные клетки с некоторыми нарушениями ультра структурной организации. Митохондрии некоторых клеток поверх ностного легочного эпителия набухают, наблюдается небольшая
