
- •Основы молекулярной физики и термодинамики
- •12. 1. Статистический и термодинамический методы исследования.
- •12. 2. Основные понятия термодинамики и молекулярной физики.
- •12. 2. 1. Основные понятия термодинамики.
- •12. 2. 2.. Молекулярная физика.
- •12. 2. 3.. Агрегатные состояния вещества.
- •12. 2. 4. Единицы измерений молекулярной физики.
- •12. 2. 5. Броуновское движение.
- •12. 2. 6. Модель идеального газа.
- •12. 2. 7. Микро- и макросостояния. Уравнение состояния.
- •12. 3. Молекулярно – кинетический смысл макроскопических параметров.
- •12. 3. 1. Давление.
- •12. 3. 2. Температура.
- •12. 3. 2. 1.Шкала Кельвина.
- •12. 3. 2. 2.Шкала Цельсия.
- •12. 4. Реальные газы.
- •12. 4. 1. Силы межмолекулярного взаимодействия.
- •Т.К. При отталкивании расстояние между молекулами увеличивается, то будем считать, что сила отталкивания имеет положительное значение, а сила притяжения – отрицательное.
- •12. 4. 2. Уравнение Ван-дер-Ваальса.
- •12. 4. 2. 1. Изотермы Ван-дер-Ваальса.
Т.К. При отталкивании расстояние между молекулами увеличивается, то будем считать, что сила отталкивания имеет положительное значение, а сила притяжения – отрицательное.
На
расстоянии r = r0
(см. рис. 12.4) модули сил притяжения и сил
отталкивания равны, т.е. уравновешены.
r0 –
это расстояние между молекулами, на
котором они находились бы в отсутствии
теплового движения, или, по-другому,
равновесное расстояние. На расстоянии
![]() 10–9
м силы межмолекулярного взаимодействия
отсутствуют или стремятся к нулю.
10–9
м силы межмолекулярного взаимодействия
отсутствуют или стремятся к нулю.
|
|
При постепенном сближении молекул между ними появляются силы притяжения, которые совершают положительную работу (сила отрицательна, а расстояние уменьшается). Тогда потенциальная энергия взаимодействия уменьшается, достигая при r = r0 минимума. При дальнейшем уменьшении r силы отталкивания резко возрастают по величине, и совершаемая |
|
Рисунок 12.4. |
против них работа отрицательна. Потенциальная энергия начинает резко возрастать и становится положительной.
Из потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия обладает минимальной энергией.
Критерием различных агрегатных состояний вещества является соотношение между величинами Пmin и kT. Пmin определяет работу, которую необходимо совершить против межмолекулярных сил для того, чтобы удалить молекулы, находящиеся в состоянии равновесия при r = r0 на бесконечно большое расстояние. Величина kT определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического теплового движения молекул.
Если Пmin >> kT, то вещество находится в твердом состоянии, т.к. молекулы, не могут удалиться на значительные расстояния и совершают колебания около положения равновесия r0.
Если
Пmin ![]() kT,
то вещество находится в жидком
состоянии,
т.к. в результате теплового движения
молекулы перемещаются в пространстве
обмениваясь местами, сохраняя между
собой расстояние близкое к r0.
kT,
то вещество находится в жидком
состоянии,
т.к. в результате теплового движения
молекулы перемещаются в пространстве
обмениваясь местами, сохраняя между
собой расстояние близкое к r0.
Если Пmin << kT, то вещество находится в газообразном состоянии, т.к. за счет свей кинетической энергии теплового движения молекулы способны покинуть потенциальную яму.
Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твердом агрегатном состоянии, причем температура перехода зависит от Пmin для данного вещества.
12. 4. 2. Уравнение Ван-дер-Ваальса.
Развитие физики и техники на рубеже 19 и 20 веков потребовало описания газов при достаточно высоких давлениях в широком диапазоне температур, когда расстояния между молекулами становятся сравнимы с размерами молекул. Решение данной проблемы голландский физик Ван-дер-Ваальс построил следующим образом. Он при составлении уравнения реального газа учел такие обстоятельства как то, что молекулы обладают собственным объемом, а большую часть времени молекулы находятся под действием сил межмолекулярного притяжения. Таким образом, Ван-дер-Ваальсом в уравнение Клапейрона - Менделеева были введены две поправки.
1)
Первая поправка обусловлена наличием
сил отталкивания, которые противодействуют
проникновению в занятый молекулой объем
других молекул. Тогда фактически
свободный объем, в котором может двигаться
молекула реального газа, будет не
![]() ,
а
,
а![]() ,
где
,
где![]() – объем, занимаемый собственно молекулами
в одном моле вещества. Объем
– объем, занимаемый собственно молекулами
в одном моле вещества. Объем![]() равен учетверенному собственному объему
молекул. (Если в сосуде находится две
молекулы, то центр любой из них не может
приблизиться к центру другой молекулы
на расстояние меньше диаметра
равен учетверенному собственному объему
молекул. (Если в сосуде находится две
молекулы, то центр любой из них не может
приблизиться к центру другой молекулы
на расстояние меньше диаметра![]() молекул. Следовательно, для центров
обеих молекул оказывается недоступным
сферический объем радиуса
молекул. Следовательно, для центров
обеих молекул оказывается недоступным
сферический объем радиуса![]() ,
т.е. объем равный восьми объемам молекул,
или учетверенному объему молекулы в
расчете на одну молекулу).
,
т.е. объем равный восьми объемам молекул,
или учетверенному объему молекулы в
расчете на одну молекулу).
2) Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением.Ван-дер-Ваальса показал, что в этом случае внутреннее давление обратно пропорционально квадрату молярного объема:
![]()
где
![]() – постоянная Ван-дер-Ваальса,
характеризующая силы межмолекулярного
притяжения,
– постоянная Ван-дер-Ваальса,
характеризующая силы межмолекулярного
притяжения,![]() - молярный объем газа.
- молярный объем газа.
Вводя эти поправки, Ван-дер-Ваальс получил уравнение для моля газа, или уравнение состояния реального газа:
|
|
(12.25) |
Для произвольного количества вещества газа получим:
|
|
(12.26) |
где
![]() и
и![]() – постоянные для данного газа величины,
определяемые опытным путем. (Для
их определения записывается уравнение
Ван-дер-Ваальса для двух известных из
опыта состояний газа и система решается
относительно a
и b).
– постоянные для данного газа величины,
определяемые опытным путем. (Для
их определения записывается уравнение
Ван-дер-Ваальса для двух известных из
опыта состояний газа и система решается
относительно a
и b).
Отметим, что при выводе уравнения Ван-дер-Ваальса сделан целый ряд упрощений, поэтому оно также является приближенным, хотя особенно для сильно сжатых газов, хорошо согласуется с опытами в отличии от уравнения состояния идеального газа.


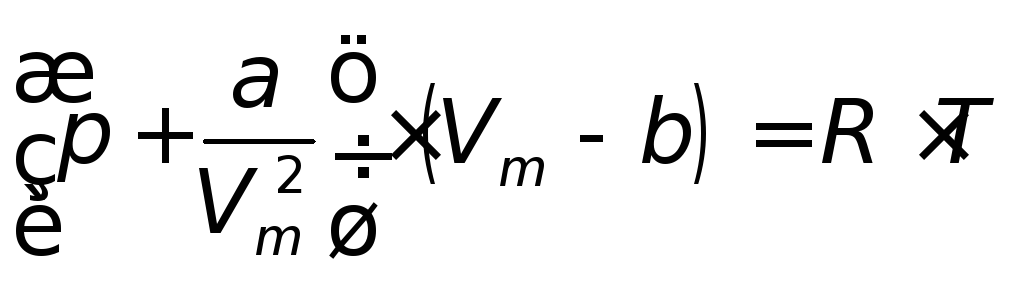 .
.