
Автореферат-06.07.2014
.pdfНа правах рукописи
ГЕРАСИМОВ ДМИТРИЙ АЛЕКСАНДРОВИЧ
ХИМИКО-ТОКСИКОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ НИМЕСУЛИДА И БЛИЗКИХ ПО СТРУКТУРЕ СОЕДИНЕНИЙ
14.04.02 – фармацевтическая химия, фармакогнозия
АВТОРЕФЕРАТ диссертации на соискание ученой степени
кандидата фармацевтических наук
Курск– 2014
Работа выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Курский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Научные руководители:
доктор фармацевтических наук, профессор, Шорманов Владимир Камбулатович доктор биологических наук, профессор, Сипливая Любовь Евгеньевна
Официальные оппоненты:
Саломатин Евгений Михайлович - доктор фармацевтических наук, профессор, Федеральное государственное бюджетное учреждение «Российский центр судебномедицинской экспертизы» Минздрава России, лаборатория судебно-химических и химико-токсикологических научных и экспертных исследований, судебный эксперт (химик) высшей квалификационной категории Сливкин Алексей Иванович - доктор фармацевтических наук, профессор,
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Воронежский государственный университет», фармацевтический факультет, заведующий кафедрой фармацевтической химии и фармацевтической технологии
Ведущая организация: Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Российский университет дружбы народов» (РУДН)
Защита состоится «10» октября 2014 г. В 12-00 часов на заседании диссертационного совета Д 208.039.03 при Государственном бюджетном образовательном учреждении высшего профессионального образования «Курский государственный медицинский университет» Министерства здравоохранения Российской Федерации (305041, г. Курск, ул. К. Маркса, д.3).
С диссертацией можно ознакомиться в библиотеке и на сайте ГБОУ ВПО КГМУ Минздрава России, www.kurskmed.com/diss2/load/uploads/cbc97e8.pdf
Автореферат разослан « |
» |
2014 г. |
Ученый секретарь |
|
|
диссертационного совета |
|
Овод Алла Ивановна |
2
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Нимесулид (N-(4-нитро-2-феноксифенил)- метансульфонанилид) применяется в медицине как нестероидное противовоспалительное лекарственное средство. Близкими по структуре к нимесулиду являются 4- нитроанилин (базовая структура), N-(4-амино-2-феноксифенил)- метансульфонанилид и N-(4-метансульфониламино-3-феноксифенил)-ацетамид (метаболиты нимесулида), 4-нитро-2-феноксианилин (фармакопейная примесь нимесулида), N-(4-гидрокси-2-феноксифенил)-метансульфонанилид (вновь синтезированное вещество).
Рассматриваемые соединения токсичны для теплокровных и человека. LD50 нимесулида для крыс при внутрижелудочном введении, например, составляет 200 мг/кг, LD100 4-нитроанилина – 600 мг/кг. Токсичность данной группы веществ чаще всего сопряжена с нарушением функций печени и почек.
Зарегистрированы частые случаи летального отравления человека нимесулидом и 4-нитроанилином. Отравления ими могут происходить в процессе производства веществ, при попадании их в атмосферу и сточные воды предприятий, при приёме завышенных доз или суицидальных попытках.
Широкое применение нимесулида и 4-нитроанилина, их токсические свойства, наличие случаев отравлений с летальным исходом обуславливают необходимость изучения этих соединений в химико-токсикологическом отношении. Для более надежного доказательства отравлений нимесулидом необходимо изучение его близких структур, в том числе и его метаболитов, как потенциальных объектов химико-токсикологического анализа.
Степень разработанности темы исследования. До настоящего времени недостаточно разработаны вопросы изолирования рассматриваемых веществ из биоматериала, их очистки, обнаружения, идентификации и количественного определения. Недостаточно изучены закономерности их распределения в теплокровных организмах. В доступной литературе отсутствуют данные по сохраняемости рассматриваемых веществ в трупном материале.
Исходя из вышеизложенного, разработка методик химикотоксикологического исследования нимесулида и близких по структуре соединений является актуальной.
Цель исследования. Целью настоящего исследования является разработка методик химико-токсикологического анализа нимесулида и близких по структуре соединений.
Задачи исследования. Для достижения поставленной цели необходимо было решить следующие задачи:
провести подбор условий синтеза из нимесулида рабочих стандартных образцов 4-Н-2-ФА, 4-А-2-ФФМСА, 4-МСА-3-ФФА, 4-Г-2-ФФМСА и определить условия их очистки;
установить структуру и содержание основного вещества в полученных субстанциях;
изучить особенности электронных, колебательных и ЯМР 1Н спектров объектов исследования;
определить характер хроматографической активности исследуемых веществ в тонких слоях и колонках различных сорбентов при использовании методов ТСХ, макроколоночной хроматографии низкого давления, ВЭЖХ и ГХ-МС;
3
изучить распределение исследуемых веществ в системах из несмешивающихся жидкостей;
исследовать особенности изолирования объектов изучения из биологического материала настаиванием с изолирующими агентами различной химической природы и различного состава, разработать схемы очистки извлечений;
изучить распределение исследуемых веществ в органах и биожидкостях теплокровных животных;
определить сроки сохранения рассматриваемых веществ в гнилостноразлагающемся трупном материале.
Научная новизна. Определены оптимальные условия синтеза из нимесулида рабочих стандартных образцов 4-Н-2-ФА, 4-МСА-3-ФФА, 4-Г-2- ФФМСА и предложены схемы их очистки. Изучены особенности поглощения анализируемыми веществами УФ-, видимого и ИК-излучения. Исследованы ЯМР 1Н-спектры данных структур.
Изучены особенности масс-спектров изучаемых веществ, полученных методом электронного удара. Показана возможность селективного и высокочувствительного определения данных соединений по совокупности характеристических сигналов осколков молекулы в масс-спектре и времени удерживания в капиллярной колонке при идентификации методом ГХ-МС.
Определены оптимальные условия и рассчитаны параметры хроматографирования исследуемых веществ методами ТСХ, ВЭЖХ и макроколоночной хроматографии низкого давления в условиях применения нормальнофазовых и обращеннофазовых сорбентов.
Разработаны методики идентификации и количественного определения объектов исследования спектральными и хроматографическими методами.
Выявлены основные параметры и условия очистки нимесулида и близких по структуре соединений от соэкстрактивных веществ биоматериала методами жидкость-жидкостной экстракции и хроматографии.
Впервые обосновано применение ацетона в качестве универсального изолирующего агента для извлечения нимесулида и близких по структуре соединений из биоматериала. На основе использования ацетона как изолирующего агента и очистки методами жидкость-жидкостной экстракции и хроматографии в тонких слоях и колонках сорбентов разработаны оригинальные методики определения рассматриваемых соединений в ткани трупных органов и биожидкостях, приемлемые как для исследования свежего, так и гнилостноизмененного трупного материала.
В эксперименте на животных (крысы) исследованы особенности распределения рассматриваемых веществ в организме теплокровных.
Изучена сохраняемость рассматриваемых отравляющих агентов и их трансформация в гнилостно-разлагающемся трупном материале в зависимости от температурного режима и продолжительности сохранения.
Теоретическая и практическая значимость работы. Результаты химико-
токсикологического исследования нимесулида и близких по структуре соединений позволяют расширить знания о химических и физико-химических свойствах анализируемых веществ. Полученные данные составляют основу для разработки и внедрения в практику методик химико-токсикологического анализа изучаемых веществ.
4
На основании проведенных исследований разработаны два варианта практических рекомендаций к проведению химико-токсикологических исследований при отравлении отдельными производными 4-нитроанилина и нимесулидом.
Внедрены и апробированы результаты работы:
методика идентификации нимесулида и его метаболитов (4-амино-2- феноксифенилметансульфонамида и 4-ацетиламино-2-феноксифенилметан- сульфонамида) методами ТСХ и УФ-спектрофотометрии внедрена в учебную и научную работу кафедры фармацевтической химии и фармакогнозии Белгородского государственного национального исследовательского университета (акт внедрения № 32 от 21.09.12 г.); методика очистки нимесулида и его метаболитов (4-амино-2-феноксифенилметансульфонамида и 4-ацетиламино-2- феноксифенилметан-сульфонамида) методами жидкость-жидкостной экстракции и нормальнофазовой колоночной хроматографии внедрена в учебную и научную работу кафедры фармацевтической химии и фармакогнозии Белгородского государственного национального исследовательского университета (акт внедрения № 31 от 21.09.12 г.); методика изолирования 4-нитроанилина и нимесулида из ткани печени и определения методами ТСХ и УФ-спектрофотометрией внедрена в учебную и научную работу кафедры фармацевтической химии и фармацевтической технологии Воронежской государственной медицинской академии им. Н.Н. Бурденко (акт внедрения № 62 от 17.04.12 г.); методика изолирования 4- нитроанилина и нимесулида из крови, плазмы крови и определения методами ТСХ
иУФ-спектрофотометрией внедрена в учебную и научную работу кафедры фармацевтической химии и фармацевтической технологии Воронежской государственной медицинской академии им. Н.Н. Бурденко (акт внедрения № 63 от 17.04.12 г.); методика концентрирования и выделения в чистом виде нимесулида и 4-нитро-2-феноксианилина из растворов методом колоночной хроматографии низкого давления внедрена в учебную и научную работу кафедры биологической и химической технологии Курского государственного медицинского университета (акт внедрения № 48 от 25.05.12 г.); методика концентрирования и количественного определения нимесулида и 4-нитро-2-феноксианилина методом хроматоспектрофотометрии внедрена в учебную и научную работу кафедры биологической и химической технологии Курского государственного медицинского университета (акт внедрения № 49 от 25.05.12 г.); методика изолирования нимесулида, 4-нитроанилина и 4-нитро-2-феноксианилина из ткани печени и определения методами ТСХ и УФ-спектрофотометрией апробирована в экспертно-криминалистическом центре УМВД по Орловской области (акт апробации № 3 от 01.06.12 г.); методика изолирования нимесулида, 4- нитроанилина и 4-нитро-2-феноксианилина из мочи и определения методами ТСХ
иУФ-спектрофотометрией апробирована в экспертно-криминалистическом центре УМВД по Орловской области (акт апробации № 4 от 01.06.12 г.).
Методология и методы исследования. Методологической составляющей диссертационного исследования стали фармакопейные статьи предприятия, а также труды отечественных ученых [В.К. Шорманова, 2004; А.С. Зайцевой, 2012].
Вдиссертационной работе использованы химические (титриметрия), физико-химические (ядерно-магнитный резонанс 1Н, спектрофотометрия, высокоэффективная жидкостная хроматография и газовая хроматография,
5
жидкостная колоночная хроматография низкого давления, жидкость-жидкостная экстракция).
Основные положения, выносимые на защиту:
условия синтеза из нимесулида 4-Н-2-ФА, 4-А-2-ФФМСА, 4-МСА-3-ФФА, 4-Г- 2-ФФМСА и особенности очистки указанных соединений;
особенности поглощения анализируемыми веществами электромагнитного
излучения в УФ-, видимой, ИК-областях спектра и резонансного поглощения радиочастотной электромагнитной энергии (ЯМР 1Н);
результаты исследования хроматографического поведения рассматриваемых соединений в тонких слоях и колонках сорбентов с гидроксилированной и привитой поверхностями;
методики идентификации и количественного определения рассматриваемых веществ методами хроматографии, фотометрии и хромато-масс-спектрометрии;
результаты исследования особенностей очистки исследуемых веществ методами жидкость-жидкостной экстракции и хроматографии;
методики изолирования объектов исследования из тканей органов и биожидкостей на основе настаивания с ацетоном и очистки от соэкстрактивных веществ биоматериала;
распределение анализируемых соединений в организме теплокровных животных и сохраняемость исследуемых соединений в трупном материале.
Степень достоверности и апробация результатов. Достоверность
полученных результатов обусловлена использованием современных и высокотехнологичных методов исследования. Значительный объем проведенных исследований отражен в виде таблиц, графиков и рисунков. Достоверность разработанных методик количественного определения изучаемых веществ подтверждается путем их валидации и статистической обработки по требованиям ГФ XI с использованием пакета прикладных программ «Microsoft Excel 2013».
Основные положения работы представлены и доложены на Всероссийской научно-практической конференции с международным участием «Традиции и инновации фармацевтической науки и практики» (Курск, 2011 г.), на Итоговых научных конференциях сотрудников КГМУ «Университетская наука: Взгляд в будущее» (Курск, 2011 г., 2013 г.), на IV, V и VI Всероссийских научнопрактических конференциях с международным участием: «Биомедицинская инженерия и биотехнология» (Курск, 2011 г., 2012 г., 2013 г.), на Четвертой международной дистанционной научной конференции «Инновации в медицине» (Курск, 2011 г.), на Всероссийской научно-практической интернет-конференции с международным участием «Современные аспекты разработки и совершенствования состава и технологии лекарственных форм» (Курск, 2011 г.), на XVIII Российском национальном конгрессе «Человек и лекарство» (Москва, 2011 г.), на Научно-практической конференции с международным участием «Актуальные проблемы судебно-медицинской экспертизы» (Москва, 2012 г.), на 77-ой Всероссийской научной конференции с международным участием «Молодежная наука и современность» (Курск, 2012 г.), на V Международной научно-методической конференции «Пути и формы совершенствования фармацевтического образования. Создание новых физиологически активных веществ» (Воронеж, 2013 г.), на IX Всероссийской конференции «Химия и медицина» с Молодежной научной школой (Уфа-Абзаково, 2013 г.).
6
Связь задач исследования с проблемным планом фармацевтических наук. Диссертационная работа выполнена по плану научно-исследовательских работ кафедры фармацевтической, токсикологической и аналитической химии Курского государственного медицинского университета и соответствует проблеме «Фармация» межведомственного научного совета № 36 РАМН и научной проблеме 35.04 «Научные проблемы судебно-медицинской токсикологии, токсикологической и судебной химии» по специальности «Судебная медицина» при РАМН. Номер госрегистрации 01201157804.
Публикации. Содержание работы отражено в 36 публикациях, 6 из них в журналах, рекомендуемых ВАК к опубликованию материалов диссертационных исследований. Имеется 1 положительное решение о выдаче патента.
Объем и структура диссертации. Диссертация состоит из введения, обзора литературы (глава 1), экспериментальной части (главы 2, 3, 4, 5 и 6), выводов, списка литературы, приложения, изложенного на 154 страницах. Диссертационная работа изложена на 144 страницах машинописного текста, содержит 21 таблицу и 17 рисунков. Библиографический список состоит из 246 источников, в том числе 151 – на иностранном языке.
В автореферате используются следующие сокращения: 4-А-2-ФФМСА – N-(4-амино-2-феноксифенил)-метансульфонанилид; 4-Г-2-ФФМСА – N-(4- гидрокси-2-феноксифенил)-метансульфонанилид; 4-НА – 4-нитроанилин; 4-Н-2- ФА – 4-нитро-2-феноксианилин; 4-МСА-3-ФФА – N-(4-метансульфониламино-3- феноксифенил)-ацетамид; ВЭЖХ – высокоэффективная жидкостная хроматография; ГХ-МС – газовая хроматография с масс-спектрометрическим детектированием; ДМСО – диметилсульфоксид; ДМФА – диметилформамид; ИК – инфракрасный; НД – нормативный документ; НФ-ВЭЖХ – нормальнофазовая высокоэффективная жидкостная хроматография; НФ-Кл – нормальнофазовая жидкостная колоночная хроматография; НФ-ТСХ – нормальнофазовая тонкослойная хроматография; ОФ-ВЭЖХ – обращеннофазовая высокоэффективная жидкостная хроматография; ОФ-Кл – обращеннофазовая жидкостная колоночная хроматография; ОФ-ТСХ – обращеннофазовая тонкослойная хроматография; ТСХ
– тонкослойная хроматография; УФ – ультрафиолетовый; ФСП – фармакопейная статья предприятия; ЯМР – ядерно-магнитный резонанс; LD50 – полулетальная доза вещества; LD100 – смертельная доза вещества.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В работе использованы: нимесулид (НМС), субстанция, НД N 012824/03040411, дополнительно очищенный перекристаллизацией (tпл=148-149 °С); 4- нитроанилин (4-НА) ч.д.а. ТУ-6-09-258-87; синтезированные и очищенные образцы 4-нитро-2-феноксианилина (4-Н-2-ФА); 4-амино-2-феноксифенилметансульфон- анилида (4-А-2-ФФМСА); N-(4-метансульфониламино-3-феноксифенил)-ацет- амида (4-МСА-3-ФФА); N-(4-гидрокси-2-феноксифенил)-метансульфонанилида (4- Г-2-ФФМСА); нитразепам (НТЗ), субстанция, ФСП-0034632105 (дополнительный объект исследования). Применены методы ТСХ, макроколоночной хроматографии низкого давления, ВЭЖХ, электронной и ИК-спектрофотометрии, ГХ-МС, ЯМР 1Н. Методики определения разработаны на модельных смесях с известным содержанием определяемого вещества. Результаты обрабатывались в соответствии
7
с установленными требованиями с использованием пакета прикладных программ
«Miсrosoft Excel».
Синтез рабочих стандартных образцов. На основе нимесулида, по методикам разработанным в нашей лаборатории, были синтезированы 4-Н-2-ФА, 4-А-2-ФФМСА, 4-МСА-3-ФФА, 4-Г-2-ФФМСА (рисунок 1).
4-Н-2-ФА (2) получен в результате кислотного гидролиза нимесулида (1). Наиболее приемлемым оказалось использование серной кислоты, как наиболее сильного гидролизующего агента. Во избежание образования побочных продуктов окисления и перегрева реакционной смеси использована серная кислота 60%, обладающая температурой кипения близкой к температуре плавления (148-149 °С) гидролизуемого нимесулида, что обуславливает малое время синтеза 4-Н-2-ФА (3- 5 минут). Продукт очищен перекристаллизацией и колоночной хроматографией, кристаллизован из ацетона, представляет собой желто-зеленый кристаллический
порошок, tпл=114-116 °С. УФ (этанол) λmax/нм 209,8 (lg ε 4,33), 262,4 (lg ε 3,80), 376,1 (lg ε 4,13); ИК (KBr) νmax/см-1 1025, 1155, 1263, 1336, 1516, 1587, 3198, 3236, 3350, 3473; ЯМР 1Н (300 MГц, ДМСО-d6) δ 6,26 (с, 1Н), 6,82 (д, 1Н), 7,46 (т, 2Н), 7,52 (с, 1Н); Масс-спектр (m/z) 230 (М+, 99,9%), 77 (23,3%), 52 (22,4%), 51 (22,1%), 200 (19,4%).
4-А-2-ФФМСА (3) получен в результате восстановления ароматической нитрогруппы нимесулида (1). Оптимальным восстановителем явилось металлическое олово в среде хлороводородной кислоты концентрированной с добавлением этанола. Восстановление нимесулида возможно в указанных условиях при кипении реакционной смеси в течение 2-2,5 часов. Продукт очищен перекристаллизацией и колоночной хроматографией, кристаллизован из ацетона, представляет собой бесцветные игольчатые кристаллы или белый с сероватым оттенком кристаллический порошок. Возможно окисление на свету. tпл=164-166 °С.
УФ (этанол) λmax/нм 219,5 (lg ε 4,53), 249,7 (lg ε 4,14), 298,4 (lg ε 3,48); ИК (KBr) νmax/см-1 985, 1105, 1463, 1583, 3037, 3329, 3398; ЯМР 1Н (300 MГц, ДМСО-d6) δ 2,78 (с, 3Н), 4,88 (с, 2Н), 6,29 (д, J 7,2 Гц, 1Н), 6,95-7,12 (м, 1Н+3Н), 8,48 (с, 1Н); Масс-спектр (m/z) 199 (99,9%), 171 (69,8%), 77 (19,7%), 51 (16,8%), 278 (М+, 14,5%).
4-МСА-3-ФФА (4) получен ацетилированием ароматической аминогруппы 4-А-2-ФФМСА (3). Оптимальные условия синтеза целевого продукта достигаются при использовании избытка ацетилирующего агента – ангидрида уксусной кислоты и температуры 20-25 °С. Процесс ацетилирования завершается после полного растворения 4-А-2-ФФМСА в ацетилирующем агенте и отгоне последнего в токе воздуха при комнатной температуре. Продукт очищен колоночной хроматографией, кристаллизован из ацетона, представляет собой белый или белый с телесным оттенком кристаллический порошок, tпл=104-106 °С. УФ (этанол) λmax/нм 220,8 (lg ε 4,48), 254,3 (lg ε 4,27), 287,6 (lg ε 3,53); ИК (KBr) νmax/см-1 1024, 1147, 1209, 1589, 1672, 3072, 3269, 3354, 3574; ЯМР 1Н (300 MГц, ДМСО-d6) δ 1,96 (с, 3Н), 2,85 (с, 3Н), 7,03 (д, J 7,2 Гц, 2Н), 7,20-7,42 (м, 2Н+3Н), 8,90 (уш. с, 1Н), 9,76 (с, 1Н); Масс-спектр (m/z) 199 (99,9%), 43 (89,8%), 171 (68,9%), 241 (64,7%), 320 (М+, 24,2%).
4-Г-2-ФФМСА (5б) получен разложением сернокислой соли диазония 4-А-2- ФФМСА (5а) из предварительно диазотированного 4-А-2-ФФМСА (3). Синтез проходит в две стадии. На первой стадии синтеза диазотирование 4-А-2-ФФМСА
8
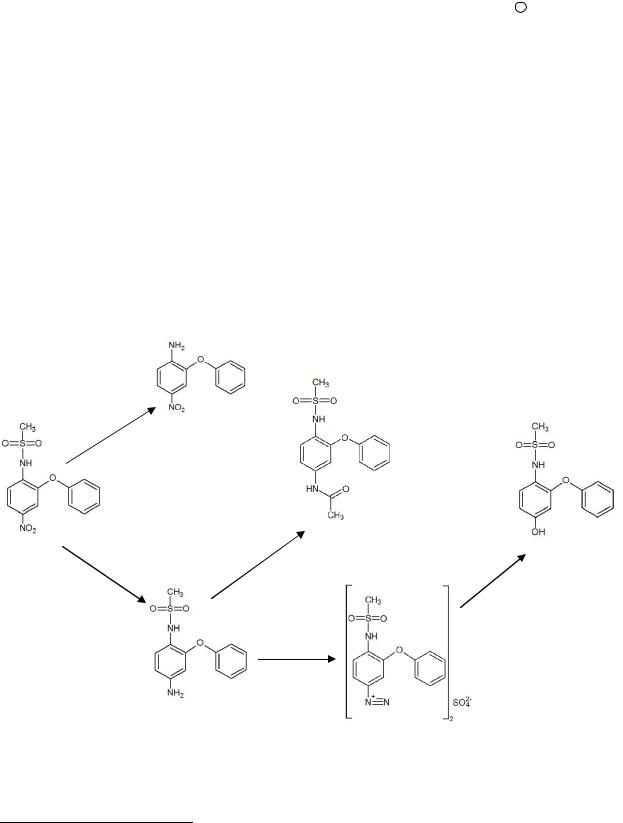
(3) проводят натрия нитритом в сернокислой среде при оптимальной температуре 0-5 °С. Ввиду последующего нагрева, а также с целью стабилизации образующегося диазосоединения выбран анион сильной кислоты (сульфат-анион). Для снижения мешающего влияния нитрозирующей частицы NO+ и снижения числа побочных продуктов реакции при разложении диазосоединения (5а) использован избыток карбамида. Также для снижения количества побочных продуктов и облегчения нуклеофильной атаки (SN1) диазосоединения (5а) гидроксил-ионами воды был применен катализатор состава CuSO4•5H2O (39%)+Cu2O. На второй стадии синтеза после удаления нитрозирующей частицы избытком карбамида диазосоединение (5а) в присутствии указанного катализатора при 95-100 °С и максимально быстром нагреве реакционной смеси разлагается с выделением азота до 4-Г-2-ФФМСА (5б). Продукт реакции очищен колоночной хроматографией (в два этапа), кристаллизован из ацетона о.с.ч. и представляет собой белый с кремоватым оттенком кристаллический порошок, tпл=153-156 °С.
УФ (этанол) λmax/нм 219,3 (lg ε 4,45), 280,6 (lg ε 3,44); ИК (KBr) νmax/см-1 1109, 1253, 1388, 1618, 2939, 3034, 3271, 3363; ЯМР 1Н (300 MГц, ДМСО-d6) δ 2,83 (с, 3Н), 6,48
(д, J 7,2 Гц, 1Н), 7,00-7,19 (м, 1Н+3Н), 7,36 (т, 2Н), 8,65 (с, 1Н), 9,24 (с, 1Н); Массспектр (m/z) 201 (99,9%), 96 (42,5%), 124 (27,3%), 51 (21,0%), 77 (18,8%).
Количественное содержание основного вещества нимесулида и синтезированных соединений установлено титриметрическими методами.1
Н2SO4 60%, t = 145-155 0C
2 (95%)
|
|
|
4 (99%) |
|
|
НCl конц, Sn0 |
(CH3CO)2O, |
(NH2)2CO изб., |
|
|
t = 20-25 0C |
|
||
1 |
t = 95-100 0C |
5б (20,4%) |
||
t = 95-100 0C |
|
kat. Cu2O+Cu2SO4 |
||
|
|
|
|
2н. Н2SO4,
1,5 моль NaNO2 t = 0-5 0C
3 (94%) |
5а |
|
Рисунок 1 – Синтез из нимесулида (1) его метаболитов – 4-А-2-ФФМСА (3), 4-МСА-3-ФФА (4), и близких к нему по структуре соединений – 4-Н-2-ФА (2), 4-Г- 2-ФФМСА (5б)
1 Автор приносит отдельные благодарности Филипповой О.Э. за предоставление фармакопейного образца основного объекта исследования (нимесулида) и Безъязычной А.А. за ценные рекомендации при обработке экспериментальных результатов.
9

ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ В качестве спектральных методов использовали УФ-, ИК-, видимую
спектрофотометрию, ЯМР 1Н.
Изучено поглощение исследуемыми соединениями электромагнитного излучения в УФ- и видимом диапазоне. Спектры регистрировались в ацетоне, ацетонитриле, бензоле, воде, н-гексане, 1,4-диоксане, диэтиловом эфире, N,N- диметилформамиде (ДМФА), хлороформе, этаноле, этилацетате, 0,1 М растворах хлороводородной кислоты и гидроксида натрия. Изучено поглощение исследуемыми соединениями электромагнитного излучения в ИК-диапазоне (4000400 см-1). Установлено присутствие достаточного количества характеристических полос колебаний различных фрагментов молекул анализируемых веществ. Показана возможность их идентификации по электронным и колебательным спектрам.
Изучены спектры ЯМР 1Н анализируемых веществ и определены величины сдвигов милионных долей, соответствующие сигналам протонам определенных функциональных групп в молекуле. Показана возможность установления структуры исследуемых веществ по ЯМР 1Н спектрам.
По данным изучения электронных спектров разработаны методики количественного анализа исследуемых веществ по поглощению в ацетонитриле этаноле, ДМФА (табл. 1).
Таблица 1 – Результаты определения нимесулида и близких по структуре соединений методом электронной спектрофотометрии (n=6; Р=0,95)
Анализируемое |
Среда анализа |
|
|
|
|
Найдено, % |
|
|
|
|
||||
вещество |
(длина волны λ, нм) |
|
|
|
S |
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
||||||||||||
4-НА |
ДМФА (384,9) |
99,76 |
0,99 |
|
0,40 |
|
1,04 |
1,04 |
||||||
Ацетонитрил (366,5) |
100,04 |
0,79 |
|
0,32 |
|
0,83 |
0,83 |
|||||||
|
|
|
||||||||||||
4-Н-2-ФА |
ДМФА (391,4) |
100,06 |
0,79 |
|
0,32 |
|
0,82 |
0,82 |
||||||
Ацетонитрил (375,1) |
100,04 |
0,74 |
|
0,30 |
|
0,78 |
0,77 |
|||||||
|
|
|
||||||||||||
Нимесулид |
ДМФА (439,4) |
100,04 |
0,66 |
|
0,27 |
|
0,69 |
0,69 |
||||||
Ацетонитрил (298,8) |
99,96 |
0,86 |
|
0,35 |
|
0,91 |
0,91 |
|||||||
|
|
|
||||||||||||
4-А-2-ФФМСА |
Этанол (249,7) |
99,97 |
0,98 |
|
0,40 |
|
1,03 |
1,03 |
||||||
Этанол (298,4) |
99,92 |
0,91 |
|
0,37 |
|
0,96 |
0,96 |
|||||||
|
Ацетонитрил (302,9) |
99,96 |
0,86 |
|
0,35 |
|
0,91 |
0,91 |
||||||
4-МСА-3-ФФА |
Этанол (254,3) |
100,02 |
0,90 |
|
0,37 |
|
0,94 |
0,94 |
||||||
Этанол (287,6) |
99,95 |
0,84 |
|
0,34 |
|
0,88 |
0,88 |
|||||||
|
Ацетонитрил (290,5) |
99,95 |
0,76 |
|
0,31 |
|
0,79 |
0,79 |
||||||
4-Г-2-ФФМСА |
Этанол (241,5) |
100,02 |
0,81 |
|
0,33 |
|
0,85 |
0,85 |
||||||
Этанол (280,6) |
100,04 |
0,76 |
|
0,31 |
|
0,80 |
0,80 |
|||||||
|
Ацетонитрил (287,2) |
100,08 |
0,88 |
|
0,36 |
|
0,92 |
0,92 |
||||||
Как свидетельствуют полученные данные, разработанные методики достаточно воспроизводимы и правильны. Относительная ошибка среднего результата не более 1,04%.
В качестве хроматографических методов применяли нормальнофазовую и обращеннофазовую хроматографию в тонком слое сорбента (НФ-ТСХ и ОФ-ТСХ), нормальнофазовую и обращеннофазовую высокоэффективную жидкостную
10
