
- •1. Визначення умов, при яких можливе протікання процесу і
- •2.Складання матеріального балансу процесу
- •3. Тепловий (енергетичний) баланс процесу
- •4. Визначення швидкості процесу
- •5. Визначення розмірів апаратів
- •Основи теорії подібності процесів
- •1. Методи вивчення процесів
- •2. Ознаки подібності систем
- •3. Теореми подібності
3. Тепловий (енергетичний) баланс процесу
Заключається у визначенні витрат тепла на проведення процесу і кількості теплоносіїв, з якими тепло підводиться до системи або відводиться з неї.
Складання теплового балансу ґрунтується на законі збереження енергії, згідно з яким кількість тепла, що надходить в системі, дорівнює кількості тепла, що відводиться із системи.
|
|
де Qi i Qi״ – - фізичне тепло, що вноситься в с систему або виноситься із неї і-им матеріальним потоком (ентальпія потоку)
|
Qp - тепловий ефект екзотермічної (+) або ендотермічної (-) реакції;
Qт/- - тепло, що підводиться в системі (+) або відводиться з неї (-)
через теплообмінну поверхню;
Qвтр - тепло, що втрачається внаслідок теплообміну між системою і
навколишнім середовищем.
Ентальпія матеріального потоку визначається за рівнянням Qі=Gi·Ii, де Ii – питома ентальпія речовини, тобто кількість тепла, яке необхідне затратити, щоб перевести 1 кг речовини із стандартного стану при оС в даний стан при даній температурі, кДж/кг.
Якщо речовина не змінює фазового стану при нагріванні від 0 до toC, то I = ct, де С – питома теплоємкість речовини, кдж/кг·град.
Якщо ж речовина змінює фазовий стан в інтервалі 0 - toC, то питома ентальпія враховує також теплоту фазових перетворень (плавлення, випаровування).
Наприклад, ситальнія водяної пари при температурі tоС
i
= τo+cn
tn
де τo - питома теплота випарення води при 0оС, кДж/кг;
cn - питома теплоємкість водяної пари, кДж/кг∙град.
Тепловий ефект хімічних реакцій
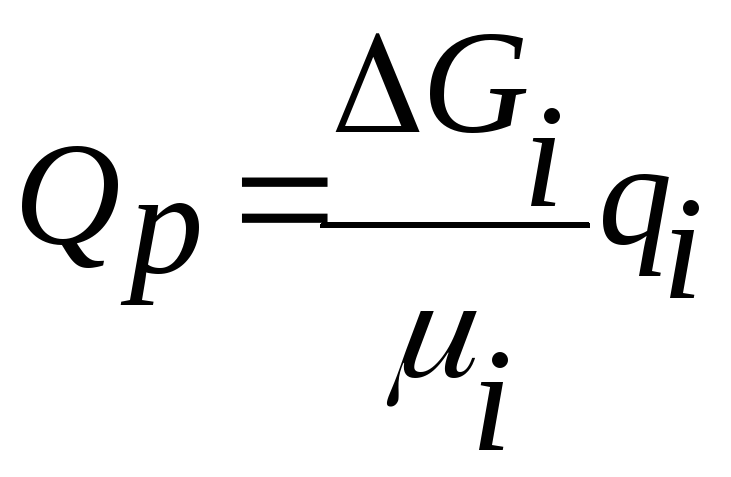
де ∆Gi - маса і-го компонента, що утворилась або зникла в насадок
реакції;
µi - молекулярна маса і-го компонента;
qi - тепловий ефект реакції, кДж/кмоль.
Кількість тепла, що підводиться в систему або возводиться з неї через теплообміну поверхню визначається по рівнянню теплопередачі
QТ/О = К ∆ t F
де К - коефіцієнт теплопередачі, вт/м2∙град;
∆t - різниця температур теплоносія і суміщі речовин в системі, град;
F - поверхня теплопередачі, м2.
4. Визначення швидкості процесу
Швидкістю тепло-масообмінних процесів називають кількість тепла або речовин, що передається із одної фази в іншу за одиницю часу через одиницю поверхні контакту фаз:
![]()
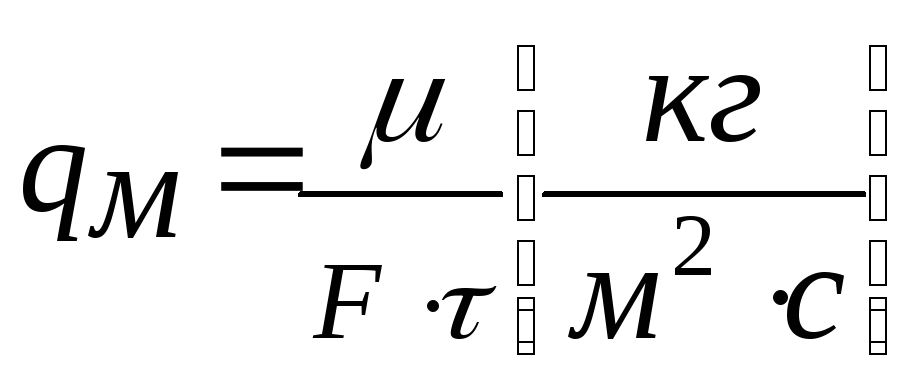
|
Швидкість будь-якого процесу прямо пропорційна рушійній силі процесу і обернено пропорційна спротиву системи. |
Наприклад, швидкість переносу тепла
![]()
де ∆t - різниця температур в точках, між якими відбувається перенос тепла;
Rt - термічний опір системи між цими точками.
Швидкість переносу речовини (маса)
![]()
де ∆C - різниця концентрацій речовини між двома точками системи;
Rдиф - спротив системи процесу дифузії.
Наведені закони аналогічні закону Ома
![]()
де ∆И - різниця потенціалів між двома точками провідника;
Rел - спротив електричний провідника.
Величина, обернено пропорційна супротив у системі, називається коефіцієнтом швидкості процесу:
![]()
З урахуванням цього рівняння швидкості переносу тепла в даній точці може бути записано в формі:
qт = Kт ∆t i qм = Kм ∆С
Кількість тепла або маси, що переноситься через всю поверхню контакту фаз F за одиницю часу, становить:
Q=Kт ΔtcрF μ=Kм ΔСсрF
Рівняння теплопередачі і масопередачі зв'язують продуктивність системи (апарату) з її розмірами.

