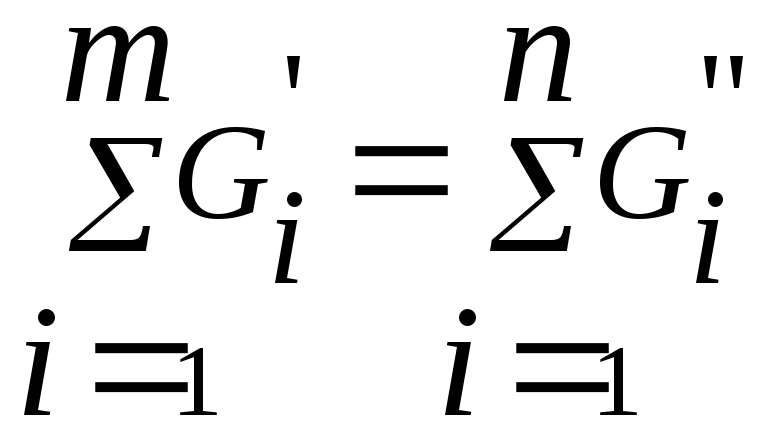- •1. Визначення умов, при яких можливе протікання процесу і
- •2.Складання матеріального балансу процесу
- •3. Тепловий (енергетичний) баланс процесу
- •4. Визначення швидкості процесу
- •5. Визначення розмірів апаратів
- •Основи теорії подібності процесів
- •1. Методи вивчення процесів
- •2. Ознаки подібності систем
- •3. Теореми подібності
ЗАГАЛЬНІ ПРИНЦИПИ АНАЛІЗУ І РОЗРАХУНКУ ХТП
При дослідженні або розрахунку хіміко-технологічних процесів одною з основних задач є визначення швидкості переносу субстанції (маси, тепла, кількості руху) із однієї точки системи в другу, а в гетерогенних системах – із однієї фази в другу. Існує загальна схема аналізу і розрахунку різних процесів, яка включає декілька станів.
1. Визначення умов, при яких можливе протікання процесу і
кінцевого стану системи, при якому процес припиняється,
тобто наступає рівновага
Умовою протікання гідромеханічних процесів в системі є нерівномірний розподіл в ній тиску, теплових процесів – нерівномірний розподіл температур, масообмінних процесів – нерівність хімічних потенціалів окремих компонентів в різних фазах.
Якщо в системі dP=0, то наступає механічна рівновага, якщо dТ=0, то підтримується теплова рівновага, якщо dµі=0, то відсутній перенос відповідного компонента.
Хімічний потенціал і-го компонента µі – це приріст внутрішньої енергії системі при додаванні до неї 1 моля і-го компонента (при безкінечному числі молей компонентів в системі).
![]()
Для
суміші ідеальних газів 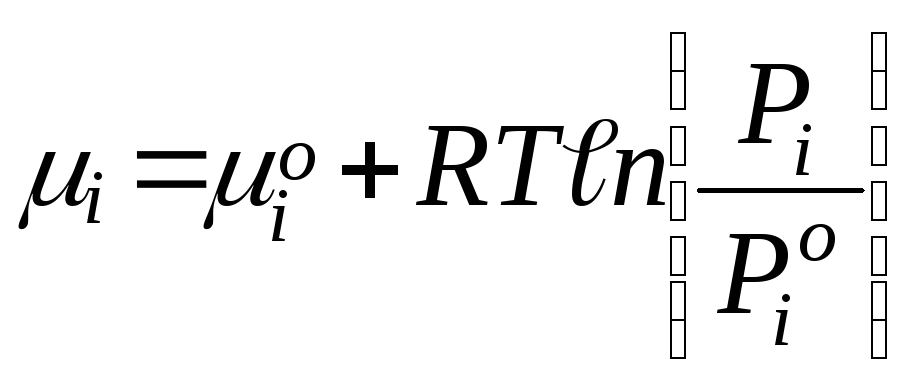 (1)
де µі - значення
хімічного потенціалу при стандартному
тиску
(1)
де µі - значення
хімічного потенціалу при стандартному
тиску
(Ріо=0,1 МПа);
Рі - парціальний тиск і-го компонента в суміші.
Для ідеальних розчинів µі=φіо + Rтℓnxі (2) де xі - мольна доля і-го компонента в розчині.
При рівновазі між газом і розчином
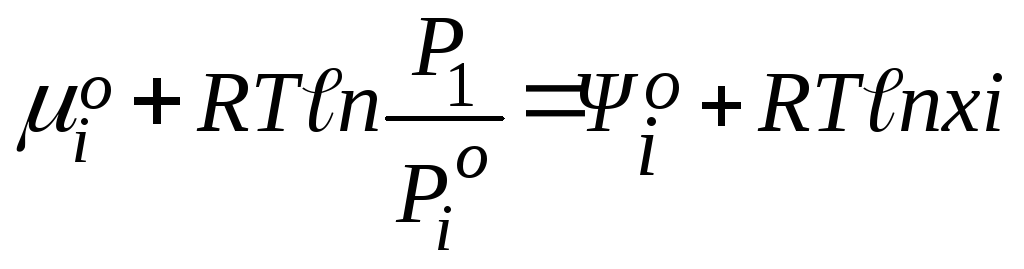
або
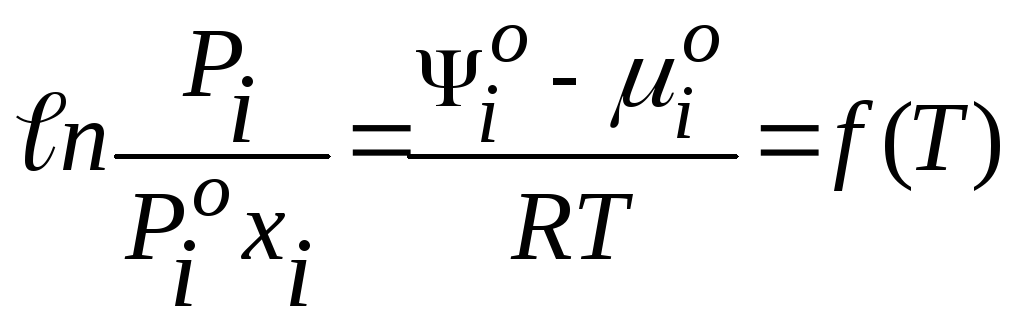
П


 ри
даній температуріТ=const
ри
даній температуріТ=const


![]() -
закон Генрі.
-
закон Генрі.
Тут Н - константа Генрі
xi - мольна доля і-го компонента в розчині;
Ріх - парціальний тиск і-го компонента в газовій фазі при
рівновазі в системі.
Pi
= yi
P
По закону Дальтона , де Р - загальний тиск в системі;
y
уіх
= mxi
Тоді
рівняння рівноваги в вигляді
,
де ![]() - коефіцієнт
розподілу і-го компонент а між фазами.
- коефіцієнт
розподілу і-го компонент а між фазами.
Якщо уі > уі* , то компонент переходить із газу в розчин.
Якщо уі < уі* , то компонент переходить із розчину в газ
Якщо уі > уі* , то система перебуває в рівновазі.
При протіканні в системі оборотної реакції рівновага наступає, коли співвідношення концентрацій компонентів суміші буде відповідати константі рівноваги.
Наприклад, при досягненні рівноваги реакції
 СН4+Н2О
СО+3Н2
СН4+Н2О
СО+3Н2
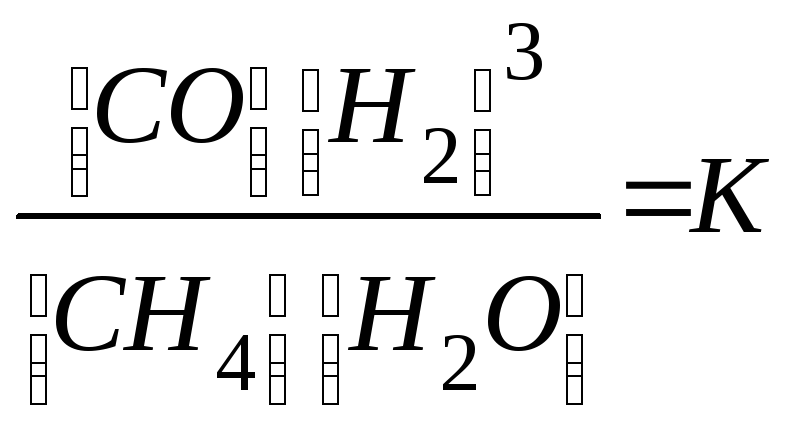 де
К
– f
(т)
- константа рівноваги реакції.
де
К
– f
(т)
- константа рівноваги реакції.
Знаючи К і склад початкової суміші, можна визначити максимальну ступінь перетворення початкової речи винив кінцеві продукти
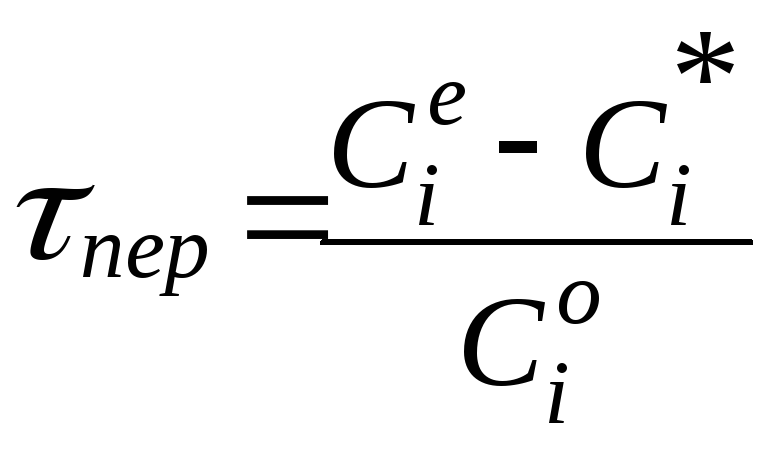
або максимальний вихід кінцевого продукту
![]() ,
,
де ![]() -
початкова концентрація речовини, що
вступає в реакцію;
-
початкова концентрація речовини, що
вступає в реакцію;
![]() -
концентрація цієї речовини після
закінчення реакції
(при
досягненні рівноваги);
-
концентрація цієї речовини після
закінчення реакції
(при
досягненні рівноваги);
![]() -
концентрація продукту в суміші після
досягнення рівноваги;
-
концентрація продукту в суміші після
досягнення рівноваги;
![]() -
концентрація продукту в суміші при
умові повного
-
концентрація продукту в суміші при
умові повного
перетворення початкової речовини.
2.Складання матеріального балансу процесу
Матеріальний розрахунок процесу заклечається в визначенні витрат початкових речовин (сировини) і кількості одержаних продуктів. Він заснований на законі збереження матерії, у відповідності з яким маса речовини, що надходить в систему, дорівнює масі речовин, що виходять із системи.
|
|
|
![]()
Це рівняння справедливе як для загальної маси потоків, що входять в систему і виходять із неї, так і для кожного окремого компонента, якщо в системі немає хімічних реакцій.
Якщо в системі протікають хімічні реакції,то в рівняннях балансу окремих компонентів необхідно враховувати кількість компонента прореагувавшого або утвореного внаслідок реакції:
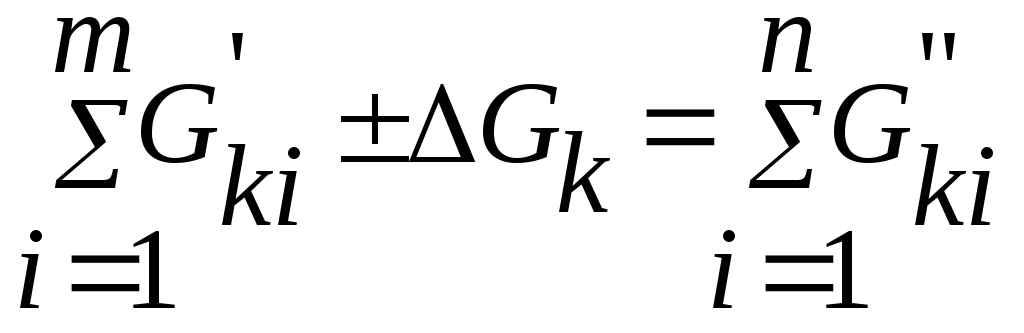
де і - порядковий номер матеріального потоку, що входить в систему або виходить з неї;
К - порядковий номер компонента;
∆Gk - кількість к-го компонента, що утворилась (+) або зникла (-) внаслідок реакції.
Матеріальний баланс може складатись як на всю продуктивність технологічної установки, так і на одиницю маси (об’єму) сировини або кінцевого продукту.