
Масообміні процеси
Масообміні процеси – це процеси, в яких відбувається перехід маси одного або декількох компонентів із однієї фази в іншу.
В залежності від агрегатного стану фаз, що приймають участь в масообміні, процеси діляться на декілька видів:
-
Абсорбція – це процес поглинання газів (парів) рідинами, тобто процес в системі

-
Адсорбція – процес поглинання газів (парів) твердими речовинами – процес в системі

-
Перегонка рідин (дистиляція, ректифікація) – поділ гомогенних рідких сумішей (розчинів) шляхом взаємного обміну компонентами між рідиною і її парою, тобто процес в системі

-
Екстракція – витяг речовин із однієї рідини (розчину) іншою рідиною, яка практично нерозчинна в першій, тобто процес в системі

-
Розчинення – перехід речовини із твердої фази в рідину, тобто процес в системі
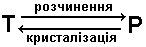
-
Сушіння – перенос вологи із твердого матеріалу в газову фазу шляхом її випарювання, тобто процес в системі
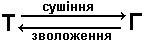
Оскільки швидкість сушіння в технологічних процесах визначається в більшості випадків швидкістю підведення тепла до матеріалів, що висушуються, то сушіння може бути віднесене до теплообмінних процесів.
Абсорбція
Це поглинання окремих компонентів газових сумішей рідкими поглиначами (абсорбентами).
Розрізняються два види абсорбції:
- фізичну, при якій компонент, що поглинається, не вступає в хімічну взаємодію з абсорбентами, тобто не створює з ним хімічну сполуку.
- хемосорбцію, при якій абсорбитів (компонент, що поглинається) створює з абсорбентом хімічну сполуку.
Приклад фізичної абсорбції: поглинання бензольних вуглеводнів із коксового газу маслом кам’яновугільним або соляровим, внаслідок чого отримують розчин бензольних вуглеводів в маслі.
Приклад хімічної абсорбції:
- поглинання аміаку сірчаною кислотою, внаслідок чого отримають розчин сульфату аммонія за реакцією 2NH3+H2SO4→(NH4)2SO4 ;
- поглинання сірководню розчином соди за реакцією H2S+Na2CO3↔NaHS+NaHCO3
Фізична абсорбція і деякі види хемосорбції є оборотними процесами, тобто при деяких умовах вони можуть протікати в зворотному напрямку з виділенням компоненту, що був поглинутий речовиною. Цей зворотній процес називається десорбцією.
Абсорбція в поєднанні з десорбцією застосовується для вилучення із коксового газу аміаку, нафталіну, бензольних вуглеводнів, сірководню, ціаністого водню і інших компонентів.
Принципова схема абсорбційної установки показана на рисунку:

1. Фазова рівновага (статика процесу)
Позначимо Ф – число фаз в системі;
К – число компонентів в системі;
При відсутності рівноваги в системі відбувається перенос одного або декількох компонентів із однієї фази в іншу до досягнення рівноваги, коли хімічний потенціал компонента в обох фазах стане однаковим.
Компоненти, що переходять із однієї фази в іншу, називається розподіляємими.
Компоненти, що утворюють різні фази і не переходять із однієї фази в іншу, називаються інертними або носіями розподіляємих компонентів.
Фазовий стан системи(кількість вад фаз) визначається параметрами стану, до яких відносяться:
Т, Р, склад фази Фх(х1, х2, …. хn), склад фази Фу(у1, у2, …. уn).
Способи вираження складу фаз:
мольна доля х, у (Кмоль компонента)/(Кмоль суміші)
об’ємна концентрація Сх, Су (К2 ком-та)/(м3 суміші), (Кмоль компонента)/ (м3 суміші)
масова
доля
![]() ,
,
![]() (К2
ком-та)/( К2
суміші)
(К2
ком-та)/( К2
суміші)
відносна
мольна концентрація
![]() ,
,
![]() (К моль ком-та)/(К моль інертної фази)
(К моль ком-та)/(К моль інертної фази)
При рівновазі в системі між цими параметрами існує однозначна залежність, що називається рівнянням рівноваги:
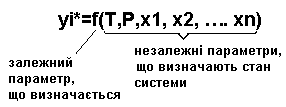
Число незалежних параметрів називається числом ступенів вільності системи.
За
правилом фах Гіббса
![]()
Наприклад, при абсорбції NH3 водою із коксового газу К=3, Ф=2, С=3+2-2=3
При
цьому рівняння рівноваги має вигляд
![]()
Якщо процес відбувається при Р = const і Т = const, то
![]()
Графічне зображення рівняння рівноваги в координатах х – у називається лінією рівноваги
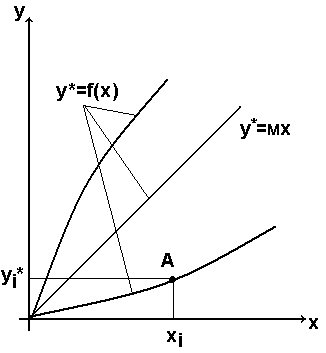
Для довільної точки А(х і, у і) на лінії рівноваги відношення у*і/х і = м називається коефіцієнтом розподілу компонента між фазами.
В загальному випадку м= f(Р,Т,х,у) – змінна величина.
В окремих
випадках, коли м= const лінія рівноваги є
пряма лінія
![]()
Це має місце для ідеальних систем. Для реальних систем Г-Р м≈ const тільки при низьких тисках газів (Р<10 ат) і при малих концентраціях компонента в рідині.
Оскільки уі = Рі / Р (де Р – загальний тиск в газовій фазі) то рівняння рівноваги можна представити у вигляді Р*і=мР хі. Якщо Р = const і м = const, то мР=Е= const, де Е – константа Генрі.
Т оді
оді
![]() - Закон Генрі.
- Закон Генрі.
Парціальний тиск і-го компонента в газовій суміші при рівновазі в системі пропорційной мольній долі компонента в розчині.
В загальних випадках Е=f(Т, властивості газу і рідини).
Для
даної системи
![]() ,
де q- диференцтика теплота розчинення
газу, ктм/кмольгазу.
,
де q- диференцтика теплота розчинення
газу, ктм/кмольгазу.
Закон Генрі можна представити також у вигляді:
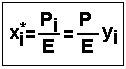
- розчинність газу в рідині при даних умовах.
Якщо Т↑ , то Е↑, а х*і↓.
Якщо Р↑, то при даному уі х*і↑.
Т аким
чином, розчинність газів(парів) в рідинах
зростає при збільшенні тиску і
зменшенні температури.
аким
чином, розчинність газів(парів) в рідинах
зростає при збільшенні тиску і
зменшенні температури.
2. Матеріальний баланс абсорбції. Рівняння робочої лінії процесу.
Рівняння рівноваги визначає залежність між концентраціями компоненту в фазах при рівновазі. Але при проведенні процесів в промислових умовах рівновага між газом і рідиною не досягається, тому фактичні концентрації компонента в фазах (робочі концентрації) відрізняються від рівноважних, тобто у≠у*.
Залежність між фактичними концентраціями компонента в фазах в різних перерізах абсорбера може бути визначена із матеріального балансу компонента в апараті.
П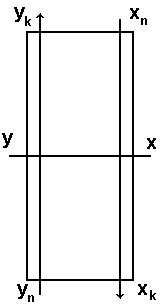 означимо
G-
витрата
фази Фу(газу),
кмоль/год;
означимо
G-
витрата
фази Фу(газу),
кмоль/год;
уn,ук – початкова і кінцева концентрація розподіляє мого компоненту в фазі Фу (тобто на вході і виході апарату), кмоль/кмоль;
L – витрати фази Фх(рідини), кмоль/год;
хn,хк – концентрація компонента в рідині на вході і виході апарату, кмоль/кмоль;
Якщо G=const, L=const , то рівняння балансу розподіляємого компоненту в апараті можна представити у вигляді:
G(уn-ук)=L(хn-хк)
Із цього рівняння можна визначити витрату абсорбента
L= G(уn-ук)/(хn-хк) кмоль/год .
Розділивши це рівняння на витрату фази Фу , маємо
L/G=(уn-ук)/(хn-хк)=L – питома витрати рідини, кмоль абсорбента/кмоль газу,
або (уn-ук) = (хn-хк)L – рівняння робочої процесу, вираження через початкові і кінцеві концентрації компонента в фазах, тобто через координати точок А і В.
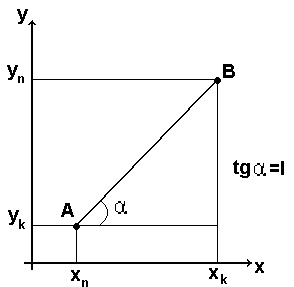
Виразимо рівняння робочої лінії процесу через концентрації компонента х і у в довільному перерізі апарату. Із матеріального балансу компонента маємо для верхньої частини абсорбера маємо: G(уn-ук) = (хn-хк)L, звідки

Таким чином робоча лінія процесу абсорбції є пряма. В залежності від взаємного положення робочої і рівноважної лінії можна визначити напрям переносу компонента
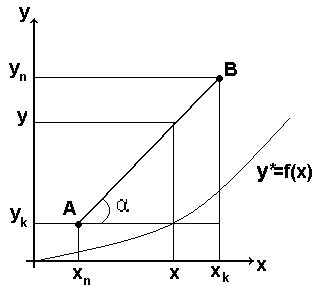
Робоча лінія над рівноважною
Оскільки у> у*, то відбувається перехід компоненту із газу в рідину(абсорбція).
Р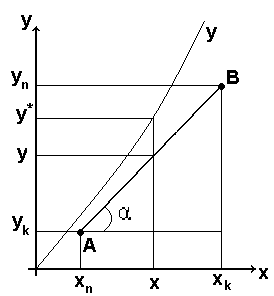 обоча
лінія під рівноважною
обоча
лінія під рівноважною
Оскільки у<у*, то відбувається перехід компонента із рідини в газ(десорбція)
3. Визначення оптимальної витрати абсорбента.
Питома витрата абсорбента впливає в значній мірі на розміри абсорбера(капітальні витрати) і на витрати електроенергії, пари і води(експлуатаційні витрати). Розглянемо рисунок, на якому зображені лінія рівноваги і робочої лінії процесу абсорбції при різних витратах абсорбента.
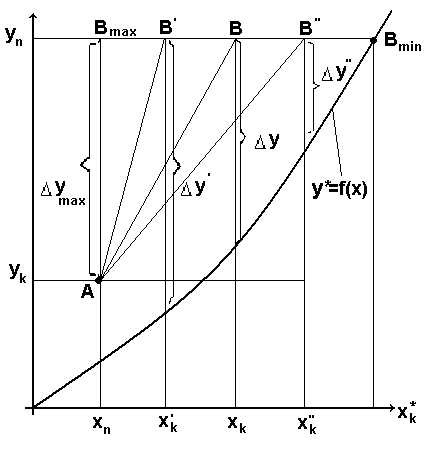
Робочі лінії АВ,АВ′,АВ″ відповідають різним питомим витратам поглинача.
Зі збільшенням витрати поглинача збільшується рушійна сила процесу Δу, а необхідна поверхня масо передачі і висота абсорбера відповідно зменшується (F=m/(KyΔycp)).
Якщо l→∞, то Δу→ymax, а F→Fmin.
Такий режим не може бути реалізований на практиці.
При зменшенні l рушійна сила процесу Δу також зменшується. Мінімальна витрата поглинача відповідає положенню робочої лінії АВmin. При цьому рушійна сила Δу=0 і потрібна безкінечна поверхня масо передачі, тобто безкінечна висота абсорбера. Такий режим також не може бути реалізований на практиці.
Вочевидь існує таке значення питомої витрати поглинача lmin<l<l∞, при якому сумарні витрати на здійснення процесу є найменшими. Така витрата поглинача називається оптимальною. Її величину визначають шляхом технікоекономічних розрахунків.
Н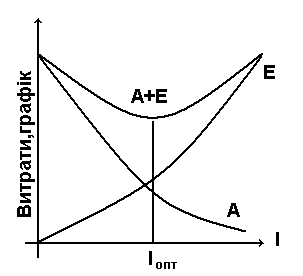 а
практиці при розрахунках абсорберів
витрату поглинача визначають по
відношенню до мінімальної витрати:
а
практиці при розрахунках абсорберів
витрату поглинача визначають по
відношенню до мінімальної витрати:
l=Кнадлlmin , де Кнадл – коефіцієнт надлишку поглинача.
Мінімальна витрата поглинача lmin=(уn-ук)/(х*к-х n).
Значення Кнадл приймається по практичним даним. Наприклад, при абсорбції б.у. із пресового газу маслом Кнадл = 1,5-1,6.
4. Механізми і швидкість масопереносу в фазах.
В нерухомій фазі перенос маси відбувається тільки за молекулярним механізмом(молекулярна дифузія).
Швидкість молекулярного переносу(щільність потоку)
qm=-Ddc/dn – закон Фіка
D – коефіцієнт дифузії розподіляє мого компоненту в даній фазі, м2/с;
D= qm/dc/dn= кг/ м2*с/кг/ м3 м= м2 / с – це швидкість переносу маси при значенні градієнта концентрації dc/dn=1.
D=f(властивостей розподіляє мого компонента і фази).
Значення коефіцієнтів дифузії для деяких речовин приведені в довідниках.
В рухомій фазі перенос маси відбувається за різними механізмами:
- молекулярна дифузія, тобто перенос мікрочастинками, що хаотично рухаються. Щільність потоку маси qm=-Ddc/dn – закон Фіка.
- конвективний перенос, тобто перенос потоком рідини(газу). Щільність потоку маси в напрямку руху рідини qк=w*e.
При турбулентному режимі руху рідини перенос маси здійснюється також макрочастинками рідини(турбулентними вихорами), що хаотично переміщуються.
Перенос маси турбулентними вихорами називається турбулентною дифузією. Щільність потоку маси за цим механізмом визначається по закону, подібному до закону Фіка, тобто qт=-Еdc/dn, де Е=f(Rc) – коефіцієнт турбулентної дифузії.
Перенос маси за турбулентної дифузії, як і за молекулярної, відбувається у всіх напрямках, в тому числі в напрямку потоку рідини, в протилежному і поперечному напрямках. Оскільки E>>D, то при однакових значеннях градієнта концентрацій qт>> qм.
5. Механізм масопереносу між фазами.
В промисловому абсорбері перенос компонента відбувається одночасно за всіма механізмами.

Конвективний перенос відбувається тільки вздовж напрямку руху фаз.
Перенос компонента із фазу Фу в фазу Фх відбувається тільки за рахунок молекулярної і
турбулентної дифузії.
Розглянемо гідродинамічну модель процесу переносу речовини із однієї фази в іншу, який називається масопередачею.

Цей процес включає декілька стадій:
-
Перенос речовини із ядра фази до межі поділу фаз (масовіддача в фазі Фу);
-
Перенос речовин через межу поділу фаз;
-
Перенос речовин від межі поділу в ядро фази Фх.
Швидкість цих стадій різна. Стадія, яка має найменшу швидкість, називається лімітуючою, тобто такого, що обмежує загальну(підсумкову) швидкість процесу масопередачі.
Перенос речовини через межу поділу фаз зводиться до того, що сили, які діють на молекули речовини з боку фази Фу послабляються, а сили, що дають з боку фази Фх зростають, внаслідок чого: відбувається перехід молекул через межу поділу. Визначення швидкості цієї стадії є складною задачею, але в більшості випадків вона значно перевищую швидкість переносу в фазах Фу і Фх і тому майже не впливає на підсумкову швидкість масопередачі.
Загальна швидкість масопередачі визначається шляхом рішення системи рівнянь швидкостей кожної із стадії. Це рішення має вигляд:
Qзаг= ∑Δсі/∑rі = Δс/∑rі = кΔс
де ΔСі – рушійна сила процесу на кожній стадії;
rі – сиротив процесу переносу на кожній стадії;
к – коефіцієнт швидкості процесу масопередачі;
Звідси витікає, що коефіцієнт швидкості масопередачі менше коефіцієнтів швидкості будь-якої із стадій, в тому числі і лімітуючої.
Розглянемо тепер механізм переносу речовин із ядра фази Фу до межі поділу фаз, тобто механізм масовіддачі.
В турбулентному ядрі фази Фу перенос відбувається шляхом молекулярної і турбулентної дифузії. Швидкість цього переносу
qт=(-D+Eт)(Dcy/dn)т=-Eт(Dcy/dn)лам
(Оскільки D<<E).
В межовому ламінарному шарі перенос відбувається тільки шляхом молекулярної дифузії, а швидкість переносу qм = - Ddcy/dn;
При стаціонарному режимі переносу qт=qм , тобто
–Eт(Dcy/dn)турб=-D(Dcy/dn)лам
Оскільки Eт>>D, то градієнт концентрації в турбулентному ядрі потоку фази Фу безмежно малий в порівнянні з градієнтом концентрації в межовому ламінарному шарі. Тому за звичай при аналізі і розрахунках процесів масопередачі вважають, що концентрація розподіляємого компонента в даному поперечному перерізі потоку фази є постійна величина.
Аналогічним шляхом відбувається перенос речовини від межі поділу фаз в ядро фази Фх . З теоретичної точки зору щільність потоку речовини в фазах Фу і Фх , а також із однієї фази в іншу можна визначити за законом Фіка
qm=-Dy(dcy/dn) або qm=-Dх(dcх/dn)
Оскільки градієнт концентрації dcу/dn і dcх/dn не можуть бути визначені ні теоретично, ні експериментально, то теоретичне рішення цієї задачі неможливе. Тому для визначення щільності потоку речовини в фазах було запроповане симетричне рівняння, аналогічне рівнянню тепловіддачі Ньютона.
6. Рівняння масовіддачі.
Це рівняння, які визначають щільність потока речовини із ядра фази до поверхні її контакту з іншою фазою або в зворотному напрямку. В залежності від способу визначення масовіддачі мають різний вигляд:
q = βcy(Cy-Cгр) або q = βcх(Cхгр-Cх)
q = βy(у-угр) або q = βх(хгр-х)
В цих рівняннях β – коефіцієнт масовіддачі. Його фізична суть і розмірність витікають із виразу β=q/Δc, тобто це щільність потоку речовини при різниці концентрації в ядрі фази і на межі поділу Δc=1.
Розмірність коефіцієнта масовіддачі залежить від способу визначення концентрацій розподіляємого компонента в фазах.
|
Рушійна сила Δ |
Коефіцієнт масовіддачі β |
|
об’ємна концентрація ΔС, кг/м3
мольна доля Δу,Δх,(кмоль к-та)/(кмоль суміш)
парц. Тиск ΔР,н/м2=кг*м/(м2*сек2) |
кг/(м2*с) : кг/м3 = [м/с]
(кмоль к-та)/( м2*с) : (кмоль к-та)/(кмоль суміш) = [кмоль суміш/( м2*с)] кг к-та/( м2*с) : кг*м/( м2*с) = [с/м] |
Коефіцієнт масовіддачі залежать від режиму руху фаз, властивостей фаз і компонентів.
β = f ( w, l, ρ, μ, D).
Теоретично його можна (було б) визначити із умови, що при стаціонарному режимі переносу молекулярний потік через межовий ламінарний шар дорівнює конвективному потоку із ядра фази до межі поділу фаз, тобто
q=Dy(Cy-Cyгр)/бу= βсу (Cy-Cyгр) ,
βсу = Dу/бу. Аналогічно βх = Dх/бх .
Значення коефіцієнтів дифузії для різних систем наведені в довідниках, але товщина межового ламінарного шару не може бути визначена, тому теоретичне визначення коефіцієнтів масовіддачі також неможливе.
Їх значення знаходять експериментальним шляхом, за яким результати експериментів представляють у вигляді залежностей між безрозмірним шляхом подібного перетворення диференційних рівнянь конвективного масо переносу.
7. Диференційне рівняння конвективного масопереносу.
Це рівняння визначає зміни концентрації компонента в потоці фази залежності від часу і координат. Воно може бути одержане на основі матеріального балансу розподіляємого компонента для довільно вибраного об’єму системи. Для одиночного об’єму матеріальний баланс може бути представлений основним рівнянням переносу:
ө φ/өτ
= -divq +γ
φ/өτ
= -divq +γ
П

 отенціал
переносу маси φ=С, щільність потоку в
даній точці q
=cw-Dgrade
отенціал
переносу маси φ=С, щільність потоку в
даній точці q
=cw-Dgrade
Я
 кщо
φ=0, то өφ/өτ = -div cw-Dgrade
кщо
φ=0, то өφ/өτ = -div cw-Dgrade
а

 бо
өφ/өτ + cdivw
+ wgrade
= D
(ө2c/өx2+ө2c/өy2+ө2c/өz2)
бо
өφ/өτ + cdivw
+ wgrade
= D
(ө2c/өx2+ө2c/өy2+ө2c/өz2)
Д ля
нестисної рідини divw=0
ля
нестисної рідини divw=0
Тоді өc/өτ+ wxөc/өx+ wyөc/өy+wzөc/өz=Dv2c
субстанційна похідниця dc/dτ
Отже диференційне рівняння конвективного масо переносу має вигляд:
d c/dτ=
Dv2c
c/dτ=
Dv2c
Його рішення повинно враховувати рівняння руху в’язкої рідини, нерозривності потоку, а також початкові і межові умови.
В загальному випадку ця система рівнянь не може бути вирішена аналітичними методами. Тому її рішення знаходять на основі експериментів у вигляді залежності між безрозмірними комплексами величин, одержаних шляхом подібного перетворення диференційних рівнянь.
8. Критерії подібності процесів конвективного масопереносу.
өс/өτ + wxөc/өx+ wyөc/өy+wzөc/өz=D(ө2c/өx2+ө2c/өy2+ө2c/өz2)
де өс/өτ= с/τ(накопичення),
wxөc/өx+ wyөc/өy+wzөc/өz=wc/l(конвективний перенос),
D(ө2c/өx2+ө2c/өy2+ө2c/өz2)=Dc/l2 (молекулярний перенос).
В изначаємо
безрозмірні комплекси величин
изначаємо
безрозмірні комплекси величин
1 .
с/τ : Dc/l2
=
l2
/Dτ→
Dτ/l2
=
Fog
- критерій Фур’є дифузійний характеризує
стадію розвитку процесу(безрозмірний
час) ;
.
с/τ : Dc/l2
=
l2
/Dτ→
Dτ/l2
=
Fog
- критерій Фур’є дифузійний характеризує
стадію розвитку процесу(безрозмірний
час) ;
2. wc/l : Dc/l2 = wl/D = Peg - критерій Пекле дифузійний характеризує співвідношення інтенсивностей конвективного і молекулярного переносу.
З амість
критерії Пекле часто застосовують
походний критерій, в який не входить
швидкості рідини:
амість
критерії Пекле часто застосовують
походний критерій, в який не входить
швидкості рідини:
Peg : Re = wl/D : wl/v = v/D = μ/ρD = Prg - критерій Прандтля дифузійний характеризує властивості компонента і інертної фази.
Критерії Fog,Peg,Prg є визначальними, оскільки в них входять тільки величини із умов однозначності. Визначуваний критерій одержується із межової умови, тобто із рівності конвективного потоку речовини із ядра фази до межі поділу фаз(закон масовіддачі) і молекулярного потоку через межовий ламінарний шар(закон Фіка):
q= βсу (Cy-Cyгр) = -Ddcy/dn
3. Звідки βΔc : DΔc/l = βl/D = Nug - критерій Нуссельта.
Характеризує умови масопереносу на межі розділу фаз(співвідношення поперечного розміру потоку фази і товщини ламінарного шару).
У відповідності з другою теоремою подібності рішення системи рівнянь конвективного масопереносу може бути представлено у вигляді залежності між одержаними безрозмірними комплексами величин:
Nug = f(Ho, Re, F2, Fog, Prg, l/D)
де Ho, Re, F2 - гідродинамічний критерії,
Fog, Prg – теплові критерії,
l/D – геометричні критерії.
При уставному режимі масопереносу критерії Ho і Fog вироджуються в константи, тобто можуть не враховуватись.
При примусовій конвекції сила вага мала в порівнянні з силами тиску, тобто критерії F2 може не враховуватись.
Тоді критеріальне рівняння масовіддачі при примусовій конвекції має загальний вигляд
Nug = f(Re, Prg, l/D)
За звичай ця залежність представляється у вигляді степінної функції:
Nug = A RemPrgn(l/d)q
Значення постійних A,m,n,q для множення подібних процесів знаходять шляхом обробки експериментальних даних.
9. Рівняння масопередачі.
Це рівняння, які визначають інтенсивність масопереносу із однієї фази в іншу через концентрації розподіляємого компонента в фазах. Рівняння масовіддачі визначають масу компонента, що переносить із ядра фази до межі поділу. При усталеному режимі переносу ця маса переноситься також із однієї фази в іншу. Але для практичних розрахунків рівняння масовіддачі непридатні, тому що в них входять невідомі концентрації компонента в фазах на межі розподілу.
Задача зводиться до визначення потоку компонента із однієї фази в іншу через коефіцієнти масовіддачі в фазах і концентрації компонента в ядрах однієї і другої фаз, тобто через величини, задані в умовах однозначності.
Хай у,х – концентрації розподіляємого компонента в фазах Фу і Фх в даному перерізі абсорбера;
βх, βу – коефіцієнти масовіддачі в фазах Фу і Фх .
Хай рівняння рівноваги в системі має вигляд у*= mx, де m-коефіцієнт розподілу компонента між фазами.
Необхідно визначити щільність потоку речовини q із однієї фази в іншу в даному перерізі.

Щільність потоку в фазі Фу
qу= βу (y-yгр)
Щільність потоку в фазі Фх
qx= βx (xгр-x)
При стаціонарному режимі масопереносу qх = qу = q, тобто в цих рівняннях маємо три невідомі величини q, угр, хгр. В якості третього рівняння використаємо рівняння рівноваги між фазами:
y*=mx
Представимо рівняння (1) і (2) в іншому вигляді:
( 1)
q
/ βу
=
y-yгр
1
1)
q
/ βу
=
y-yгр
1
(2) q / βx = xгр-x m
помножимо рівняння (2) на m і складемо його з рівнянням (1), в результаті чого одержимо:
q /(1/ βx + m / βу) = y-yгр + mxгр- mx
У відповідності з рівнянням рівноваги у*= mx.
Якщо опір переходу компонента через межу поділу фаз рівний 0, тобто на межі поділу між фазами складається рівноваги, то угр= mxгр.
З урахуванням цих співвідношень одержимо
q /(1/ βx + m / βу) = y-y* або q = (y-yгр)/ (1/ βу + m / βх)
Це рівняння масопередачі, тобто щільність потоку компонента із Фу фази в фазу Фх, туту у - у* = Δу – рушійна сила масопереносу в даному перерізі абсорбера, тобто різниця між робочою концентрацією компонента в фазі Фу і рівноважною концентрацією його в межовому шарі над поверхнею фази Фх;
1/ βу – дифузійний опір фази Фу;
m/βх – дифузійний опір фази Фх, виражений через концентрації фази Фу.
Величина 1/ βу + m / βх =ку називається коефіцієнтом масопередачі, вираженим через концентрації фази Фу.
Тоді щільність потоку в даному перерізу
q =ку( y-y*)
Кількість компонента, що переноситься із фази Фу в фазу Фх через всю поверхню контакту фаз в апараті
M =ку(
y-y*)
ср
F
= ку
Δуср
F
- рівняння масопередачі
=ку(
y-y*)
ср
F
= ку
Δуср
F
- рівняння масопередачі
тут Δуср =( у - у* ) ср - середнє значення рушійної сили в апараті.
Аналогічним шляхом можна одержати рівняння масопередачі, виражено через концентрації компонента в фазі Фх:
1 .
q
* 1/βy
=
y
- yгр
1/m
.
q
* 1/βy
=
y
- yгр
1/m
2. q * 1/βx = xгр - x 1
тоді q = (x*-x)/ (1/ βx + 1 /mβy ) = кx(x*-x)
де кx =1/(1/ βx + 1 /mβy) - коефіцієнт масопередачі, виражений через концентрації компонента в фазі Фх.
В інтегральний формі рівняння масопередачі
мас вигляд:
інтегральний формі рівняння масопередачі
мас вигляд:
M= кx(x*-x)ср F = кxΔxср F
В окремих випадках розрахунок коефіцієнтів масопередачі спршується:
1. Якщо 1 /βy>> m/βx , то ку≈ βy ;
2. Якщо 1 /βх>> 1/mβу , то кх≈ βх ;
10. Об’ємні коефіцієнтів масовіддачі і масопереносу.
В розглянутих вище рівняннях масовіддачі і масопередачі коефіцієнти швидкості масопереносу β і k представляють собою масу компонента, що переноситься через 1 м2 поверхні контакту фаз за 1 сек при рушійний силі, рівний одиниці:
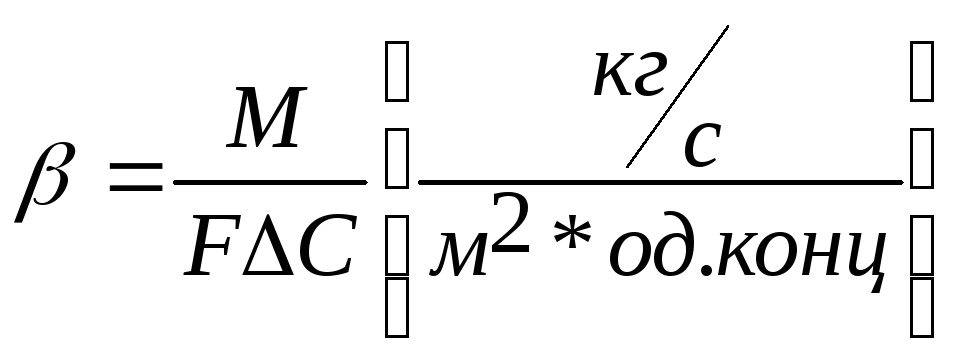 ,
,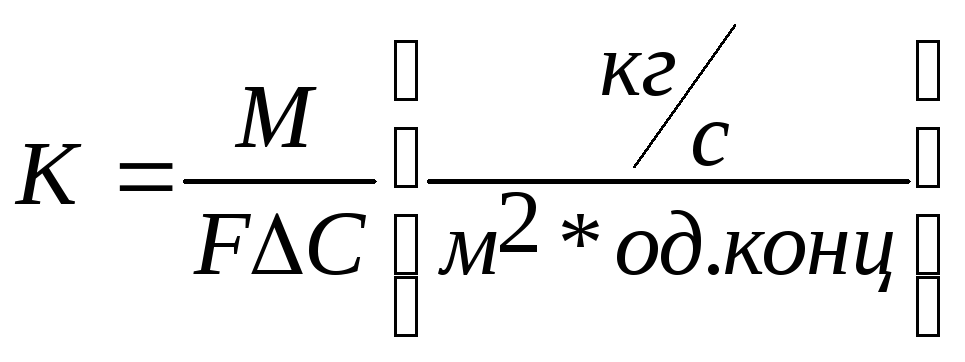
Ці рівняння використовуються для розрахунків насадкових масообмінних апаратів, в яких поверхня контакту фаз рівна поверхні насадки і легко визначається.
В деяких конструкціях масообмінних апаратів поверхня контакту фаз трудно визначається. До них відносяться розпилювальні, барботажні, тарілчасті абсорбери.
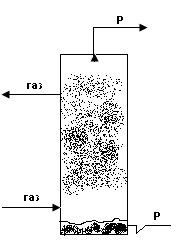
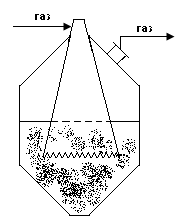

Розрахунки таких апаратів проводять з допомогою об’ємних коефіцієнтів масовіддачі і масопередачі. При цьому рівняння масовіддачі і масопередачі мають вигляд:
![]() і
і
![]()
де V – об’єм робочої зони в апараті, м3;
![]() ,
,![]() - об’ємні коефіцієнти масовіддачі і
масопередачі,
- об’ємні коефіцієнти масовіддачі і
масопередачі,
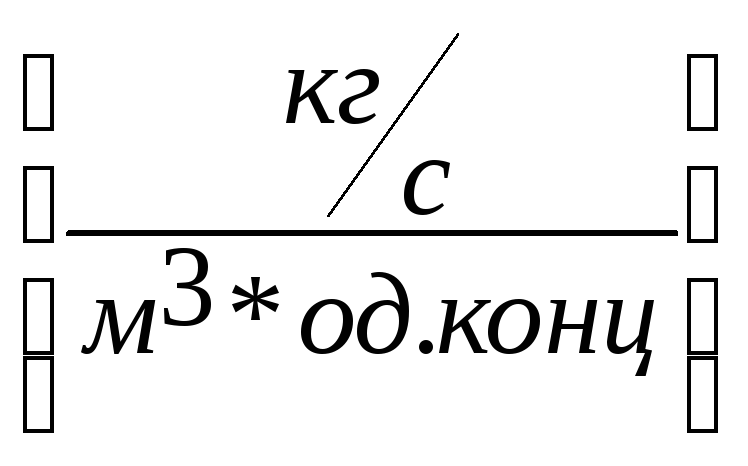
Об’єм робочої зони в апараті визначається значно легше, ніж поверхня контакту фаз.
Співвідношення між об’ємами
і поверхневими коефіцієнтами визначається
питомою поверхнею контакту фаз в даному
апараті
![]()
![]() ,
,
де
![]()
![]() ,
,
де
![]()
11. Рушійна сила процесу масопередачі
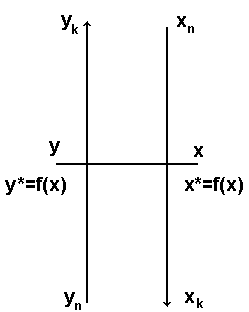
Рушійною силою масопередачі є різниця між фактичною концентрацією компонента в даній фазі і її значенням при рівновазі з іншою фазою.
В довільному перерізі апарату рушійна сила може бути виражена двома способами:
1)
![]() або 2)
або 2)
![]()
По висоті апарату її значення змінюється. В абсорберах з проти точним рухом фаз вона має максимальне значення внизу і мінімальне вверху. Середнє значення рушійної сили в даному апараті визначається концентраціями компонента в фазах на вході і виході, схемою руху фаз, способом контакту фаз:
![]()
Існує два способи контактування фаз:
-
безперервний, при якому концентрації компонента в фазах змінюються по висоті плавно(в апаратах насадкових і розпилювальних);
-
ступінчастий, при якому концентрації компонента в фазах змінюються по висоті стрибкоподібно(в тарілчастих апаратах).
Розглянемо апарат с безперервним контактом фаз, що рухаються в протилежних напрямах.
Позначимо L
– витрата фази
![]()
![]() - концентрація компонента в
фазі
- концентрація компонента в
фазі![]() початкова
і кінцева;
початкова
і кінцева;
G – витрата фази
![]() ;
;
![]() - концентрація компонента в
фазі
- концентрація компонента в
фазі
![]() початкова
і кінцева;
початкова
і кінцева;
![]() -
коефіцієнти масопередачі в апараті.
-
коефіцієнти масопередачі в апараті.

Хай х,у – робочі концентрації
компонента в фазах
![]() і
і![]() в
довільному перерізі F.
в
довільному перерізі F.
![]() - рівноважна концентрація
компонента в фазі
- рівноважна концентрація
компонента в фазі
![]() в
цьому перерізі;
в
цьому перерізі;
dx,dy – зміна
робочих концентрацій компонента в фазах
![]() і
і![]() в
безконечно малому елементіі з поверхнею
контакту dF.
в
безконечно малому елементіі з поверхнею
контакту dF.
Кількість компонента, що
переходить із фази
![]() в фазу
в фазу
![]() через поверхню контакту dF складає:
через поверхню контакту dF складає:
по рівнянню матеріального
балансу компонента в фазі
![]()
![]() (1)
(1)
По рівнянню масопередачі
![]() (2)
(2)
Із (1) і (2) маємо :
 (3)
(3)
Після інтегрування рівняння (3) по всій поверхні контакту фаз в апараті одержимо
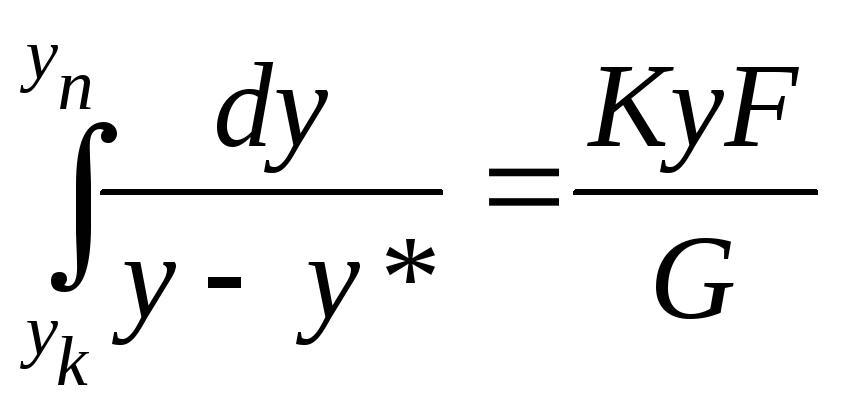
Із рівняння матеріального
балансу компонента в фазі
![]()
![]()
Тоді
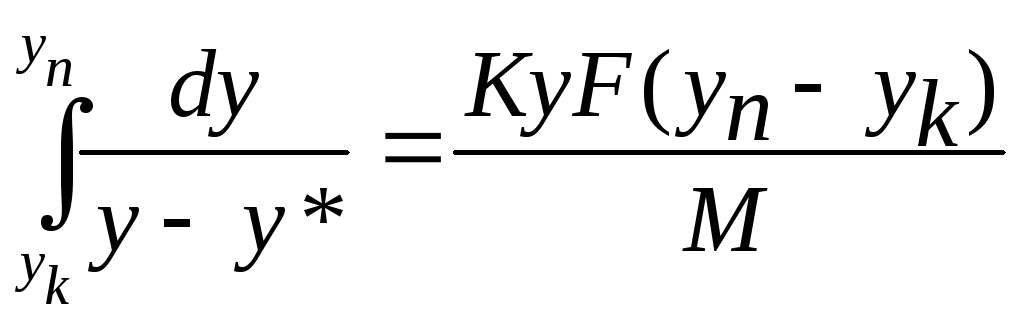 або
або
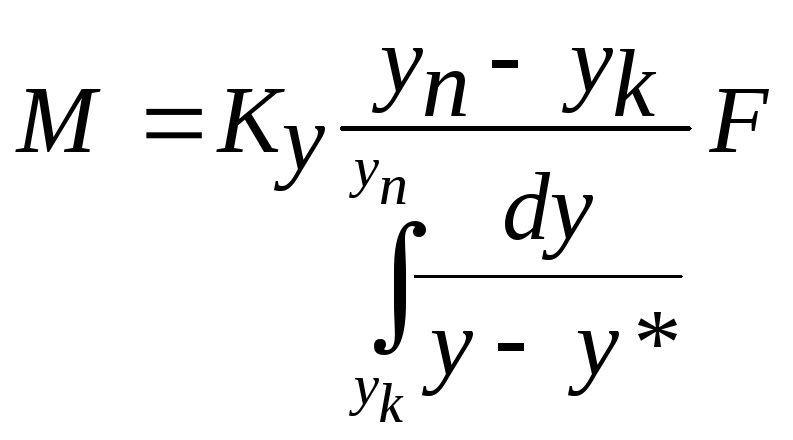
Порівнюючи останнє рівняння
з рівнянням масопередачі
![]() ,
можна зробити висновок, що
,
можна зробити висновок, що
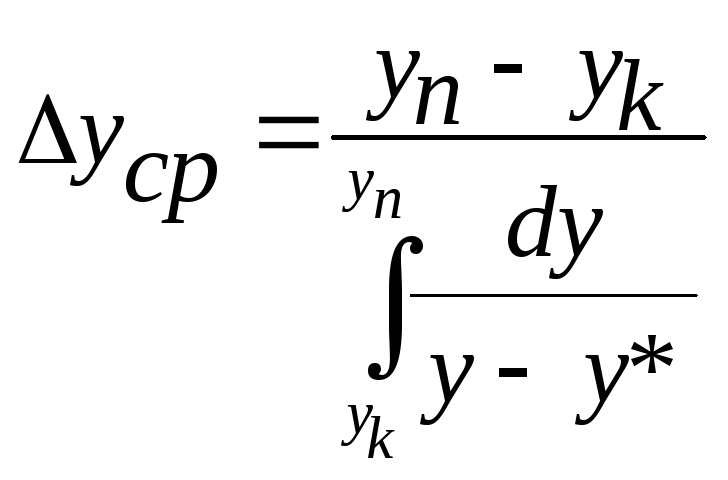 (4)
(4)
Величина
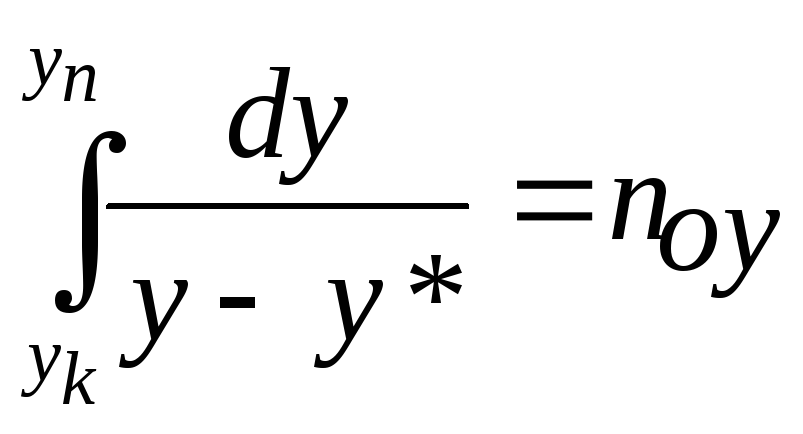 називається числом одиниць переносу
із фази
називається числом одиниць переносу
із фази
![]() в фазу
в фазу
![]() ,
вираженим через концентрації компонента
в фазі
,
вираженим через концентрації компонента
в фазі
![]() .
.
Тоді рівняння (4) можна
представити у вигляді
![]() або
або
![]()
Таким чином, число одиниць переносу показує, в скільки разів зміна робочої концентрації компонента в апараті більша за середню рушійну силу в ньому.
Одна одиниця переносу – це такий апарат (або фрагмент апарату), в якому робоча концентрація компонента змінюється на величину середньої рушійної сили в ньому.
Аналогічним чином можна
визначити число одиниць переносу в
апараті, виражене через концентрації
компонента в фазі
![]() .
.
![]() ,
звідки
,
звідки
![]() .
.
З урахуванням
![]() одержимо
одержимо
 ,
де
,
де
![]() - число одиниць переносу в апараті,
виражене через концентрації компонента
в фазі
- число одиниць переносу в апараті,
виражене через концентрації компонента
в фазі
![]() .
.
Тоді
![]()
![]() .
.
12. Визначення необхідного числа одиниць переносу.
В загальному випадку, коли
![]() є нелінійною функцією, значення інтегралів
є нелінійною функцією, значення інтегралів
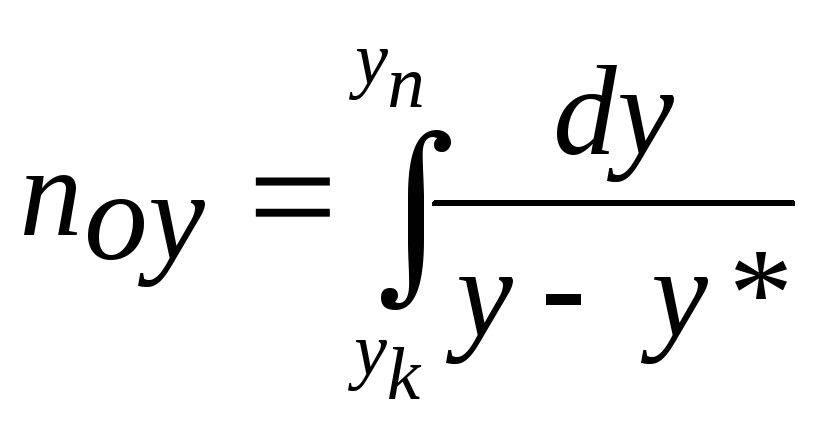 і
і
![]()
може бути визначено методом
графічного інтегрування.
Суть метода зводиться до побудови
графіка функції
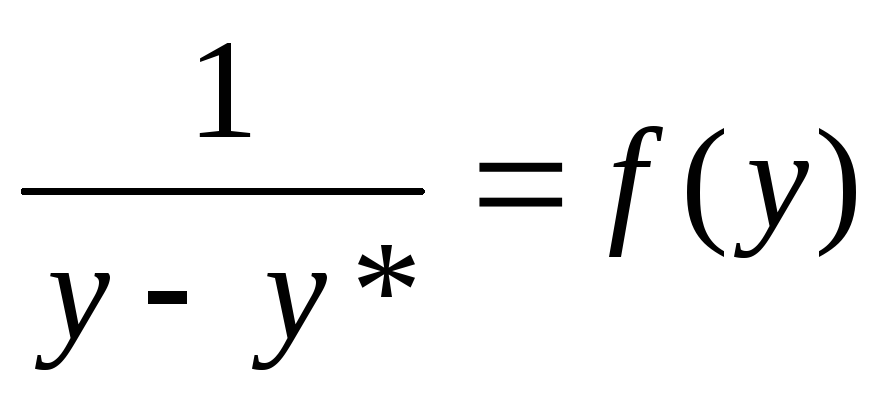 або
або
![]() і визначенні площі фігури під кривою,
обмеженої ординатами
і визначенні площі фігури під кривою,
обмеженої ординатами
![]() і
і
![]() або
або
![]() і
і
![]() .
.
Для побудови графіка функції необхідно мати рівняння рівноваги і робочої лінії процесу.
Хай
![]() - рівняння робочої лінії;
- рівняння робочої лінії;
![]() - рівняння рівноваги.
- рівняння рівноваги.
Для декількох значень X
в інтервалі
![]() визначаємо величини y,y*,
визначаємо величини y,y*,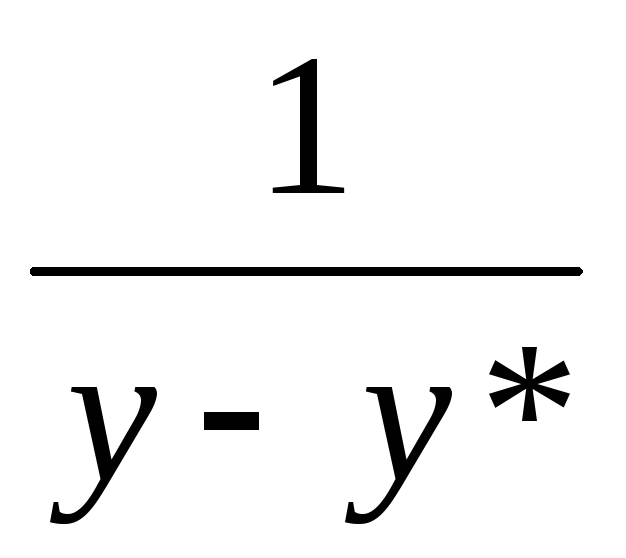 і будуємо графік.
і будуємо графік.
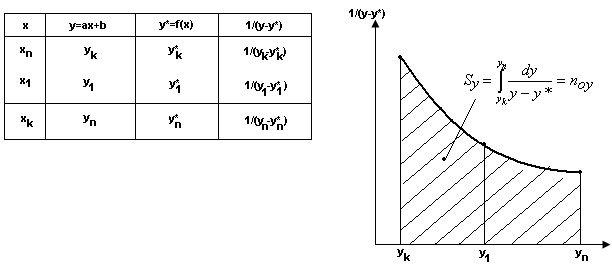
Аналогічним чином визначається
![]()
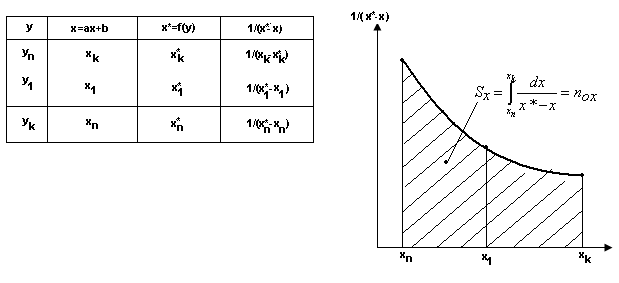
В окремих випадках, коли
рівняння рівноваги є лінійною функцією
![]() ,
величина інтегралів може бути визначена
аналітичним шляхом, а саме:
,
величина інтегралів може бути визначена
аналітичним шляхом, а саме:
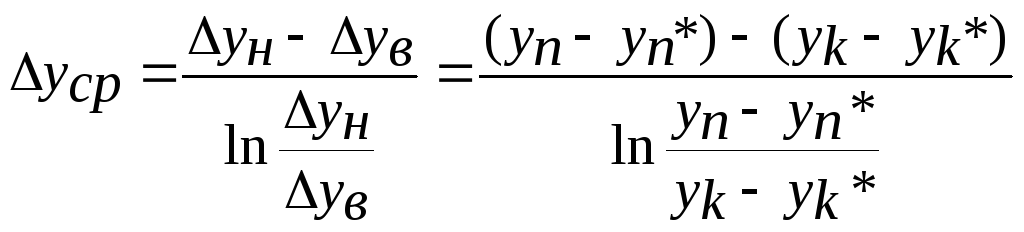 ,
,
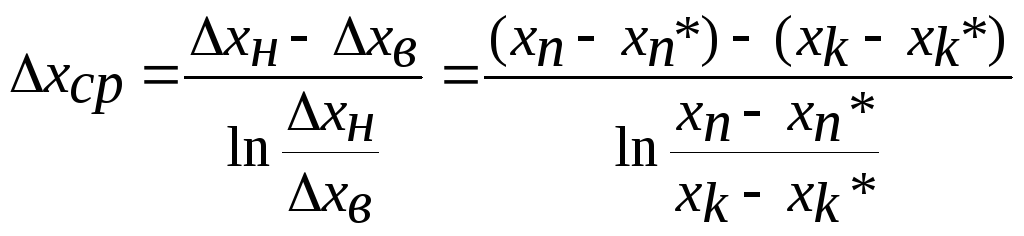
13. Висота одиниці переносу (воп).
Знаючи число одиниць переносу
![]() або
або
![]() ,
яке необхідно для змін фактичної
концентрації компонента в фазі
,
яке необхідно для змін фактичної
концентрації компонента в фазі
![]() від
від
![]() до
до
![]() і в фазі
і в фазі
![]() від
від
![]() до
до
![]() ,
можна визначити середню рушійну силу
масопередачі
,
можна визначити середню рушійну силу
масопередачі
![]() або
або
![]() ,
необхідну поверхню масопередачі
,
необхідну поверхню масопередачі
![]() або
або
![]() ,
,
Висоту апарата
![]() ,
,
де a
- питома поверхня контакту фаз,
![]() ;
;
S - площа
поперечного перерізу апарата,
![]() ;
;
V - об’єм
контактної зони апарата,
![]() .
.
Але висоту апарату можна
розрахувати також безпосередньо по
числу одиниць переносу
![]() або
або
![]() і висоті одиниці переносу
і висоті одиниці переносу
![]() або
або
![]() ,
тобто висоті фрагменту апарата,
еквівалентного одній одиниці переносу,
а саме:
,
тобто висоті фрагменту апарата,
еквівалентного одній одиниці переносу,
а саме:
![]() або
або
![]() .
.
Визначимо величину висоту
одиниці переносу
![]() .
Із рівняння балансу компонента в фазі
.
Із рівняння балансу компонента в фазі
![]() і рівняння масопередачі маємо:
і рівняння масопередачі маємо:
![]()
Поверхня масопередачі
![]()
Тоді
![]() ,
звідки
,
звідки
![]()
Таким чином, висота одиниці переносу
![]()
де
![]() - об’ємний коефіцієнт масопередачі
- об’ємний коефіцієнт масопередачі
![]() - швидкість руху фази
- швидкість руху фази
![]() .
.
Аналогічним чином визначається
висота одиниці переносу
![]() :
:
Із рівняння
![]() маємо
маємо
![]() ,
,
де
![]() ,
,
де
![]() - об’ємний коефіцієнт масопередачі
- об’ємний коефіцієнт масопередачі
![]() - швидкість руху фази
- швидкість руху фази![]() .
.
Значення
![]() і
і
![]() можуть бути знайдені через величини
висоти одиниці переносу
можуть бути знайдені через величини
висоти одиниці переносу
![]() і
і
![]() в фазах
в фазах
![]() і
і
![]() відповідно.
відповідно.
Визначимо величини
![]() і
і
![]() .
.
Із рівнянь балансу компонента
і масовіддачі в фазі
![]() маємо
маємо
![]() ,
,
звідки
![]() ,
,
де
![]() - число одиниць переносу в фазі
- число одиниць переносу в фазі
![]() ;
;
![]() - висота одиниці переносу в
фазі
- висота одиниці переносу в
фазі
![]() .
.
Аналогічно для фази
![]()
![]() ,
,
звідки
![]() ,
,
де
![]() - число одиниць переносу в фазі
- число одиниць переносу в фазі
![]() ;
;
![]() - висота одиниці переносу в
фазі
- висота одиниці переносу в
фазі
![]() .
.
Між величинами
![]() ,
,![]() ,
,
![]() і
і
![]() існує однозначна залежність. Визначимо
цю залежність. Оскільки
існує однозначна залежність. Визначимо
цю залежність. Оскільки
![]() ,
то помноживши ліву і праву частини цього
рівняння на
,
то помноживши ліву і праву частини цього
рівняння на
![]() ,
одержимо
,
одержимо
![]() ,
тобто
,
тобто
![]() .
.
Аналогічно для фази
![]() :
:
![]()
Помноживши це рівняння на
![]() ,
одержимо
,
одержимо
![]() ,
тобто
,
тобто
![]() .
.
Значення
![]() і
і
![]() залежать від режиму руху відповідної
фази, а також властивостей фази і
компонента. Цю залежність визначають
експериментальним шляхом і представляють
у вигляді критеріальних рівнянь:
залежать від режиму руху відповідної
фази, а також властивостей фази і
компонента. Цю залежність визначають
експериментальним шляхом і представляють
у вигляді критеріальних рівнянь:
![]() і
і
![]() .
.
Наприклад, при абсорбції в насадочних апаратах знайдені такі залежності:
![]() ,
,
![]() ,
,
де індекс “r” відноситься до газової фази, а індекс “p” до рідкої фази;
![]() - приведена товщина плівки рідини на
поверхні насадки, м;
- приведена товщина плівки рідини на
поверхні насадки, м;
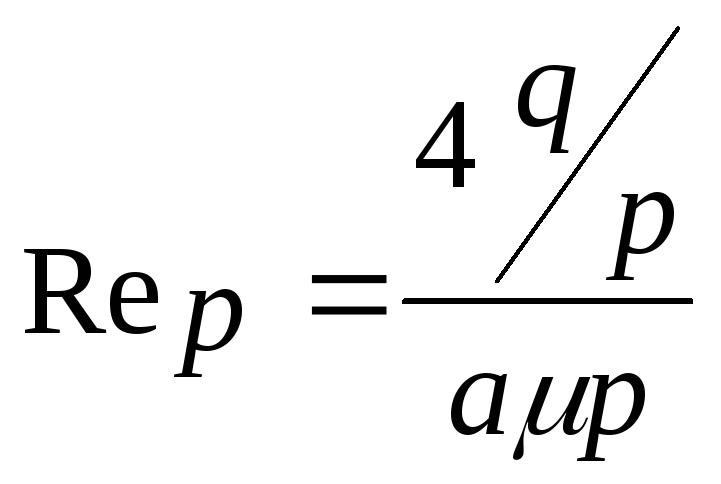 ,
,
![]() - масова швидкість рідини в апараті,
- масова швидкість рідини в апараті,
![]() .
.
14. Основні фактори, що визначають швидкість абсорбції.
Згідно з рівнянням масопередачі швидкість абсорбції можна представити у вигляді:
![]() ,
де
,
де
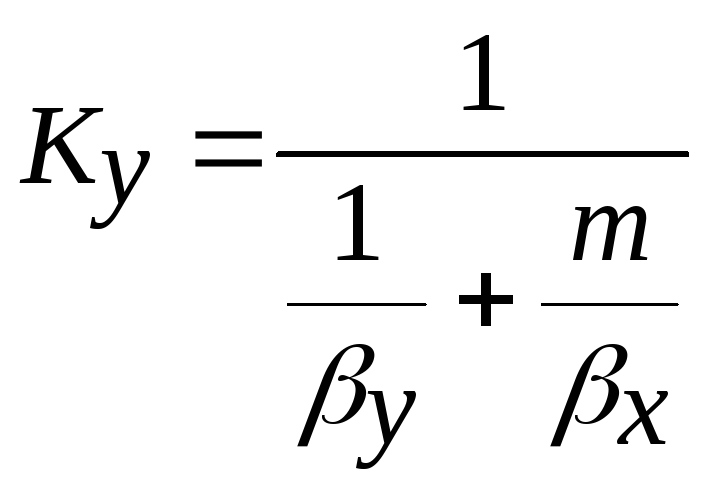 ,
,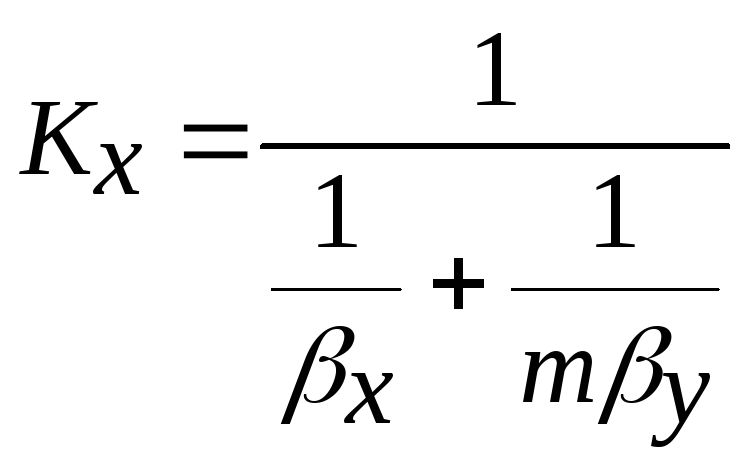 ,
,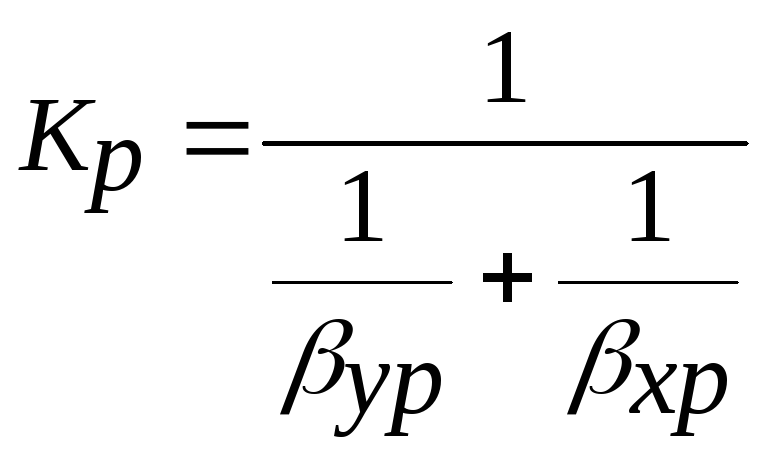 .
.
Із аналізу цих рівнянь можна зробити висновок, що швидкість абсорбції залежить головним чином від режиму руху фаз, температури і тиску в апараті.
Зі збільшенням
швидкості руху газу і
рідини зростають
коефіцієнти масовіддачі
![]() ,
,![]() ,
а значить і коефіцієнти
масопередачі
,
а значить і коефіцієнти
масопередачі
![]() і швидкість абсорбції.
і швидкість абсорбції.
При підвищенні температури
зростають коефіцієнти
дифузії компонента в фазах Dr
і Dp, а значить
зростають коефіцієнти масовіддачі
![]() ,
,![]() і коефіцієнти масопередачі
і коефіцієнти масопередачі
![]() ,
але в той же час зменшується рушійна
сила масопередачі
,
але в той же час зменшується рушійна
сила масопередачі
![]() ,
де
,
де
![]() - парціальний тиск компонента
в газі, який не залежить від температури;
- парціальний тиск компонента
в газі, який не залежить від температури;
![]() - рівноважний тиск компонента
над розчином;
- рівноважний тиск компонента
над розчином;
E - константа Генрі, яка різко зростає з підвищенням температури.
Оскільки при цьому рушійна сила зменшується в більшій мірі, ніж зростають коефіцієнти масопередачі, то швидкість абсорбції зменшується при підвищенні температури.
При збільшенні
тиску в апараті
коефіцієнти масопередачі незначно
зменшуються із-за зменшення коефіцієнтів
дифузії Dr.
В той же час рушійна сила процесу різко
зростає, оскільки зростає парціальний
тиск компонента
![]() ,
а рівноважний тиск над розчином Pp
практично не зменшується.
,
а рівноважний тиск над розчином Pp
практично не зменшується.
В підсумку при підвищенні тиску в апараті швидкість абсорбції зростає. Таким чином, швидкість абсорбції збільшується в апараті, при підвищенні тиску і зниженні температури розчину і газу.
У відповідності з цим абсорбцію бензольних вуглеводнів і сірководню належало б проводити при підвищеному тиску (10-12 ат) і пониженій температурі (15-20ºС ). Але такий режим може бути економічно виправданим тільки в тому разі, якщо очищений газ під тиском 10-12 ат буде мати споживачів, згодних відшкодувати затрати електроенергії на стиснення коксового газу.
Крім того при пониженій температурі зростає в’язкість поглинальних розчинів (кам’яноварільного масла і содового розчину), внаслідок чого ефективністю процесу абсорбції зменшується.
