
- •«Ухтинский государственный технический университет»
- •Оглавление Часть ι
- •Тема 1: Происхождение магматических, осадочных, метаморфических пород. Минеральный и химический составы пород, их изменение под воздействием выветривания скальных пород………………………………….91
- •1. Формирование и состав горных пород
- •2. Неорганические материалы с высокотемпературной обработкой
- •2.1 Керамические материалы
- •2.2 Силикаты
- •2.3 Металлы
- •3. Минеральные вяжущие вещества
- •3.1 Воздушные вяжущие вещества
- •3.2 Гидравлические вяжущие вещества
- •3.3 Бетоны
- •4. Строительные материалы органического происхождения
- •4.1 Древесина
- •4.2 Полимеры
- •4.3 Битумы
- •5. Лакокрасочные материалы
- •6. Создание композиционных материалов
- •Часть ιι
- •1.Происхождение горных пород.
- •16. Укрепление поверхности строительных материалов
- •Задача № 1
- •Задача №2
- •Задача №3
- •Лариса Алексеевна Ерохина
3.2 Гидравлические вяжущие вещества
Портландцемент является полиминеральным вяжущим веществом, основу которого составляет клинкер – продукт спекания смеси известковых и глинистых пород, состоящий из силикатов, алюминатов и ферритов кальция. Сырьевые материалы для спекания подбираются так, чтобы образующийся при обжиге оксид кальция полностью соединился при спекании с оксидами глины и образовались эти искусственные минералы – силикаты, алюминаты и ферриты кальция (соли). Это происходит при соотношении компонентов известняк : глина как 3 : 1. Технология получения цемента осуществляется последовательно по схеме: приготовление сырьевой смеси – обжиг – помол спёкшегося полиминерального продукта (клинкера).
Приготовление сырьевой смеси имеет своей целью однородное перемешивание измельчённого сырья для обеспечения полного соединения разных горных пород (известняка и глины). В зависимости от качества сырья смешение их может происходить в воде – мокрый способ, перемешивание сухих компонентов – сухой способ и комбинированным способом. При мокром способе получают качественную шихту для обжига, сухой способ более дешевый.
Обжиг шихты производят во вращающихся наклонных обжигательных печах при температуре около 1450°С. В начале обжига с повышением температуры в печи до 250°С из шихты (смеси сырьевых материалов) уходит свободная и адсорбированная вода. При дальнейшем повышении температуры до 600-800°С в смеси начинаются химические процессы разложения глины, когда её оксиды теряют связи и становятся самостоятельными:
Al2O3 ∙ 2SiO2 ∙ 2Н2О → Al2O3 + 2SiO2 + 2Н2О↑.
В зоне обжигательной печи при температуре 900-1000°С происходит декарбонизация известняка и появляется свободный оксид кальция:
СаСО3 → СаО + СО2↑
Здесь же образуется оксид железа Fe2O3 из глинистых минералов. Свободные оксиды кальция, кремния, алюминия и железа при высокой температуре начинают реагировать друг с другом и при температуре 1300°С твёрдофазовые реакции соединения завершаются образованием трёх солей кальция: силиката - 2СаО + SiO2 → 2CaO· SiO2, алюмината - 3CaO + Al2O3 → 3CaO ·Al2O3, и феррита - 2CaO + Fe2O3 → 2CaO· Fe2O3.
Алюминаты частично образуют с ферритом кальция четвёртый минерал - алюмоферрит: 4СаО ·Al2O3· Fe2O3.
Наконец при более высокой температуре 1450°С появляется расплав – жидкая фаза и происходит важнейшая реакция соединения оставшейся свободной СаО с силикатом кальция: СаОсв. + 2СаО· SiO2 → 3CaO· SiO2 – образовался главный минерал цементного клинкера, которого не было в гидравлической извести, для получения которого подняли температуру в печи до 1450˚С.
Получили четыре основных искусственных минерала, составляющих цементный клинкер:
алит – трёхкальциевый силикат 3СаО· SiO2, его должно быть в цементном клинкере 40-65%;
белит – двухкальциевый силикат 2CaO· SiO2, его должно быть в клинкере 15-40%;
целит - трёхкальциевый алюминат 3CaO ·Al2O3, самый мягкий минерал – 5-15%; и четырёхкальциевый алюмоферрит 4CaO ·Al2O3· Fe2O3, которого в клинкере должно быть 10-20%.
Названия минералам дали по первым буквам латинского алфавита и по их роли в твердении вяжущего. Алит – основной носитель вяжущих свойств портландцемента, химически активен и сохраняется при нормальной температуре только при быстром охлаждении клинкера. Белит - устойчивая форма силиката кальция, обладает более плотной структурой и вяжущие свойства проявляет очень медленно. Трёхкальциевый алюминат быстро реагирует с водой, четырёхкальциевый алюмоферрит немного медленнее реагирует с водой, образуя кристаллогидраты и гель Fe(OH)3.
В составе клинкера четыре основных минерала – два силиката и два алюмината. Только в составе цемента они в разных долях: силикатов – 75%, алюминатов – 25%.
Кроме кристаллических компонентов в составе клинкера образуется при быстром охлаждении до 15% стекловидной фазы, соединяющей в клинкере при остывании все составляющие и содержащей в основном силикаты и алюмосиликаты кальция, магния, калия и натрия. Они химически активны и играют заметную роль в процессах взаимодействия цемента с водой.
Таким образом химический состав клинкера содержит оксиды в пределах (масс. %):
СаО – 63-67; SiO2 – 21-24; Al2O3 – 3,5-7; Fe2O3 – 2,5-4; остальных оксидов: MgO, TiO2, SO3, Na2O и др. – не более 3-4%.
После быстрого остывания раскалённого клинкера его необходимо помо лоть, превратив в тонкий порошок. На этой стадии при помоле к нему добавляют 2-5% гипса и от 5 до 15% аморфного кремнезёма (гидравлической добавки), а также пластификаторы или гидрофобизаторы при их необходимости.
Чем тоньше измельчён цемент, тем активнее он будет реагировать с водой, тем полнее пройдут физико-химические процессы при твердении, тем плотнее он свяжет в растворе все компоненты. Портландцемент относится к медленнотвердеющим вяжущим веществам. Схватывание цементного теста начинается через 1,5-3 часа, а марочную прочность он приобретает к 28 суткам, завершая твердение примерно через год.
При смешивании цемента с водой в присутствии гипса между минералами, входящими в его состав, и водой начинаются химические реакции взаимодействия не одновременно. Наибольшую скорость взаимодействия с водой показывает трёхкальциевый алюминат, наименьшую – белит. Затем начинает реакцию четырёхкальциевый алюмоферрит и только потом подвергается гидролизу и начинает гидратацию алит, образующий два новых соединения: гидросиликат кальция и гидроксид кальция. Образующийся гидросиликат кальция устойчив в контакте с Са(ОН)2, который появляется вместе с ним. Скорость реакции больше у алюминатов, большую прочность при твердении обеспечивают силикаты, поэтому их в составе больше.
После гидролиза наиболее активным по отношению к воде минералом становится алит – соль сильного основания Са(ОН)2 и слабой кислоты Н4SiO4. Гидратация безводных солей приводит к образованию кристаллогидратов, вода входит в структуру новообразования и увеличивает его объём, количество свободной воды в тесте заметно убывает, начинается схватывание, переходящее в твердение.
2(3СаО· SiO2) + 6H2O → 3Ca(OH)2 + 3CaO· 2SiO2· 3H2O.
Это слабо закристаллизованный гель (первичный) постепенно переходящий в более крупные кристаллы гидросиликата кальция (вторичный), обеспечивая рост прочности.
Двухкальциевый силикат – белит начинает гидратацию позже других минералов, набирает прочность долго, но в конце гидратации сравнивает прочность с прочностью алита. Он формирует также гидросиликаты кальция и одну молекулу Са(ОН)2.
Алюминаты при гидратации образуют гидроалюминаты и гидроферриты кальция:
3CaO ·Al2O3·6H2O и CaO· Fe2O3· 3H2O.
Структура цементного камня.
Процесс твердения цемента согласно теории Байкова проходит три физико-химические стадии:
растворение или насыщение водной оболочки вокруг зерна щёлочью;
стадия коллоидации соответствует периоду схватывания, когда начинают выделяться аморфные частицы микрокристаллов размером 1-100 нм (гель);
стадия кристаллизации – твердения, когда коагуляционная структура постепенно переходит в кристаллизационную, способную воспринимать механические нагрузки.
В результате полной гидратации цементной частички её размер увеличивается более чем в два раза за счёт увеличивающейся диспергации каждой цементной частицы при гидратации. Из твёрдого цементного зерна образуются сплетения аморфных волокон гидросиликатов размером 3-5 нм и пластинок гидроалюминатов, разделённых такими же расстояниями в наноразмерах между собой – порами геля. Коллоидная система не устойчива и самопроизвольно стремится повысить свою устойчивость укрупняясь. Субмикрокристаллы начинают перекристаллизацию, появляется прочность и твёрдость.
Вода затворения расходуется на гидратацию, адсорбируется на образующейся поверхности новообразований и частично испаряется. Постепенно цементное тесто превращается из геля в цементный камень, который долго продолжает увеличивать прочность, если в структуре есть влага, если за ним продолжают влажный уход. Последняя стадия перекристаллизации самая длительная, твердение продолжается, если есть влажные условия, за счёт:
образования ковалентных силоксановых связей ≡Si-O-Si≡ внутри цепочек гидросиликатов;
за счёт роста контактов между микрокристаллами;
за счёт водородных связей гидроксильных групп гидросиликатов;
за счёт взаимодействия сил Ван-дер-Ваальса между структурами новообразований.
Прочность материалов из зернистых компонентов может появиться в результате крепнувших контактов между ними. При интенсификации твердения (гидротермальная обработка в автоклаве) под воздействием высокой температуры и давления быстро образуется щелочная среда. Частички кварцевого песка растворяются с поверхности в щёлочной среде и вступают во взаимодействие с гидроксидом кальция. Образуются низкоосновные гидросиликаты и гидроалюминаты кальция, располагающиеся на поверхности не растворившихся песчинок, связывая их. Такой же механизм появления контактов между заполнителем и вяжущим у цемента. Но контакт у отдельных частиц не может быть сплошным, охватывающим всю поверхность. Концентрации дисперсных частиц не хватает, чтобы уплотнить их как при расплаве, когда не остаётся пустых промежутков. Поэтому образуется пористая коагуляционная структура с промежутками между контактами – порами. При автоклавном твердении и даже при пропаривании аморфизированные продукты гидратации быстрее кристаллизуются, обеспечивая прочное срастание с поверхностью всех компонентов. Основными продуктами химических реакций являются гидросиликаты – тоберморит, одноосновный СSH(B), ангидрит (СаSO4), гидрогранат, кварц. Мельчайшие кристаллики тоберморита обеспечивают прочность и малую усадку. При нормальном твердении формируются мелкие слабо закристаллизованные гидросиликаты кальция – СSН, имеющие в начальный период преимущественно коагуляционную структуру, в которой дисперсные частички разделены между собой тонкими прослойками растворной жидкости, содержащей ПАВ. Отсутствие контакта обусловлено отсутствием кристаллизованных новообразований. Они в цементном камне появляются через некоторое время, но поры остаются.
Если необходимо ускорить твердение вяжущего, есть способы ускорения и замедления твердения. Ускоряют твердение добавками в воду затворения солей-электролитов: СаСl2· 2H2O, Na2CO3 (сода или поташ), Ca[OC(O)H]2 (формиат кальция), Na2Si3O7 (жидкое стекло) и другие, а также повышение температуры (пропаривание, электроразогрев бетонной смеси).
Замедляют твердение без уменьшения конечной прочности цементного камня органические продукты: сахара, абиетат натрия, поверхностно-активные вещества (лигносульфонаты кальция, производные меламиновой смолы, гидрофобизаторы).
Если рассматривать затвердевший цементный камень в электронный микроскоп, то можно увидеть между непрореагировавшими зёрнами цемента и песка сложное переплетение кристаллов и волокон размером от 5 до 50 нм, воздушные прослойки – поры разных размеров, заполненные дисперсионной средой, что придаёт цементному камню монолитность и вид микробетона.
Тот факт, что частички цементных зёрен не все полностью гидратированы, обеспечивает цементу длительное твердение (клинкерный фонд) и способность к самозалечиванию при благоприятных условиях.
Вяжущие - и цемент и известь (кроме гипсовых) в чистом виде не применяют. Это мельчайшие частички, которые после смачивания водой начинают с ней химическое взаимодействие. Вокруг каждой частички цемента образуется гель – масса, похожая на студень, обладающая клеющей способностью, тем в большей степени, чем меньше воды. Если воды много, капиллярные силы не связывают компоненты смеси, она растекается. После гидратации и высыхания смеси, особенно при избытке воды, появляются трещины усадки, даже, если воды было требуемое количество. Чтобы исключить трещинообразование цементный и известковый растворы армируют более крупными частичками кварцевого песка, которого в смесь добавляют больше, чем цемента в 3-5 раз (мелкий заполнитель). Так готовят строительные растворы. Цемента в объёме становится меньше, образующийся гель при его гидратации окутывает каждую песчинку, связывая их в единый камень, трещин в меньшем объёме геля - меньше.
Чтобы приготовить ещё больший объём искусственного камня, делают бетон. Уже цементный раствор связывает более крупные камни из горных пород, которые называют заполнителем. Крупный заполнитель тоже армирует растворную часть, сокращая её объём и трещины усадки. Чтобы бетон был прочным, камни заполнителя должны быть полностью окружены раствором, раствор их скрепляет, отвердевая. Растворная часть (цементный камень) закрывает все заполнители, придаёт форму изделию и защищает его от внешних воздействий. Это матрица в бетоне. Чем плотнее цементный камень, тем прочнее и более стоек бетон в неблагоприятных условиях работы.
Коррозия цементного камня и защита от неё
Бетонные конструкции эксплуатируются в разных условиях и испытывают воздействия окружающей среды, не всегда благоприятные для их долговечности. Наряду с механическими (удар, вибрация, истирание) и физическими (перепады температуры, увлажнение-высушивание) причинами разрушения становятся химические факторы. Это длительное пребывание в проточной воде, воздействие морской или сточной воды с растворёнными в ней солями, длительный контакт с кислыми растворами, органическими веществами. В любых условиях работы агрессивное вещество попадает на бетон и первым взаимодействует с агрессивным веществом цементный камень. Процессы химического разрушения материалов от действия окружающей среды называют коррозией. Все виды химического разрушения цементного камня сгруппированы в 3 вида:
постоянная фильтрация проточной мягкой воды сквозь бетон или омывание его водой приводит к растворению и вымыванию растворимых компонентов из состава цементного камня. Называют этот процесс выщелачиванием или I видом коррозии;
воздействие кислой среды на цементный камень, даже растворённого в воде диоксида углерода. Этот процесс называют кислотной коррозией или II видом коррозии;
воздействие морской или грунтовой водой, содержащей растворённые сульфаты. Такая коррозия называется сульфатной и относится к III виду коррозии.
Опасным воздействием является и попеременное замораживание бетона в водонасыщенном состоянии и оттаивание. Цементный камень всегда обладает развитой пористостью, что увеличивает поверхность контакта с агрессивной средой, и опасность его разрушения.
При первом виде коррозии проточная вода постепенно и постоянно растворяет и выносит из структуры наиболее растворимый компонент Са(ОН)2. Это сильная щёлочь, она обеспечивает рН ≥ 12 в структуре цементного камня и только в щелочной среде могут оставаться невредимыми гидросиликаты кальция, формирующие его прочность и плотность. Как только снижается щёлочность, снижается основность гидросиликатов кальция, становятся возможными процессы дальнейшего гидролитического распада гидросиликатов кальция, начинает снижаться прочность и это приводит к разрушению цементного камня и бетона. Гидросиликаты выделяют Са(ОН)2 на сохранение щёлочности, в ущерб своей целостности, а вода её уносит:
2CaO ∙SiO2∙ 2H2O → CaO∙ SiO2∙ H2O + Ca(OH)2.
При втором виде коррозии на цементный камень действуют растворённые в воде соединения. В зависимости от вида соединения различают углекислотную, магнезиальную и общекислотную коррозию.
Углекислотная имеет место тогда, когда на бетон воздействуют подземные воды, содержащие агрессивную углекислоту. Образовавшийся сначала карбонат кальция при большой концентрации СО2 переходит в водный раствор в виде гидрокарбоната, растворимого в воде, и потому вымываемого водой из структуры цементного камня. Происходит разрушение гидросиликатной составляющей, появляются поры на месте растворённого вещества, нарушаются связи, прочность падает.
СаСО3 + СО2 + Н2О → Са(НСО3)2.
Магнезиальная коррозия происходит в воде, содержащей соли магния. Это морская вода, где катион Mg2+ имеет концентрацию в несколько раз более высокую, чем в речной воде. Соли магния сначала реагируют с гидроксидом кальция:
Са(ОН)2 + MgCl2 → CaCl2 + Mg(OH)2.
В результате этой реакции гидросиликатный каркас замещается рыхлой массой кристалликов Mg(OH)2, не связанных между собой, и растворимым в воде хлористым кальцием. Щёлочность падает, начинают разрушаться гидросиликаты кальция.
Кислотная коррозия возникает на химических предприятиях, при переработке отходов, или от проникающих в поры бетона газов, когда они, соединяясь с капиллярной влагой, образуют кислоты, активно вступающие в реакции обмена с щелочными компонентами цементного камня. В первую очередь разрушается гидроксид кальция, затем гидросиликаты:
Са(ОН)2 + 2НСl → CaCl2 + 2H2O.
Происходит полное разрушение цементного камня, а вместе с ним и бетона.
Третий вид коррозии вызывают сульфаты, если в воде растворены сернокислые соли кальция, магния, натрия и др. Это может быть в морской воде или в почвенных водах, при контакте бетона с гипсовой штукатуркой. Проникая в пористую структуру, вода несёт туда сульфаты, которые встречаясь с гидроалюминатами цементного камня, начинают реакцию обмена:
Na2SO4 + Ca(OH)2 → CaSO4 + 2NaOH, и далее:
3CaO ·Al2O3· 6H2O + 3CaSO4 + 26H2O → 6CaO ·Al2O3· 3SO3· 32H2O.
Образующиеся кристаллы гидросульфоалюмината кальция (минерал эттрингит) имеют в 2-2,5 раза объём больший, чем исходные минералы. Это иглообразные кристаллы, разрушающие пористую структуру цементного камня изнутри. Происходит растрескивание, искривление поверхности бетона, он разрушается.
К третьему виду коррозии относится и щелочная коррозия. Это не действие щелочей, цементному камню опасно воздействие только концентрированных щелочей, они разрушают алюминаты. Щелочной коррозией цементного камня называют взаимодействие щелочей цемента (гидроксида кальция) с аморфным кремнезёмом, который может содержаться в крупном заполнителе бетона (это могут быть кремнистые породы – опал, трасс, трепел). На границе заполнителя с цементным камнем образуется в результате реакции гидрогель, объём его увеличивается, и это приводит к росту внутренних напряжений, разрушению.
За годы эксплуатации бетонов в разных условиях выработаны меры защиты бетона и цементного камня от коррозионного разрушения. Они сводятся в три основные задачи:
регулирование состава цемента;
снижение пористости цементного камня;
применение защитных покрытий.
Два первых пункта – это пассивная или первичная защита, о которой надо думать прежде, чем делать изделия из бетона, чтобы предупредить коррозию. Регулирование состава – это правильный выбор вида цемента для изготовления бетона. Проектировщик знает, в каких условиях будет работать бетон, какие технологические процессы будут в проектируемом здании, будут ли вредные газы или кислоты воздействовать на бетонные конструкции. Если намерены строить жилое или административное здание, там будут нормальные условия и для жизни людей и для работы бетона. Если будут строить цех по производству минеральных удобрений, надо предусмотреть заранее пассивную защиту. Какие химические реактивы будут использованы, какие вещества будут выделяться, как они подействуют на цементный камень, на какие его составляющие? Какой цемент предпочесть в этих условиях? Об этом проектировщики думают заранее.
При наличии опасности сульфатной коррозии (морская вода или сточные воды, выделение сернистых газов, высокая концентрация гипса) используют бетон, приготовленный на сульфатостойком цементе. В его составе очень мало алюминатов, с которыми взаимодействуют сульфаты, эттрингит не образуется, цементный камень не пострадает. Сульфатостойкий цемент специально делают с низким содержанием алюминатов.
В случае опасности выщелачивания или углекислотной коррозии, снижают концентрацию выделяющегося гидроксида кальция при гидратации, т. е. разбавляют цемент активной минеральной добавкой. Такая добавка специально вводится при помоле портландцемента до 40%. Такой цемент называют пуццолановым цементом. Или можно использовать шлакопортландцемент, где в качестве активной минеральной добавки присутствует молотый доменный шлак до 60%, в котором также есть аморфный кремнезём. Выделяющийся Са(ОН)2 вступает в химическую реакцию с аморфным кремнезёмом этой добавки и превращается в гидросиликат кальция, имеющий очень низкую растворимость в воде. Эти цементы можно использовать и при опасности магнезиальной коррозии и при действии слабых кислот. При воздействии сильных кислот цементный камень защитить невозможно, его надо заменить кислотостойкими композициями на основе керамики, каменного литья или полимербетона.
Задача по снижению пористости цементного камня решается повышением его плотности. Причиной возникновения пористости в цементном камне является зернистость компонентов, неплотности при укладке смеси и присутствие избыточной воды затворения в тесте при его изготовлении. С нею тесто пластичнее, легче перемешивается. Но на химическую реакцию гидратации требуется всего 18-20% воды от массы цемента, остальная вода после укладки растворной массы испарится и оставит капилляры и поры, увеличивающие поверхность контакта цементного камня с вредной средой. Общая величина пористости составляет около 30%. Сокращение пористости цементного камня будет эффективной защитой от всех видов коррозии. Чтобы увеличить плотность формуемого материала есть способы более плотной упаковки частиц компонентов. Одним из них является снижение поверхностного натяжения воды, когда вода лучше смачивает частицы при ничтожной толщине прослойки между ними. Вещества, изменяющие поверхностное натяжение жидкости называют поверхностно-активными веществами (ПАВ).
ПАВ представляют собой органические порошки или жидкости (углеводороды) с высокой удельной поверхностью, понижающие поверхностное натяжение воды (гидрофильные) или повышающие его (гидрофобные). Эти вещества изменяют угол смачивания (Рис.9), занимают ориентированное положение в поверхностном слое, облегчающее перемешивание бетонной смеси с малым количеством воды. Такие вещества назвали пластификаторами, они увеличивают пластичность растворных смесей. При добавлении этого вещества в строительный раствор полярные части молекул ПАВ располагаются на поверхности раздела твёрдых частиц и жидкости, а другая, неполярная часть молекулы, – располагается перпендикулярно к поверхности воды, образуя мономолекулярный слой (Рис 8). Этот слой, как масло, обволакивая твёрдую частицу способствует более лёгкому перемешиванию компонентов с меньшим количеством жидкости.
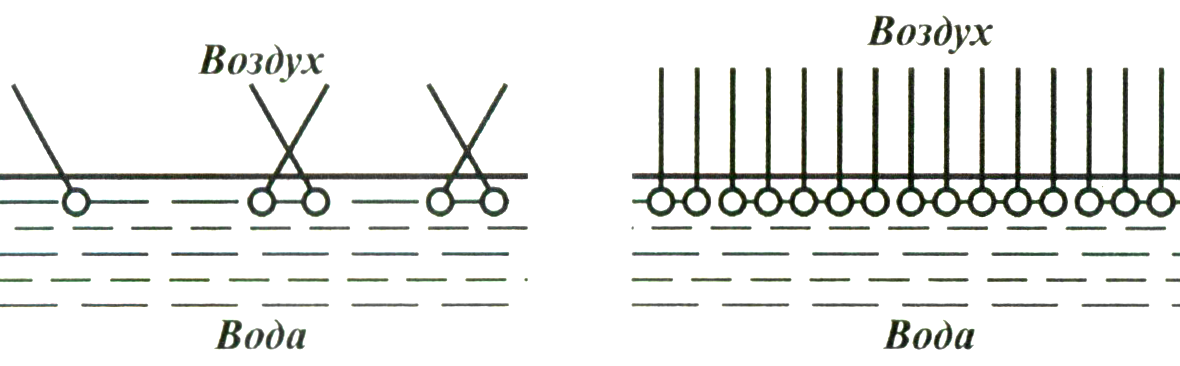
Рис.8 Расположение молекул ПАВ на поверхности раздела вода-воздух [2].
Длина углеводородного радикала оказывает значительное влияние на поверхностную активность молекул. С увеличением длины неполярной части молекулы, повышается их способность переходить из объёма раствора в поверхностный слой, повышая эффект пластификации.
Изменение поверхностного натяжения жидкости под воздействием ПАВ влияет на смачиваемость твёрдых тел. Молекулы воды полярны, вода хорошо смачивает поверхности силикатов, но хуже смачивает поверхности карбонатов, некоторых кристаллических пород, пластмасс. При введении ПАВ в воду поверхностное натяжение воды снижается, т. е. наблюдается улучшение смачивания частиц водой и её меньше требуется для изготовления строительных смесей, так как смесь хорошо и однородно перемешивается и укладывается в форму с более плотной упаковкой частиц.

Рис. .9 Схема гидрофильного и гидрофобного вещества на поверхности [2].
В современной технологии бетона широко применяют поверхностно-активные вещества в малых дозах (0,03-0,5% от массы цемента) при изготовлении изделий. Расположение ПАВ на границе раздела толщиной всего в один молекулярный слой стабилизирует коллоидную систему, позволяет снизить количество воды, улучшить при этом удобоформуемость смеси и, если прочность позволяет, снизить количество цемента. Но, необходимо учитывать, что эффективность ПАВ возрастает с увеличением содержания цемента в смеси. При адсорбции цементом пластификатора твёрдые частички лучше смачиваются водой, повышается пластичность и подвижность смеси. Если ПАВ обладает гидрофобизующим действием, твёрдые частицы цемента становятся гидрофобными и затвердевшие изделия не смачиваются водой.
Применение пластификаторов позволило увеличить плотность растворов и бетонов, так как при снижении количества воды затворения подвижность смеси не снижается, а плотность цементного камня с меньшим количеством воды увеличивается. Вместе с уплотнением структуры увеличивается водонепроницаемость и морозостойкость. Традиционные пластификаторы позволяют снизить водоцементное отношение (В/Ц) на 5-15%, новые суперпластификаторы – на 30%.
Способность бетона сопротивляться разрушению при замерзании влаги в поровом пространстве увеличивают введением в смесь воздухововлекающих добавок ПАВ. При перемешивании смеси образуются обособленные воздушные пузырьки микроскопического размера, способные разместить в своём пространстве отжимаемую из капилляров замерзающую влагу и тем снять напряжение в тончайших капиллярах. Кроме этого вовлеченный воздух улучшает удобоукдадываемость смеси с меньшим количеством воды, что уплотняет структуру.
Уплотняют структуру современных высококачественных бетонов, вводя в смесь минеральные добавки-уплотнители. Это микрокремнезёмы, глинозёмы, некоторые золы и специально составленные модификаторы. Минеральные частички этих добавок имеют высокую удельную поверхность, в десятки раз выше чем у цемента и пуццоланическую активность, т. е. вступают в химическое взаимодействие с гидроксидом кальция.
Уплотняют бетонные смеси при укладке их в формы и механическими способами: прокатом, виброуплотнением, прессованием, вакуумированием, центрифугированием и др.
Выполнение третьего пункта защиты бетона необходимо в случае эксплуатации его в сильно агрессивной среде, когда первичные меры защиты недостаточны. Тогда применяют вторичную защиту: покрытия, облицовки, футеровки, покраски, пропитки и прочее. Это плёночные покрытия, масляные краски, полимерные краски и лаки, устройство плиточного покрытия на слой раствора, пропитки водонерастворимыми соединениями. Гидрофобизация поверхности бетона – пропитка кремнийорганическими полимерами или жидкой серой закупоривает капилляры или образует сплошную защитную плёнку и защищает поверхность от агрессивного воздействия.
Используют и неорганические покрытия, наносимые на поверхность в жидком виде с последующим отверждением – это флюатирование. Водным раствором ΜgSiF6 обрабатывают поверхность цементного камня, содержащего выделяющийся при гидратации гидроксид кальция, происходит реакция с образованием нерастворимых солей, закупоривающих капилляры:
MgSiF6 + 2Ca(OH)2 = MgF2 + 2CaF2 + SiO2 0,5H2O + 1,5H2O.
