
- •«Ухтинский государственный технический университет»
- •Оглавление Часть ι
- •Тема 1: Происхождение магматических, осадочных, метаморфических пород. Минеральный и химический составы пород, их изменение под воздействием выветривания скальных пород………………………………….91
- •1. Формирование и состав горных пород
- •2. Неорганические материалы с высокотемпературной обработкой
- •2.1 Керамические материалы
- •2.2 Силикаты
- •2.3 Металлы
- •3. Минеральные вяжущие вещества
- •3.1 Воздушные вяжущие вещества
- •3.2 Гидравлические вяжущие вещества
- •3.3 Бетоны
- •4. Строительные материалы органического происхождения
- •4.1 Древесина
- •4.2 Полимеры
- •4.3 Битумы
- •5. Лакокрасочные материалы
- •6. Создание композиционных материалов
- •Часть ιι
- •1.Происхождение горных пород.
- •16. Укрепление поверхности строительных материалов
- •Задача № 1
- •Задача №2
- •Задача №3
- •Лариса Алексеевна Ерохина
2.3 Металлы
В технике к металлам относят как собственно металлы, так и их сплавы, для которых также характерны металлические свойства: высокая электропроводимость и теплопроводность, металлический блеск, пластичность. Кроме того, они обладают специфическими механическими свойствами – большой прочностью при растяжении и сжатии, способностью к ковке, отрицательным коэффициентом электрической проводимости (понижением электрической проводимости с ростом температуры). Металлические свойства присущи металлам в твёрдом и жидком состоянии, пары металлов прозрачны и не проводят электрический ток.
К наиболее распространённым в природе металлам относятся алюминий, железо, кальций, натрий, калий, магний, титан. Большая часть металлов находится в земной коре в виде химических соединений – минералов. Самыми распространёнными минералами, содержащими соединения металлов, являются силикаты, оксиды, сульфиды, карбонаты, сульфаты, фосфаты, галогениды.
Черные металлы
Чёрными металлами называют сталь и чугун, которые получают из таких минералов как магнетит Fe3O4, гематит Fe2O3, гетит Fe2O3· Fe(OH)3, хромистый железняк FeO· Сr2O3, боксит Al2O3· H2O, пиролюзит MnO2, гаусманит Mn3O4, куприт Cu2O3, валентинит Sb2O3, сервантит Sb2O4 и сульфиды (железный колчедан) FeS2. Исходным сырьём для получения металлов являются руды.
Руда – это природное минеральное образование с таким содержанием полезных минералов, которое обеспечивает экономическую целесообразность их извлечения. Руду обрабатывают, отделяют пустую породу для увеличения концентрации металла. Большинство металлов в природе находится в окисленном состоянии, извлечение их основано на восстановлении их и отделении от примесей.
Железо и его сплавы составляют основу современной техники. Основную массу железа выплавляют в виде чугуна и стали. Железную руду дробят и плавят в доменных печах, где поддерживают высокую температуру, сжигая кокс (специально обработанный уголь). При сжигании угля образуется углекислый газ, который, проходя через слой раскалённого угля, восстанавливается до оксида углерода: С+О2 = СО2 → СО2 + С = 2СО;
Оксид углерода восстанавливает руду (Fe2O3). По мере повышения температуры железо восстанавливается сначала при 400-500°С:
3Fe2O3 + CO = 2Fe3O4 + CO2.
При температуре 600°С превращается: Fe3O4 + CO = 3FeO + CO2;
При температуре 700-900°C железо восстанавливается до металлического:
FeO + CO = Fe + CO2.
При ещё более высокой температуре 1000-1100°С уже всё железо восстанавливается углеродом:
FeO + C = Fe + CO,
и восстановленное железо частично взаимодействует с оксидом углерода, образуя карбид железа: 3Fe + 2CO = Fe3C + CO2 .
В результате науглероживания железо переходит в жидкое состояние и стекает в нижнюю часть печи.
Пустую породу в руде составляют, главным образом, оксиды кремния SiO2, алюминия Al2O3 и другие оксиды, относящиеся к тугоплавким веществам. Для превращения тугоплавких примесей в более легкоплавкие соединения к руде добавляют флюс. В качестве флюса используют известняк или доломит. При температуре 900°С известняк превращается в оксид кальция (известь):
СаСО3→СаО + СО2.
Оксид кальция, являясь активным веществом, при температуре 1000-1200°С взаимодействует с веществами пустой породы, образуя шлаки, состоящие главным образом из силикатов и алюмосиликатов кальция.
В зоне высоких температур параллельно с восстановлением оксидов железа частично восстанавливается кремний: SiO2 + 2C = Si + 2CO.
Восстанавливаются марганец и фосфор, а сера превращается в сульфиды. Сульфид железа хорошо растворим в чугуне. Снижение сульфида железа в чугуне осуществляется с помощью образующейся извести и часть серы переходит в шлак в виде сульфида кальция (СаS). Расплавленное железо при температуре 1600-1750°С растворяет в себе углерод, цементит, кремний, марганец, фосфор, серу и образуется чугун.
Шлак имеет плотность 2,5г/см3, чугун – 6,9г/см3, поэтому шлак собирается над чугуном, предохраняя его от окисления. Жидкий чугун и шлак легко отделяются друг от друга, вытекая из доменной печи через отверстия, расположенные на разных уровнях. Получаемый чугун содержит около 93% железа, от 2,5 до 5% углерода, а также 0,5-4% кремния, 1-3% марганца, 0,02-2,5% фосфора и 0,005-0,08% серы. В зависимости от условий охлаждения получаются два вида чугуна: белый и серый. При быстром охлаждении чугуна углерод выделяется в виде цементита Fe3C, образуется белый чугун. Такой чугун имеет высокую твёрдость, но очень хрупок, поэтому его перерабатывают на сталь (передельный чугун).
Выплавляют сталь кислородно-конверторным, мартеновским, бессемеровским способами и для выплавки качественных и высоколегированных сталей всё более широкое применение получил электросталеплавильный метод, позволяющий производить плавку в вакууме, под высоким давлением, при температуре расплава свыше 3000°С.
При медленном охлаждении жидкого чугуна углерод выделяется в виде графита и образующийся чугун имеет серый цвет, поэтому его называют серым чугуном. Этот чугун характеризуется высокими литейными свойствами и применяется в машиностроении для отливки тяжелых частей машин, маховиков, поршней, цилиндров и др. Это наиболее распространённый литейный сплав.
80-85% чугуна расходуется на получение стали. При переработке чугуна в сталь из него удаляют примеси серы, фосфора, кремния, содержание углерода снижается до 2,14% и менее. В результате выплавки из чугуна стали получают более пластичный материал, который подвергают легированию и раскислению. С помощью раскисления восстанавливается железо и снижается красноломкость:
FeO + Mn = Fe + MnO или 2FeO + Si = 2Fe + SiO2.
Для полного удаления кислорода в конце процесса добавляется немного алюминия:
2FeO + Al = 2Fe + Al2O3.
По степени раскисления сталь делят на спокойную, полуспокойную и кипящую. Кристаллизация нераскисленной стали сопровождается выделением газообразного оксида углерода СО, металл как бы кипит. Такая сталь называется кипящей. Кипящие стали дешевле, но более деформативны, из них не делают ответственных конструкций.
Образующиеся оксиды кремния, марганца и алюминия переходят в шлак.
Всё многообразие способов получения металлов разбивают на три: пирометаллургические, гидрометаллургические и электрометаллургические процессы. Металлургические процессы, протекающие при высоких температурах, называются пирометаллургическими. Такие малоактивные металлы как железо, цинк, свинец, медь и др. получают из оксидов восстановлением углеродом.
Самым замечательным свойством металлов является очень высокая электрическая проводимость, которая объясняется наличием свободных подвижных электронов в атоме металла. Движением электронов объясняется и большая теплопроводность металлов и даже их непрозрачность тоже объясняется присутствием свободных электронов. Так как металлы почти полностью отражают свет всех длин волн спектра, то они имеют цвет серебристо-белый (алюминий, серебро, никель) или серебристо-серый (железо, свинец).
Механические свойства металлов – прочность, твёрдость, упругость характеризуют их способность сопротивляться деформации и разрушению при воздействии внешних напряжений. Большая или меньшая пластичность металлов зависит от структуры металлической кристаллической решётки. Важное значение при использовании металлов в качестве конструкционных материалов имеет сочетание их пластичности с прочностью, твёрдостью и упругостью. Особые свойства металлов объясняются кристаллической структурой и особым типом химической связи – металлической связью. В металлическом кристалле распределение электронов изменяется, так как кристаллическая решётка металлов образована положительно заряженными ионами. При образовании металлического кристалла из свободных атомов их сближение приводит к смыканию уровней электронов в непрерывные энергетические зоны. Внутренние электроны остаются каждый у своего атома. Они вместе с ядром образуют положительные ионы металлического кристалла. На внешнем уровне возникают свободные электроны. Их называют «электронным газом».
Таким образом, металл можно представить в виде остова из положительно заряженных ионов, окруженного «электронным газом», компенсирующим силы взаимного отталкивания положительных ионов. Высокая теплопроводность металлов объясняется способностью свободных электронов передвигаться по кристаллу и переносить энергию из более нагретой части в менее нагретую. При нагревании металла колебания атомов в кристаллической решетке становятся более интенсивными, что затрудняет движение электронов. Поэтому с повышением температуры электрическое сопротивление металлов возрастает, что приводит к уменьшению электропроводности. При сильном охлаждении, температурах, близких к абсолютному нулю, наступает явление сверхпроводимости, когда почти исчезает сопротивление металла электрическому току.
Вследствие особенностей металлической связи для кристаллических решёток металлов характерна высокая плотность упаковки и чаще высокая симметрия в упаковке. Большинство металлов кристаллизуются в одном из трёх типов кристаллической решётки (Рис.4):
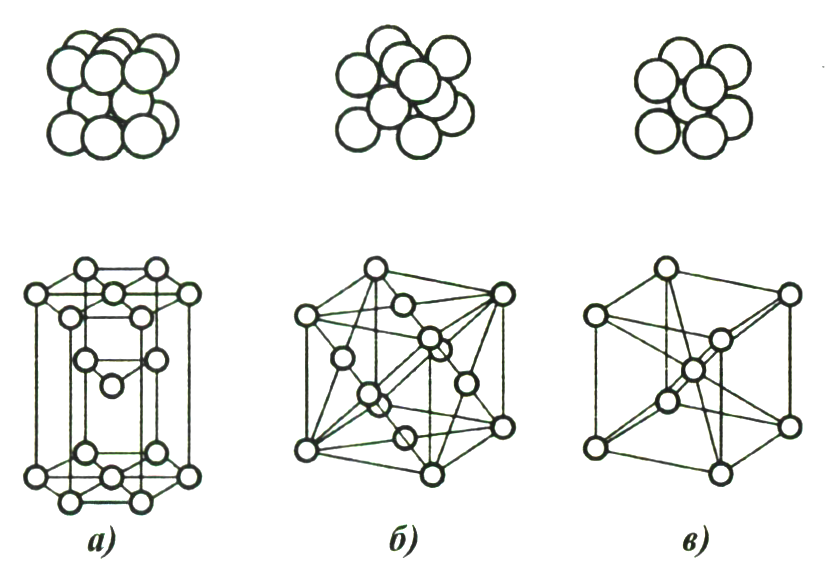
Рис.4 Типы кристаллических решёток металла [2]:
а) плотная гексагональная решётка; б) плотная кубическая гранецентрированная решётка; в) объёмно-центрированная кубическая решётка.
В схемах решёток а) и б) каждый атом окружен 12-ю другими на одинаковом расстоянии. Такое расположение соответствует самому плотному заполнению пространства. Степень заполнения пространства составляет 74,05%. Координационное число равно 12.
В объёмно-центрированной кубической решётке упаковка атомов более рыхлая и координационное число составляет 8.
Большая прочность и твёрдость металлов объясняется максимально плотной упаковкой частиц и прочностью самих кристаллических решёток. Пластичность можно объяснить скольжением слоёв частиц, образующих металлическую решётку. Они сдвигаются относительно друг друга без разрыва, так как при этом сохраняются связи между слоями.
В строительстве металлы в чистом виде используют очень редко. Чаще применяют металлические сплавы, которых насчитывается десятки тысяч марок. Металлические сплавы – это макроскопические однородные системы, состоящие из двух или большего числа металлов и неметаллов с характерными металлическими свойствами. Многие сплавы, такие как сталь, чугун, бронза, были известны в глубокой древности и имели практическое применение. Техническое значение металлических сплавов объясняется тем, что многие их свойства (твёрдость, прочность, коррозионная стойкость и др.) значительно выше, чем у составляющих их чистых металлов. Металлы (или неметаллы), вводимые в сплавы для улучшения их свойств, называют легирующими элементами, а сам процесс – легированием. Сплавы в твёрдом состоянии представляют собой поликристаллические тела, состоящие из множества мелких (10-3-10-7м), различно ориентированных относительно друг друга кристаллов, называемых кристаллитами или зёрнами.
Свойства стали зависят от состава, структуры сплава, термической обработки и др.
Диаграмма состояния «железо – углерод» является основой науки о стали и чугуне (Рис.5).

Рисунок5. Диаграмма состояния «железо-углерод» [2].
Точка А на диаграмме соответствует температуре плавления чистого железа, точка D – температуре плавления цементита. Процесс кристаллизации расплава начинается по линии ликвидуса АВСД. Выше линии ликвидуса сплав находится в жидком состоянии.
Линия солидуса АНJECF – граница кристаллизации расплава, ниже сплавы находятся в твёрдом состоянии. Между линиями ликвидуса и солидуса существуют две фазы – жидкий расплав и твёрдые кристаллиты.
В расплавленном железе углерод находится в растворённом состоянии, сплав однороден. При охлаждении расплава углерод выделяется либо в виде графита при медленном охлаждении сплава, либо в виде цементита (Ц). Цементит (карбид железа) обладает большой твёрдостью и хрупкостью, содержит 6,67% углерода. Это неустойчивое соединение, при высоких температурах распадается по реакции: Fe3C → 3Fe + C.
Устойчивой фазой при низком содержании углерода (до 0,02%) является феррит (Ф). Это твёрдый раствор углерода в железе. Он мягок, пластичен, магнитен.
Аустенит (А) – устойчивая фаза при температуре сплава выше 727°С. Легирование повышает устойчивость аустенита при охлаждении вплоть до нормальной температуры и даёт возможность получения закалочных структур – бейнита и мартенсита. При высоком нагреве стали имеют структуру чистого аустенита. Предельная растворимость углерода в аустените 2,14% при температуре 1147°С, при температуре 727°С – 0,8%.
При распаде аустенита и концентрации углерода 0,8% образуется перлит (П) – механическая смесь, состоящая из тонких зёрен или пластинок цементита и феррита. Механические свойства перлита зависят от формы зёрен цементита.
Ледебурит (Л) – механическая смесь, состоящая из аустенита и цементита, содержащая углерода 4,3%. Ледебурит образуется при остывании расплава до 1147°С. Ниже 727°С образуется перлит и вторичный цементит.
Вертикальная линия, соответствующая содержанию углерода 2,14%, делит диаграмму на две части: расположенные слева от линии сплавы называются сталями, справа – чугунами.
При температуре 1147°С кристаллизация всех сплавов заканчивается, причём точка С соответствует эвтектике – это тонкая механическая смесь аустенита и цементита, называемая ледебуритом. Сталь, содержащая углерода 0,8%, называется эвтектоидной, от 0,8 до 2,14% – заэвтектоидной. Доэвтектоидная сталь (содержание углерода менее 0,8%) состоит из участков феррита и перлита.
Диаграмма состояния сплавов железа с углеродом показывает фазовые превращения, происходящие со сплавом при нагревании и охлаждении в зависимости от содержания в них составных компонентов. Так же, как и в природе при остывании вулканической магмы, в зависимости от скорости охлаждения формируется разная структура камня, так и при воздействии высокой температурой на металлы можно влиять на их структуру, а значит и на их свойства. Так, при изготовлении металлоконструкций отдельные части конструкции сваривают или механически обрабатывают, при этом нарушается однородность в изделии, возникают напряжения. Для улучшения механических свойств стали, повышения её однородности и снятия напряжения её подвергают термической обработке. Это совокупность операций нагрева до определённой температуры в твёрдом состоянии, выдержки и охлаждения по особому режиму. Этим приёмом меняют структуру сплава, добиваются измельчения зерна в сплаве, а значит большей однородности и прочности. Термическая обработка может быть промежуточной (для заготовок) и окончательной для готовых изделий.
Основными видами термической обработки являются отжиг, закалка, отпуск. Цель отжига смягчить структуру стали для облегчения механической и пластической обработки. Есть два вида отжига I и II рода. Отжиг первого рода применяется для снятия внутренних напряжений при нагреве до температуры ниже фазовых превращений (гомогенизация). Отжиг второго рода проводят при температуре выше фазовых превращений, выдерживают и после перекристаллизации медленно охлаждают с выдержкой в процессе охлаждения и затем до полного охлаждения. Такой отжиг приводит сталь в равновесное состояние, улучшает её обрабатываемость (нормализация).
Нормализация заключается в нагреве стали до аустенитного состояния, выдержке и охлаждении на воздухе. Так получают мелкозернистую однородную структуру, с более высокой прочностью и твёрдостью в сочетании с пластичностью. Для некоторых сталей нормализация – окончательная термическая обработка.
Закалка и отпуск – основной вид окончательной термической обработки, придающей сплаву повышенную твёрдость, высокую прочность и износоустойчивость. Такая структура образуется с формированием мартенсита, который обладает максимальной твёрдостью и минимальной пластичностью. После закалки для повышения пластичности, снижения внутренних напряжений и твёрдости применяют отпуск стали, заключающийся в нагреве до температуры 150-250°С – низкий отпуск, до температуры 300-450°С – средний отпуск и до температуры 500-680°С – высокий отпуск с охлаждением с заданной скоростью. Главная цель охлаждения стали – превращение аустенита в желаемую структуру: перлит, сорбит, троостит или мартенсит. Образование этих структур зависит от температуры нагрева и скорости охлаждения.
Совмещение закалки с высоким отпуском применяют для конструкционных сталей, когда достигается оптимальное сочетание прочности и вязкости.
Термической обработке подвергают также чугун и сплавы других металлов. Для повышения износостойкости, твёрдости и коррозионной стойкости поверхностного слоя стальных изделий их подвергают различным видам химико-термической обработки. При этом насыщается поверхностный слой изделия упрочняющим элементом: углеродом – цементация, азотом – азотирование, азотом и цианистой солью – цианирование, хромом – хромирование и т. п.
По химическому составу стали делят на углеродистые и легированные. По назначению – на конструкционные и инструментальные. Конструкционные стали разделяют на строительные и машиностроительные.
Строительные стали содержат углерода в сплаве до 0,3%, машиностроительные – до 0,5%, пружинные – от 0,5 до 0,8%, инструментальные – от 0,7 до 1,3%. С увеличением содержания углерода в стали повышается твёрдость, прочность, но снижается пластичность, ухудшается свариваемость.
Наиболее надёжным способом улучшения структуры стали (модифицирования) является легирование. Стали считаются низколегированными, если в сплав ввели до 2,5% легирующих элементов, среднелегированными, если легирующих элементов до 10%, и высоколегированными, если их выше 10%.
В качестве легирующих элементов применяют Сr, Mn, Ni, Si, W, Mo, Ti, V, Co, Cu, Nb и др. В сплаве может содержаться два и более легирующих элементов. Легированные сплавы стали выдерживают широкий диапазон температур (от -269 до +1200°С, в отдельных случаях до 2500°С).
Легирующие элементы с железом образуют твёрдые растворы, т. е. они входят в состав феррита и аустенита, упрочняя их. В зависимости от структуры, полученной при охлаждении, легированная сталь называется перлитной, мартенситной, аустенитной, ферритной и карбидной. Кроме того, легированные стали делят на несколько классов: нержавеющие, жаростойкие и жаропрочные, износоустойчивые, магнитные, с особыми тепловыми свойствами и др. Среди нержавеющих сталей наиболее широко применяют хромистые стали. Железо и хром образуют ряд твёрдых растворов. С углеродом хром образует карбиды, что приводит к уменьшению концентрации хрома в твёрдом растворе. Коррозионная устойчивость хромистых сталей обусловлена способностью хрома пассивироваться. В результате на его поверхности образуется тонкая (в несколько молекулярных слоёв) плотная оксидная плёнка, защищающая сталь от агрессивных воздействий. Хром относится к самопассивирующим металлам, поэтому при механическом повреждении пассивной плёнки она легко восстанавливается, не снижая защитных качеств.
Нержавеющие стали содержат углерода 0,1-0,45% и 12-14% хрома, в ферритных сталях хрома содержится ещё больше – до 25-30%. Высокой коррозионной стойкостью обладают нержавеющие хромоникелевые стали аустенитного класса.
В состав жаростойких сталей вводят хром, алюминий, кремний. Жаростойкие – это сплавы, которые при температуре 550°С не разрушаются с поверхности под действием газовой среды. Жаропрочную сталь изготавливают из сложного хромоникелекремнистого сплава. Износоустойчивые стали содержат до 12-14% марганца.
Стали с большим содержанием никеля (35-44%) и малым содержанием углерода (до 0,35%) имеют аустенитную структуру и низкий коэффициент теплового расширения, обладают особыми тепловыми свойствами.
Строительные конструкционные стали предназначены для работы в атмосферных условиях при нормальных и пониженных температурах. Они должны обладать хорошей свариваемостью, пластичностью, обрабатываемостью резанием. Для изготовления строительных конструкций применяют низкоуглеродистую сталь обыкновенного качества. Несущие сварные и клёпаные конструкции зданий и сооружений изготавливают из мартеновской и кислородно-конверторной стали. Для конструкций, не имеющих сварных соединений, и для сварных конструкций, подверженных только статическим нагрузкам, применяют мартеновскую сталь.
Конструкции из листовой стали (резервуары, трубопроводы и другие изделия) изготавливают из мартеновской или конверторной стали, кипящей или полуспокойной. Эти стали обладают хорошей свариваемостью, достаточно высокой ударной вязкостью, малочувствительны к концентрации напряжений.
Гарантированные механические свойства необходимы для арматурной стали, используемой для армирования железобетонных конструкций. Поэтому для изготовления арматуры берут качественную низкоуглеродистую сталь, упрочнённую закалкой. Сталь марок А-I, А-II, А-III и В-I относится к обычной низкоуглеродистой стали. Высокопрочные арматурные стали, рекомендованные для преднапряжённых конструкций, как правило, сложнолегированные, проходят термическую и термомеханическую обработку, нормализацию и высокий отпуск 600-650°С. Они имеют мелкозернистую структуру, хладостойкость и малую чувствительность к концентраторам напряжений. Лучшими характеристиками обладает горячекатаная арматура периодического профиля Ат-IV, Ат-V, Ат-VI после термического упрочнения. В качестве ненапрягаемой арматуры в железобетонные конструкции предпочитают стержневую арматурную сталь классов А-III и Ат-IVС, а также проволочную арматуру Вр-I. Высокопрочная проволочная арматура В-II, Вр-II малопластична, испытывает растягивающие напряжения, близкие к пределу текучести. Введение легирующих добавок и термоупрочнения улучшают механические и антикоррозионные свойства арматурной стали.
Мостовые металлические конструкции изготавливают из горячекатаной малоуглеродистой, низко-, но сложнолегированной мартеновской стали. Структура мостовых сталей должна быть однородной, мелкозернистой, без дефектов. Предел прочности, предел текучести, относительное удлинение, ударная вязкость имеют решающее значение для элементов мостовых конструкций.
Необходимость снижения массы строительных конструкций, уменьшения сечения, снижения строительного коэффициента требуют более высоких физико-механических свойств стали, что привело к замене углеродистых сталей низколегированными. Низколегированные стали обладают высокой пластичностью и ударной вязкостью. Их применяют для сварных и клёпаных конструкций, для армирования железобетонных конструкций. Способом легирования и термообработкой получают стали повышенного качества.
Алюминиевые сплавы
Исходным сырьём для алюминия являются бокситы, нефелины, алуниты, каолины.
Технология заключается в производстве глинозёма – Al2O3 из руд и электролитического получения алюминия. Глинозём имеет высокую температуру плавления – 2050°С, для её снижения до 940-960°С добавляют минерал криолит и ведут электролиз в специальных ваннах сложной конструкции. В расплавленном электролите происходит диссоциация криолита и глинозёма, на катоде образуется металлический алюминий. Чистота электролитического алюминия составляет 98,5-99,8%. Алюминий – пластичный, коррозионностойкий и экономичный материал.
Для изготовления строительных изделий выплавляют алюминиевые сплавы, они обладают более высокими физико-механическими свойствами и коррозионной стойкостью. Наиболее широко применяются сплавы с медью, магнием, кремнием, марганцем. Их используют не только в ограждающих элементах, оконных и дверных переплётах, но и в качестве основного конструкционного материала в несущих конструкциях жилых и общественных зданий, сельскохозяйственных объектов, для оборудования подстанций и др.
Недостатками алюминиевых сплавов являются сравнительно низкий модуль упругости, высокий коэффициент линейного температурного расширения и относительная сложность соединения элементов конструкций.
В зависимости от состава алюминиевые сплавы делят на несколько групп: силумины – Аl-Si; дюралюмины – Аl-Сu-Мg; магналии – Аl-Мg; авиали – Аl-Мg-Si и более сложные (многокомпонентные) с улучшенными свойствами. Алюминиевые сплавы легируют, используя хром, цирконий, цинк, никель, литий и др.
По способу обработки алюминиевые сплавы делят на литейные и деформируемые.
К литейным относят силумины. Они обладают высокой прочностью, удовлетворительной пластичностью, высокой жидкотекучестью. Литейные сплавы с магнием являются коррозионностойкими, прочными, легко обрабатываются резанием. Из них изготавливают изделия, эксплуатируемые в морской воде.
Деформируемые алюминиевые сплавы делят на неупрочняемые и упрочняемые термической обработкой. Термически неупрочняемые представляют собой однородный твёрдый раствор магния, марганца, меди в алюминии. Их упрочняют деформацией в холодном состоянии (нагартовка, наклёп). Термически неупрочняемые сплавы применяют для несущих сварных конструкций (балки, арки, фермы и др.), ненагруженных и малонагруженных элементов конструкций зданий (стеновые панели, арматурные детали, кровельные настилы, оконные переплёты).
Деформируемые сплавы, упрочняемые термической обработкой, делят на сплавы высокой прочности и специальные сплавы, работающие при повышенных температурах – жаропрочные. Сплавы этой группы приобретают высокие механические свойства и коррозионную стойкость только в результате термической обработки, которая заключается в закалке и последующем старении.
Алюминиевые сплавы отличаются лёгкостью, повышенной коррозионной стойкостью в агрессивных средах, значительной удельной прочностью, высокой технологичностью (в холодном и горячем состоянии), сохраняют высокие прочностные свойства при отрицательных температурах. Конструкции и изделия из алюминия имеют хороший внешний вид, огне- и сейсмостойки, легко обрабатываются и свариваются определёнными видами сварки. Элементы строительных конструкций высокой коррозионной стойкости изготавливают из деформируемых, термически неупрочняемых, алюминиево-магниевых и алюминиево-марганцевых сплавов. Эти же сплавы применяют для изготовления элементов конструкций, совмещающих функции ограждающих и несущих конструкций (каркасы стеновых панелей, кровельные панели, панели покрытия, подвесные потолки и др.). Алюминиевые сплавы различных марок применяют для изготовления малонагруженных элементов конструкций зданий (обшивки стеновых и кровельных панелей, арматурные детали, санитарно-технические короба и др.).
Литейные алюминиево-магниевые сплавы используют в качестве опорных частей строительных конструкций, успешно заменяя аналогичные отливки из углеродистой стали. Строительные сплавы, характеризующиеся высокой коррозионной стойкостью, легируют титаном, ванадием, кремнием с добавкой марганца.
Применение алюминиевых сплавов позволяет уменьшить массу стен и кровли в десятки раз, сократить трудоёмкость монтажа и его сроки в 2-3 раза.
Сплавы на основе меди
С целью повышения механических, технологических, антикоррозионных и других свойств в технике применяют сплавы меди с цинком, оловом, алюминием, никелем, бериллием, хромом, кремнием и др. Сплавы меди с цинком называют латунями, с другими элементами – бронзами, за исключением сплавов с никелем. Максимальной прочностью обладают латуни, содержащие 42-45% цинка, наибольшей пластичностью обладают латуни с содержанием цинка 30-32%. Сплавы, содержащие цинка до 10%, называют томпаками, от 10 до 20% – полутомпаками. Легированные латуни алюминием, марганцем и оловом увеличивают прочность и коррозионную стойкость (морские латуни), кремнием – твёрдость и прочность, а также улучшает литейные свойства.
Бронзы – сплавы меди с другими химическими элементами за исключением цинка и никеля. Оловянные бронзы обладают повышенными антифрикционными свойствами, высокой коррозионной стойкостью, жидкотекучестью. Бронзы имеют высокую износоустойчивость, устойчивы на воздухе, в водяном паре, в кислых средах, алюминиевые бронзы устойчивы в морской воде, кремнистые – в сухих газах, в сточных щелочных средах.
Коррозия металлов
Коррозия – самопроизвольное разрушение металлов под действием окружающей среды. Это окислительно-восстановительный процесс, происходящий на поверхности металла. По нарушениям поверхности металла различают равномерную, точечную, питтинговую, межкристаллитную коррозию. Особенно опасна межкристаллитная коррозия, при которой разрушение происходит по границам зёрен, из которых состоит металл, что приводит к быстрому разрушению изделия.
Изучение причин, вызывающих начало коррозии, выявило 3 фактора:
химическая природа металла, его микроструктура;
химическая природа окружающей среды, содержание в ней агрессивных веществ;
температура и влажность окружающей среды.
По механизму коррозионных процессов различают химическую и электрохимическую коррозию. Химическая происходит в атмосфере сухих газов (при высокой температуре) и в растворах неэлектролитов. Иначе её называют газовой коррозией. К газовой коррозии относятся процессы окисления клапанов двигателей внутреннего сгорания, лопаток газовых турбин, жаровых труб и др. Окисление металла в атмосфере кислорода при высокой температуре проходит: 2Fe + O2 → 2FeO и далее: 6FeO + O2 → 2Fe3O4,
Образуется окалина – плёнка продуктов из нескольких слоёв при их окислении кислородом.
Малая химическая активность некоторых металлов (Ti, Zr, Аl) обусловлена образованием на их поверхности тонкой, но очень прочной защитной плёнки МеО2. Переход металла в пассивное состояние называется пассивацией. На поверхности образуется пассивирующий слой, представляющий собой прочную тонкую сплошную плёнку толщиной до нескольких нм. Пассивация металлов обеспечивает коррозионную стойкость в агрессивной среде конструкций из алюминия, титана, хрома, никеля и других металлов.
Углеродистые стали и чугун подвергаются быстрому окислению с образованием непрочной окалины при температурах выше 600°С. При газовой коррозии чугуна иногда наблюдается увеличение его объёма в результате образования на границе зёрен металла и графита оксидов, занимающих больший объём, чем исходные кристаллиты. Появляются многочисленные трещины. Окалиностойкость зависит от природы металла. Алюминий при обычных температурах покрывается прочной оксидной плёнкой, не разрушающейся даже при температуре плавления алюминия. Поэтому такие металлы как алюминий, медь, никель, хром и сплавы на их основе применяют как жаростойкие конструкционные материалы. При температуре выше 700°С в среде водяного пара процесс коррозии углеродистых сталей значительно ускоряется, так как одновременно с окислением происходит разрушение цементита: Fe3C + O2 = 3Fe + CO2.
Обезуглероживание вызывает ухудшение структуры стали и приводит к снижению прочности, понижает предел усталости. Помимо кислорода при высоких температурах становятся более агрессивными к металлам фтор, хлор, диоксид серы, сероводород, хлористый водород и др. Химическая стойкость металлов зависит от природы металла.
Химическая активность газов при температуре выше 200-300°С значительно возрастает, поэтому скорость газовой коррозии с повышением температуры усиливается. Агрессивные среды, транспортируемые по трубопроводам от нефтяных и газовых месторождений, вызывают внутреннюю коррозию труб и оборудования. В нефтехимических производствах углеродистые стали применяются только до температуры 200°С. Совместное действие влаги и агрессивной среды в процессе добычи и транспортировки нефти и природного газа значительно усиливают коррозию металлов. В этом случае процесс коррозии протекает по другому механизму – электрохимическому.
Электрохимическая коррозия отличается отсутствием контакта металла с окислителем, воздействие на металл происходит через возникновение гальванических пар, образующихся за счёт разности потенциалов на разных участках металлической конструкции. Разность потенциалов возникает при наличии контакта металла с электролитом – тонкой водяной плёнкой, образующейся на металле во влажной атмосфере. В этой плёнке воды растворяется кислород, углекислый газ и другие газы, что приводит к увеличению электропроводности и агрессивности среды.
Электрохимическая коррозия представляет опасность для арматурной стали, расположенной в железобетонных конструкциях, поэтому принимают первичные меры защиты, исключающие эту опасность. Для начала процесса коррозии стали в структуре бетона должна быть критическая влажность воздуха – 50-60%, обеспечивающая наличие в порах жидкости (капиллярной влаги) и перемещение ионов в ней. Если в составе добавок в бетон есть ионы хлора, то для начала коррозионного процесса достаточно влажности 30-35%, а при низком рН ≤ 3 процесс коррозии начинается даже без доступа кислорода. Защитные свойства бетона зависят от состава, структуры, окружающей среды и определяются способностью его щелочной среды пассивировать поверхность арматуры. Даже частичное нарушение сцепления арматуры с бетоном способствует развитию электрохимической коррозии. Капиллярная влага в поровой структуре бетона служит электролитом, более активный металл обогащает раствор электролита заряженными электронами (в силу своей природы), а сам заряжается отрицательно: 2Fe - 4℮‾ → 2Fe++, на другом конце: 4℮‾ + 2Н2О + О2 = 4ОН‾.
Возникает анод и катод, электроны перемещаются к катоду, а ионы железа группируются у анода, куда по электролиту перемещаются гидроксил-ионы, образуя гидрат закиси и затем окиси железа, или ржавчину:
2OH‾ + Fe++ → Fe(OH)2 и далее 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3.
Таким образом, по металлу – проводнику первого рода передвигаются электроны (анод), а в растворе электролита (капиллярной влаге) – проводнике второго рода (катод) – перемещаются ионы. На катоде с помощью кислорода воздуха идет процесс восстановления атомов. Металл при контакте с жидкой фазой отдаёт положительно заряженный ион и становится отрицательно заряженным электродом с избытком электронов. На границе раздела фаз образуется двойной электрический слой, который является механизмом электрохимического процесса только при наличии электролита, т. е. влажности в капиллярном пространстве. Влага в структуре бетона всегда есть. Наиболее активно коррозия идёт при влажности воздуха 70-80%, когда капилляры заполнены влагой. Щелочная среда бетона оказывает пассивирующее действие на сталь арматуры, если водородный показатель среды будет не ниже рН ≥ 11,8, она препятствует растворению металла. Чем ниже водородный показатель, тем быстрее идёт процесс коррозии. Опасен контакт стали с частями, подвергавшимися термической или механической обработке, так как это приводит к возникновению разности потенциалов между этими участками конструкции. Нельзя использовать для покраски оксиды металлов, обладающие электропроводностью (ZnO, Fe2O3). К возникновению разности потенциалов у металла приводит даже неодинаковая температура на разных концах конструкции и различная их деформация.
Нарушают пассивность металла проникающие в трещины и поры бетона кислые газы, влажный воздух, изменяющие пассивирующее воздействие защитного слоя бетона. Накапливаясь, продукты коррозии создают давление на бетон, отслаивая защитный слой.
Целостность арматуры зависит от толщины и плотности защитного слоя бетона. Он должен обладать значительной и одинаковой плотностью, уплотнение бетона повышает его защитные качества.
При выборе арматуры и конструкций, предназначенных для работы в агрессивной кислой среде, следует отдавать предпочтение специальным маркам легированной стали, использованию ингибиторов коррозии катодного действия (катапин), добавки которого 0,1-0,3% обеспечивают оболочку полимолекулярной плёнки на поверхности металла и повышают эффективность нитрита натрия – самого распространённого ингибитора в технологии бетонов. Защитные свойства проявляются при концентрации ингибитора NaNO2 немногим более 2 г/л.
Если есть опасность раскрытия трещин в бетоне, арматуру и закладные детали защищают специальными покрытиями. Первичная или пассивная защита в агрессивных условиях эксплуатации заключается в правильном выборе материалов для изготовления бетона и специальных марок стали для арматуры и закладных деталей. Должен быть исключен контакт арматуры с токонесущими элементами. Если этого недостаточно, выполняют меры по активной защите: покрытие поверхности защитными плёнками (металлическими и неметаллическими), электрохимические методы защиты (Рис 6,7), а также электродренаж.

Рис.6 Схема катодной защиты трубопровода [2].
Защита строительных материалов от воздействия атмосферных факторов достигается гидрофобизацией поверхности кремнийорганическими составами. В последнее время разрабатывают составы бетона с полимерными добавками или полимербетоны. Они более стойки к кислым агрессивным средам, не впитывают влагу, трещиностойки. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, силикатно-цинковое покрытие и др. Эмали эффективны и для защиты от газовой коррозии.
Уменьшение агрессивности среды достигается применением химических соединений, называемых ингибиторами – замедлители коррозии. В их присутствии изменяется состояние поверхности металла вследствие образования с ионами металла трудно растворимых соединений.
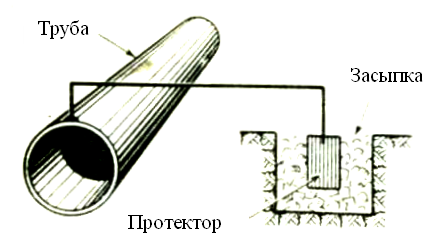
Рис.7 Схема протекторной защиты трубопровода [2].
Ингибиторы делят на анодные и катодные замедлители коррозии. Одни адсорбируются на анодных участках и замедляют анодный процесс растворения металла (хроматы, фосфаты, нитриты и др. соли неорганических кислот), другие адсорбируются на катодных участках и тем снижают интенсивность катодных процессов. Эффективными катодными ингибиторами являются катионы металлов (Zn2+, Ca2+, Mg2+, Ni2+и др.). Применение ингибиторов коррозии сочетают с электрозащитой или нанесением защитных покрытий.
Рациональное конструирование элементов сооружений относится также к первичной защите (сечение металла, форма конструкции, возможность возобновления защиты и др.).
