
- •1. Основные положения молекулярно-кинетической теории.
- •Основное уравнение молекулярно-кинетической теории ( уравнение Клаузиуса )
- •Внутренняя энергия идеального газа
- •Максвелловское распределение молекул по их кинетическим энергиям:
- •Опыт Штерна (1920г.)
- •7. Распределение Больцмана молекул по их потенциальным энергиям
- •Распределение Больцмана молекул по их потенциальным энергиям
- •11.Средняя длина свободного пробега молекул газа
- •12.Теплопроводность газов
- •13. Диффузия и внутр. Трение в ид. Газах
- •14.Первое начало термодинамики, теплоёмкость ид. Газа,работа газа при изменении объёма.
- •Второе начало термодинамики:
13. Диффузия и внутр. Трение в ид. Газах
Вследствие теплового движения молекул будет происходить процесс выравнивания концентраций, сопровождающийся переносом массы каждой из компонент в направлении убывания её концентрации. Этот процесс носит название диффузии. Диффузия наблюдается так же в жидких и твёрдых телах.
Поток молекул i – го вида через перпендикулярную к оси х поверхность S определяется выражением

где D – коэффициент пропорциональности, называемый коэффициентом диффузии.
Умножив обе части этого равенства на массу молекулы i – го вида mi, получим выражение для потока массы i – ой компоненты:

где i = nimi – парциальная плотность i – ой компоненты. Эти формулы - уравнения Фика.
Поток молекул первой компоненты летящих через поверхность S в положительном направлении оси х, равен

а соответствующий поток молекул первой компоненты, летящих в отрицательном направлении оси х равен разности этих потоков

Таким образом, мы пришли к уравнению диффузии Фика, причём получили для коэффициента диффузии выражение
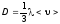 .
.
Сила трения между двумя слоями жидкости может быть вычислена по формуле

где
- коэффициент вязкости, du/dx-
градиент скорости, S – величина
поверхности, по которой действует сила
F.![]()
Уравнение вязкости
![]()

14.Первое начало термодинамики, теплоёмкость ид. Газа,работа газа при изменении объёма.
Первое начало термодинамики. Количество теплоты, сообщённое газу, идёт на приращение внутренней энергии газа и на совершение газом работы над внешними телами.
dQ=dU+dA - первое начало термодинамики.
Физические величины, входящие в этот закон.
а) Внутренняя энергия идеального газа равна
 ,
где
,
где
 - количество вещества, i – число степеней
свободы молекул газа.
- количество вещества, i – число степеней
свободы молекул газа.
Тогда изменение внутренней энергии газа равно

б) Вычислим теперь работу, совершаемую газом при изменении объёма. Для этого рассмотрим газ, находящийся в цилиндре под поршнем, который может свободно перемещаться. При нагревании давление газа P , будет оставаться постоянным, и, как видно из рисунка, работа, которую совершает газ, будет равна:
 где
dV = S dl - изменение объема газа.
где
dV = S dl - изменение объема газа.
 -
работа, совершаемая газом при изменении
его объема
-
работа, совершаемая газом при изменении
его объема
в)
Молярная теплоёмкость газа – это количество теплоты, сообщённой 1 молю газа, для увеличения его температуры на dT.
 -
теплота, сообщённая газу для увеличения
его температуры на dT.
-
теплота, сообщённая газу для увеличения
его температуры на dT.
Применим первое начало термодинамики к изопроцессам в газе.
Изопроцесс - это процесс, происходящий в газе, когда один из параметров, описывающих газ, является постоянным.
теплоемкость
для случаев, когда нагревание происходит
при постоянном объеме или постоянном
давлении. Для первого случая теплоемкость
обозначается Cv и равна
 ,
для второго случая теплоемкость
обозначается Cp и равна
,
для второго случая теплоемкость
обозначается Cp и равна
 ,
где i – число степеней свободы молекулы.
Для изотермического процесса теплоемкость
CТ = , а для адиабатического процесса
теплоемкость Cадиаб. = 0.
,
где i – число степеней свободы молекулы.
Для изотермического процесса теплоемкость
CТ = , а для адиабатического процесса
теплоемкость Cадиаб. = 0.
Согласно
рассмотренной нами теории теплоемкости
Cv и Cp газов должны быть целыми, кратными
R/2, ибо число степеней свободы может
быть только целым.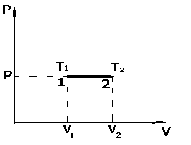
15. Термодинамика изохорического процесса: V=const
Рассмотрим закон, описывающий этот процесс и его график в координатах (P,V). Этот закон является частным случаем уравнения состояния идеального газа: PV = RT. Закон Шарля:
![]()
Так
как V=const,
то dV=0
и dA=PdV=0,
т.е![]()
A=0
- работа совершаемая газом при
изохорическом процессе равна нулю.
Тогда ![]()
dQ=dU - первое начало термодинамики для изохорического процесса.
Поскольку
количество теплоты, сообщенное газу,
равно dQ= *CvdT, где
*CvdT, где
 -
молярная теплоёмкость газа при постоянном
объёме, то мы получаем полезную формулу
для подсчёта приращения внутренней
энергии газа:
-
молярная теплоёмкость газа при постоянном
объёме, то мы получаем полезную формулу
для подсчёта приращения внутренней
энергии газа:
 -
изменение внутренней энергии газа
-
изменение внутренней энергии газа
Сравнивая эту формулу с другой формулой

получим выражение для молярной теплоёмкости газа при постоянном объёме:

16. Термодинамика изобарического процесса: P=const. Соотношение Майера
Сначала рассмотрим закон, описывающий этот процесс и его график в координатах (P,V).
![]()
- закон Гей-Люссака.
Теперь работа, совершаемая газом, dA=PdV≠0 -приращение внутренней энергии газа тоже не равно нулю dU≠0, и первое начало термодинамики не меняет своего вида: dQ=dU+dA - первое начало термодинамики для изобарического процесса.
Формула для подсчёта теплоты теперь примет вид
 где
Cp-
молярная теплоёмкость газа при постоянном
давлении.
где
Cp-
молярная теплоёмкость газа при постоянном
давлении.
Приращение внутренней энергии запишем в виде

Работa,
совершаемую газом:
Уравнение
Менделеева-Клапейрона

дифференциальное
уравнение которого при P=const
дает
Из выражения для работы следует размерность и физический смысл универсальной газовой постоянной R:
Универсальная
газовая постоянная R
численно равно работе, совершённой
одним молем газа при изобарическом
процессе при увеличении его температуры
на один градус.![]()
![]()
Изобарический процесс. Подставляя полученные выражения для dQ, dU, dA в первое начало термодинамики, получим:
 Сократить
на dT,
получим соотношение между молярными
теплоёмкостями газа при постоянном
объёме Cv
и постоянном давлении Cp:
Сократить
на dT,
получим соотношение между молярными
теплоёмкостями газа при постоянном
объёме Cv
и постоянном давлении Cp:
Cp= Cv+R - соотношение Майера.
Cv=(i/2)R, получим аналогичное выражение для Cp Cp=((i+2)/2)R
Выражение для отношения моляр-х теплоёмкостей Cp и Cv:
Для
двухатомных молекул при невысоких
температурах i = 5, тогда γ=1,4.![]()
Работа, совершаема газом при изобарическом процессе (P=const):

-
работа, совершаемая газом при изобарическом процессе.

На графике (P,V) работа, совершаемая газом, численно равна площади прямоугольника 1-2-V1-V2, построенного под изобарой
17.Термодинамика изотермического процесса: T=const.
Закон, описывающий этот процесс, и его график в координатах (P,V).
-
закон Бойля-Мариотта![]()
Так как T = const, то
т. е. dU = 0 - изменение внутренней энергии газа при изотермическом процессе равно нулю. Тогда
dQ = dA - Первое начало термодинамики при изотермическом процессе
При изотермическом процессе вся теплота, сообщенная газу, идет на работу, совершаемую газом: Q = A.
Работа,
совершаемая газом при изотермическом
процессе. Используя уравнение
Менделеева-Клапейрона
 представим
элементарную работу в виде:
представим
элементарную работу в виде:

Тогда
 .
.
работа,
совершаемая газом при изотермическом
процессе![]()
Учитывая
то, что при изотермическом процессе
 работу можно вычислить также по формуле:
работу можно вычислить также по формуле:

 ;
;
На графике (P,V) работа, совершаемая газом, численно равна площади (1-2-V1-V2) под кривой, описывающий изотермический процесс.
18.
Термодинамика
адиабатического процесса:
dQ=0
Адиабатический процесс - это процесс, протекающий без теплообмена с окружающей средой. Поскольку dQ = 0, то первое начало термодинамики примет вид: dU+dA=0
Работа, совершаемая газом:

или работа для конечного адиабатического процесса:
 -
-
Исходя из dU + dA = 0, выведем закон, которому удовлетворяют параметры газа при адиабатическом процессе. Для этого dU и dA представим в виде
![]()
Подставив это выражение в dU + dA = 0, получим дифференциальное уравнение:

которое,
разделив на СV T и используя соотношения
![]()
![]()

можно записать в виде
 .
.
Это дифференциальное уравнение приводится к полному дифференциалу:

уравнение адиабатического процесса в переменных(T,V):

Воспользовавшись уравнением Менделеева-Клапейрона PV = RT, можно перейти к переменным (P,V) и (T,P).
Например,
из
 Подставляя это в уравнение
Подставляя это в уравнение
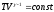 ,
получим
,
получим


или
 -
уравнение Пуассона, где
-
уравнение Пуассона, где
 -коэффициент
Пуассона.
-коэффициент
Пуассона.
![]()
уравнения адиабаты.
19.
Политропические
процессы – это
процессы, при которых тердлёмкость
газа =const
(c=const)

20. 2-е начало термодинамики. Цикл Карно и его КПД
